修回日期: 2019-01-22
接受日期: 2019-03-15
在线出版日期: 2019-04-08
肝癌是一种高发的消化系统恶性肿瘤, 传统的治疗方法对于中晚期肝癌疗效不佳, 索拉非尼是第一个用于肝癌治疗的分子靶向药物, 靶向药物的出现为中晚期肝癌患者提供了新的选择. 近年来, 特别是免疫治疗的加入, 已发现许多新型靶向药物可明显改善中晚期肝癌患者的预后, 因此靶向药物成为了研究热点. 本文就近年来肝癌靶向药物治疗试验及临床研究进展做一综述.
核心提要: 自索拉非尼问世后, 靶向治疗成为肝癌治疗的热点, 许多研究相继开展, 但均未取得明显效果. 近两年肝癌靶向药物有较大进展, 出现了新的一线及二线肝癌靶向药物, 逐渐成为新的治疗方向, 在未来有极大的发展潜力.
引文著录: 杨哲, 李建基, 黄赞松. 原发性肝癌靶向药物治疗试验与临床研究进展. 世界华人消化杂志 2019; 27(7): 450-458
Revised: January 22, 2019
Accepted: March 15, 2019
Published online: April 8, 2019
Hepatocellular carcinoma is one of the most common malignancies of the digestive system. Traditional treatment is not effective for advanced hepatocellular carcinoma. Sorafenib is the first molecule-targeted drug for hepatocellular carcinoma treatment. The emergence of molecule-targeted drugs provided a new choice for patients with advanced hepatocellular carcinoma. In recent years, thanks to the development of immunotherapy, many new molecule-targeted drugs have been found to significantly improve the prognosis of patients with hepatocellular carcinoma. Therefore, targeted drugs have become a research hotspot. This article reviews the progress in basic and clinical research of molecule-targeted drugs for hepatocellular carcinoma.
- Citation: Yang Z, Li JJ, Huang ZS. Progress in basic and clinical research of targeted drugs for primary hepatocellular carcinoma. Shijie Huaren Xiaohua Zazhi 2019; 27(7): 450-458
- URL: https://www.wjgnet.com/1009-3079/full/v27/i7/450.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v27.i7.450
原发性肝癌是消化系统常见的恶性肿瘤, 国内资料显示, 在年龄小于60岁的人群中, 肝癌是最常见的癌症, 也是导致男性癌症患者死亡的主要原因[1]. 肝癌在发病早期往往没有明显临床症状及体征, 在出现明显症状而就诊时, 肝癌很可能已经进展到中晚期(巴塞罗那分期为B期、C期或D期). 由于中国的肝癌患者大部分有乙型肝炎病毒感染, 在晚期肝癌时其肝功能常受损严重且全身状态较差, 失去了手术治疗机会. 这部分患者只能进行放/化疗、局部介入或生物治疗等, 但预后往往不佳[2].
靶向药物是近年肿瘤治疗研究的热点, 因其良好的特异性、高效性及耐受性而备受关注. 索拉非尼(Sorafenib)是一种多激酶抑制剂, 早先进行的SHARP研究[3]、 研究[4]强有力地证明了索拉非尼对于中晚期肝癌的疗效及安全性. 索拉非尼也因此成为了第一个被美国食品药品管理局(United States Food and Drug Administration, FDA)与欧洲药品评价局(European Medicines Evaluation Agency, EMEA)批准用于晚期肝癌患者的靶向药物. 在索拉非尼取得成功以后, 大家对肝癌靶向药物的研究热情高涨, 各类研究结果不断见诸报道, 尤其在近两年, 针对肝癌靶向药物研究取得许多重大成果, 索拉非尼不再是一线药物唯一的选择, 并且发现了可供备选的二线药物, 极大改善了肝癌患者的预后. 本文对部分肝癌靶向药物相关信号通路进行简要介绍, 并阐述近年来的肝癌靶向药物药物治疗试验与临床研究进展.
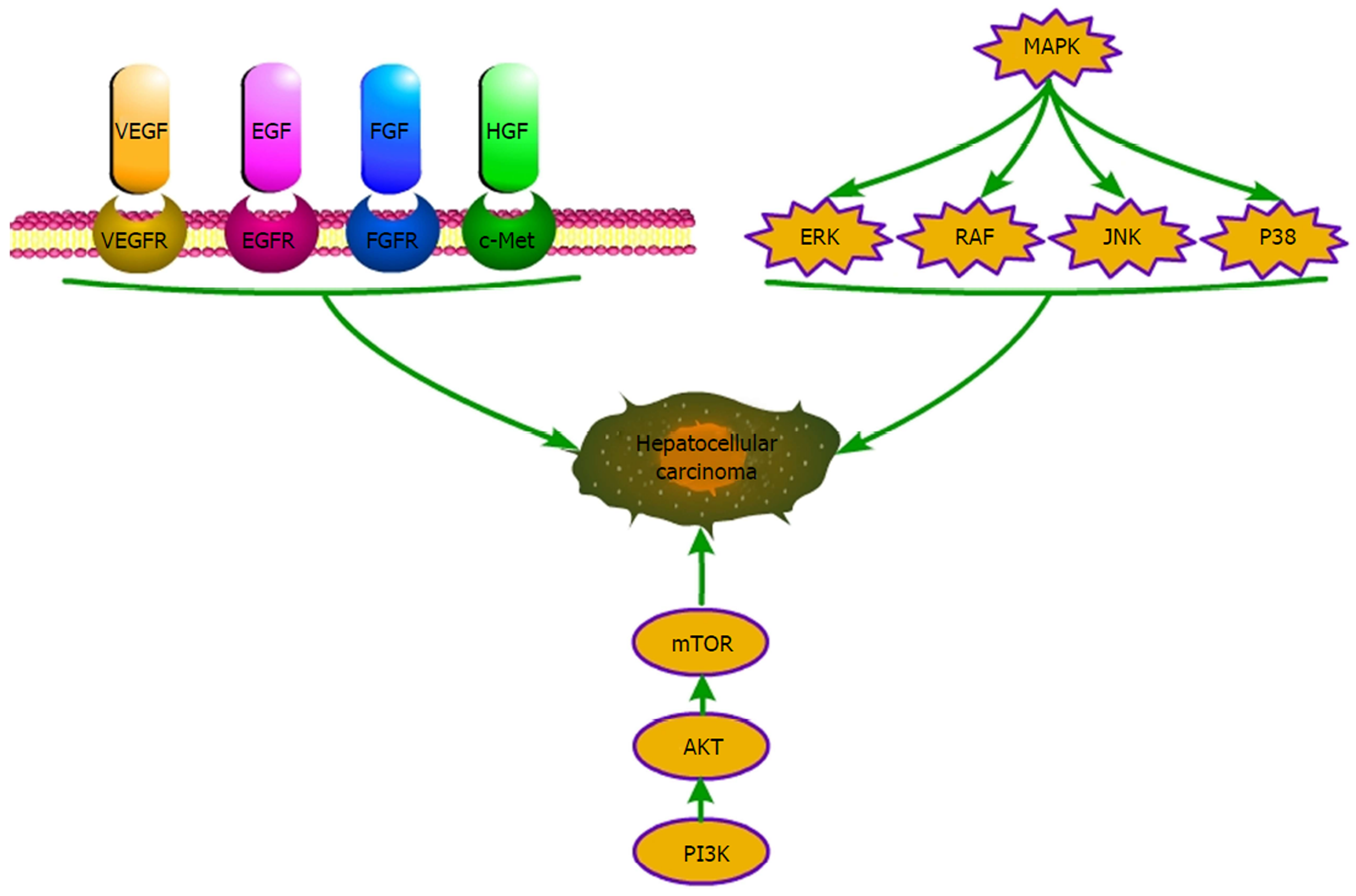
血管内皮生长因子(vascular endothelial growth factor, VEGF)通路是目前研究较多的分子通路, 是由Napoleone Ferrara于1989年发现的, 在新生血管形成中扮演了非常重要的角色, 其家族包括VEGF、VEGF-B、VEGF-C、VEGF-D、VEGF-E和胎盘生长因子(placental growth factor, PLGF). 目前已知包括肝癌在内的许多肿瘤细胞均可大量表达VEGF, 可作用于肿瘤血管内皮细胞上的特异性VEGF受体(VEGF receptor, VEGFR)并通过酪氨酸激酶介导的信号转导, 调控内皮细胞分化和血管形成. 有研究发现在下调VEGF表达时, 肝癌细胞的增殖会受到明显抑制[5,6]. 此外还有更多的证据提示VEGF与肝癌的恶性行为(肿瘤的复发、转移等)具有密切关系[7].
表皮生长因子(epidermal growth factor, EGF)最早是由Stanley Cohen、Rita Levi-Montalcini于1962年发现的, 它可直接诱导表皮细胞的生长, 因此命名为EGF. 它在体内外均可诱导细胞生长, 并使细胞分化的基因表达, 从而促进细胞生长. 其受体EGF受体(EGF receptor, EGFR)属于酪氨酸激酶受体的一种, 是人类表皮细胞中正常的表达成分之一. EGFR常通过以下信号转导通路发挥作用: 丝裂原活化蛋白激酶-细胞外调节蛋白激酶(mitogen-activated protein kinases-extracellular regulated protein kinases, MAPK-ERK)途径、磷脂酰肌醇三激酶-蛋白激酶B(phosphoinositide-3 kinase-protein kinase B, PI3K-PKB)途径、信号传导及转录激活因子3(signal transducers and activators of transcription, STAT3)途径. 它通过调节细胞生长及分裂, 在恶性肿瘤细胞增殖、损伤修复、侵袭、血管形成等多方面起到了重要的作用, 近年来EGFR与其同一家族的人表皮生长因子(human epidermal growth factor receptor, HER)成为了目前肿瘤研究的热点. 有研究发现EGFR不但在肝癌组织中有大量表达, 而且与VEGF的阳性表达呈正相关的关系, 可能在肿瘤的进展过程中与VEGF一同发挥了协同作用[8].
成纤维细胞生长因子(fibroblast growth factor, FGF)通过作用于其受体(FGF receptor, FGFR), 在胚胎形成、创伤修复、血管生成等过程中, 发挥着很重要的作用. FGFR属于受体酪氨酸激酶家族(receptor tyrosine kinases, RTKs), 包含有四种亚型(FGFR-1、2、3、4). FGFRs活化后可激活下游的信号通路: MAPK信号通路与FGFR介导的细胞增殖和转移相关, PI3K/AKT信号通路与细胞的运动性和存活相关. 在2013年ASCO就认为关于FGF的研究可改善肿瘤患者治疗及生活质量. 近年许多研究已经发现FGF/FGFR信号通路是肿瘤的驱动因子, 与肿瘤增殖、分化关系密切. 施露等[9]发现FGF19在肝癌中表达明显高于癌旁组织, FGF19低表达的患者拥有更长的生存时间, 说明FGF19蛋白表达与肝癌细胞的侵袭能力及生存时间有关.
肝细胞生长因子(hepatocyte growth factor, HGF)是其受体c-Met(Cellular-mesenchymal to epithelial transition factor)的唯一天然配体, 两者结合后对肝细胞的增殖具有很强的促进作用. c-Met受体与HGF结合后会进一步激活下游的MAPK、PI3K-Akt、c-Jun氨基末端激酶(c-Jun N-terminal kinase, JNK)以及核因子κB(nuclear factor of kappa B, NF-κB)等通路从而发挥作用. 既往的研究结论认为HGF对肝炎治疗有一定作用, 甚至可以抑制肝癌发展. 但后来的研究逐渐发现HGF/c-Met在人体中会促进肝癌细胞的增值与发展. c-Met受体在不同肝癌细胞中会有不同的表达, 与肿瘤的恶性程度紧密相关, 在上皮表型的肝癌细胞呈较低水平的表达, 由间叶细胞组成的肝癌细胞中则表达水平较高[10].
MAPK是细胞内的一类丝氨酸/苏氨酸蛋白激酶, 它介导的细胞反应信号系统存在于大部分哺乳动物的细胞内, 对细胞的生命过程有重要影响. 其包括四个信号通路, 分别是ERK、RAF、JNK以及p38等[11], ERK最早被证实可以介导丝裂原的信号转导, 但近年的研究提示多种物质均可通过不同的途径激活此信号通路, Raf1蛋白激酶就是其中之一, RAF是于20世纪80年代在猪肉瘤病毒中发现的一种蛋白, 随后发现其原癌基因c-raf-1也存在于正常细胞中, 并且受其编码的蛋白也存在于多种细胞中. 生长因子受体、细胞因子受体等通道激活均可激活Raf, 进而激活下游的MAPK, 起到调节细胞增殖、凋亡及分化的作用[12].
哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin, mTOR), 是PI3K/Akt信号通路下游的一种重要的丝氨酸-苏氨酸蛋白激酶, 是雷帕霉素的作用位点, 可以调节细胞的生长代谢、控制细胞转录及蛋白质表达、调节细胞凋亡及自噬, 还参与了细胞的免疫抑制. 它其中一部分与PI3K的催化域同源从而具有丝/苏氨酸蛋白激酶活性, 能够磷酸化蛋白底物的对应残基从而发挥作用. 有研究发现该通路与新生肿瘤血管的关系十分密切[13]并且可以通过抑制该通路来减少肿瘤的增殖和转移[14].
由上可见, 原发性肝癌治疗相关的信号通路较多(图1), 靶向药物可选择性阻断其中一种或数种信号通路, 从而靶向性地抑制肿瘤细胞的生长.
2.1.1 索拉非尼(Sorafenib): 索拉非尼是一种多靶点酪氨酸激酶抑制剂(tyrosine kinase inhibitors, TKIs), 它可作用于VEGFR (包括VEGFR-1, VEGFR-2, VEGFR-3)、血小板衍生生长因子受体(platelet-derived growth factor receptors, PDGF-R)、RAS/RAF/MAPK/ERK信号通路、原癌基因c-KIT、Fms样酪氨酸激酶3(fms-like tyrosine kinase 3, Flt-3)等, 起到阻止HCC细胞增值以及阻止血管生成的双重作用. 索拉非尼是晚期肝癌的一线治疗药物, 为进一步挖掘索拉非尼的疗效, 国内外陆续开展了一系列以索拉非尼为基础的联合治疗研究.
大规模的START试验证明了索拉非尼联合肝动脉栓塞灌注化疗(transcatheter arterial chemoembolization, TACE)的疗效安全性[15]. 一项Ⅲ期临床研究对比索拉非尼单药(s-m组)与索拉非尼联合局部治疗(包括动脉内化疗及局部放射治疗, s-lrts组)晚期肝癌患者的疗效, 在290名患者中, s-lrts组的总体生存期(overall survival, OS)(8.5 mo)和无进展生存期(progression free survival, PFS)(5.3 mo)比s-m组要长. 并且在无论是否合并肝外转移及区域淋巴结转移的情况下, s-lrts组的OS均比s-m组要长(不合并转移: 18.0 mo: 7.8 mo, 合并肝外及区域淋巴结转移: 8.3 mo: 4.8 mo). 并且治疗中发现s-lrts组没有增加额外的毒性反应[16], 可以看到TACE联合索拉非尼的疗效显著, 若患者无TACE相关禁忌症, 是一种疗效颇佳的晚期肝癌综合治疗方法. 一项多中心Ⅱ期临床研究以评价索拉非尼联合mFOLFOX化疗的有效性及安全性, 结果显示中位疾病进展期(median time to progression, mTTP)为7.7 mo, 客观反应率(objective response rate, ORR)为18%, mOS为16.1 mo, 均优于早先进行的SHARP试验(mTTP为5.5 mo, ORR为2%, mOS为10.7 mo), 且没有表现出过大的肝毒性, 该研究中患者的预后与高水平VEGFR-1表达、调节性T细胞及CD56dimNK细胞的升高有关, 为预测预后提供了新的途径[17].
索拉非尼作为晚期肝癌的一线治疗药物, 提高肿瘤对索拉非尼敏感性的研究成为该药基础研究的重点. Guan等[18]研究发现肝癌细胞中TSC-AKT级联反应程度反应了其对于索拉非尼的耐药性大小, TSC-2的表达与预后成负相关的关系, 并且发现全反式维甲酸能够降低AKT活性, 减少了上皮细胞黏附分子细胞的数量, 可以改善对索拉非尼耐药型HCC的预后. Dong等[19]对缺氧诱导因子-2α(hypoxia inducible factor-1, HIF-2α)进行研究, 结果提示环氧化酶-2/前列腺素-2(cyclooxygenase-2/prostaglandin E-2, COX-2/PGE-2)提高了HIF-2α的活性, 间接引起VEGF、细胞周期蛋白D1(cyclin-D1)和TGF-α/EGFR通路活性增强, 从而介导肝癌的发生, 也降低了对索拉非尼的敏感性, 提示了特异性COX-2抑制剂在治疗肝癌方面的潜力. Sun等[20]发现索拉非尼可以明显增强肝癌细胞中MT-1G的mRNA和蛋白质表达从而导致耐药性的发生, 通过基因和药理的方式抑制MT-1G的表达能够增强索拉非尼在体外和肿瘤移植模型中的抗癌活性, 这是一种新的索拉非尼耐药机制.
2.1.2 瑞戈非尼(Regorafenib): 其结构与索拉非尼类似, 可作用于血管生成和肿瘤发生的相关靶点, 包括VEGFR-2和-3、人血管生成素受体酪氨酸激酶-2(tyrosine kinase with immunoglobulin-like and EGF-like domains 2, TIE-2)、PDGFR-β、b FGFR-和原癌基因Ret、c-Kit、c-Raf等, 从而发挥抗肿瘤作用. 已被批准用于转移性结肠癌、经系统治疗后病情进展的胃肠道间质肿瘤等的治疗.
Bruix等[21]进行的国际性、随机、双盲、安慰剂对照Ⅲ期临床研究中, 瑞戈非尼作为二线方案取得了令人鼓舞的效果, 接受瑞戈非尼治疗的肝癌患者mOS为10.6 mo, 而安慰剂组则为7.8 mo, 明显提高了生存期, 因此瑞戈非尼已经被FDA批准肝癌靶向治疗的二线药物, 使得肝癌的靶向治疗体系拥有了"第二梯队". D'Alessandro等[22]发现瑞戈非尼诱导的细胞凋亡能够被EGF所阻断, 且相关癌细胞迁移、入侵的减少效应也会被EGF抑制, 提示瑞戈非尼与EGF、EGFR及其下游途径的抑制剂或者抗血小板药物联合使用可能有更好的抗癌效果, 但其实际效果仍需进一步临床试验检验. 另有研究发现瑞戈非尼可通过解除SHP-1结构域中的N-SH2自动抑制并同时抑制p-STAT3信号来诱导肝细胞凋亡, 该研究还发现在晚期肝癌和低分化肿瘤患者中STAT3的表达水平更高, STAT有可能成为HCC的预后标志物及瑞戈非尼的药物敏感筛选标志物[23].
2.1.3 乐伐替尼(Lenvatinib): 乐伐替尼作为一种多靶点激酶抑制剂可作用于VERGR-1、VERGR-2、VERGR-3、RET、FGFR(1- 4)、c-KIT、PDGFR-α和PDGFR-β等位点, 能够同时抑制肿瘤的新生血管形成及肿瘤细胞的增殖. Kudo等[24]最新公布的研究中对比了乐伐替尼和索拉非尼的疗效及安全性, 结果显示乐伐替尼组的mOS(13.6 mo)与索拉非尼组(12.3 mo)没有明显差异, 而乐伐替尼则在PFS(7.4 mo: 3.4 mo)、TTP(8.9 mo: 3.7 mo)、ORR(24.1%: 9.2%)方面全面优于索拉非尼, 且两种药物不良反应的发生率相当, 此研究结果的公布令人为振奋, 提示乐伐替尼作为一线药物的疗效及安全性丝毫不逊色于索拉非尼, 因此乐伐替尼也被多个国家批准成为治疗肝癌的第二个一线靶向药物[25], 大有全面超越索拉非尼的趋势, 但目前一线药物首选索拉非尼还是乐伐替尼, 仍然需要研究进一步找出差异, 明确不同选择的获益大小. Kimura等[26]研究了乐伐替尼和程序性细胞死亡受体1(programmed cell death 1, PD-1)抗体联合使用, 以了解乐伐替尼的抗肿瘤与免疫调节活性, 研究发现在小鼠中乐伐替尼的抗肿瘤活性联合PD-1抗体后得到增强, 具有更好的肿瘤消退率和反应率, 乐伐替尼联合PD-1抗体的方案值得进一步研究.
2.2.1 贝伐单抗(Bevacizumab): 是一种能作用在人VEGF的重组人源化单克隆IgG1抗体, 贝伐单抗可结合VEGF并防止其与内皮细胞表面的受体结合进而抑制其活性, 起到阻断肿瘤血管生成的作用. 是第一个获得FDA批准上市的抑制肿瘤血管生成药物. 已被批准用于转移性结直肠癌、转移性乳腺癌、晚期非小细胞肺癌、转移性肾细胞癌的治疗.
Hsu等[27]研究了贝伐单抗联合厄洛替尼晚期肝癌患者安全性与有效性, 以PFS = 16 wk为主要终点, 达到终点的病例为35.3%, mPFS为2.9 mo, mOS为10.7 mo. 主要不良反应有皮疹、痤疮(10%), 腹泻(6%)和胃肠道出血(4%), 表现出良好的适应与耐受性. DE Pasquale等[28]报道了5名儿童肝癌患者接受贝伐单抗联合铂类化疗的研究, 结果54 mo后4名患者仍存活, OS范围为20-85 mo, 由于仅纳入5例儿童肝癌患者, 其疗效需进一步验证.
2.2.2 雷莫芦单抗(Ramucirumab): 是作用于VEGFR-2的人源化免疫球蛋白G1单克隆抗体, 可以干扰配体与VEGFR-2的结合从而抑制肿瘤的新生血管形成. Zhu等[29]进行的REACH研究, 显示雷莫芦单抗作为二线治疗药物并没有显著提高晚期肝癌患者的生存期, 雷莫芦单抗组OS为9.2 mo, 安慰剂组为7.6 mo, 但在甲胎蛋白(alpha-fetoprotein, AFP)≥400 ng/mL的患者中能显著提高其生存期(7.8 mo: 4.2 mo). 根据肝功能进行分组后的分析表明, 雷莫芦单抗只能改善child-pugh评分为5分和6分的患者的总体生存率[30]. 对REACH研究中日本人亚组的数据进行分析, 同样也发现了在AFP≥400 ng/mL的患者中, 雷莫芦单抗能够为患者带来更大的获益[31], 提示AFP的表达水平可能是雷莫芦单抗治疗的预后预测指标. 随后的REACH-2研究对此开展针对性的探索, 初步结果在2018年的ASCO年会上得到公布[32], 雷莫芦单抗组相对安慰剂组拥有更长的OS(8.5:7.3), 雷莫芦单抗对AFP明显升高的肝癌患者获益更加明显, 对于该类患者雷莫芦单抗将可能成为有效的二线治疗药物.
2.2.3 bd0801: 中国新发现的抗VEGF单克隆抗体bd0801在体内体外均能抑制肝癌细胞的增值并诱导凋亡, 其机制可能为BD0801可抑制AKT、ERK1/2、磷酸化Rb基因及Cyclin D1的表达. 该研究还发现在体内及体外BD0801均比贝伐单抗有更强的抑制细胞生长及诱导细胞凋亡的作用[33], BD0801很有希望成为新型国产抗肝癌药物.
2.3.1 拉帕替尼(Lapatinib): 为新型的酪氨酸酶抑制剂, 能够通过抑制EGFR以及HER2这两种受体起到抑瘤作用, 常与卡培他滨联合治疗晚期乳腺癌. 有研究提示拉帕替尼能够诱导自噬性细胞死亡从而抑制肝癌生长, 其可能成为新型的抗肝癌药物[34]. Chen等[35]发现拉帕替尼可通过诱导ErbB3(也称HER3)表达增强HCC细胞对EGFR/ErbB2抑制剂的敏感性, 提示拉帕替尼与其他EGFR / ErbB2抑制剂联合使用有可能获得更好的疗效.
2.3.2 西妥昔单抗(Cetuximab): 是抗EGFR的IgG1单克隆抗体, 可以与EGFR的配体转化生长因子-β(transforming growth factor-α, TGF-α)、EGF进行竞争, 并最终与EGFR结合, 阻止其异常活化, 从而抑制肿瘤进展. 有研究发现雷帕霉素的治疗显著地恢复了HCC细胞对西妥昔单抗的敏感性, 并降低该细胞中的mTOR信号表达[36]. 另一项研究也发现了西妥昔单抗与雷帕霉素的协同作用, 提示EGFR和PI3K/Akt信号通路抑制剂联合治疗可能是治疗肝癌的一种新方法[37]. Xue等[38]报道Let-7a和STAT3这两个信号通路在提高肝癌细胞对西妥昔单抗的敏感性方面有功能上的联系, 为西妥昔的耐药机制研究提供了新思路.
2.4.1 Tivantinib: 是一种口服的高选择性C-met抑制剂, 对多种肿瘤均有不同程度疗效, 它的抗肿瘤机制包括抑制靶点酪氨酸激酶、蛋白激酶、C-met受体酪氨酸激酶以及抑制肿瘤血管生成. Tivantinib安全性的研究结果提示其不良反应是可控的、轻微的, 并表现出了一定的抗瘤活性[39]. 一项多中心、随机、安慰剂对照、双盲、二期研究中, Tivantinib作为二线药物对比安慰剂治疗拥有更长的TTP(1.6 mo: 1.4 mo), 在MET高活性的肿瘤中, Tivantinib组的mTTP更长(2.7 mo: 1.4 mo), 提示Tivantinib成为二线治疗药物的潜力[40]. 但随后的METIV-HCC试验[41]得出了相反的结论, 此研究共纳入340名患者, 均通过病理检测确定其肿瘤为MET高活性表达, 结果发现tivantinib组与安慰剂组相比并未拥有更长的生存时间(mOS: 8.4 mo: 9.1 mo), 目前看来, Tivantinib作为一种MET抑制剂对于晚期肝癌患者的疗效并不明确.
2.4.2 卡博替尼(Cabozantinib): 是一种原癌基因(RET)、c-Met及VEGFR抑制剂, 可以抑制多种肿瘤靶点. 2012年获得FDA批准用于治疗晚期甲状腺髓样癌. 在Kelley报道的一项二期、安慰剂对照、随机临床试验中, 12周达到部分缓解(partial response, PR)的为66%, 结果提示卡博替尼提高了肝癌患者的PFS(试验组及安慰剂组的mOS为2.5 mo、1.4 mo)并能降低AFP水平[42]. 更大规模的研究中纳入了707例经过系统治疗仍出现进展的肝癌患者, 结果显示卡博替尼组的OS及PFS均优于安慰剂组(mOS: 10.2 mo: 8.0 mo, PFS: 5.2 mo: 1.9 mo), 提示卡博替尼能够使之前接受过系统治疗仍进展的晚期肝癌患者获益[43].
雷帕霉素(Rapamycin, Sirolimus)与依维莫司(Everolimus)均为口服的mTOR抑制剂, 依维莫司是雷帕霉素的衍生物. 已有研究发现雷帕霉素对于晚期肝癌患者有一定疗效(mTTP为3.8 mo, mOS为6.6 mo)[44], 早期也发现了依维莫司对于肝癌细胞生长及肿瘤新生血管形成起到了明显的抑制作用[45], 然而进一步多个大规模的临床试验表明, 单独使用依维莫司[46]或是与联合索拉非尼进行治疗[47], 均无法使患者得到更多的获益. 但近来发现, mTOR拮抗剂与雄激素受体拮抗剂联合使用对治疗肝癌具有协同作用[48], 这两种药物组合的疗效值得进一步检验.
2.6.1 硼替佐米(bortezomib): 是第一个在临床得到应用的可逆性蛋白酶体抑制剂, 它是一种二肽硼酸盐, 可以与蛋白酶体活性位点的苏氨酸结合来抑制其26S亚基的活性, 从而抑制与细胞增殖相关基因的表达. 硼替佐米联合肿瘤坏死因子相关凋亡诱导配体(TRAIL)可以选择性诱导肝肿瘤细胞凋亡, 但在健康的肝细胞中却不会引起凋亡, 为肝癌治疗提供了一种新的探索方向[49].
2.6.2 纳武单抗(Nivolumab): 是PD-1的人源化单克隆抗体, 可以阻止PD-1与程序性细胞死亡受体-配体 1(programmed cell death-ligand 1, PD-L1)及程序性细胞死亡受体-配体 1(programmed cell death-ligand 2, PD-L2)发生相互作用, 启动PD-1信号通路相关的免疫反应, 使得T淋巴细胞的抗肿瘤活性及免疫应答得以恢复, 发挥抑制肿瘤细胞增殖及杀伤肿瘤细胞的作用. 纳武单抗在2015年被FDA批准用于无法切除或有转移的黑色素瘤, 随后在转移性鳞状非小细胞肺癌上也得到应用, 收到了良好的疗效. 随着PD-1通路药物在许多肿瘤治疗上相继取得成功, 其对于肝癌治疗的潜力也正逐渐被开发. Check Mate 040研究共262名患者参与研究(包括既往曾接受过索拉非尼治疗的患者), 其中完成剂量递增试验的为48名, 完成剂量扩展试验的为214名, 在剂量递增试验中的发生3/4级治疗相关不良反应率为25%(12例), 剂量扩展试验中, 纳武单抗的客观有效率为20%, 疾病控制率为64%, 9 mo的生存期达74%, 无进展生存期的中位数为4.0 mo, 结果显示纳武单抗应用于晚期肝癌患者的安全性及有效性[50], 许多国家在2017年批准了其用于晚期肝癌的二线治疗[51]. 纳武单抗由于其独特的抗癌通路, 是目前对多靶点激酶抑制剂耐药患者的新选择, 即使服用过多种TKIs后发生耐药, 纳武单抗仍然能够产生抗癌作用. 以PD-1通路药物为代表的免疫治疗正在迅速发展, 众多该类新药试验正在开展, 未来在肝癌治疗上的表现非常值得期待.
肝癌, 作为一种全世界范围内高发的消化系统恶性肿瘤, 给人类带来极大的经济、精神负担, 而传统疗法对于晚期肝癌收效甚微, 晚期肝癌如何治疗才能最大获益是我们长期的困扰. 靶向药物的诞生, 特别是索拉非尼的成功为肝癌的治疗翻开了新的篇章, 许多靶向药物的研究相继开展(表1), 但到目前为止, 取得明确疗效的靶向药物依然只有寥寥2-3种. 究其原因, 是因为肝癌发生发展的因素众多, 在进展过程中多种信号通路均发挥着不同的作用, 单一的抑制某一通路难以带来预期的效果, 靶向治疗若想进一步发展, 需要明确能够促进肝癌进展的主要通路, 从而在其主要通路上进行治疗.
| 类型 | 药名 | 试验阶段 | 试验数量 |
| PD-1通路抑制剂 | Pembrolizumab | 3 | 24 |
| Durvalumab | 2 | 8 | |
| SHR-1210 | 3 | 7 | |
| Tremelimumab | 3 | 7 | |
| PDR001 | 1/2 | 3 | |
| Atezolizumab | 3 | 3 | |
| Avelumab | 1/2 | 3 | |
| BGB-A317 | 3 | 2 | |
| Sintilimab | 2/3 | 1 | |
| KN035 | 1 | 1 | |
| 血管生成抑制剂 | 阿帕替尼 | 3 | 21 |
| 贝伐单抗 | 3 | 8 | |
| 雷莫芦单抗 | 3 | 3 | |
| Rh-endostatin | 2 | 2 | |
| Brivanib | 2 | 1 | |
| Carotuximab | 1/2 | 1 | |
| 多靶点激酶抑制剂 | 索拉非尼 | 获批临床应用 | 108 |
| 乐伐替尼 | 获批临床应用 | 13 | |
| 卡博替尼 | 3 | 8 | |
| Vorolanib | 1 | 1 | |
| Chiauranib | 1 | 1 | |
| CDK抑制剂 | Abemaciclib | 2 | 1 |
| LEE011 | 2 | 1 | |
| CTLA-4抑制剂 | Lpilimumab | 2 | 6 |
| 表皮生长因子抑制剂 | Varlitinib | 1/2 | 1 |
| 磷脂酰丝氨酸抗体 | Bavituximab | 2 | 1 |
| mTor通路抑制剂 | ATG-008 | 2 | 1 |
目前肿瘤的治疗仍以综合治疗为主, 要想提高靶向治疗的疗效, 不但要在提高药物靶向性、寻找最佳剂量及疗程等方面加强研究, 还要大力发掘靶向药物结合其他治疗方法的潜力, 发挥各自所长、综合施治. 并进一步寻找预测靶向药物敏感的标记物, 在治疗前就能为不同的患者定制个体化的治疗方案, 以期省时省力达到精准治疗的效果. 靶向药物治疗用于肝癌治疗只有十余年的历史, 肝癌靶向的道路刚起步不久, 仍然需要长时间大量基础及临床研究将其治疗体系逐渐完善, 随着研究的逐渐深入, 相信未来靶向药物能够在肝癌治疗上有进一步的突破.
学科分类: 胃肠病学和肝病学
手稿来源地: 广西壮族自治区
同行评议报告分类
A级 (优秀): 0
B级 (非常好): 0
C级 (良好): C, C, C
D级 (一般): D
E级 (差): 0
编辑: 崔丽君 电编:张砚梁
| 1. | Chen W, Zheng R, Baade PD, Zhang S, Zeng H, Bray F, Jemal A, Yu XQ, He J. Cancer statistics in China, 2015. CA Cancer J Clin. 2016;66:115-132. [PubMed] [DOI] |
| 2. | Lan T, Chang L, Rahmathullah MN, Wu L, Yuan YF. Comparative Efficacy of Interventional Therapies for Early-stage Hepatocellular Carcinoma: A PRISMA-compliant Systematic Review and Network Meta-analysis. Medicine (Baltimore). 2016;95:e3185. [PubMed] [DOI] |
| 3. | Llovet JM, Ricci S, Mazzaferro V, Hilgard P, Gane E, Blanc JF, de Oliveira AC, Santoro A, Raoul JL, Forner A, Schwartz M, Porta C, Zeuzem S, Bolondi L, Greten TF, Galle PR, Seitz JF, Borbath I, Häussinger D, Giannaris T, Shan M, Moscovici M, Voliotis D, Bruix J; SHARP Investigators Study Group. Sorafenib in advanced hepatocellular carcinoma. N Engl J Med. 2008;359:378-390. [PubMed] [DOI] |
| 4. | Zhu AX. Beyond sorafenib: novel targeted therapies for advanced hepatocellular carcinoma. Expert Opin Investig Drugs. 2010;19:663-672. [PubMed] [DOI] |
| 5. | 赵 海亮, 黄 桂柳, 黄 赞松, 周 喜汉, 邓 志华, 覃 月秋. 苦参碱抑制人肝癌HepG2细胞增殖及其对VEGF、MMP-9表达的影响. 右江民族医学院学报. 2016;38:1-5. [DOI] |
| 7. | 高 建芝, 杜 经丽, 李 佳, 姬 翔, 韦 立新. VEGF相关信号通路在肝癌组织中的表达及临床意义. 临床与实验病理学杂志. 2014;30:75-78. [DOI] |
| 8. | 高 潺潺, 吴 平平, 金 潇潇. VEGF、EGFR在原发性肝癌中的表达及其临床意义. 南京医科大学学报(自然科学版). 2016;36:1436-1439. [DOI] |
| 10. | You H, Ding W, Dang H, Jiang Y, Rountree CB. c-Met represents a potential therapeutic target for personalized treatment in hepatocellular carcinoma. Hepatology. 2011;54:879-889. [PubMed] [DOI] |
| 11. | Chong H, Vikis HG, Guan K. Mechanisms of regulating the Raf kinase family. Cell Signal. 2003;15:463-469. [PubMed] |
| 12. | Huang M, Huang B, Li G, Zeng S. Apatinib affect VEGF-mediated cell proliferation, migration, invasion via blocking VEGFR2/RAF/MEK/ERK and PI3K/AKT pathways in cholangiocarcinoma cell. BMC Gastroenterol. 2018;18:169. [PubMed] [DOI] |
| 14. | Li JX, Bi YP, Wang J, Yang X, Tian YF, Sun ZF. JTC-801 inhibits the proliferation and metastasis of ovarian cancer cell SKOV3 through inhibition of the PI3K - AKT signaling pathway. Pharmazie. 2018;73:283-287. [PubMed] [DOI] |
| 15. | Pawlik TM, Reyes DK, Cosgrove D, Kamel IR, Bhagat N, Geschwind JF. Phase II trial of sorafenib combined with concurrent transarterial chemoembolization with drug-eluting beads for hepatocellular carcinoma. J Clin Oncol. 2011;29:3960-3967. [PubMed] [DOI] |
| 16. | Lee S, Kim BK, Kim SU, Park Y, Chang S, Park JY, Kim DY, Ahn SH, Chon CY, Han KH. Efficacy of sorafenib monotherapy versus sorafenib-based loco-regional treatments in advanced hepatocellular carcinoma. PLoS One. 2013;8:e77240. [PubMed] [DOI] |
| 17. | Goyal L, Zheng H, Abrams TA, Miksad R, Bullock AJ, Allen JN, Yurgelun MB, Clark JW, Kambadakone A, Muzikansky A, Knowles M, Galway A, Afflitto AJ, Dinicola CF, Regan E, Hato T, Mamessier E, Shigeta K, Jain RK, Duda DG, Zhu AX. A Phase II and Biomarker Study of Sorafenib Combined with Modified FOLFOX in Patients with Advanced Hepatocellular Carcinoma. Clin Cancer Res. 2019;25:80-89. [PubMed] [DOI] |
| 18. | Guan DX, Shi J, Zhang Y, Zhao JS, Long LY, Chen TW, Zhang EB, Feng YY, Bao WD, Deng YZ, Qiu L, Zhang XL, Koeffler HP, Cheng SQ, Li JJ, Xie D. Sorafenib enriches epithelial cell adhesion molecule-positive tumor initiating cells and exacerbates a subtype of hepatocellular carcinoma through TSC2-AKT cascade. Hepatology. 2015;62:1791-1803. [PubMed] [DOI] |
| 19. | Dong XF, Liu TQ, Zhi XT, Zou J, Zhong JT, Li T, Mo XL, Zhou W, Guo WW, Liu X, Chen YY, Li MY, Zhong XG, Han YM, Wang ZH, Dong ZR. COX-2/PGE2 Axis Regulates HIF2α Activity to Promote Hepatocellular Carcinoma Hypoxic Response and Reduce the Sensitivity of Sorafenib Treatment. Clin Cancer Res. 2018;24:3204-3216. [PubMed] [DOI] |
| 20. | Sun X, Niu X, Chen R, He W, Chen D, Kang R, Tang D. Metallothionein-1G facilitates sorafenib resistance through inhibition of ferroptosis. Hepatology. 2016;64:488-500. [PubMed] [DOI] |
| 21. | Bruix J, Tak WY, Gasbarrini A, Santoro A, Colombo M, Lim HY, Mazzaferro V, Wiest R, Reig M, Wagner A, Bolondi L. Regorafenib as second-line therapy for intermediate or advanced hepatocellular carcinoma: multicentre, open-label, phase II safety study. Eur J Cancer. 2013;49:3412-3419. [PubMed] [DOI] |
| 22. | D'Alessandro R, Refolo MG, Lippolis C, Carella N, Messa C, Cavallini A, Carr BI. Modulation of Regorafenib effects on HCC cell lines by epidermal growth factor. Cancer Chemother Pharmacol. 2015;75:1237-1245. [PubMed] [DOI] |
| 23. | Tai WT, Chu PY, Shiau CW, Chen YL, Li YS, Hung MH, Chen LJ, Chen PL, Su JC, Lin PY, Yu HC, Chen KF. STAT3 mediates regorafenib-induced apoptosis in hepatocellular carcinoma. Clin Cancer Res. 2014;20:5768-5776. [PubMed] [DOI] |
| 24. | Kudo M, Finn RS, Qin S, Han KH, Ikeda K, Piscaglia F, Baron A, Park JW, Han G, Jassem J, Blanc JF, Vogel A, Komov D, Evans TRJ, Lopez C, Dutcus C, Guo M, Saito K, Kraljevic S, Tamai T, Ren M, Cheng AL. Lenvatinib versus sorafenib in first-line treatment of patients with unresectable hepatocellular carcinoma: a randomised phase 3 non-inferiority trial. Lancet. 2018;391:1163-1173. [PubMed] [DOI] |
| 25. | Kudo M. Systemic Therapy for Hepatocellular Carcinoma: Latest Advances. Cancers (Basel). 2018;10:pii: E412. [PubMed] [DOI] |
| 26. | Kimura T, Kato Y, Ozawa Y, Kodama K, Ito J, Ichikawa K, Yamada K, Hori Y, Tabata K, Takase K, Matsui J, Funahashi Y, Nomoto K. Immunomodulatory activity of lenvatinib contributes to antitumor activity in the Hepa1-6 hepatocellular carcinoma model. Cancer Sci. 2018;109:3993-4002. [PubMed] [DOI] |
| 27. | Hsu CH, Kang YK, Yang TS, Shun CT, Shao YY, Su WC, Sandoval-Tan J, Chiou TJ, Jin K, Hsu C, Cheng AL. Bevacizumab with erlotinib as first-line therapy in Asian patients with advanced hepatocellular carcinoma: a multicenter phase II study. Oncology. 2013;85:44-52. [PubMed] [DOI] |
| 28. | DE Pasquale MD, de Ville de Goyet J, Monti L, Grimaldi C, Crocoli A, Castellano A. Bevacizumab Combined with Chemotherapy in Children Affected by Hepatocellular Carcinoma: a Single-center Experience. Anticancer Res. 2017;37:1489-1493. [PubMed] [DOI] |
| 29. | Zhu AX, Park JO, Ryoo BY, Yen CJ, Poon R, Pastorelli D, Blanc JF, Chung HC, Baron AD, Pfiffer TE, Okusaka T, Kubackova K, Trojan J, Sastre J, Chau I, Chang SC, Abada PB, Yang L, Schwartz JD, Kudo M; REACH Trial Investigators. Ramucirumab versus placebo as second-line treatment in patients with advanced hepatocellular carcinoma following first-line therapy with sorafenib (REACH): a randomised, double-blind, multicentre, phase 3 trial. Lancet Oncol. 2015;16:859-870. [PubMed] [DOI] |
| 30. | Zhu AX, Baron AD, Malfertheiner P, Kudo M, Kawazoe S, Pezet D, Weissinger F, Brandi G, Barone CA, Okusaka T, Wada Y, Park JO, Ryoo BY, Cho JY, Chung HC, Li CP, Yen CJ, Lee KD, Chang SC, Yang L, Abada PB, Chau I. Ramucirumab as Second-Line Treatment in Patients With Advanced Hepatocellular Carcinoma: Analysis of REACH Trial Results by Child-Pugh Score. JAMA Oncol. 2016;. [PubMed] [DOI] |
| 31. | Kudo M, Hatano E, Ohkawa S, Fujii H, Masumoto A, Furuse J, Wada Y, Ishii H, Obi S, Kaneko S, Kawazoe S, Yokosuka O, Ikeda M, Ukai K, Morita S, Tsuji A, Kudo T, Shimada M, Osaki Y, Tateishi R, Sugiyama G, Abada PB, Yang L, Okusaka T, Zhu AX. Ramucirumab as second-line treatment in patients with advanced hepatocellular carcinoma: Japanese subgroup analysis of the REACH trial. J Gastroenterol. 2017;52:494-503. [PubMed] [DOI] |
| 32. | Kudo M. Ramucirumab as Second-Line Systemic Therapy in Hepatocellular Carcinoma. Liver Cancer. 2018;7:305-311. [PubMed] [DOI] |
| 33. | Liu L, Qin S, Zheng Y, Han L, Zhang M, Luo N, Liu Z, Gu N, Gu X, Yin X. Molecular targeting of VEGF/VEGFR signaling by the anti-VEGF monoclonal antibody BD0801 inhibits the growth and induces apoptosis of human hepatocellular carcinoma cells in vitro and in vivo. Cancer Biol Ther. 2017;18:166-176. [PubMed] [DOI] |
| 34. | Chen YJ, Chi CW, Su WC, Huang HL. Lapatinib induces autophagic cell death and inhibits growth of human hepatocellular carcinoma. Oncotarget. 2014;5:4845-4854. [PubMed] [DOI] |
| 35. | Chen JY, Chen YJ, Yen CJ, Chen WS, Huang WC. HBx sensitizes hepatocellular carcinoma cells to lapatinib by up-regulating ErbB3. Oncotarget. 2016;7:473-489. [PubMed] [DOI] |
| 36. | Chen W, Hu QD, Xia XF, Liang C, Liu H, Zhang Q, Ma T, Liang F, Liang TB. Rapamycin enhances cetuximab cytotoxicity by inhibiting mTOR-mediated drug resistance in mesenchymal hepatoma cells. Cancer Biol Ther. 2014;15:992-999. [PubMed] [DOI] |
| 37. | Geng J, Li X, Lang X, Qiao C, Hu M, Yang J, Feng J, Lv M. Combination of cetuximab and rapamycin enhances the therapeutic efficacy in hepatocellular carcinoma. Technol Cancer Res Treat. 2014;13:377-385. [PubMed] [DOI] |
| 38. | Xue F, Liu Y, Zhang H, Wen Y, Yan L, Tang Q, Xiao E, Zhang D. Let-7a enhances the sensitivity of hepatocellular carcinoma cells to cetuximab by regulating STAT3 expression. Onco Targets Ther. 2016;9:7253-7261. [PubMed] [DOI] |
| 39. | Santoro A, Simonelli M, Rodriguez-Lope C, Zucali P, Camacho LH, Granito A, Senzer N, Rimassa L, Abbadessa G, Schwartz B, Lamar M, Savage RE, Bruix J. A Phase-1b study of tivantinib (ARQ 197) in adult patients with hepatocellular carcinoma and cirrhosis. Br J Cancer. 2013;108:21-24. [PubMed] [DOI] |
| 40. | Santoro A, Rimassa L, Borbath I, Daniele B, Salvagni S, Van Laethem JL, Van Vlierberghe H, Trojan J, Kolligs FT, Weiss A, Miles S, Gasbarrini A, Lencioni M, Cicalese L, Sherman M, Gridelli C, Buggisch P, Gerken G, Schmid RM, Boni C, Personeni N, Hassoun Z, Abbadessa G, Schwartz B, Von Roemeling R, Lamar ME, Chen Y, Porta C. Tivantinib for second-line treatment of advanced hepatocellular carcinoma: a randomised, placebo-controlled phase 2 study. Lancet Oncol. 2013;14:55-63. [PubMed] [DOI] |
| 41. | Rimassa L, Assenat E, Peck-Radosavljevic M, Pracht M, Zagonel V, Mathurin P, Rota Caremoli E, Porta C, Daniele B, Bolondi L, Mazzaferro V, Harris W, Damjanov N, Pastorelli D, Reig M, Knox J, Negri F, Trojan J, López López C, Personeni N, Decaens T, Dupuy M, Sieghart W, Abbadessa G, Schwartz B, Lamar M, Goldberg T, Shuster D, Santoro A, Bruix J. Tivantinib for second-line treatment of MET-high, advanced hepatocellular carcinoma (METIV-HCC): a final analysis of a phase 3, randomised, placebo-controlled study. Lancet Oncol. 2018;19:682-693. [PubMed] [DOI] |
| 42. | Kelley RK, Verslype C, Cohn AL, Yang TS, Su WC, Burris H, Braiteh F, Vogelzang N, Spira A, Foster P, Lee Y, Van Cutsem E. Cabozantinib in hepatocellular carcinoma: results of a phase 2 placebo-controlled randomized discontinuation study. Ann Oncol. 2017;28:528-534. [PubMed] [DOI] |
| 43. | Abou-Alfa GK, Meyer T, Cheng AL, El-Khoueiry AB, Rimassa L, Ryoo BY, Cicin I, Merle P, Chen Y, Park JW, Blanc JF, Bolondi L, Klümpen HJ, Chan SL, Zagonel V, Pressiani T, Ryu MH, Venook AP, Hessel C, Borgman-Hagey AE, Schwab G, Kelley RK. Cabozantinib in Patients with Advanced and Progressing Hepatocellular Carcinoma. N Engl J Med. 2018;379:54-63. [PubMed] [DOI] |
| 44. | Decaens T, Luciani A, Itti E, Hulin A, Roudot-Thoraval F, Laurent A, Zafrani ES, Mallat A, Duvoux C. Phase II study of sirolimus in treatment-naive patients with advanced hepatocellular carcinoma. Dig Liver Dis. 2012;44:610-616. [PubMed] [DOI] |
| 45. | Huynh H, Chow KH, Soo KC, Toh HC, Choo SP, Foo KF, Poon D, Ngo VC, Tran E. RAD001 (everolimus) inhibits tumour growth in xenograft models of human hepatocellular carcinoma. J Cell Mol Med. 2009;13:1371-1380. [PubMed] [DOI] |
| 46. | Finn RS, Poon RT, Yau T, Klümpen HJ, Chen LT, Kang YK, Kim TY, Gomez-Martin C, Rodriguez-Lope C, Kunz T, Paquet T, Brandt U, Sellami D, Bruix J. Phase I study investigating everolimus combined with sorafenib in patients with advanced hepatocellular carcinoma. J Hepatol. 2013;59:1271-1277. [PubMed] [DOI] |
| 47. | Zhu AX, Kudo M, Assenat E, Cattan S, Kang YK, Lim HY, Poon RT, Blanc JF, Vogel A, Chen CL, Dorval E, Peck-Radosavljevic M, Santoro A, Daniele B, Furuse J, Jappe A, Perraud K, Anak O, Sellami DB, Chen LT. Effect of everolimus on survival in advanced hepatocellular carcinoma after failure of sorafenib: the EVOLVE-1 randomized clinical trial. JAMA. 2014;312:57-67. [PubMed] [DOI] |
| 48. | Zhang H, Li XX, Yang Y, Zhang Y, Wang HY, Zheng XFS. Significance and mechanism of androgen receptor overexpression and androgen receptor/mechanistic target of rapamycin cross-talk in hepatocellular carcinoma. Hepatology. 2018;67:2271-2286. [PubMed] [DOI] |
| 49. | Wahl K, Siegemund M, Lehner F, Vondran F, Nüssler A, Länger F, Krech T, Kontermann R, Manns MP, Schulze-Osthoff K, Pfizenmaier K, Bantel H. Increased apoptosis induction in hepatocellular carcinoma by a novel tumor-targeted TRAIL fusion protein combined with bortezomib. Hepatology. 2013;57:625-636. [PubMed] [DOI] |
| 50. | El Khoueiry AB, Sangro B, Yau T, Crocenzi TS, Kudo M, Hsu C, Kim TY, Choo SP, Trojan J, Welling TH RD, Meyer T, Kang YK, Yeo W, Chopra A, Anderson J, Dela Cruz C, Lang L, Neely J, Tang H, Dastani HB, Melero I. Nivolumab in patients with advanced hepatocellular carcinoma (CheckMate 040): an open-label, non-comparative, phase 1/2 dose escalation and expansion trial. Lancet. 2017;389:2492-2502. [PubMed] [DOI] |
| 51. | Nivolumab Approved for Liver Cancer. Cancer Discov. 2017;7:OF3. [PubMed] [DOI] |