修回日期: 2019-01-30
接受日期: 2019-03-10
在线出版日期: 2019-04-08
加速康复外科(enhanced recovery after surgery, ERAS)是指在围手术期通过多学科协作模式采取一系列基于循证医学证据的最优化措施, 降低围手术期应激反应, 加快患者术后各器官功能恢复. ERAS已在多个学科得到推广, 并被证实可以提高患者近期预后, 而针对患者远期预后的研究正在初步进行.
评价围手术期应用ERAS对消化道肿瘤患者生存率的影响.
应用计算机检索1995-01/2018-11万方、CNKI、维普、PubMed、Cochrane Library、EMBASE数据库有关消化道肿瘤患者围手术期应用ERAS的随机对照试验、病例对照研究, 由两名研究者分别对符合纳入标准的研究进行质量评价和数据提取, 采用RevMan5.3.5软件进行Meta分析.
共纳入10篇研究进行Meta分析, 共计2477例患者, 其中ERAS组751例, 对照组(采取传统围手术期管理)1726例. 与对照组相比, ERAS组术后3年生存率提高(OR = 0.48, 95%CI: 0.30-0.78, P<0.05), 术后5年生存率提高(OR = 0.51, 95%CI: 0.40-0.65, P<0.05); 两组术后1年生存率差异无统计学意义(OR = 1.13, 95%CI: 0.63-2.02, P>0.05), 术后2年生存率差异无统计学意义(OR = 1.19, 95%CI: 0.38-3.73, P>0.05).
消化道肿瘤手术围手术期实施ERAS可以改善预后, 3年生存率, 5年生存率.
核心提要: 加速康复外科通过多学科合作模式采取一系列基于循证医学证据的最优化措施, 减少围手术期应激反应, 改善患者围手术期的免疫抑制状态, 可以提高肿瘤患者的远期预后.
引文著录: 冀海斌, 陈强谱, 张帆, 朱文涛, 赵宝磊, 魏强, 孙宝房, 杨祯, 王霄霄. 加速康复外科对消化道肿瘤患者长期生存率影响的Meta分析. 世界华人消化杂志 2019; 27(7): 442-449
Revised: January 30, 2019
Accepted: March 10, 2019
Published online: April 8, 2019
Enhanced recovery after surgery (ERAS) programs refer to a series of optimization measures based on evidence-based medical evidence to reduce perioperative stress response and speed up the recovery of organ function after surgery through a multi-disciplinary collaboration model. ERAS has been popularized in many disciplines and proved to improve the short-term prognosis of patients, while the study of long-term prognosis of patients is limited.
To evaluate the impact of ERAS programs on the long-term survival among patients undergoing digestive tract tumor surgery.
Computer searches were performed in databases including Wanfang, CNKI, VIP, PubMed, Cochrane Library, and EMBASE for randomized controlled trials or case-control studies describing ERAS programs in patients undergoing digestive tract tumor surgery published between January 1995 and November 2018. Two researchers independently evaluated the quality of studies that met the inclusion criteria and performed a meta-analysis using RevMan5.3.5 software.
A total of ten studies including 2477 patients were selected for the meta-analysis, including the ERAS group (n = 751) and the control group (n = 1726, undergoing traditional perioperative management). Compared with the control group, the ERAS group had improved 3-year survival (OR = 0.48, 95%CI: 0.30-0.78, P < 0.05) and 5-year survival (OR = 0.51, 95%CI: 0.40-0.65, P < 0.05). However, no significant difference was observed in 1-year survival (OR = 1.13, 95%CI: 0.63-2.02, P > 0.05) or 2-year survival (OR = 1.19, 95%CI: 0.38-3.73, P > 0.05) between the two groups.
Perioperative implementation of ERAS programs can improve outcomes and 3- and 5-year survival among patients undergoing digestive tract tumor surgery.
- Citation: Ji HB, Chen QP, Zhang F, Zhu WT, Zhao BL, Wei Q, Sun BF, Yang Z, Wang XX. Impact of enhanced recovery after surgery programs on long-term survival among patients undergoing digestive tract tumor surgery: A meta-analysis. Shijie Huaren Xiaohua Zazhi 2019; 27(7): 442-449
- URL: https://www.wjgnet.com/1009-3079/full/v27/i7/442.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v27.i7.442
加速康复外科(enhanced recovery after surgery, ERAS)或快通道外科(fast track surgery)由丹麦医生Kehlet[1]于1997年首次提出, 其核心理念是指在外科围手术期通过多学科合作模式采取一系列基于循证医学证据的最优化措施, 减少围手术期应激反应, 加快患者术后器官功能恢复, 缩短术后住院时间. ERAS已经在多个学科得到推广, 并被证实围手术期实施ERAS不仅可以缩短术后住院时间, 还可以减少术后并发症发生率, 减少患者住院费用, 节约医疗资源[2]. 研究证实, 肿瘤患者手术创伤可使血液循环中的自然杀伤细胞、细胞毒性T淋巴细胞等免疫细胞数目减少, 而引起免疫抑制, 围手术期应用ERAS(如, 麻醉理念、镇痛方式的转变等)可以改善患者围手术期的免疫抑制状态, 或许可以改善肿瘤患者的远期预后[3]. 本研究经检索国内外相关文献, 运用Meta分析评价围手术期应用ERAS理念对消化道肿瘤患者远期生存率的影响.
应用计算机检索1995-01/2018-11万方、CNKI、维普、PubMed、Cochrane Library、EMBASE数据库, 语种为中文或英文; 中文检索词为"快速康复外科"、"加速康复外科"、"快通道外科"、"生存率"、"生存期"、"消化道肿瘤"、"胃肠肿瘤"; 英文检索词为"enhanced recovery after surgery"、"fast track surgery"、"ERAS"、"clinical pathways"、"survival rate"、"digestive tract tumor"、"gastrointestinal cancer".
纳入标准: (1)研究对象为接受手术的消化道肿瘤患者; (2)实验组围手术期应用ERAS理念, 对照组则采用传统围手术期管理; (3)研究必须对ERAS组和对照组的主要围手术期管理措施进行描述; (4)观察结局需要包括对患者出院后的随访并记录不同时间段的生存率.
排除标准: (1)单个研究样本量低于20例; (2)评论、综述、病例报告和单一队列等非对照性研究; (3)针对同一研究人群而重复发表的文献; (4)病例临床资料不完整.
1.2.1 文献质量评价: 两名研究者分别对纳入的所有研究进行独立评价, 若有分歧, 则由第三名研究者参与协商或裁定. 两名研究者可根据MINORS(Methodological Index for Non-Randomized Studies)条目对纳入的病例对照研究进行评价; MINORS质量评价工具共包括12个质量条目, 第1-8个条目适于评价非随机无对照研究, 增添第9-12个条目用于评价非随机对照研究, 每个条目评分0-2分(0分, 未报道; 1分, 不完全报道; 2分, 完全报道). 同时, 两名研究者根据Cochrane协作网工作组制定的Cochrane偏倚风险评价工具对纳入的随机对照研究进行评价, 评价内容包括6个方面: (1)随机序列的产生; (2)是否进行分配隐藏; (3)是否对受试者、研究人员和结局评价者施盲; (4)结局资料是否完全; (5)是否说明没有选择性结局报告; (6)是否说明没有其他偏倚来源; "是"表明低偏倚风险, "否"表明高偏倚风险, "不清楚"表明无法判断偏倚风险.
1.2.2 数据提取: 两名研究者分别对纳入研究进行全文阅读, 按预先制定的方案独立提取数据, 主要包括: 纳入研究的一般资料(题目、第一作者、发表年份、文献来源等)、研究方法(实验设计、样本量、研究人群特征、干预措施等)及观察结局.
统计学处理 利用国际Cochrane协作网提供的RevMan5.3.5软件进行统计分析, 二分类数据采用比值比(OR)作为合并统计量; 所有的统计量均计算95%CI. 采用χ2评估各项研究之间的异质性, P>0.05认为研究之间异质性不显著; 反之, 异质性显著; I2检验被用来评估统计学异质性, I2<50%可认为异质性低, 采用固定效应模型; 反之, I2≥50%认为异质性高, 采用随机效应模型. 此外, 以5年生存率制作漏斗图评价发表偏倚.
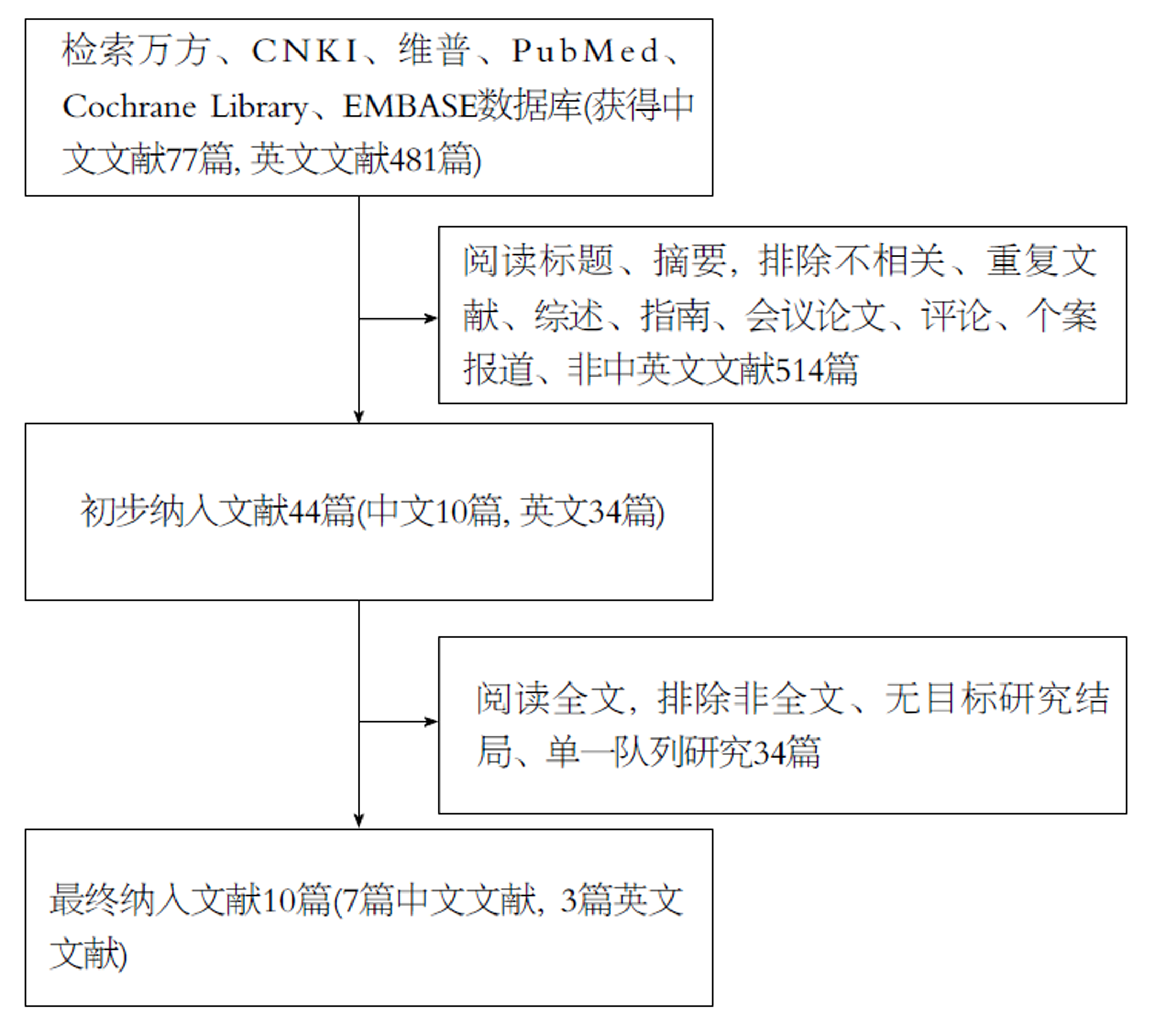
初步检索获得558篇相关文献, 依据预先制定的纳入/排除标准, 最终纳入10篇文献(见图1), 研究人群均为消化道肿瘤患者, 包括中文文献7篇, 英文文献3篇; 随机对照试验2篇, 病例对照研究8篇. 本研究分析2477例患者, 其中ERAS组751例, 对照组(传统围手术期管理)1726例. 纳入的随机对照试验和病例对照研究分别采用Cochrane偏倚风险评价工具、MINORS条目进行文献质量评价. 纳入文献的一般资料与文献质量评价情况见表1和图2.
| 纳入文献 | 发表时间 | 国家 | 研究类型 | 样本量 | MINORS评分 | |
| ERAS组 | 对照组 | |||||
| 叶松[4] | 2017 | 中国 | 随机对照试验 | 47 | 38 | a |
| 张威庆等[5] | 2018 | 中国 | 随机对照试验 | 48 | 48 | a |
| Oakley等[6] | 2016 | 英国 | 病例对照研究 | 66 | 81 | 14/24 |
| 方法等[7] | 2016 | 中国 | 病例对照研究 | 35 | 32 | 14/24 |
| Gustafsson等[8] | 2016 | 瑞典 | 病例对照研究 | 273 | 638 | 16/24 |
| 林威等[9] | 2017 | 中国 | 病例对照研究 | 32 | 30 | 14/24 |
| Asklid等[10] | 2017 | 瑞典 | 病例对照研究 | 145 | 753 | 17/24 |
| 许国定等[11] | 2017 | 中国 | 病例对照研究 | 22 | 21 | 12/24 |
| 陈诚等[12] | 2018 | 中国 | 病例对照研究 | 38 | 40 | 13/24 |
| 刘刚等[13] | 2018 | 中国 | 病例对照研究 | 45 | 45 | 16/24 |
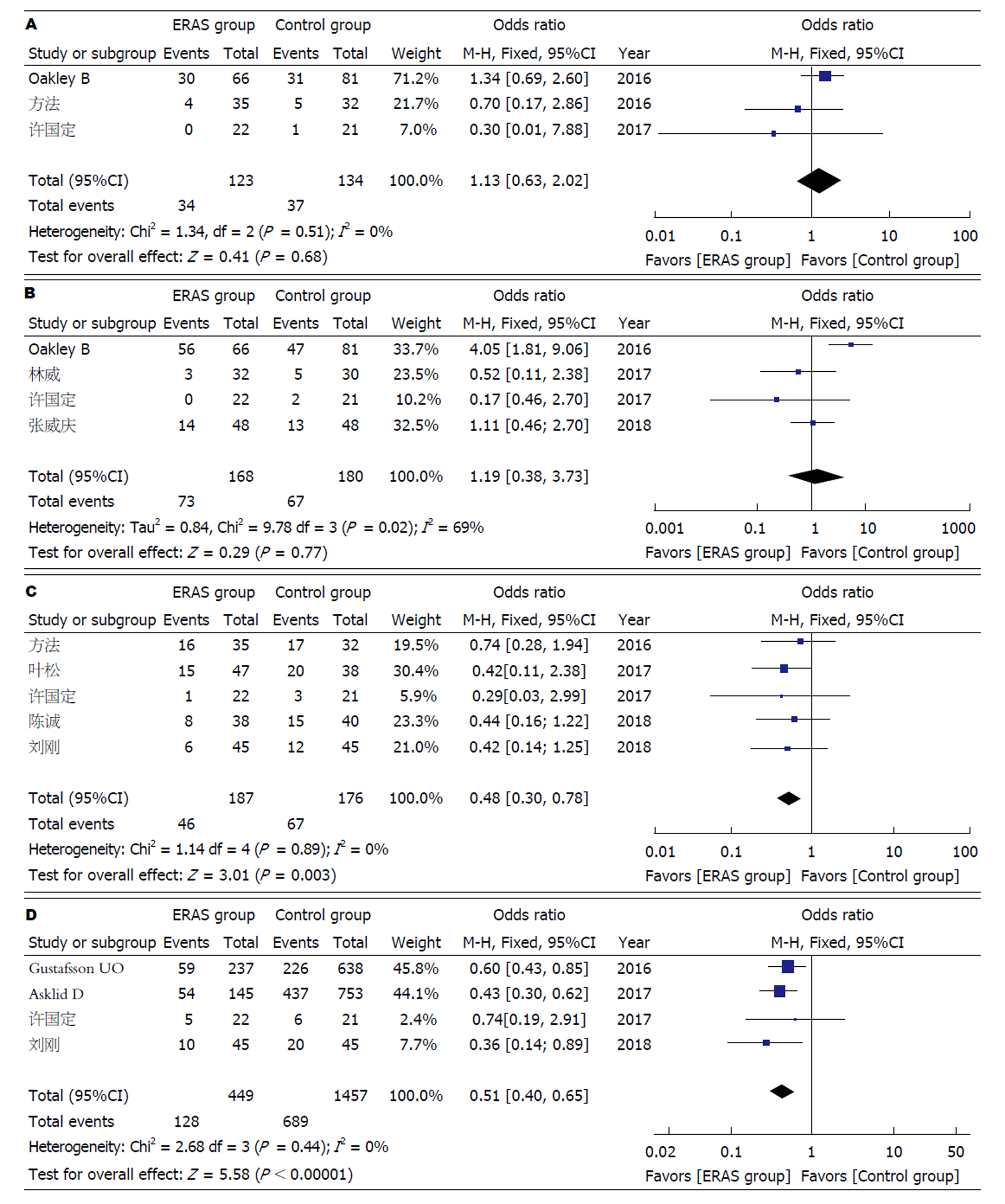
2.2.1 术后1年生存率: 3篇文献报道了术后1年生存率, 均为病例对照研究. 各研究之间异质性不显著(P = 0.51, I2 = 0%), 采用固定效应模型. 合并统计量分析显示: 两组术后1年生存率差异无统计学意义(OR = 1.13, 95%CI: 0.63-2.02, P>0.05)(图3A).
2.2.2 术后2年生存率: 4篇文献报道了术后2年生存率, 其中, 3篇病例对照研究, 1篇随机对照试验. 各研究之间存在异质性(P = 0.02, I2 = 69%), 采用随机效应模型. 合并统计量分析显示: 两组术后2年生存率差异无统计学意义(OR = 1.19, 95%CI: 0.38-3.73, P>0.05)(图3B).
2.2.3 术后3年生存率: 5篇文献报道了术后3年生存率, 其中, 4篇病例对照研究, 1篇随机对照试验. 各研究之间异质性不显著(P = 0.89, I2 = 0%), 采用固定效应模型. 合并统计量分析显示: 与对照组相比较, ERAS组术后3年生存率提高(OR = 0.48, 95%CI: 0.30-0.78, P<0.05)(图3C).
2.2.4 术后5年生存率: 4篇文献报道了术后5年生存率, 均为病例对照研究. 各研究之间异质性不显著(P = 0.44, I2 = 0%), 采用固定效应模型. 合并统计量分析显示: 与对照组相比较, ERAS组术后5年生存率提高(OR = 0.51, 95%CI: 0.40-0.65, P<0.05)(图3D).
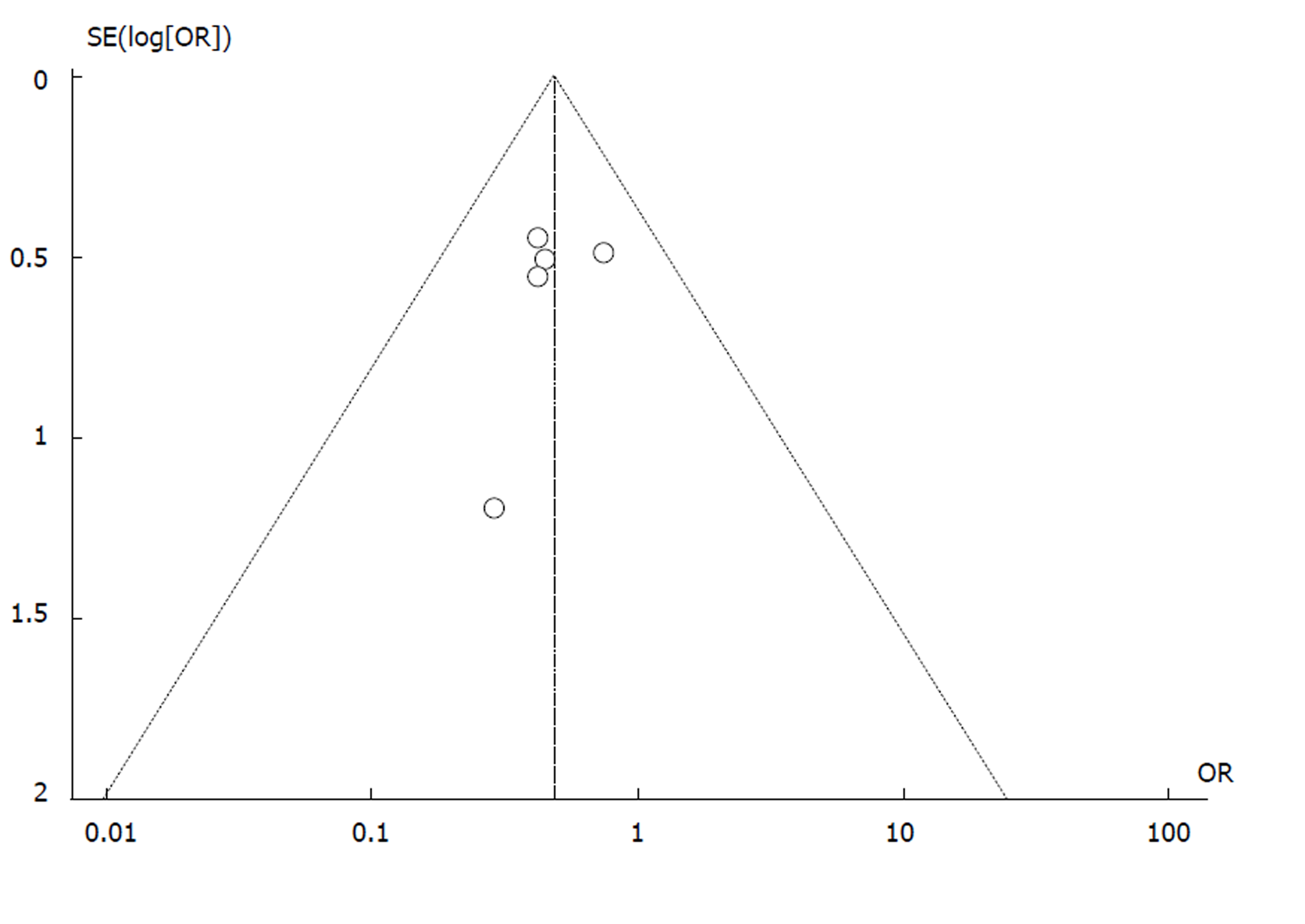
以术后3年生存率为指标制作漏斗图, 以评价本研究是否存在发表偏倚, 散点大致对称的分布在倒漏斗图内, 说明本次Meta分析存在发表偏倚的可能性较低(见图4).
ERAS是指由外科、护理、麻醉、营养等学科共同参与, 采取一系列基于循证医学证据的最优化围手术期管理措施, 形成一种全新理念, 其核心在于减少患者围手术期应激反应, 不仅可以减少术后并发症, 缩短住院时间, 还可改善患者术后免疫功能抑制, 影响肿瘤患者预后[2,14]. ERAS已经在胃肠外科、胰腺外科、骨科、妇科等学科实施, 可以降低患者围手术期并发症发生率[15-18]. 临床研究证实, 消化道肿瘤患者围手术期实施ERAS不仅可以降低手术创伤应激引起的机体过度炎症反应, 还能够提高患者术后血清IgA、IgM、IgG、CD3+T细胞、CD4+T细胞水平及CD4+/CD8+T细胞比例, 改善患者免疫功能, 进一步影响患者术后远期预后[19,20]. 外科手术是治愈消化道肿瘤的有效措施, 但手术创伤对于机体又是一种"打击", 导致机体产生应激反应和免疫功能抑制, 同时机体处于分解代谢状态, 不及时进行干预, 则会延长患者术后恢复时间和免疫抑制状态. ERAS提倡在微创、精准及损伤控制理念下完成手术, 降低创伤后应激反应. Martínez等[21]进行的一项研究证实, 围手术期实施ERAS可以大幅度的减少外科手术对结肠癌患者术后免疫功能的影响, 同时腹腔镜等微创手术对免疫功能的影响更小. 此外, ERAS提出新的麻醉理念和镇痛方案, 可以拮抗手术创伤、术后切口疼痛刺激等引起的应激反应, 改善肿瘤患者术后免疫功能抑制.
消化道肿瘤患者常伴有不同程度的营养不良和免疫功能低下. ERAS更加注重患者围手术期的营养管理, 包括及时的营养评估和营养支持方案的制定[22]. ERAS提倡患者缩短术前禁饮食时间、术后早期恢复经口进食和下床活动, 不仅可以促进胃肠道运动和屏障功能的恢复, 还可以改善患者的营养状态, 纠正负氮平衡, 增强机体免疫功能, 降低患者近期感染、瘘等并发症发生率, 改善患者远期生活质量及生存率[23-25]. 有研究证实, 术前2 h饮用口服补液溶液或葡萄糖溶液, 不仅可缓解肿瘤患者术前焦虑、饥渴感, 还可提高患者术后胰岛素的敏感性, 促进机体合成代谢, 改善机体免疫功能[26]. 另有研究证实, 结肠癌患者术后早期的肠内喂养可刺激胃肠激素和免疫球蛋白的分泌,改善患者免疫功能[27].
先前的动物实验证实, 原发性肿瘤灶完整切除后将会引起体内微小转移灶内的肿瘤细胞快速增殖, 此时肿瘤细胞对化疗药物较为敏感, 因此, 术后早期给予辅助性化疗可有效抑制、杀灭肿瘤细胞, 降低肿瘤复发率, 提高远期生存率[28]. 外科手术创伤引起患者术后器官功能受损, 采取传统的围手术期管理措施患者通常不能耐受术后早期的辅助性放化疗. ERAS通过采取一系列优化措施减少围手术期应激反应, 加快肿瘤患者术后器官功能恢复, 使术后早期开始辅助性放化疗成为可能, 最大程度的杀灭残留的肿瘤细胞, 从而改善肿瘤患者的远期生存率. Biagi等[29]进行的一项Meta分析表明, 术后尽早开始辅助性化疗可提高结直肠肿瘤患者远期生存率. 另有研究表明, 围手术期实施ERAS的结直肠肿瘤患者辅助性化疗开始时间可提前至术后2 wk内, 与对照组相比, 术后并发症及化疗相关的副作用发生率并不增加[30]. 因此, ERAS亦可通过提前术后放化疗时间而对消化道肿瘤患者的远期生存率产生影响.
目前, 国内外学者们关于ERAS对消化道肿瘤患者生存率的影响得出的结论尚不统一. 本研究共纳入10篇国内外与消化道肿瘤相关的文献, ERAS组围手术期均采取一种或多种优化措施, 对照组采取传统的围手术期管理措施. 年龄、性别、基础疾病、营养状况、围手术期的辅助放化疗、肿瘤分期、手术切除率等许多因素都可以对患者术后近期和远期生存率和生存质量产生重要影响. 因此, 在本研究中我们对纳入文献进行分析, ERAS组与对照组患者的年龄分布、伴发基础疾病、肿瘤分期、围手术期放化疗治疗和手术切除率之间差异无统计学意义, 基本可以排除这些因素对研究结果的影响.
本研究也存在一些不足: (1)纳入随机对照试验较少, 而病例对照研究较多, 可能会对研究结果造成一定的影响; (2)各个研究之间采取的ERAS措施不完全相同, 可能对研究结果的评估产生偏倚; (3)研究之间患者对ERAS措施的依从性有差异, 可能会对结研究果产生一定的影响.
本研究结果表明, 围手术期应用ERAS理念可以提高消化道肿瘤患者的3年生存率和5年生存率, 两组之间1年、2年生存率差异无统计学意义. 但是, 本结果仍需要纳入更多的高质量、严格的随机对照试验进一步评价.
加速康复外科(enhanced recovery after surgery, ERAS)通过一系列基于循证医学证据的优化管理措施, 降低围手术期应激反应, 改善患者免疫功能. 相关研究发现ERAS可能对肿瘤患者远期预后产生重要影响.
近年来, 随着ERAS的不断推广, 多项研究发现围手术期实施ERAS可以改善患者的近期临床效果, 但是对于肿瘤患者长期生存率的相关研究结果并不统一, 因此我们通过检索国内外相关研究, 针对消化道肿瘤患者围手术期实施ERAS措施的临床效果进行系统、科学的评价.
本研究首次通过Meta分析的方式, 总结和分析前期的相关研究进行探讨ERAS对消化道肿瘤患者长期生存率的影响.
根据预定的纳入/排除标准, 检索万方、CNKI、维普、PubMed、Cochrane Library、EMBASE数据库有关消化道肿瘤患者围手术期应用ERAS的随机对照试验、病例对照研究, 提取数据并最终合并分析.
本次Meta分析结果表明, 与对照组相比, ERAS组术后3年生存率提高(OR = 0.48, 95%CI: 0.30-0.78, P<0.05), 术后5年生存率提高(OR = 0.51, 95%CI: 0.40-0.65, P<0.05); 两组术后1年、2年生存率差异无统计学意义.
本研究对近几年关于ERAS和消化道肿瘤患者远期生存率相关的研究进行了检索、归纳和总结, 研究结果表明, 围手术期应用ERAS理念可以提高消化道肿瘤患者的3年、5年生存率, 两组之间1年、2年生存率差异无统计学意义. 本研究发现, ERAS对肿瘤患者远期生存率的影响可能与增强免疫功能、提高术后放化疗耐受性和提前术后放化疗时间有关, 这或许能为提高肿瘤患者手术后的临床效果提供新的思路.
本结果仍需要纳入更多的高质量、严格的随机对照试验进一步评价.
学科分类: 胃肠病学和肝病学
手稿来源地: 山东省
同行评议报告分类
A级 (优秀): 0
B级 (非常好): B, B
C级 (良好): C
D级 (一般): 0
E级 (差): 0
编辑: 崔丽君 电编:张砚梁
| 1. | Kehlet H. Multimodal approach to control postoperative pathophysiology and rehabilitation. Br J Anaesth. 1997;78:606-617. [PubMed] |
| 3. | Snyder GL, Greenberg S. Effect of anaesthetic technique and other perioperative factors on cancer recurrence. Br J Anaesth. 2010;105:106-115. [PubMed] [DOI] |
| 6. | Oakley B, Lamb C, Vohra R, Catton J. Achieving long term survival in oesophagectomy patients aged over 75. Ann Med Surg (Lond). 2016;9:15-21. [PubMed] [DOI] |
| 8. | Gustafsson UO, Oppelstrup H, Thorell A, Nygren J, Ljungqvist O. Adherence to the ERAS protocol is Associated with 5-Year Survival After Colorectal Cancer Surgery: A Retrospective Cohort Study. World J Surg. 2016;40:1741-1747. [PubMed] [DOI] |
| 9. | 林 威, 龚 瑾, 方 丁玲, 包 真. 加速康复外科理念在完全腹腔镜右半结肠切除术中的应用研究. 消化肿瘤杂志(电子版). 2017;3:173-177. [DOI] |
| 10. | Asklid D, Segelman J, Gedda C, Hjern F, Pekkari K, Gustafsson UO. The impact of perioperative fluid therapy on short-term outcomes and 5-year survival among patients undergoing colorectal cancer surgery - A prospective cohort study within an ERAS protocol. Eur J Surg Oncol. 2017;43:1433-1439. [PubMed] [DOI] |
| 15. | Zhu S, Qian W, Jiang C, Ye C, Chen X. Enhanced recovery after surgery for hip and knee arthroplasty: a systematic review and meta-analysis. Postgrad Med J. 2017;93:736-742. [PubMed] [DOI] |
| 16. | Li MZ, Wu WH, Li L, Zhou XF, Zhu HL, Li JF, He YL. Is ERAS effective and safe in laparoscopic gastrectomy for gastric carcinoma? A meta-analysis. World J Surg Oncol. 2018;16:17. [PubMed] [DOI] |
| 17. | Ji HB, Zhu WT, Wei Q, Wang XX, Wang HB, Chen QP. Impact of enhanced recovery after surgery programs on pancreatic surgery: A meta-analysis. World J Gastroenterol. 2018;24:1666-1678. [PubMed] [DOI] |
| 18. | de Groot JJ, Ament SM, Maessen JM, Dejong CH, Kleijnen JM, Slangen BF. Enhanced recovery pathways in abdominal gynecologic surgery: a systematic review and meta-analysis. Acta Obstet Gynecol Scand. 2016;95:382-395. [PubMed] [DOI] |
| 20. | 宫 为一, 鲍 峰, 吴 宗阳, 夏 禹, 许 瑞. ERAS理念对食管癌围术期患者血清免疫、肿瘤指标的变化及其生理功能恢复的影响分析. 东南大学学报(医学版). 2018;1:142-145. [DOI] |
| 21. | Martínez AB, Longás J, Ramírez JM. A model for lymphocyte activation in open versus laparoscopic surgery in colorectal cancer patients in enhanced recovery after surgery (ERAS) protocols. Int J Colorectal Dis. 2017;32:913-916. [PubMed] [DOI] |
| 22. | 陈 强谱, 冀 海斌, 魏 强. 加速康复外科理念下围手术期营养管理. 中华普通外科学文献(电子版). 2018;12:289-291. [DOI] |
| 23. | Hur H, Si Y, Kang WK, Kim W, Jeon HM. Effects of early oral feeding on surgical outcomes and recovery after curative surgery for gastric cancer: pilot study results. World J Surg. 2009;33:1454-1458. [PubMed] [DOI] |
| 24. | Marano L, Porfidia R, Pezzella M, Grassia M, Petrillo M, Esposito G, Braccio B, Gallo P, Boccardi V, Cosenza A, Izzo G, Di Martino N. Clinical and immunological impact of early postoperative enteral immunonutrition after total gastrectomy in gastric cancer patients: a prospective randomized study. Ann Surg Oncol. 2013;20:3912-3918. [PubMed] [DOI] |
| 25. | Valdés-Ramos R, Benítez-Arciniega AD. Nutrition and immunity in cancer. Br J Nutr. 2007;98 Suppl 1:S127-S132. [PubMed] [DOI] |
| 26. | 李 成付, 夏 瑞, 朱 斌. 术前饮水与加速康复外科实践. 中国现代普通外科进展. 2017;11:876-880. [DOI] |
| 28. | Berg J, Gebhardt MC, Rand WM. Effect of timing of postoperative chemotherapy on survival of dogs with osteosarcoma. Cancer. 1997;79:1343-1350. [PubMed] |