修回日期: 2019-01-21
接受日期: 2019-02-26
在线出版日期: 2019-03-28
胃癌(gastric cancer, GC)是常见的消化系统恶性肿瘤之一, 其发病率和死亡率都很高. 据报道, 青藤碱在GC细胞中有抗肿瘤活性. 但其机制有待进一步研究.
研究青藤碱通过肺癌转移相关转录本1(metastasis-associated lung adenocarcinoma transcript 1, MALAT1)靶向miR-141调控GC细胞增殖、侵袭和迁移的机制及其临床意义.
分别用浓度为100 μmol/L, 200 μmol/L和400 μmol/L的青藤碱处理体外培养的GCAGS细胞(分别记为L-SIN组, M-SIN组和H-SIN组), 分别用MTT法和Transwell小室实验检测细胞的增殖和迁移、侵袭能力的变化, RT-qPCR检测MALAT1与miR-141的表达情况. 利用LipofectamineTM2000转染构建下调MALAT1或上调miR-141的AGS细胞, RT-qPCR检测转染效果及miR-141的表达情况, 检测细胞的增殖率和迁移、侵袭情况. 预测miR-141靶标基因结合位点, 双荧光素酶报告基因实验验证miR-141和MALAT1的靶向关系, 检测各处理组miR-141相对表达量. 用400 μmol/L的青藤碱处理仅上调MALAT1或与miR-141同时上调的GC细胞, 检测细胞的增殖率和迁移、侵袭情况.
与人正常胃粘膜上皮细胞GES-1相比, Control组AGS细胞活力和迁移、侵袭能力均明显增强(P<0.05), MALAT1 mRNA表达量明显升高(P<0.05), 而miR-141 mRNA表达量明显降低(P<0.05); 与Control组相比, L-SIN组, M-SIN组和L-SIN组细胞活力和迁移、侵袭能力均明显下降(P<0.05), MALAT1表达量明显降低(P<0.05), 而miR-141表达量明显升高(P<0.05), 均呈浓度依赖性. 转染si-MALAT1后, MALAT1表达量明显降低(P<0.05), 而miR-141表达量明显升高(P<0.05); AGS细胞活力和迁移、侵袭能力均明显降低. 转染miR-141 mimics对AGS细胞有同样的影响(P<0.05), 并上调miR-141表达水平(P<0.05). 经Starbase预测miR-141和MALAT1 3'UTR存在靶向结合位点, 双荧光素酶报告基因实验和RT-qPCR验证了miR-141是MALAT1的靶基因. 仅上调MALAT1可以逆转青藤碱对GC细胞增殖、侵袭和迁移的抑制作用; 同时上调MALAT1和miR-141可部分恢复青藤碱对GC细胞增殖、侵袭和迁移的抑制作用(P<0.05).
青藤碱能够抑制GC细胞增殖、侵袭和迁移, 其作用机制与通过MALAT1靶向调控miR-141有关.
核心提要: 据报道, 中药提取物青藤碱对胃癌(gastric cancer, GC)有抑制作用. 本研究发现, 青藤碱以浓度依赖性方式抑制GC细胞的增殖、转移和侵袭, 其作用机制与通过肺癌转移相关转录本1靶向miR-141.
引文著录: 陈小兰, 苏丽丽. 青藤碱通过MALAT1靶向miR-141调控胃癌细胞增殖、侵袭和迁移的机制研究以及临床意义. 世界华人消化杂志 2019; 27(6): 352-360
Revised: January 21, 2019
Accepted: February 26, 2019
Published online: March 28, 2019
Gastric cancer (GC), one of the common malignant tumors of the digestive system, has high morbidity and mortality. Sinomenine has been reported to exert anti-tumor activities in GC cells, but the action mechanism remains to be further investigated.
To explore the mechanism of Sinomenine to inhibit the proliferation, migration, and invasion of GC cells, the role of metastasis-associated lung adenocarcinoma transcript 1 (MALAT1) and miR-141 in this process, and the clinical significance of these findings.
Sinomenine at concentrations of 100 μmol/L, 200 μmol/L, and 400 μmol/L were applied to AGS cells cultured in vitro (L-SIN group, M-SIN group, and H-SIN group, respectively). Cell proliferation was detected by MTT assay after 24, 48, and 72 h of treatment. Transwell assay was employed to examine the migration and invasion of GES-1 and AGS cells after 24 h. RT-qPCR was employed to determine the expression levels of MALAT1 mRNA and miR-141 in GES-1 and AGS cells. AGS cells that had up-regulated miR-141 or down-regulated MALAT1 were constructed by cell transfection with LipofectamineTM2000, and RT-qPCR was used to detect transfection efficiency and the expression of miR-141. Then, the proliferation, migration, and invasion of AGS cells were examined. Binding sites of miR-141 were predicted, and luciferase reporter assay was conducted to confirm the relationship between miR-141 and MALAT1. The relative expression of miR-141 was determined. AGS cells with MALAT1 up-regulation only or with miR-141 up-regulation simultaneously were treated with 400 μmol/L Sinomenine, and the proliferation, migration, and invasion of the cells were determined.
Compared with GES-1 cells, the cell viability, migration, and invasion of control AGS in the control group were significantly higher (P < 0.05), the mRNA expression level of MALAT1 significantly increased (P < 0.05), and the mRNA expression level of miR-141 significantly decreased (P < 0.05). Compared with control AGS cells, the cell viability, migration, and invasion of AGS cells in the L-SIN group, M-SIN group, and H-SIN group were significantly reduced (P < 0.05), the expression of MALAT1 was significantly decreased, and the expression of miR-141 was significantly increased (P < 0.05), all of which were in a concentration-dependent manner. After transfection with si-MALAT1, the expression of MALAT1 was significantly decreased, the expression of miR-141 was significantly increased (P < 0.05), and the proliferation, migration, and invasion of AGS cells were significantly reduced (P < 0.05). Transfection with miR-141 mimic induced the same effects on AGS cells as those of transfection with si-MALAT1 (P < 0.05), with the expression of miR-141 up-regulated (P < 0.05). It was found that miR-141 has binding sites in the 3-'UTR of MALAT1, and the dual-luciferase reporter assay and RT-qPCR confirmed that MALAT1 is a target gene of miR-141. Up-regulation of MALAT1 could reverse the inhibitory effect of Sinomenine on the proliferation, invasion, and migration of GC cells, while up-regulation of miR-141 and MALAT1 simultaneously can partially alleviate such inhibitory effects (P < 0.05).
Sinomenine can inhibit the proliferation, migration, and invasion of AGS cells via mechanisms possibly related to targeting MALAT1 to regulate miR-141.
- Citation: Chen XL, Su LL. Sinomenine inhibits proliferation, migration, and invasion of gastric cancer cells via MALAT1 to regulate miR-141: Clinical implications. Shijie Huaren Xiaohua Zazhi 2019; 27(6): 352-360
- URL: https://www.wjgnet.com/1009-3079/full/v27/i6/352.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v27.i6.352
胃癌(gastric cancer, GC)是一种常见的消化系统恶性肿瘤, 其发病率位居全球恶性肿瘤发病率第4位, 且致死率很高[1]. 我国的GC死亡患者占全球GC死亡患者总数的40%[2]. 受多种因素如遗传和基因、外部环境、饮食习惯、幽门螺杆菌感染等影响, 尽管当前我国有关GC的诊疗手段有所进步, 但GC死亡病例仍然较多. 因此, 探索新的化疗药物和作用靶点在临床上意义重大.
青藤碱(Sinomenine)是从传统中药青风藤中提取出的一种活性生物碱, 由于其抗炎、免疫抑制作用, 青藤碱被长期用于治疗风湿和类风湿性关节炎[3]. 近年来的报道称, 青藤碱在多种癌细胞中具有抗肿瘤作用, 例如滑膜肉瘤、肺癌、肝细胞癌和GC[4].
长链非编码RNA(long noncoding RNA, lncRNA)是一种长度超过200个碱基的非编码RNA. 研究表明lncRNA在许多生物学过程中发挥重要作用, 包括X染色体失活、染色质修饰和基因转录与剪接等[5,6]. 大量证据表明, LncRNA在多种人类癌症中异常表达, 这可能与人类肿瘤特异表型和生物学特性(如治疗反应和预后)相关[7]. 肺癌转移相关转录本1(metastasis-associated lung adenocarcinoma transcript 1, MALAT1)属于lncRNA家族, 最早在非小细胞肺癌的研究中被发现得到广泛关注. MALAT1在多种肿瘤中高表达, 可促进肿瘤细胞的增殖、转移和侵袭[8].
miRNA也是非编码RNA可结合靶基因mRNA的3'UTR, 导致靶基因mRNA的降解或者翻译抑制, 调控癌基因和抑癌基因[9]. miR-141与多种肿瘤的发病机制及转移密切相关[10].
本研究检测了经不同浓度青藤碱处理对GC细胞AGS增殖和迁移、侵袭能力的影响及细胞中MALAT1与miR-141的表达情况. 利用脂质体转染构建下调MALAT1或上调miR-141的AGS细胞, 检测细胞的增殖和迁移、侵袭能力的变化. 借助在线数据库预测miR-141与MALAT1靶向结合, 双荧光素酶报告基因实验验证其靶向关系. 通过共转染同时上调miR-141或(和)上调MALAT1, 检测细胞增殖和迁移、侵袭能力的变化. 为GC的早期诊断或治疗提供实验基础.
1.1.1 细胞: 人正常胃粘膜上皮细胞GES-1北京北纳创联生物技术研究院, 编号为BNCC342074; GC细胞AGS购自美国ATCC, 编号为CRL-1739.
1.1.2 主要试剂: RPMI1640培养液, 胎牛血清(FBS)(美国Gibco公司, 批号分别为SH30809, 10099-141); 胰蛋白酶(美国Hyclone公司, 批号为J140028); MTT(美国Amersco公司, 批号为298931); DMSO(美国Sigma公司, 批号为D2650); TRIzol细胞裂解液(美国Gibco公司, 批号为15596-026); 反转录试剂盒(天根生化科技(北京)有限公司, 批号为KR104-01); SYBR Premix Ex TaqTM Ⅱ(日本Takara公司, 批号分别为RR047A和RR820A); 本研究所用全部引物由北京六合华大基因科技有限公司合成; 转染试剂LipofectamineTM2000(Invitrogen公司, 批号为11668019); MALAT1抑制因子(MALAT1 siRNA)和MALAT1抑制因子(阴性对照siRNA), miR-141模拟物(miR-141 mimics)和miR-141模拟物阴性对照(mimics NC)以及miR-141抑制剂(miR-141 inhibitor)和miR-141抑制剂阴性对照(inhibitor-NC)均由上海吉玛制药技术有限公司合成; pcDNA 3.1质粒(美国Thermo Fisher Scientific公司, 批号为V79020); 所用荧光素酶报告基因载体质粒及pcDNA 3.1-MALAT1质粒均由本实验室构建保存; Transwell小室(美国Corning公司, 批号3140928); Matrigel基质胶(美国HyClone公司, 批号354254); 双荧光素酶报告基因检测系统(美国Promega公司, 批号为E1910).
1.1.3 主要仪器: MCO-18AC型CO2培养箱(日本SANYO公司), Nanodrop2000型超微量分光光度计(美国Thermo公司), 3k15型低温高速离心机(美国Sigma公司), 7700型实时荧光定量PCR仪(美国ABI公司), TS100型倒置显微镜(日本Nikon公司).
1.2.1 细胞培养与分组: GES-1和AGS置于RPMI1640培养液中(含10% FBS), 于37 ℃、5% CO2培养箱中培养.
取对数期、生长状态良好的GES-1和AGS细胞, 接种于含RPMI1640培养液的24孔板上(终浓度为5×104个细胞/mL), 每孔100 μL, 于37 ℃、5% CO2条件下培养. 24 h后, 向AGS细胞中加入200 μL含不同浓度青藤碱的培养液, 使其终浓度为100 μmol/L(记为L-SIN组), 200 μmol/L(记为M-SIN组)和400 μmol/L(记为H-SIN组), 对照组加入200 μL RPMI1640培养液(记为Control组).
遵循LipofectamineTM2000说明书进行转染操作, 转染试剂+阴性对照siRNA(记为si-NC组)、转染试剂+ MALAT1 siRNA(记为si-MALAT1组)、转染试剂+mimics NC(记为mimics NC组)、转染试剂+miR-141 mimics(记为miR-141 mimics组)、转染试剂+400 μmol/L SIN(记为Con组)、转染试剂+400 μmol/L SIN+pcDNA 3.1(记为Vector组)、转染试剂+400 μmol/L SIN +pcDNA 3.1-MALAT1(记为MALAT1组)、转染试剂+400 μmol/L SIN+pcDNA 3.1-MALAT1+mimics NC(记为MALAT1+miR-NC组)、转染试剂+400 μmol/L SIN+pcDNA 3.1-MALAT1+miR-141 mimics(记为MALAT1+miR-141组), 每个处理设置6个复孔. 实验重复4次.
1.2.2 MTT法检测不同处理组AGS细胞的增殖率: 离心收集正常培养的GES-1细胞(记为GES-1组), 经青藤碱处理24 h, 48 h和72 h后Control组、L-SIN组、M-SIN组和H-SIN组, si-NC组和si-MALAT1组, mimics NC组和miR-141 mimics组的AGS细胞以及正常培养的AGS细胞(记为Blank组)、Con组、Vector组、MALAT1组、MALAT1+miR-NC组和MALAT1+miR-141组的AGS细胞, 接种于含RPMI1640培养液的96孔板上(终浓度为2×104-2.5×104个细胞/mL), 每孔100 μL. 每组处理设3个复孔, 于5% CO2、37 ℃条件下培养. 分别于培养24 h、48 h和72 h后加入MTT(5 mg/mL), 每孔10 μL, 4 h后加入DMSO, 酶标仪测量各个时间点490 nm处吸光度(OD)值. 重复5次.
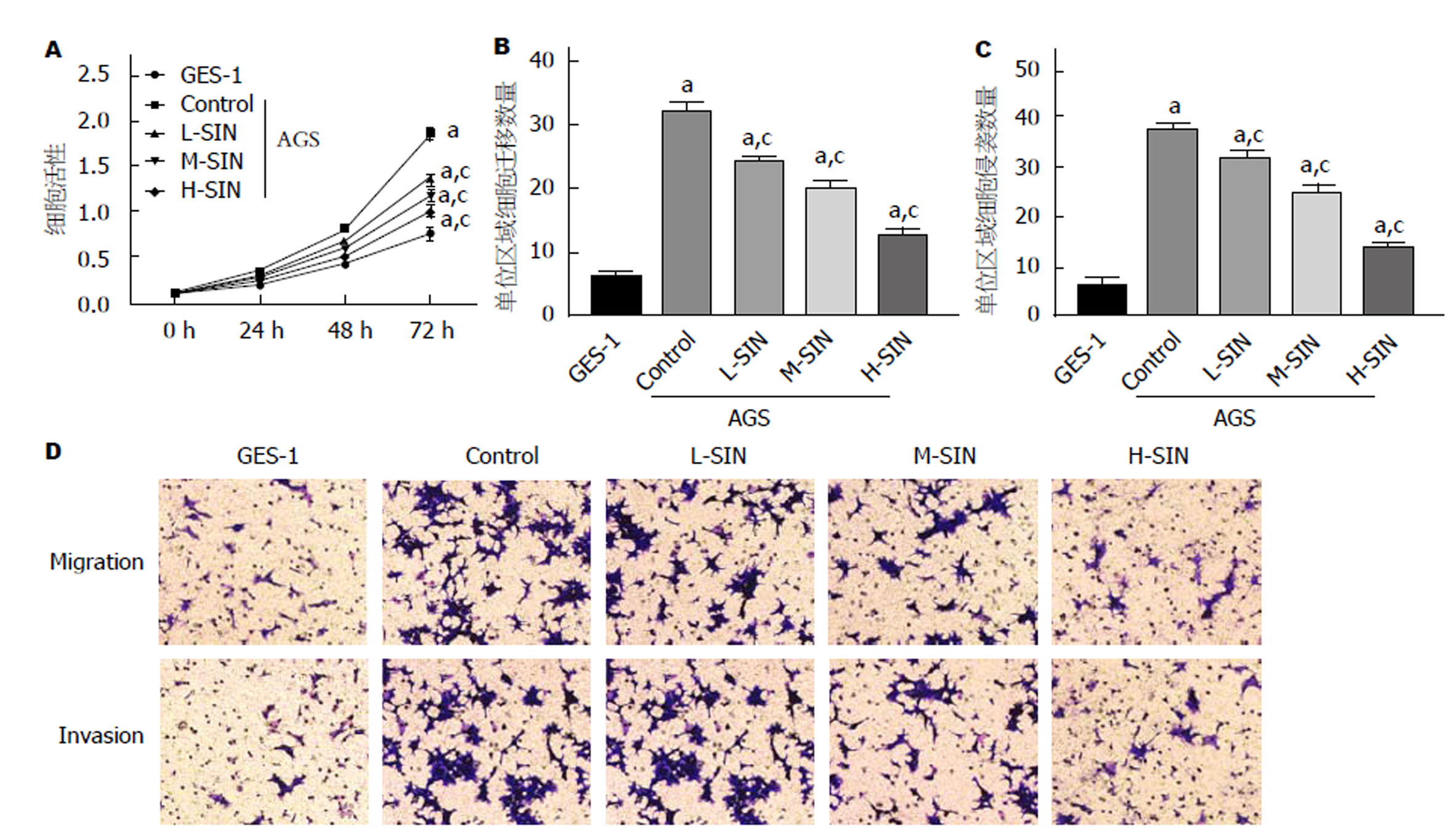
1.2.3 Transwell小室实验检测细胞迁移、侵袭能力: 将正常培养的GES-1细胞(记为GES-1组), 经青藤碱处理24 h, 48 h和72 h后Control组、L-SIN组、M-SIN组和H-SIN组, si-NC组和si-MALAT1组, mimics NC组和miR-141 mimics组, Blank组、Con组、Vector组、MALAT1组、MALAT1+miR-NC组和MALAT1+miR-141组AGS细胞制成悬浮液. 在Transwell小室的上室中加入300 μL由RPMI1640培养液稀释的细胞悬浮液(约1×105个细胞, 含0.1% FBS), 下室中加入700 μL RPMI1640培养液(含20% FBS), 每组细胞设3个复孔. 置于37 ℃、5% CO2培养箱24 h, 甲醇固定后, 用0.1%结晶紫于室温下染色25 min, 显微镜下随机选取6个视野(200×)对细胞进行计数后取其平均值, 即迁移细胞数. 实验重复5次.
细胞侵袭实验需将40 μL稀释过的Matrigel基质胶(基质胶与无血清培养液比例为1:5)加入Transwell小室内, 于37 ℃孵育2 h. 其余步骤同迁移实验. 实验重复5次.
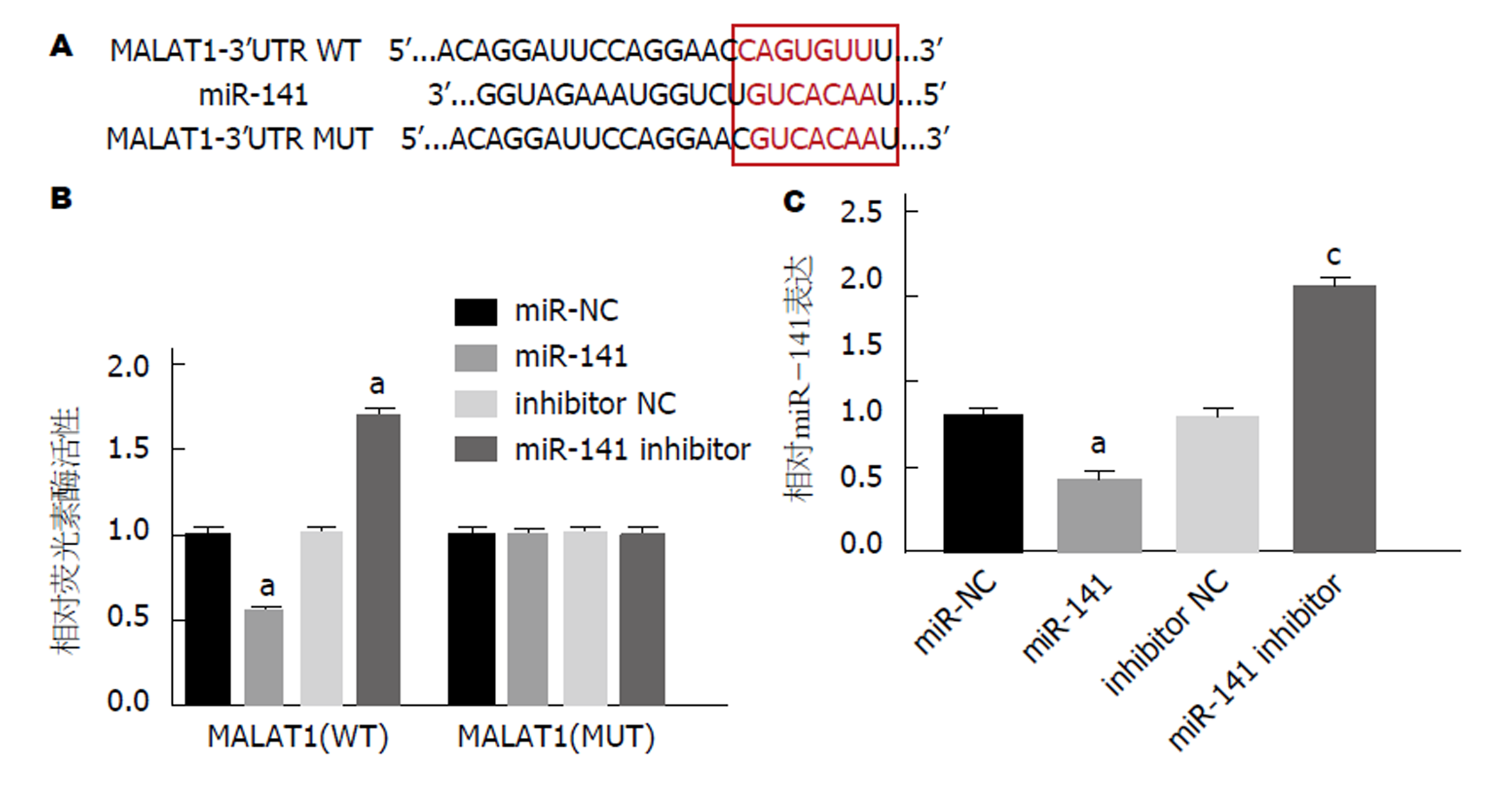
1.2.4 双荧光素酶报告基因实验: 借助在线数据库Starbase(网址: http://www.starbasemn.org/)分析预测miR-141靶标基因结合位点, 结果发现miR-141与MALAT1 3'-UTR存在靶向结合位点, 说明MALAT1可能是miR-141的靶基因. PCR扩增miR-141与MALAT1 3'-UTR结合片段及其突变序列, 构建含有MALAT1结合位点的miR-141野生型及突变型报告基因载体, 构建相应质粒. 将构建好的质粒分别与miR-141 mimics(记为miR-141组)或miR-141 inhibitor(记为miR-141 inhibitor组)共转染对数生长期的AGS细胞, 以与mimics NC(记为miR-NC组)或inhibitor-NC(记为inhibitor-NC组)共转染为对照. 24 h后, 参照试剂盒说明书检测荧光素酶相对活性, RT-qPCR检测各组AGS细胞中miR-141 mRNA相对表达量.
1.2.5 RT-qPCR: 用TRIzol试剂提取正常培养的GES-1细胞(记为GES-1组), 经青藤碱处理24 h, 48 h和72 h后Control组、L-SIN组、M-SIN组和H-SIN组, si-NC组和si-MALAT1组, mimics NC组和miR-141 mimics组, miR-NC组、miR-141组、inhibitor-NC组和miR-141 inhibitor组AGS细胞的总RNA.
取1.0 μg RNA作为模板反转录合成cDNA. 以此为模板进行qPCR反应. 以GAPDH作为内参基因, 检测MALAT1相对表达量; 以U6作为内参基因, 检测miR-141相对表达量. GAPDH的上游引物序列为5'-GTCAACGGATTTGGTCTGTATT-3', 下游引物序列为5'-AGTCTTCTGGGTGGCAGTGAT-3'; MALAT1的上游引物序列为5'-CAGTGGGGAACTCTG ACTCG-3', 下游引物序列为5'-GTGCCTGGTGCTCTC TTACC-3'; U6的上游引物序列为5'-CGCTTCACGAA TTTGCGTGTCAT-3', 下游引物序列为5'-GCTTCGGC AGCACATATACTAAAAT-3'; miR-141的上游引物序列为5'-TAACACTGTCTGGTAAAGATGG-3', 下游引物序列为5'-ATCTTTACCAGACAGTGTTATT-3'. qPCR反应程序为: 95 ℃ 5 min; 58 ℃ 30 s, 40个循环. 实验结果采用2△△Ct法进行表达量相对定量分析, 每组样品设3个重复, 实验重复5次.
统计学处理 实验数据采用SPSS 21.0统计软件分析, 结果采用mean±SD. 多组间比较使用单因素方差分析差异显著性, 组间比较采用LSD-t检验, 两组间比较采用独立样本t检验, P<0.05视为差异具有统计学意义.
为研究青藤碱对GC细胞增殖、迁移和侵袭的影响, 用不同浓度的青藤碱作用于AGS细胞24 h, 48 h和72 h后, 用MTT法检测细胞活力. 结果表明, 与GES-1组相比, Control组AGS细胞活力和迁移、侵袭能力均明显增强, 差异具有统计学意义(图1A, P<0.05); 与Control组相比, L-SIN组, M-SIN组和L-SIN组细胞活力和迁移、侵袭能力均明显下降(图1B和C, P<0.05), 且呈浓度依赖性. 说明青藤碱以浓度依赖性方式抑制GC细胞增殖、迁移和侵袭.
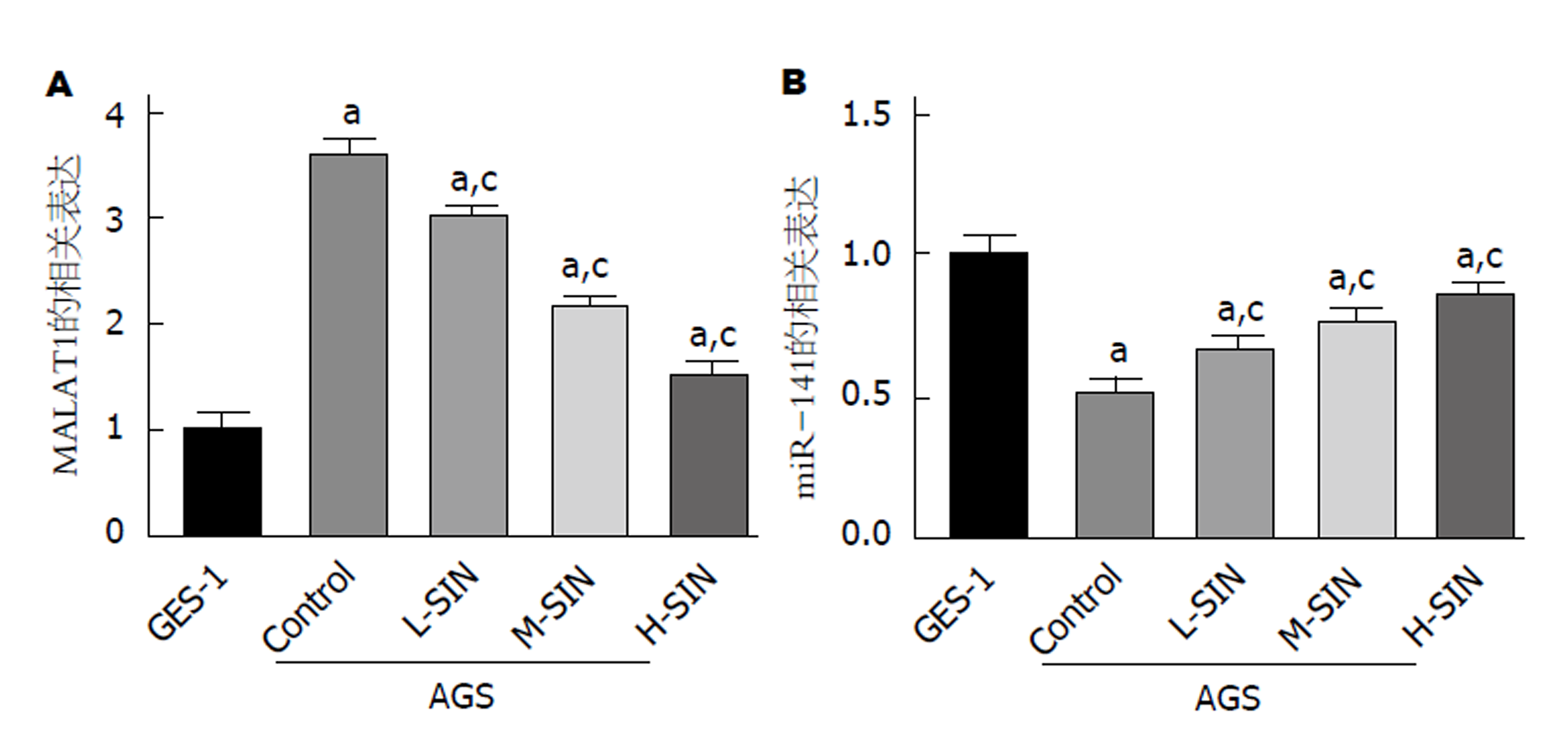
RT-qPCR检测青藤碱处理24 h后GES-1和AGS细胞中MALAT1和miR-141的表达水平. 结果显示, 与GES-1组相比, MALAT1 mRNA表达量明显上调(图2A, P<0.05), 而miR-141 mRNA表达量明显下调(图2B, P<0.05), 呈浓度依赖性; MALAT1表达量明显下调(图2A, P<0.05), 而miR-141表达量明显上调(图2B, P<0.05), 也呈浓度依赖性. 说明青藤碱以浓度依赖性方式抑制MALAT1表达, 促进miR-141表达.
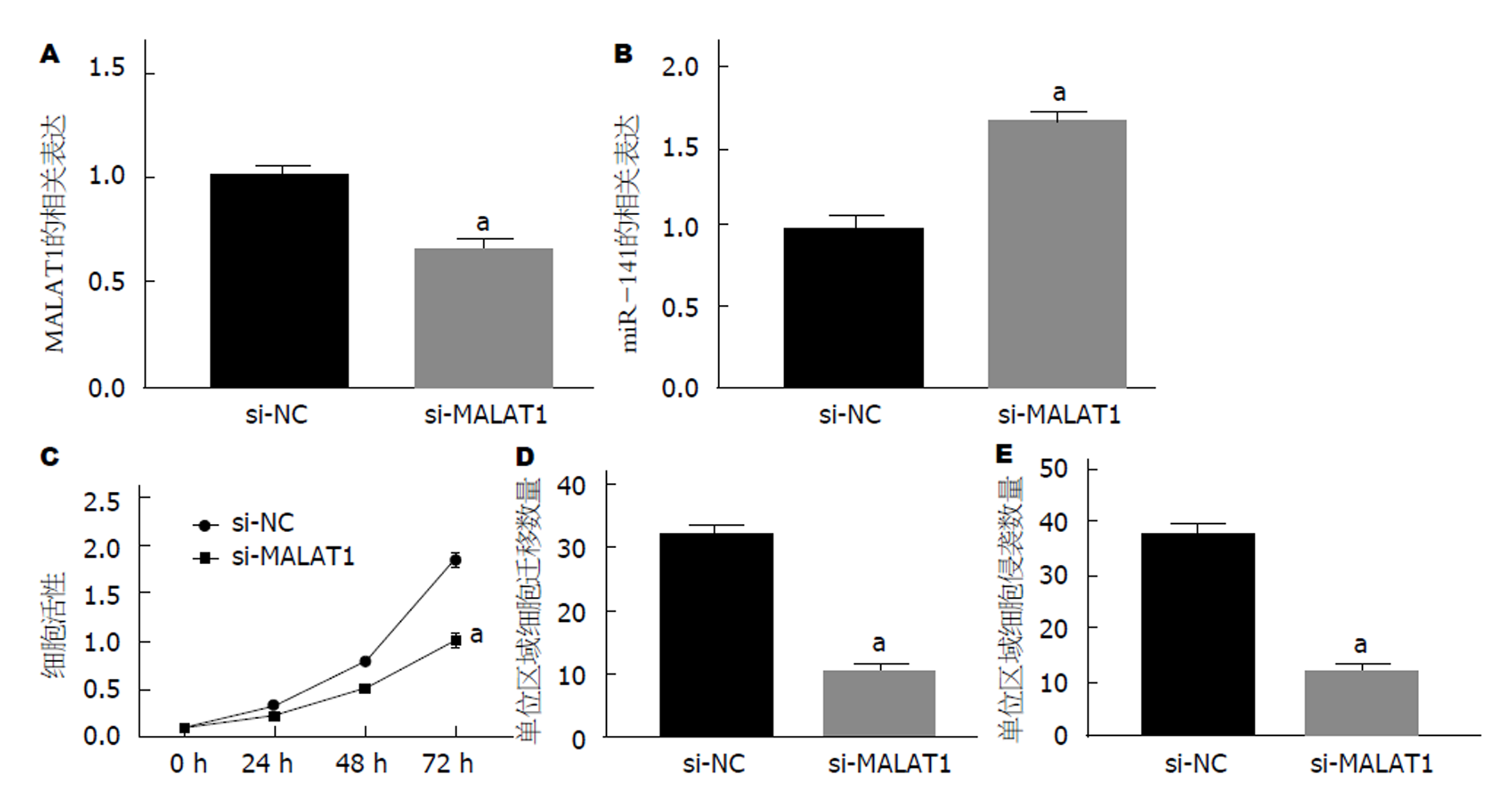
为了检测MALAT1对GC细胞增殖、迁移和侵袭的影响, 利用脂质体将MALAT1 siRNA转染AGS细胞, RT-qPCR检测转染后AGS细胞中MALAT1和miR-141 mRNA表达水平. MTT法和Transwell小室实验分别用于检测MALAT1敲减后AGS细胞的增殖、迁移和侵袭能力.
结果显示: 与si-NC组相比, 转染MALAT1 siRNA后, AGS细胞中MALAT1 mRNA表达水平明显降低, 而miR-141 mRNA表达水平明显升高(图3A和B, P<0.05); MALAT1敲减后, si-MALAT1组AGS细胞活力、迁移数和侵袭数均较si-NC组明显降低(图3C-E, P<0.05). 说明MALAT1抑制miR-141表达, 促进AGS细胞增殖、迁移和侵袭.
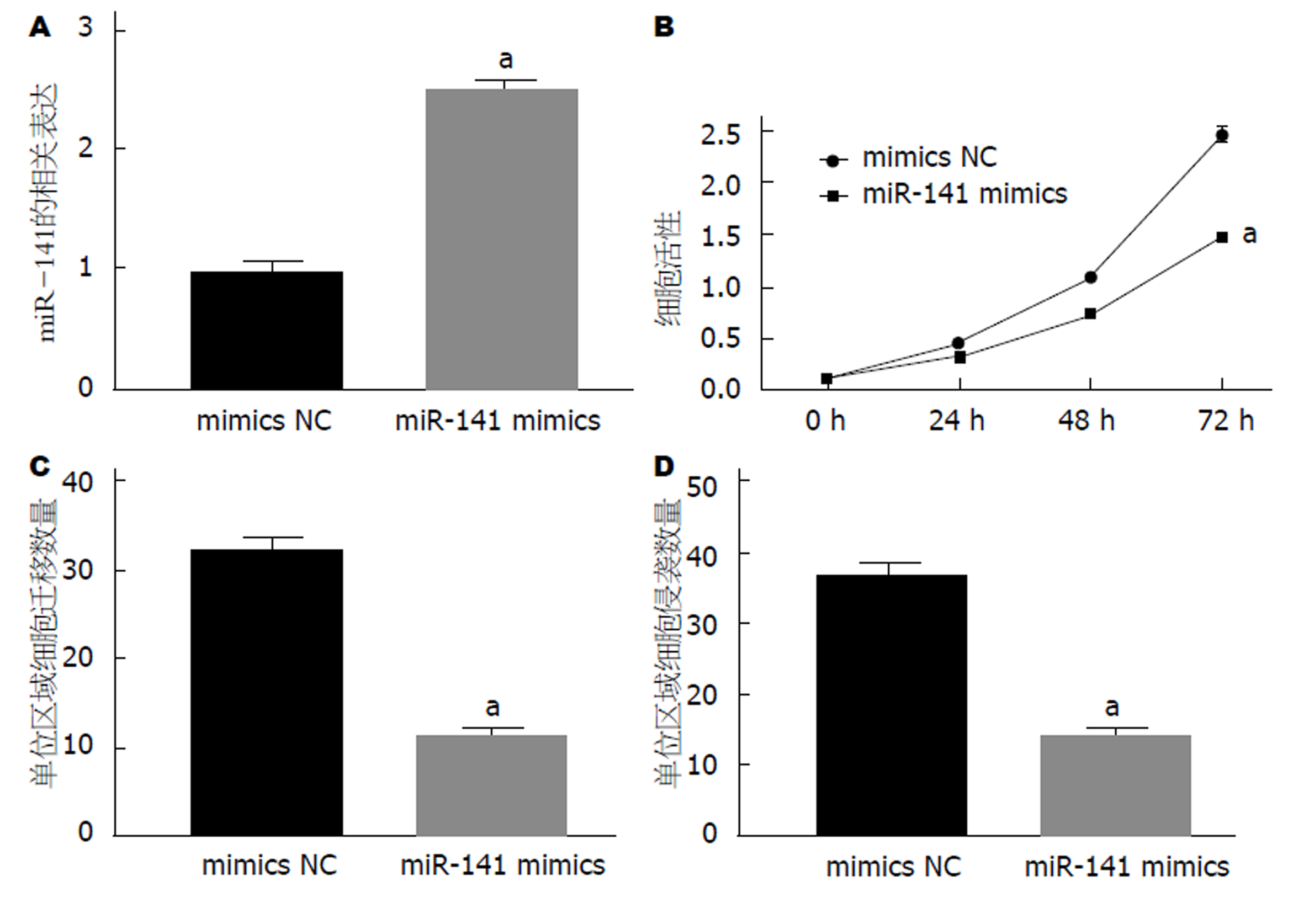
为了检测miR-141对GC细胞增殖、迁移和侵袭的影响, 利用脂质体将miR-141 mimics转染AGS细胞以上调miR-141的表达, RT-qPCR检测转染后miR-141 mRNA表达水平. 然后用MTT法检测转染后AGS细胞活力, 用Transwell小室实验检测转染后AGS细胞迁移和侵袭水平. 结果表明: 与mimics NC组相比, 转染miR-141 mimics后, AGS细胞中miR-141表达量明显升高(图4A, P<0.05); miR-141上调后, miR-141 mimics组AGS细胞活力、迁移数和侵袭数均较mimics NC组低(P<0.05, 图4B-D). 说明miR-141抑制AGS细胞增殖、迁移和侵袭.
Starbase预测结果显示, miR-141可与MALAT1 mRNA 3'UTR靶向结合(图5A). 双荧光素酶活性测定结果显示, 与miR-NC组相比, 转染miR-141 mimics后WT组AGS细胞荧光素酶活性明显降低, 转染miR-141 inhibitor后WT组AGS细胞荧光素酶活性明显升高, 差异均具有统计学意义(图5B, P<0.05), 而MUT组荧光素酶活性无明显变化. 检测WT(miR-NC组、miR-141组、inhibitor-NC组和miR-141 inhibitor组)AGS细胞中miR-141 mRNA表达水平, 结果如图5C所示, 与miR-NC组相比, miR-141组AGS细胞中miR-141明显下调; 与inhibitor-NC组相比, miR-141 inhibitor组AGS细胞中miR-141明显上调(P<0.05). 说明miR-141是MALAT1的靶基因.
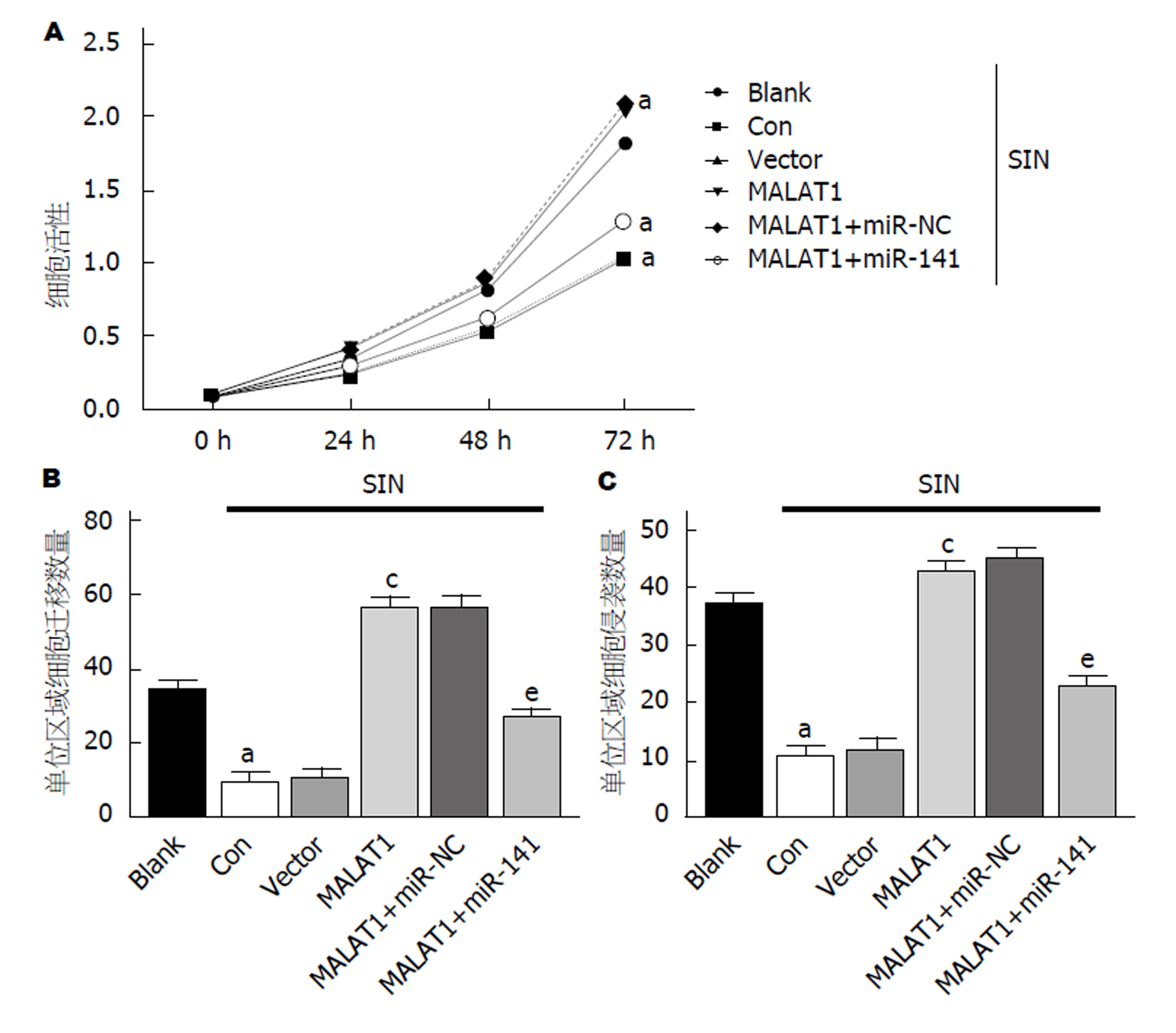
为了探讨青藤碱对GC细胞增殖、迁移和侵袭抑制作用机制, 用400 μmol/L的青藤碱处理上调miR-141或(和)上调MALAT1的AGS细胞, MTT法和Transwell小室实验用于检测共转染对AGS细胞增殖、迁移和侵袭的影响. 结果如图6所示, 与Blank组相比, 仅400 μmol/L青藤碱处理的Con组AGS细胞活力、细胞迁移和侵袭数目均明显降低(P<0.05); 与Vector组相比, 上调MALAT1组AGS细胞活力、细胞迁移和侵袭数目均显著提高(P<0.05); 与MALAT1+miR-NC组相比, 同时上调MALAT1和miR-141组AGS细胞活力、细胞迁移和侵袭数目均明显降低(P<0.05). 说明仅上调MALAT1可以逆转青藤碱对GC细胞增殖、侵袭和迁移的抑制作用; 同时上调MALAT1和miR-141可部分恢复青藤碱对GC细胞增殖、侵袭和迁移的抑制作用.
近年来, GC的发病率呈上升趋势, 作为一种常见的、高风险的恶性肿瘤, 其特点是发展快、预后差. 因此, 早发现、早诊断及早手术是降低GC患者死亡率及改善患者预后的关键. GC症状并不明显, 诊断早期和中期GC的关键手段是上消化道内窥镜检查. 手术和化疗是治疗GC的主要手段. 但术后患者生存率依然不容乐观, 因此, 开发新的治疗药物、寻找新的治疗靶点非常重要[11].
近年来, 对中药研究热度的增加, 导致许多抗肿瘤药物的发现. 青藤碱是一种来源于防几科植物青风藤的生物活性碱, 可有效治疗风湿性关节炎. 其药理特性包括抗炎、免疫抑制和细胞保护等[12,13]. 青藤碱也具有抗肿瘤作用. 青藤碱能以剂量和时间依赖的方式抑制肺癌NCI-H460细胞增殖, 并通过线粒体途径促进NCI-H460细胞凋亡, 有作为肺癌候选化疗药物的潜质[14]. 据Zhou等[15]人报道, 青藤碱能诱导肺癌NCI-H460细胞凋亡, 其作用机制与抑制PI3K/Akt和ERK信号通路有关. Hong等[16]研究表明, 盐酸青藤碱可联合TfR单克隆抗体以环氧合酶-2(COX-2)依赖的方式抑制肝癌HepG2细胞. Liao等[4]人研究发现, 青藤碱在体内外均可增强GC化疗药物5-氟尿嘧啶(5-FU)介导的GC细胞生长抑制和凋亡, 减少TS mRNA的积累, 激活线粒体凋亡途径. 证明SIN可作为5-FU的化疗增敏剂. 青藤碱的抗肿瘤机制被日渐阐明, 但其对GC细胞的作用研究较少. 本研究中使用不同浓度的青藤碱处理对数生长期的GCAGS细胞, 结果发现青藤碱对AGS细胞增殖、迁移和侵袭的抑制作用呈浓度依赖性, 与前人研究结果类似. 另外, 本研究还利用RT-qPCR检测青藤碱处理24 h后AGS细胞中MALAT1和miR-141的表达水平, 发现青藤碱以浓度依赖性方式抑制MALAT1表达, 促进miR-141表达.
MALAT1是LncRNA家族成员之一, 编码基因定位于染色体11q13.1, 转录本序列长约8 kb, 具有高度保守性[17]. 研究表明MALAT1参与多种癌症的细胞周期进展和肿瘤发生, 包括肝癌、GC、宫颈癌、透明细胞肾癌和食管鳞状细胞癌[18]. 本研究利用脂质体将MALAT1 siRNA转染AGS细胞, 发现MALAT1表达水平明显降低, 而miR-141表达水平明显升高; 且MALAT1敲减后, AGS细胞活力、迁移和侵袭能力均明显降低. 说明MALAT1抑制miR-141表达, 促进AGS细胞增殖、迁移和侵袭.
张伯恒等[10]人研究发现, miR-141可通过下调MMP-2、MMP-9蛋白表达抑制GCSGC-7901细胞增殖和侵袭. 文献报道, miR-141在原发性GC组织和GC细胞系(MGC-803、HGC-27、SGC-7901和BGC-823)中低表达, 提示miR-141参与GC的发生发展, 且对细胞增殖的抑制作用[19]. Chen等[9]人报道, miR-141通过抑肝癌衍生生长因子(HDGF)的表达来抑制GC细胞SGC7901、NUGC-3和MKN45的增殖、集落形成、迁移与侵袭. 本研究通过转染miR-141 mimics上调miR-141, 结果发现, AGS细胞增殖、迁移和侵袭均受到抑制.
为明确MALAT1和miR-141对GCAGS细胞影响的作用机制, 利用Starbase在线软件预测miR-141靶基因结合位点, 结果发现, miR-141与MALAT1 mRNA 3'-UTR靶向结合, 并借助双荧光素酶报告基因实验验证MALAT1与miR-141的靶向结合关系. 本研究还通过共转染构建同时上调miR-141和MALAT1的AGS, 并加以青藤碱处理, 检测AGS细胞增殖率及迁移、侵袭能力的变化. 结果发现, 仅上调MALAT1可以逆转青藤碱对GC细胞增殖、侵袭和迁移的抑制作用; 同时上调MALAT1和miR-141可部分恢复青藤碱对GC细胞增殖、侵袭和迁移的抑制作用.
总之, 青藤碱能够抑制GC细胞增殖、侵袭和迁移, 其作用机制与通过MALAT1靶向调控miR-141有关.
胃癌(gastric cancer, GC)是一种发病率和死亡率都很高的恶性肿瘤. 青藤碱是一种具有抑制GC功能的中药提取物, 其作用机制尚未明确.
本研究旨在探索青藤碱、肺癌转移相关转录本1(metastasis-associated lung adenocarcinoma transcript 1, MALAT1)和miR-141对GC细胞增殖、侵袭和迁移的影响, 并探讨其作用机制, 以期为青藤碱应用于GC治疗提供理论基础.
本研究目标是探索青藤碱以何种机制抑制GC细胞增殖、侵袭和迁移, 为青藤碱应用于GC治疗奠定理论基础.
MTT法用于检测GC细胞的活力, Transwell小室实验用于检测细胞的迁移、侵袭能力. RT-qPCR检测用于检测MALAT1和miR-141相对表达量. Starbase用于预测MALAT1的靶标基因, RT-qPCR和双荧光素酶报告基因实验进一步确认MALAT1与miR-141靶向关系.
本研究发现青藤碱以浓度依赖性方式抑制GC细胞的增殖、转移和侵袭, 抑制MALAT1表达, 促进miR-141表达. 回复实验证明青藤碱通过MALAT1靶向调控miR-141抑制GC细胞增殖、侵袭和迁移.
青藤碱通过MALAT1靶向调控miR-141抑制GC细胞增殖、侵袭和迁移, 为青藤碱应用于GC临床治疗提供理论依据.
本研究仅在体外研究了青藤碱对GC细胞增殖、侵袭和迁移的影响, 后续还需增加青藤碱处理活体裸鼠的实验, 观察青藤碱对裸鼠体内肿瘤生长、迁移的影响, 更明确地展现青藤碱的临床应用价值, 为青藤碱应用于GC临床治疗提供更充分的理论依据.
学科分类: 胃肠病学和肝病学
手稿来源地: 浙江省
同行评议报告分类
A级 (优秀): 0
B级 (非常好): B
C级 (良好): C
D级 (一般): 0
E级 (差): 0
编辑: 崔丽君 电编:张砚梁
| 1. | Siegel RL, Miller KD, Jemal A. Cancer statistics, 2015. CA Cancer J Clin. 2015;65:5-29. [PubMed] [DOI] |
| 2. | Chen W, Zheng R, Baade PD, Zhang S, Zeng H, Bray F, Jemal A, Yu XQ, He J. Cancer statistics in China, 2015. CA Cancer J Clin. 2016;66:115-132. [PubMed] [DOI] |
| 3. | Lv Y, Li C, Li S, Hao Z. Sinomenine inhibits proliferation of SGC-7901 gastric adenocarcinoma cells via suppression of cyclooxygenase-2 expression. Oncol Lett. 2011;2:741-745. [PubMed] [DOI] |
| 4. | Liao F, Yang Z, Lu X, Guo X, Dong W. Sinomenine sensitizes gastric cancer cells to 5-fluorouracil in vitro and in vivo. Oncol Lett. 2013;6:1604-1610. [PubMed] [DOI] |
| 5. | Liu SJ, Lim DA. Modulating the expression of long non-coding RNAs for functional studies. EMBO Rep. 2018;19. [PubMed] [DOI] |
| 6. | Wang KC, Chang HY. Molecular mechanisms of long noncoding RNAs. Mol Cell. 2011;43:904-914. [PubMed] [DOI] |
| 7. | Qiu MT, Hu JW, Yin R, Xu L. Long noncoding RNA: an emerging paradigm of cancer research. Tumour Biol. 2013;34:613-620. [PubMed] [DOI] |
| 9. | Chen B, Huang T, Jiang J, Lv L, Li H, Xia S. miR-141 suppresses proliferation and motility of gastric cancer cells by targeting HDGF. Mol Cell Biochem. 2014;388:211-218. [PubMed] [DOI] |
| 11. | Schwarz RE. Current status of management of malignant disease: current management of gastric cancer. J Gastrointest Surg. 2015;19:782-788. [PubMed] [DOI] |
| 12. | Qian L, Xu Z, Zhang W, Wilson B, Hong JS, Flood PM. Sinomenine, a natural dextrorotatory morphinan analog, is anti-inflammatory and neuroprotective through inhibition of microglial NADPH oxidase. J Neuroinflammation. 2007;4:23. [PubMed] [DOI] |
| 13. | Wang Q, Li XK. Immunosuppressive and anti-inflammatory activities of sinomenine. Int Immunopharmacol. 2011;11:373-376. [PubMed] [DOI] |
| 14. | Jiang T, Zhou L, Zhang W, Qu D, Xu X, Yang Y, Li S. Effects of sinomenine on proliferation and apoptosis in human lung cancer cell line NCI-H460 in vitro. Mol Med Rep. 2010;3:51-56. [PubMed] [DOI] |
| 15. | Zhou L, Luan H, Liu Q, Jiang T, Liang H, Dong X, Shang H. Activation of PI3K/Akt and ERK signaling pathways antagonized sinomenine-induced lung cancer cell apoptosis. Mol Med Rep. 2012;5:1256-1260. [PubMed] [DOI] |
| 16. | Hong Y, Yang J, Shen X, Zhu H, Sun X, Wen X, Bian J, Hu H, Yuan L, Tao J, Lei P, Shen G. Sinomenine hydrochloride enhancement of the inhibitory effects of anti-transferrin receptor antibody-dependent on the COX-2 pathway in human hepatoma cells. Cancer Immunol Immunother. 2013;62:447-454. [PubMed] [DOI] |
| 17. | Bernard D, Prasanth KV, Tripathi V, Colasse S, Nakamura T, Xuan Z, Zhang MQ, Sedel F, Jourdren L, Coulpier F, Triller A, Spector DL, Bessis A. A long nuclear-retained non-coding RNA regulates synaptogenesis by modulating gene expression. EMBO J. 2010;29:3082-3093. [PubMed] [DOI] |
| 18. | Wang SH, Zhang WJ, Wu XC, Weng MZ, Zhang MD, Cai Q, Zhou D, Wang JD, Quan ZW. The lncRNA MALAT1 functions as a competing endogenous RNA to regulate MCL-1 expression by sponging miR-363-3p in gallbladder cancer. J Cell Mol Med. 2016;20:2299-2308. [PubMed] [DOI] |
| 19. | Du Y, Xu Y, Ding L, Yao H, Yu H, Zhou T, Si J. Down-regulation of miR-141 in gastric cancer and its involvement in cell growth. J Gastroenterol. 2009;44:556-561. [PubMed] [DOI] |