修回日期: 2018-12-29
接受日期: 2019-01-22
在线出版日期: 2019-02-28
淀粉样变性是指具有β片层结构且刚果红染色阳性的淀粉样纤维结构物质在细胞外沉积而导致的一组疾病, 目前仍是一个通过组织学做出诊断的疾病, 活检组织刚果红染色呈砖红色, 偏光显微镜下为苹果绿双折光是淀粉样变性的诊断性特征. 系统性淀粉样变性患者, 常出现消化道症状, 表现形式复杂多样, 包括巨舌、吞咽困难、腹痛、出血、便秘、腹泻、吸收不良和不同程度的消化道出血. 淀粉样变性临床症状不典型, 容易漏诊, 导致治疗延迟. 本文就淀粉样变性累及消化系统的临床表现、内镜特征及相关治疗进展进行综述.
核心提要: 本文就消化系统淀粉样变性的临床表现及内镜下表现进行了系统的综述. 总结了消化道淀粉样变性的经典诊断方法, 介绍了生物标志物及蛋白亚型精准分型等新的诊断方法. 回顾了近年来淀粉样变性治疗的进展, 及其对临床预后的改善.
引文著录: 齐凤祥, 张颖, 季英兰, 江勇. 淀粉样变性的消化系统表现. 世界华人消化杂志 2019; 27(4): 260-266
Revised: December 29, 2018
Accepted: January 22, 2019
Published online: February 28, 2019
Amyloidosis is a group of diseases which are caused by the extracellular deposition of amyloid fibrils, which have a beta lamella structure and are positive for Congo red staining. The diagnosis of amyloidosis still relies on histology. Brick red coloration in Congo red staining of biopsy tissue and apple green double refraction under a polarizing microscope are diagnostic features of amyloidosis. Patients with systemic amyloidosis often exhibit gastrointestinal symptoms, which have complicated patterns of manifestations, including giant tongue, dysphagia, constipation, diarrhea, abdominal pain, bleeding, malabsorption, and different levels of gastrointestinal bleeding. Clinical symptoms of amyloidosis are atypical and easy to be misdiagnosed, which often causes delayed treatment. In this review, we will briefly introduce the clinical and endoscopic features of gastrointestinal manifestations of amyloidosis as well as its treatment.
- Citation: Qi FX, Zhang Y, Ji YL, Jiang Y. Gastrointestinal manifestations of amyloidosis. Shijie Huaren Xiaohua Zazhi 2019; 27(4): 260-266
- URL: https://www.wjgnet.com/1009-3079/full/v27/i4/260.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v27.i4.260
淀粉样变性是指具有β片层结构且刚果红染色阳性的淀粉样纤维结构物质在细胞外沉积而导致的一组疾病, 临床上分为: 原发性淀粉样变性(light chain primary amyloidosis, AL)、继发性淀粉样变性(secondary amyloidosis, AA)、透析相关性、遗传性、老年性和局限性[1]. 发病率6-10/百万/年, 平均65岁, 10%小于50岁[2].
淀粉样变性发病的共同病理生理机制为异常蛋白前体分子可引起系统性蛋白质毒性, 蛋白分子错误折叠后, 形成一种中间体, 聚集沉积为淀粉样蛋白间质纤维. 间质纤维对细胞和组织具有毒性, 最终导致广泛的器官功能障碍. 目前淀粉样变性仍是一个通过组织学做出诊断的疾病, 必须通过对受累器官或替代部位组织活检, 活检组织刚果红染色呈砖红色, 偏光显微镜下为苹果绿双折光是淀粉样变性的诊断性特征[3].
系统性淀粉样变性的临床表现包括乏力、体重减轻、神经病变、心脏病、肾病和关节病等[4]. 系统性淀粉样变性患者, 出现消化道症状也是很常见的. 但这些症状通常是非特异性的, 且表现形式复杂多样, 包括巨舌、吞咽困难、腹痛、出血、便秘、腹泻、吸收不良和不同程度的消化道出血[5]. 淀粉样变性临床症状不典型, 容易漏诊, 导致治疗延迟. 本文就淀粉样变性累及消化系统的临床表现、内镜特征及相关治疗原则进行综述.
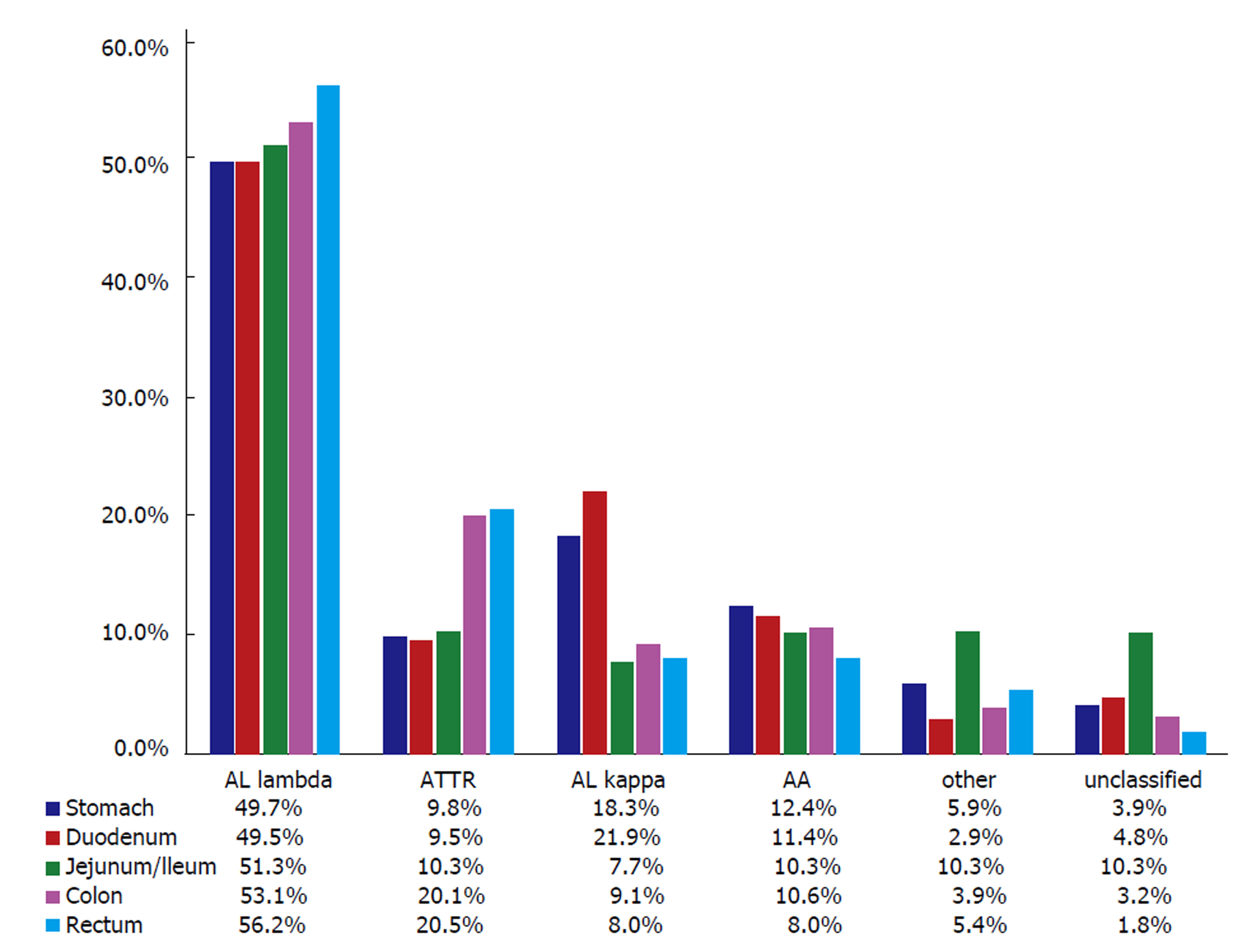
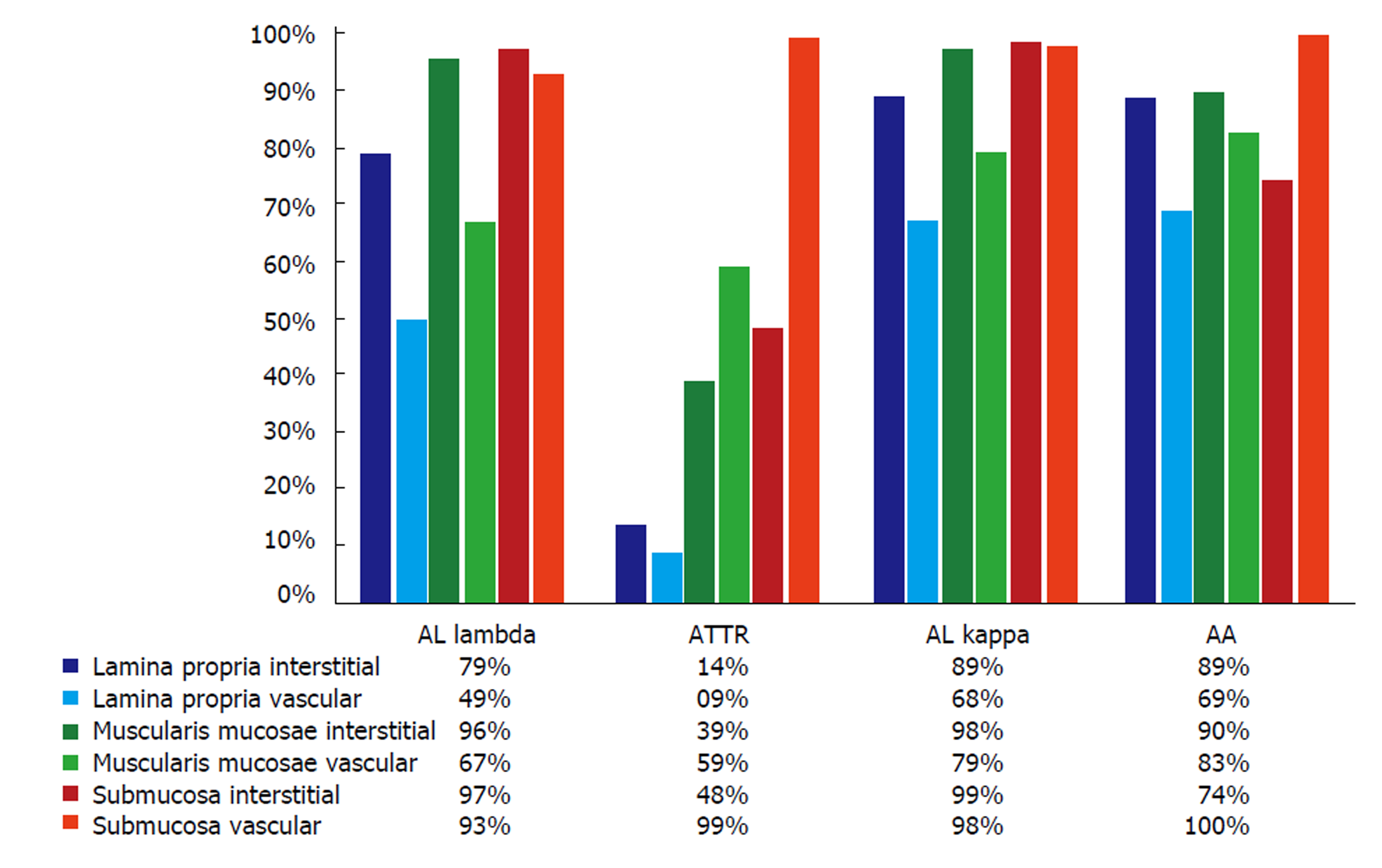
胃肠道淀粉样变性最常见的是AL型, 其中λ轻链异常多于κ轻链. Freudenthaler等[6]一项纳入542例淀粉样变性患者共663例胃肠道活检组织的回顾性观察性研究, 显示了不同类型淀粉样变性在胃肠道各个部分的分布及其在黏膜到黏膜下层的解剖分布(图1和图2). 胃肠道AL和AA淀粉样变性表现出不同的临床症状, 由于独特的受累模式. AA淀粉样蛋白的黏膜浸润可引起腹泻和吸收不良综合征, 而AL淀粉样蛋白的肌层黏膜沉积常伴有便秘或假性梗阻. 此外, 在AL淀粉样变患者中, 100%有十二指肠受累, 70%有食管受累. AL和AA淀粉样变均有神经肌肉浸润, 导致肠收缩功能受损或紊乱[7].
食管症状包括: 吞咽困难、胸骨后痛、烧心及呕血, 部分病人伴有气管误吸症状, 偶见类似贲门失迟缓症的表现. 常见的影像学表现为食管扩张、蠕动减弱. 有时可以表现为远端狭窄, 近端扩张[8].
淀粉样变性胃受累的症状包括: 恶心、呕吐、上腹痛及消化道出血等[9,10]. 淀粉样蛋白沉积在黏膜肌层、黏膜下层、肌层固有层, 导致正常胃皱襞减少或消失, 息肉状突起, 黏膜细颗粒外观. 胃溃疡可以表现为边缘不规则隆起、基底整洁, 有时形状似恶性肿瘤. 淀粉样物质侵犯黏膜下血管时, 可以出现血肿. 超声内镜可见发现胃壁不规则增厚, 黏膜及黏膜下层回声减低[11-13].
小肠是消化系统淀粉样变性最常受累的部位, 主要临床表现为腹泻、脂肪泻、蛋白丢失、出血、肠梗阻、肠系膜缺血、穿孔以及便秘等. 吸收不良、营养不良以及蛋白丢失可以引起低白蛋白血症、缺铁性贫血等[14]. 由于侵袭血管, 影响小肠血供, 可表现为缺血、溃疡、梗死和穿孔. 内镜下表现为弥漫的黏膜受累, 孤立的病变比较少见[12,15]. 腹泻形成的机制有几种可能: (1)小肠绒毛受累影响物质吸收; (2)肠壁神经丛和神经节受累引起自主神经功能异常, 胃肠运动障碍导致小肠细菌过度生长, 导致胆酸结合不良等, 可发生腹泻和脂肪泻; (3)当供应胰腺的血管受累时, 胰腺外分泌功能障碍也是引起腹泻的一个可能原因[12,15].
淀粉样变性的表现包括结肠扩张、狭窄、出血、梗死和穿孔. 当淀粉样蛋白侵及肠壁和神经导致结肠功能紊乱, 可出现腹泻与便秘交替[15,16]. 内镜下表现为息肉样病变、溃疡、结节样隆起或弥散的黏膜淤血. 其镜下表现与炎症性肠病、肿瘤、缺血性肠病或胶原性肠病相似[11,17].
结肠淀粉样变性的内镜下表现取决于淀粉样物质沉积的部位. 按血管是否受累分为两型. Ⅰ型血管未受累, 少量组织沉积于黏膜及黏膜下层, 黏膜层完整, 内镜检查可能无异常发现. Ⅱ型血管受累, 淀粉样物质沉积在肠内膜或外膜的血管壁, 黏膜下血管最常受累血管管壁增厚, 管腔狭窄, 直至闭塞. 相应肠道缺血坏死, 类似缺血性肠病的表现[18].
尸检结果显示, 约有56%-95%淀粉样变性患者肝脏受累. 这些患者中有半数曾出现肝脏受累表现, 临床表现大多较轻. 最常见的临床表现是肝脏肿大和ALP水平升高. 肝脏肿大见于约57%-83%的患者. 肝酶异常是非特异性的, 与肝脏受侵程度、肝脏实质还是血管受累等无明确相关性.腹水往往由于心力衰竭和低白蛋白血症引起, 而非肝脏病变所致[19-21]. 约有5%的患者出现高胆红素血症, ALP和胆红素的水平具有重要意义, 后期指标的升高预示着生存期的缩短[22,23].
肝淀粉样变无特异性的影像学改变, 最常见的表现为肝脏弥漫性增大.超声检查回声改变很大. CT平扫淀粉样物质沉积部位表现为灶性低密度改变, 称为"淀粉样假瘤", MR检查也无特异性改变, FibroScan一般>75[24,25].
淀粉样变性诊断的金标准是对受累器官进行组织活检, 刚果红染色呈砖红色, 偏光显微镜下为苹果绿双折光是淀粉样变性的诊断特征[3]. 对于淀粉样变性与内镜检查结果之间的相关性, 内镜检查结果可能存在很大差异. 一项涉及30名患者的研究发现, 原发性淀粉样变更多地与堆积沉积有关, 导致黏膜突出和肠皱褶增厚, 而继发性淀粉样变更多地与弥漫性沉积有关, 导致黏膜糜烂和溃疡[26]. 然而, 另一项单独的研究发现淀粉样变性与内镜检查结果[11]没有相关性.
关于系统性淀粉样变性在不同组织中的活检阳性率, 各文献报道不一. Freudenthaler等[6]回顾了542例胃肠道淀粉样变性活检结果, 其阳性率为结肠38.3%、胃23.1%、直肠16.9%、十二指肠15.8%、空肠/回肠5.9%. 国外一项纳入35例原发性系统性淀粉样变性患者的研究显示活检阳性率以受累组织器官为高, 分别为淋巴结100% 、肝脏80.0% 、肾脏66.7% 、胃十二指肠黏膜60.0%, 腹壁脂肪55.6% 、直肠黏膜40.0%[27]. 在肝脏淀粉样变性患者中由于淀粉样物质易沉积于血管壁, 使血管的脆性增加, 且血浆中淀粉样变性纤维能特异性地与Ⅹ因子结合并在组织中沉积, 导致Ⅹ因子下降, 出现凝血功能异常, 使得肝穿刺致肝脏破裂出血的风险大大增高, 故而针对肝淀粉样变性并不推荐肝穿刺活组织检查[23,28]. 最新的国外指南对于此病亦不推荐行多器官的活组织检查, 而更推荐皮肤脂肪抽吸活组织检查, 直肠活组织检查、骨穿也为可行方案[29,30].
生物标志物: 有研究表明, 血清游离轻链差值(free light chains, dFLC)大于20 mg/dL或复发时dFLC比基线增加20%或dFLC比最低点增加50%以上的患者被定义为高危dFLC进展, 这些患者的预后较差, 高危dFLC患者在可能出现器官进展前就出现需要抢救的危重症[31]. 另一个新的方法是使用锝99(99mTc)标记的丝氨酸蛋白酶抑制剂(抑肽酶), 它可能检测到身体重要器官中的早期淀粉样蛋白沉积. 但是这些新方法尚需要进一步的研究和验证[32].
淀粉样蛋白沉积的蛋白质亚基的精确分型也非常重要, 因为它可以指导治疗. 只有系统性免疫球蛋白轻链淀粉样变性可以通过化疗或干细胞移植进行治疗. 在所有其他形式的淀粉样蛋白中, 无论是系统性的还是局部性的, 化疗都是禁忌. 全身123I标记的血清淀粉样蛋白P闪烁显像对全身性AA淀粉样变的诊断灵敏度高达90%, 可显示除心脏外的器官受累程度[33]. 此外用质谱分析蛋白质组仍然是鉴定淀粉样蛋白亚基的金标准, 尽管价格昂贵且不是所有实验室都能做到[34].
AL的治疗目的是清除克隆性浆细胞产生的毒性蛋白前体, 治疗的目标是血液学完全缓解.
免疫调节治疗的目的是使患者尽快达到充分、长期的血清学缓解. 经典治疗方案为采用马法兰与泼尼松联合治疗方案. 免疫调节剂, 包括沙利度胺、来那度胺和波马度胺, 可以克服烷基化药物治疗的耐药性, 在复发的难治性AL患者中显示出了显著的活性[31], 少部分患者可达到完全缓解[35].
目前公认疗效最好的 AL 型淀粉样变性治疗方案, 大剂量药物化疗后行自体外周血干细胞移植, 可清除克隆性增生的浆细胞, 改善受累器宫的功能. 研究表明, 移植后60%以上的患者受累器官可获得症状缓解, 超过30%的患者可获得血液学完全缓解, 单独进行自体外周血造血干细胞移植完全缓解患者中远期生存时间可超过10年[36,37].
淀粉样变性的克隆浆细胞利用蛋白酶体,蛋白酶体抑制剂硼替佐米是一种潜在的靶向治疗方法. 两项研究表明, 在接受环磷酰胺/硼替佐米/地塞米松(CyBorD)治疗的患者中, 有较高的治疗反应率和并可以延长无进展生存期[38,39]. 在以硼替佐米为基础的治疗中, t(11; 14)患者的应答率很低, 而t(11; 14)可以出现在近50%的AL淀粉样变患者中如果出现. 如果t(11; 14)存在应考虑干细胞移植而不是硼替佐米, 因为这种基因异常不会对移植患者产生不利影响[40].
达雷木单抗Daratumumab是一种针对浆细胞表面CD 38抗原的人免疫球蛋白G1κ(IgG 1κ)单克隆抗体, 以往用于多发性骨髓瘤有良好的治疗作用[41]. AL中的克隆性浆细胞表达表面CD 38, 为Daratumab在AL淀粉样变中的应用提供了理论依据, 研究对标准化疗未达到完全反应的患者用达雷木单抗治疗8 wk, 总有效率为76%, CR 36%, 部分反应良好24%. 中位应答时间为1 mo, 且治疗耐受性好[31]. 托珠单抗(Tocilizumab)和肿瘤坏死因子也常用于AL的治疗, 有研究显示其治疗5年后临床和实验室缓解率为72.7%, 而抗肿瘤坏死因子治疗的患者中缓解率为40.7%[42].
胃肠道局限性淀粉样变性经手术治疗可获得长期缓解, 但系统性淀粉样变性累及胃肠道患者的总体预后较差[43]. 对于遗传因素所致的重症肝病而言, 肝移植也是一个可行的治疗方法[44,45].
强力霉素是一种抑菌抗生素, 可与30-50核糖体亚基结合, 抑制蛋白质合成. 在临床前研究中, 它已经被证明可以干扰淀粉样纤维的形成. 在标准化疗中加入强力霉素, 可以提高生存率[46].
对于胃肠道淀粉样变性, 支持治疗针对包括吸收不良、腹泻或梗阻的患者补充营养和维生素, 治疗相关的免疫损害而导致的感染. 奥曲肽可用于难治性腹泻和蛋白丢失性肠病[5].
AL预后差, 患者平均存活 12-15 mo[31]. 梅奥2012年分期显示其中器官受累与位生存时间的关系(表1), 而出现胃肠道受累者, 中位生存时间更短[47].
| 分期 | 中位生存时间(mo) |
| Ⅰ(0) | 94.1 |
| Ⅱ(1) | 40.3 |
| Ⅲ(2) | 14.0 |
| Ⅳ(3) | 5.8 |
心肌肌钙蛋白>0.025 ng/mL, N端脑钠肽前体(NT-proBNP)>1800 pg/mL, dFLC≥180 mg/L, 满足1项得1 分.
但是近十年来, 随着蛋白酶体抑制剂和自体造血干细胞移植等治疗方法的开展, AL淀粉样变性伴晚期疾病预后所改善. 最近对1551例AL淀粉样变患者的报告显示, 大约三分之一的患者的中位生存期超过10-34年. 近年来, 早期死亡率似乎从6 mo的40%降到了6 mo的24%[48,49].
总之, 胃肠道淀粉样变性临床症状不典型, 容易漏诊, 即使这种疾病的治疗已经取得重大进展, 但仍无法帮助晚期诊断的病人. 因此在临床工作中应该提高对该病的认识, 以期早期发现、早期诊断、早期干预, 改善患者生活质量.
学科分类: 胃肠病学和肝病学
手稿来源地: 天津市
同行评议报告分类
A级 (优秀): B
B级 (非常好): B
C级 (良好): C
D级 (一般): C
E级 (差): D
编辑: 崔丽君 电编:张砚梁
| 1. | Sipe JD, Benson MD, Buxbaum JN, Ikeda S, Merlini G, Saraiva MJ, Westermark P. Nomenclature 2014: Amyloid fibril proteins and clinical classification of the amyloidosis. Amyloid. 2014;21:221-224. [PubMed] [DOI] |
| 2. | Real de Asúa D, Costa R, Galván JM, Filigheddu MT, Trujillo D, Cadiñanos J. Systemic AA amyloidosis: epidemiology, diagnosis, and management. Clin Epidemiol. 2014;6:369-377. [PubMed] [DOI] |
| 3. | Desport E, Bridoux F, Sirac C, Delbes S, Bender S, Fernandez B, Quellard N, Lacombe C, Goujon JM, Lavergne D, Abraham J, Touchard G, Fermand JP, Jaccard A; Centre national de référence pour l'amylose AL et les autres maladies par dép原ts d'immunoglobulines monoclonales. Al amyloidosis. Orphanet J Rare Dis. 2012;7:54. [PubMed] [DOI] |
| 4. | Lachmann HJ, Goodman HJ, Gilbertson JA, Gallimore JR, Sabin CA, Gillmore JD, Hawkins PN. Natural history and outcome in systemic AA amyloidosis. N Engl J Med. 2007;356:2361-2371. [PubMed] [DOI] |
| 5. | Rowe K, Pankow J, Nehme F, Salyers W. Gastrointestinal Amyloidosis: Review of the Literature. Cureus. 2017;9:e1228. [PubMed] [DOI] |
| 6. | Freudenthaler S, Hegenbart U, Schönland S, Behrens HM, Krüger S, Röcken C. Amyloid in biopsies of the gastrointestinal tract-a retrospective observational study on 542 patients. Virchows Arch. 2016;468:569-577. [PubMed] [DOI] |
| 7. | Hoscheit M, Kamal A, Cline M. Gastroparesis in a Patient with Gastric AL Amyloidosis. Case Rep Gastroenterol. 2018;12:317-321. [PubMed] [DOI] |
| 8. | Syed U, Ching Companioni RA, Alkhawam H, Walfish A. Amyloidosis of the gastrointestinal tract and the liver: clinical context, diagnosis and management. Eur J Gastroenterol Hepatol. 2016;28:1109-1121. [PubMed] [DOI] |
| 9. | Cowan AJ, Skinner M, Seldin DC, Berk JL, Lichtenstein DR, O'Hara CJ, Doros G, Sanchorawala V. Amyloidosis of the gastrointestinal tract: a 13-year, single-center, referral experience. Haematologica. 2013;98:141-146. [PubMed] [DOI] |
| 10. | Khan Z, Darr U, Renno A, Tiwari A, Sofi A, Nawras A. Massive Upper and Lower GI Bleed from Simultaneous Primary (AL) Amyloidosis of the Stomach and Transverse Colon in a Patient with Multiple Myeloma. Case Rep Gastroenterol. 2017;11:625-631. [PubMed] [DOI] |
| 11. | Hokama A, Kishimoto K, Nakamoto M, Kobashigawa C, Hirata T, Kinjo N, Kinjo F, Kato S, Fujita J. Endoscopic and histopathological features of gastrointestinal amyloidosis. World J Gastrointest Endosc. 2011;3:157-161. [PubMed] [DOI] |
| 13. | Grape T, Wurm Johansson G, Eriksson M, Toth E, Thorlacius H. Primary gastroduodenal amyloidosis. Endoscopy. 2011;43 Suppl 2 UCTN:E288. [PubMed] [DOI] |
| 14. | Inayat F, Hurairah A. Duodenal Amyloidosis Masquerading as Iron Deficiency Anemia. Cureus. 2016;8:e725. [PubMed] [DOI] |
| 15. | Gaduputi V, Badipatla K, Patel H, Tariq H, Ihimoyan A. Primary systemic amyloidosis with extensive gastrointestinal involvement. Case Rep Gastroenterol. 2013;7:511-515. [PubMed] [DOI] |
| 17. | Ebert EC, Nagar M. Gastrointestinal manifestations of amyloidosis. Am J Gastroenterol. 2008;103:776-787. [PubMed] [DOI] |
| 19. | 刘 继喜, 张 明刚, 王 秀红, 王 晓娣, 赵 洪川. 结肠淀粉样变性的临床及内镜表现: 3例报道并文献复习. 胃肠病学和肝病学杂志. 2014;23:1240-1242. [DOI] |
| 20. | Hasan SM, Ahmed NN, Ahmed Z, Seibert A. Response of Bortezomib Chemotherapy in Hepatic Amyloidosis. J Investig Med High Impact Case Rep. 2018;6:2324709618760079. [PubMed] [DOI] |
| 22. | Sonthalia N, Jain S, Pawar S, Zanwar V, Surude R, Rathi PM. Primary hepatic amyloidosis: A case report and review of literature. World J Hepatol. 2016;8:340-344. [PubMed] [DOI] |
| 23. | Muchtar E, Dispenzieri A, Leung N, Lacy MQ, Buadi FK, Dingli D, Grogan M, Hayman SR, Kapoor P, Hwa YL, Fonder A, Hobbs M, Chakraborty R, Gonsalves W, Kourelis TV, Warsame R, Russell S, Lust JA, Lin Y, Go RS, Zeldenrust S, Kyle RA, Rajkumar SV, Kumar SK, Gertz MA. Depth of organ response in AL amyloidosis is associated with improved survival: grading the organ response criteria. Leukemia. 2018;32:2240-2249. [PubMed] [DOI] |
| 24. | 余 思邈, 王 亚超, 朱 云, 王 立福, 杜 宁, 孙 永强, 许 文涛, 王 丽苹, 景 婧, 张 帆, 王 睿林. 12例肝淀粉样变性患者临床特征分析. 临床肝胆病杂志. 2018;34:836-839. [DOI] |
| 25. | 王 慧慧, 田 字彬, 丁 雪丽, 荆 雪, 孔 心娟, 张 翠萍, 魏 良洲, 赵 清喜. 中国人肝淀粉样变性的临床特点. 世界华人消化杂志. 2013;21:1261-1265. [DOI] |
| 26. | Matsuda S, Motosugi U, Kato R, Muraoka M, Suzuki Y, Sato M, Shindo K, Nakayama Y, Inoue T, Maekawa S, Sakamoto M, Enomoto N. Hepatic Amyloidosis with an Extremely High Stiffness Value on Magnetic Resonance Elastography. Magn Reson Med Sci. 2016;15:251-252. [PubMed] [DOI] |
| 27. | Alcalde-Vargas A, Leo-Carnerero E, Rojas-Mercedes N, Trigo-Salado C, Herrera-Justiniano JM, Márquez-Galán JL. Correlation between location of amyloid deposits and endoscopic and clinical manifestations in symptomatic gastrointestinal amyloidosis. Rev Esp Enferm Dig. 2015;107:49-51. [PubMed] [DOI] |
| 29. | 闫 文姬, 罗 小洋, 杨 云生, 郭 明洲. 7例肝淀粉样变性的临床分析. 胃肠病学和肝病学杂志. 2012;21:339-341. [DOI] |
| 30. | Gillmore JD, Wechalekar A, Bird J, Cavenagh J, Hawkins S, Kazmi M, Lachmann HJ, Hawkins PN, Pratt G; BCSH Committee. Guidelines on the diagnosis and investigation of AL amyloidosis. Br J Haematol. 2015;168:207-218. [PubMed] [DOI] |
| 31. | Gertz MA. Immunoglobulin light chain amyloidosis diagnosis and treatment algorithm 2018. Blood Cancer J. 2018;8:44. [PubMed] [DOI] |
| 32. | Gillmore JD, Maurer MS, Falk RH, Merlini G, Damy T, Dispenzieri A, Wechalekar AD, Berk JL, Quarta CC, Grogan M, Lachmann HJ, Bokhari S, Castano A, Dorbala S, Johnson GB, Glaudemans AW, Rezk T, Fontana M, Palladini G, Milani P, Guidalotti PL, Flatman K, Lane T, Vonberg FW, Whelan CJ, Moon JC, Ruberg FL, Miller EJ, Hutt DF, Hazenberg BP, Rapezzi C, Hawkins PN. Nonbiopsy Diagnosis of Cardiac Transthyretin Amyloidosis. Circulation. 2016;133:2404-2412. [PubMed] [DOI] |
| 33. | Badar T, D'Souza A, Hari P. Recent advances in understanding and treating immunoglobulin light chain amyloidosis. F1000Res. 2018;7. [PubMed] [DOI] |
| 34. | Gertz MA, Benson MD, Dyck PJ, Grogan M, Coelho T, Cruz M, Berk JL, Plante-Bordeneuve V, Schmidt HHJ, Merlini G. Diagnosis, Prognosis, and Therapy of Transthyretin Amyloidosis. J Am Coll Cardiol. 2015;66:2451-2466. [PubMed] [DOI] |
| 35. | Winter M, Tholey A, Kristen A, Röcken C. MALDI Mass Spectrometry Imaging: A Novel Tool for the Identification and Classification of Amyloidosis. Proteomics. 2017;17. [PubMed] [DOI] |
| 36. | Palladini G, Milani P, Foli A, Basset M, Russo F, Perlini S, Merlini G. A phase 2 trial of pomalidomide and dexamethasone rescue treatment in patients with AL amyloidosis. Blood. 2017;129:2120-2123. [PubMed] [DOI] |
| 37. | Sher T, Gertz MA. Stem cell transplantation for immunoglobulin light chain amyloidosis. Curr Probl Cancer. 2017;41:129-137. [PubMed] [DOI] |
| 38. | Merlini G, Seldin DC, Gertz MA. Amyloidosis: pathogenesis and new therapeutic options. J Clin Oncol. 2011;29:1924-1933. [PubMed] [DOI] |
| 39. | Yim B, Kertowidjojo E, Zhang Y, Patel P. Poor Outcomes in Hepatic Amyloidosis: A Report of 2 Cases. Case Rep Oncol Med. 2016;2016:7625940. [PubMed] [DOI] |
| 40. | Cohen AD, Scott EC, Liedtke M, Kaufman JL, Landau H, Vesole DH, Gomes CL, Gasparetto C, Lentzsch S, Rosenzweig M, Sanchorawala V, Smith DD, Comenzo RL, Durie BG. A Phase Ⅰ Dose Escalation Study of Carfilzomib in Patients with Previously Treated Systemic Light-Chain (AL) Amyloidosis. Blood. 2014;124:4741. |
| 41. | Lokhorst HM, Plesner T, Laubach JP, Nahi H, Gimsing P, Hansson M, Minnema MC, Lassen U, Krejcik J, Palumbo A, van de Donk NW, Ahmadi T, Khan I, Uhlar CM, Wang J, Sasser AK, Losic N, Lisby S, Basse L, Brun N, Richardson PG. Targeting CD38 with Daratumumab Monotherapy in Multiple Myeloma. N Engl J Med. 2015;373:1207-1219. [PubMed] [DOI] |
| 42. | Kaufman GP, Schrier SL, Lafayette RA, Arai S, Witteles RM, Liedtke M. Daratumumab yields rapid and deep hematologic responses in patients with heavily pretreated AL amyloidosis. Blood. 2017;130:900-902. [PubMed] [DOI] |
| 43. | Okuda Y, Ohnishi M, Matoba K, Jouyama K, Yamada A, Sawada N, Mokuda S, Murata Y, Takasugi K. Comparison of the clinical utility of tocilizumab and anti-TNF therapy in AA amyloidosis complicating rheumatic diseases. Mod Rheumatol. 2014;24:137-143. [PubMed] [DOI] |
| 45. | Ueno A, Katoh N, Aramaki O, Makuuchi M, Ikeda S. Liver Transplantation Is a Potential Treatment Option for Systemic Light Chain Amyloidosis Patients with Dominant Hepatic Involvement: A Case Report and Analytical Review of the Literature. Intern Med. 2016;55:1585-1590. [PubMed] [DOI] |
| 46. | Shin JK, Jung YH, Bae MN, Baek IW, Kim KJ, Cho CS. Successful treatment of protein-losing enteropathy due to AA amyloidosis with octreotide in a patient with rheumatoid arthritis. Mod Rheumatol. 2013;23:406-411. [PubMed] [DOI] |
| 47. | Wechalekar AD, Whelan C. Encouraging impact of doxycycline on early mortality in cardiac light chain (AL) amyloidosis. Blood Cancer J. 2017;7:e546. [PubMed] [DOI] |
| 48. | Lim AY, Lee JH, Jung KS, Gwag HB, Kim DH, Kim SJ, Lee GY, Kim JS, Kim HJ, Lee SY, Lee JE, Jeon ES, Kim K. Clinical features and outcomes of systemic amyloidosis with gastrointestinal involvement: a single-center experience. Korean J Intern Med. 2015;30:496-505. [PubMed] [DOI] |
| 49. | Muchtar E, Gertz MA, Kumar SK, Lacy MQ, Dingli D, Buadi FK, Grogan M, Hayman SR, Kapoor P, Leung N, Fonder A, Hobbs M, Hwa YL, Gonsalves W, Warsame R, Kourelis TV, Russell S, Lust JA, Lin Y, Go RS, Zeldenrust S, Kyle RA, Rajkumar SV, Dispenzieri A. Improved outcomes for newly diagnosed AL amyloidosis between 2000 and 2014: cracking the glass ceiling of early death. Blood. 2017;129:2111-2119. [PubMed] [DOI] |