修回日期: 2018-12-12
接受日期: 2019-01-22
在线出版日期: 2019-02-08
探讨雷替曲塞联合伊立替康治疗转移性胃癌(gastric cancer, GC)对血清内皮细胞特异性分子-1(endothelial cell specific molecule-1, ESM-1)及胰岛素样生长因子结合蛋白3(insulin-like growth factor binding protein 3, IGFBP3)表达的影响.
选取2015-12/2017-12入住绍兴市人民医院肿瘤内科并接受治疗的转移性GC患者55例进行研究. 所有患者均采用雷替曲塞与伊立替康联合疗法: 第一天, 伊立替康: 剂量180 mg/m2, 静脉滴注1.5 h; 第二天, 雷替曲塞: 剂量3 mg/m2, 静脉滴注1.5 h. 以3 wk为一个周期, 依据患者病情, 最多进行6个周期. 随访至2018-06-31. 考察治疗后近远期疗效、治疗前后患者ESM-1和IGFBP3表达水平变化, 统计治疗过程中患者发生不良反应种类及等级.
完全缓解3例(5.45%), 部分缓解 10例(18.18%), 稳定28例(50.91%), 进展14例(25.45%), 客观有效率为23.64%(13/55), 疾病抑制率为74.55%(41/55). 中位肿瘤进展时间为6.1 mo(95%CI: 5.2-6.9 mo); 中位生存时间为9.4 mo(95%CI: 8.7-11.2 mo); 治疗后ESM-1表达水平(0.72 μg/L±0.54 μg/L)显著低于治疗前(1.03 μg/L±0.67 μg/L)(P<0.05); 治疗后IGFBP3表达水平(3.27 μg/L±0.45 μg/mL)显著高于治疗前(2.93 μg/L±0.43 μg/mL)(P<0.05); 患者最常见的不良反应主要有中性粒细胞减少(19/55, 34.55%)、肝功能异常(15/55, 27.27%)、贫血(18/55, 32.73%)及恶心呕吐(14/55, 25.45%).
雷替曲塞联合伊立替康治疗转移性GC, 可降低患者血清ESM-1的表达, 抑制肿瘤血管的生成, 并提高IGFBP3表达水平, 减少癌细胞的扩散, 从而有效控制病情的发展, 提高患者存活期, 且不良反应较少, 安全性高, 可为临床转移性GC患者的治疗提供前期治疗方案参考.
核心提要: 雷替曲塞联合伊立替康治疗转移性胃癌, 可降低患者血清内皮细胞特异性分子-1的表达, 抑制肿瘤血管的生成, 并提高胰岛素样生长因子结合蛋白3表达水平, 减少癌细胞的扩散, 从而有效控制病情的发展, 提高患者存活期, 且不良反应较少, 安全性高.
引文著录: 彭江华, 马建永. 雷替曲塞联合伊立替康治疗转移性胃癌对血清ESM-1、IGFBP3表达的影响. 世界华人消化杂志 2019; 27(3): 203-208
Revised: December 12, 2018
Accepted: January 22, 2019
Published online: February 8, 2019
To investigate the effect of raltitrexed combined with irinotecan on the expression of endothelial cell specific molecule-1 (ESM-1) and insulin-like growth factor binding protein-3 (IGFBP3) in serum of patients with metastatic gastric cancer (GC).
Fifty-five patients with metastatic GC admitted to our department from December 2015 to December 2017 were studied. All patients were treated with raltitrexed and irinotecan (irinotecan: dose 180 mg/m2, intravenous drip over 1.5 h, day 1; raltitrexed: 3 mg/m2, intravenous drip over 1.5 h, day 2). Each 3-wk period consisted of a cycle, and according to the patient's condition, there were six cycles at most. Follow-up was up to June 31, 2018.
Complete remission occurred in 3 cases (5.45%), partial remission in 10 cases (18.18%), stable disease in 28 cases (50.91%), and progressive disease in 14 cases (25.45%). The objective response rate was 23.64% (13/55), and disease inhibition rate was 74.55% (41/55). The median time to tumor progression was 6.1 months (95%CI: 5.2-6.9 mo), and the median survival time was 9.4 mo (95%CI: 8.7-11.2 mo). The expression of ESM-1 after treatment (0.72 μg/L + 0.54 μg/L) was significantly lower than that before treatment (1.03 μg/L + 0.67 μg/L; P < 0.05). The expression of IGFBP3 after treatment (3.27 μg/mL + 0.45 μg/mL) was significantly higher than that before treatment (2.93 μg/mL ± 0.43 μg/mL; P < 0.05). The most common adverse reactions were neutropenia (19/55, 34.55%), liver dysfunction (15/55, 27.27%), anemia (18/55, 32.73%), and nausea and vomiting (14/55, 25.45%).
The combination of raltitrexed and irinotecan in the treatment of metastatic GC can reduce the expression of ESM-1 in serum, inhibit the angiogenesis, increase the expression of IGFBP3, reduce the spread of cancer cells, and thus effectively control the development of the disease and improve the survival period of patients with fewer adverse reactions and high safety.
- Citation: Peng JH, Ma JY. Effect of raltitrexed combined with irinotecan on expression of ESM-1 and IGFBP3 in serum of patients with metastatic gastric cancer. Shijie Huaren Xiaohua Zazhi 2019; 27(3): 203-208
- URL: https://www.wjgnet.com/1009-3079/full/v27/i3/203.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v27.i3.203
胃癌(gastric cancer, GC)是临床常见的消化系统恶性肿瘤之一. 饮食习惯、生活习性、工作环境等都会导致该病的发生, 据2015年中国癌症数据统计[1], GC的发病率和死亡率均呈现逐年增长的趋势. 且有数据统计, 50%的患者就诊时已发展为晚期或存在远处转移, 错失行根治术的最佳时机, 从而化疗成为首选治疗方案[2]. 虽然很多化疗药物如奥沙利铂、卡培他滨等已广泛应用于GC的治疗, 但由于患者病情严重且存在转移而无法实现较好的治疗效果. 因而寻求一种有效抑制癌细胞转移、且安全性好的化疗方案对于改善转移性GC临床疗效和生存质量具有重要意义. 伊立替康是水溶性的半合成喜树碱衍生物, 可阻断DNA复制和转录过程从而杀死癌细胞, 是治疗转移性GC的一线药物[3]; 雷替曲塞是抗代谢的叶酸类似物, 可抑制细胞DNA的合成, 从而发挥细胞毒作用, 具有疗效确切、不良反应小等优点[4]. 已有临床数据表明[5], 伊立替康与雷替曲塞联合用药可有效改善晚期GC患者病情, 但鲜有报道研究其在转移性GC中疗效. 随着早期诊断技术的发展, 人们发现越来越多的肿瘤标志物, 对疾病的治疗具有重要意义. 血清内皮细胞特异性分子-1(endothelial cell specific molecule-1, ESM-1)主要存在于血管网中, 与血管生成密切相关, 且有研究表明其与癌细胞的转移密切相关[6]. 胰岛素样生长因子结合蛋白3(insulin-like growth factor binding protein 3, IGFBP3)具有调节肿瘤细胞生长的作用, 与肿瘤的增殖密切相关[7]. 通过检测以上两种血清指标可一定程度上评价GC的病情进展, 为疾病的治疗提供参考依据. 本研究针对2015-12/2017-12入住绍兴市人民医院肿瘤内科并接受治疗的转移性GC患者55例进行研究, 采用雷替曲塞联合伊立替康疗法, 考察治疗方案的近远期疗效、血清ESM-1、IGFBP3的表达并评价化疗方案安全性, 以期为临床转移性GC患者的治疗提供前期研究基础. 现将结果报道如下.
本研究选取2015-12/2017-12入住绍兴市人民医院肿瘤内科并接受治疗的转移性GC患者55例进行研究. 所有患者均通过病理组织检查确诊为GC. 研究通过我院伦理委员会批准, 所有研究对象均对研究知情并签署知情同意书. 55例患者中男27例, 女28例, 年龄18-74岁, 平均年龄42.3岁±10.5岁. 病理分级Ⅰ级8例、Ⅱ级12例、Ⅲ级15例、Ⅳ级20例. 胃体癌31例、贲门胃底癌11例、胃底癌13例. 入组标准: (1)所有患者在治疗前均经过胃镜下活检术或姑息手术, 有明确病理组织学结果支持GC诊断, GC病理分期采用2010年国际抗癌联盟/美国癌症联合委员会(UICC/AJCC)TNM分期标准确诊为转移性GC; (2)患者自愿接受化疗并签署知情同意书; (3)患者心电图、血常规等基本正常, 心肺功能、肝肾功能及心脑血管均无明显异常. 排除标准: (1)患者预计存活时间低于3 mo; (2)患者不能进行化疗; (3)女性患者妊娠试验结果为阳性; (4)患者伴有其他恶性肿瘤疾病; (5)患者已参与其他临床试验.
所有患者均采用雷替曲塞联合伊立替康疗法, 具体实施方案: 化疗前后根据患者出现的不同症状给予护肝、护胃、止呕等支持性辅助治疗. 第一天, 伊立替康: 剂量180 mg/m2, 静脉滴注1.5 h; 第二天, 雷替曲塞: 剂量3 mg/m2, 静脉滴注1.5 h. 以3周为一个治疗周期, 每个周期中观察患者临床症状变化并考察不良反应发生情况, 每两个周期评价一次疗效. 在治疗过程中, 如若患者体质及血液学等指标不满足化疗标准, 可依据实际情况顺延化疗时间, 但原则上不得延迟超过2 wk. 2个周期后, 伊立替康和雷替曲塞可根据"减量标准"于次周同时或单独减少剂量, 每次减少1个剂量级的剂量, 累计减少次数不得超过2次[8]. 在治疗过程中, 患者不能耐受或病情变化等不能继续化疗需要立即终止研究.
观察指标: (1)近期疗效判定: 采用实体肿瘤的疗效评价标准1.1版(Response Evaluation Criteria in Solid Tumors RECIST Version 1.1)[9]对患者化疗结束后一周近期疗效进行评价, 主要包括四部分: 部分缓解(partial remission, PR)、完全缓解(completely relieve, CR)、稳定(stable duration, SD)、进展(progressive duration, PD). 客观有效率(objective response rate, ORR) = PR+CR; 疾病控制率(Disease control rate, DCR) = CR+PR+SD; PR: 和基线的病灶直径总和相比, 靶病灶的直径之和下降30以上; CR: 靶病灶消失, 且对淋巴结进行病理检查, 短直径减少为10 mm以下; SD: 靶病灶的增加程度未达PD, 减小程度亦未达PR; PD: 靶病灶直径之和比治疗后病灶最小直径之和增加20%以上, 且绝对值增大5 mm或以上; 或出现新的病灶; (2)远期疗效判定: 通过疾病进展时间及总生存时间评价远期疗效. 随访截止时间为2018-06-31. 疾病进展时间(the time of progress, TTP): 从化疗起至影像学检查发现肿瘤发生进展的时间. 总生存时间(overall survival, OS): 患者从化疗起至死亡或最后一次随诊时间(标注患者生死). (3)血清指标: 分别于治疗前及治疗后1天抽取患者清晨空腹静脉血5 mL, 于2000 r/min的转速下离心10 min, 取上清于-80 ℃保存待测. 采用酶联免疫吸附法测定患者ESM-1及IGFBP3. (4)不良反应考察: 根据美国国立癌症研究所通用不良事件术语标准4.0版(NCI-CTC4.0)[10]对化疗中患者不良反应事件进行统计, 分为1-5等5个等级, 1级: 较轻微的不良反应, 通常无症状, 不需治疗; 2级: 中等程度的不良反应, 通常有临床症状, 能影响机体的功能, 需治疗; 3级: 较为严重的不良反应, 症状复杂, 需要进行外科手术或住院治疗; 4级: 可能对生命构成潜在威胁, 往往可致残, 甚至导致器官损害或器官功能的丧失; 5级: 死亡.
统计学处理 使用SPSS 19.0数理统计软件包行统计学分析, 计数资料以百分数、中位数表示, 两两对比行χ2检验, 计量资料以(mean±SD)描述, 组间对比行独立样本t检验. 采用Kaplan-Meier法绘制生存曲线.
本次研究中55例患者最少实施2个周期化疗, 最多完成6个周期. 其中CR 3例(5.45%), PR 10例(18.18%), SD28例(50.91%), PD14例(25.45%), ORR为23.64%(13/55), DCR为74.55%(41/55).
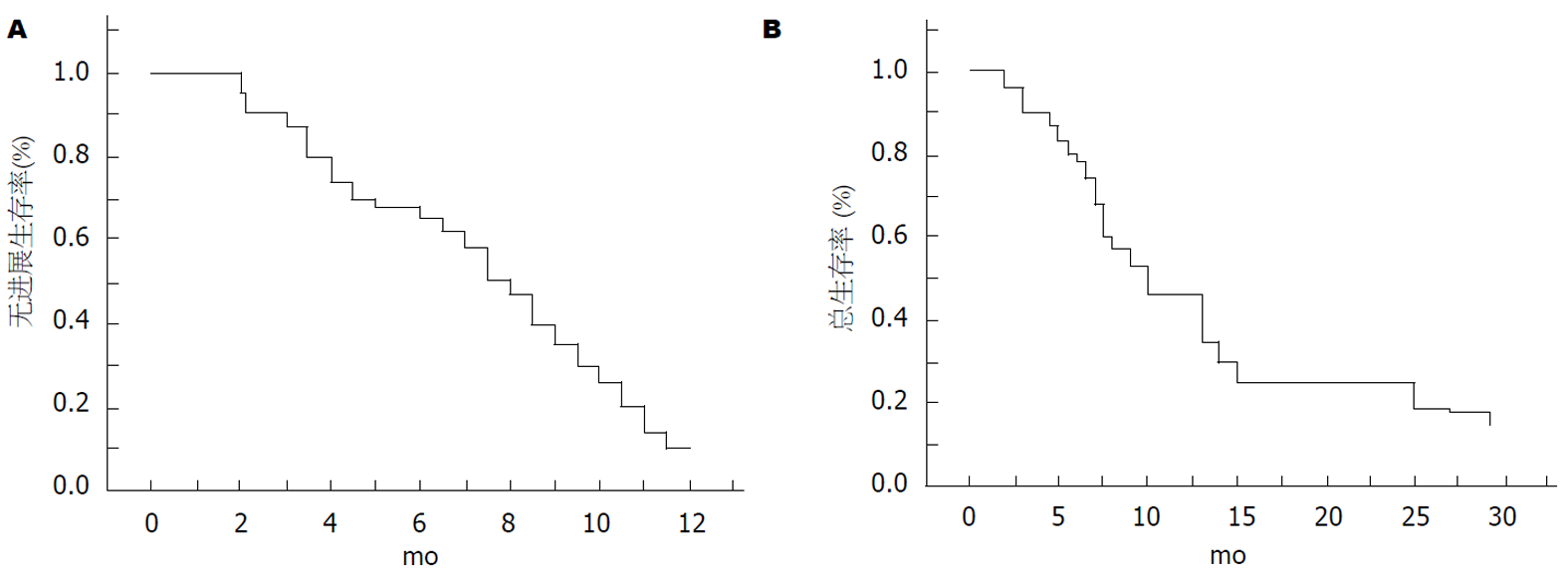
停止随访日期为2018年6月31日, 期间55例患者中18例存活, 37例死亡, 0例随访失败, 中位肿瘤进展时间TTP为6.1 mo(95%CI: 5.2-6.9 mo), TTP曲线见图1; 中位生存时间OS为9.4 mo(95%CI: 8.7-11.2 mo), OS曲线图见图2.
本研究中患者治疗后ESM-1表达水平(0.72 μg/L±0.54 μg/L)显著低于治疗前(1.03 μg/L±0.67 μg/L)(P<0.05); 治疗后IGFBP3表达水平(3.27 μg/L±0.45 μg/mL)显著高于治疗前(2.93 μg/L±0.43 μg/mL)(P<0.05), 详见表1.
| ESM-1 (μg/L) | IGFBP3 (μg/mL) | |
| 治疗前 | 1.03 ± 0.67 | 2.93 ± 0.43 |
| 治疗后 | 0.72 ± 0.54 | 3.27 ± 0.45 |
| t值 | 2.672 | 4.051 |
| P值 | 0.009 | 0.000 |
本研究中患者最常见的不良反应主要有中性粒细胞减少(19/55, 34.55%)、肝功能异常(15/55, 27.27%)、贫血(18/55, 32.73%)及恶心呕吐(14/55, 25.45%); 其他不良反应有中性粒细胞减少引起的发热(3/55, 5.45%)、血小板减少(10/55, 18.18%)、乏力、食欲下降(13/55, 23.64%)、腹泻(5/55, 9.09%)、口腔黏膜炎(1/55, 1.82%); 所有患者均未发生肌酐升高、急性胆碱综合征. 3、4级不良反应较少, 主要为中性粒细胞减少、肝功能异常和血小板减少. 本研究患者不良反应均无5级. 详见表2.
| 不良反应(n = 55) | 1级 | 2级 | 3级 | 4级 | 1-4级(%) |
| 中性粒细胞减少 | 14 | 4 | 1 | 0 | 19 (34.55) |
| 中性粒细胞减少引起的发热 | 3 | 0 | 0 | 0 | 3 (5.45) |
| 血小板减少 | 6 | 3 | 0 | 1 | 10 (18.18) |
| 肝功能异常 | 11 | 1 | 3 | 0 | 15 (27.27) |
| 贫血 | 13 | 5 | 0 | 0 | 18 (32.73) |
| 恶心呕吐 | 11 | 3 | 0 | 0 | 14 (25.45) |
| 乏力、食欲下降 | 10 | 3 | 0 | 0 | 13 (23.64) |
| 腹泻 | 4 | 1 | 0 | 0 | 5 (9.09) |
| 口腔黏膜炎 | 1 | 0 | 0 | 0 | 1 (1.82) |
| 肌酐升高 | 0 | 0 | 0 | 0 | 0.00 |
| 急性胆碱综合征 | 0 | 0 | 0 | 0 | 0.00 |
在我国, GC具有较高的发病率和死亡率, 且呈现逐年增长的趋势, 严重威胁人们的身体健康. 且临床数据显示, 约一半的患者就诊时已发展为晚期或伴随远处转移, 不能采用常规根治术进行治疗, 因此如何提高此类患者的临床疗效成为广大医师及研究人员关注的重点. 目前, 针对转移性GC患者主要通过放疗、化疗、腹腔化疗等手段[11]. 其中, 化疗作为治疗转移性GC的主要策略, 目前采用的化疗药物主要有替吉奥、卡培他滨等[12,13], 此类药物虽然可以改善病情但疗效不稳定[14], 此外靶向治疗的曲妥珠单抗、贝伐珠单抗联合化疗, 虽疗效肯定但价格昂贵[15]. 因此, 迫切需要一种疗效确切、安全性高的化疗方案来缓解转移性GC患者的病情.
伊立替康是一种特异性的DNA拓扑异构酶I抑制剂, 是一种作用于细胞周期的抗肿瘤药物, 在细胞的S期, 其与DNA及拓扑异构酶Ⅰ的结合物作用从而抑制DNA复制和转录, 使得DNA不可逆破坏, 导致肿瘤细胞死亡[3]. 临床研究表明伊立替康可有效治疗转移性GC, 提高患者存活期[16]. 美国国立综合癌症网络指南也将伊立替康推荐为转移性GC的一线化疗药物. 雷替曲塞是新一代叶酸类水溶性胸苷酸合酶抑制剂, 其通过细胞膜外还原型叶酸盐转运到细胞内部, 并被代谢为谷氨酸类化合物, 从而抑制胸苷酸合酶的活性, 达到阻断癌细胞DNA合成的作用, 实现其抗肿瘤效果[4]. 该药转化的谷氨酸类化合物可长时间停留在细胞内, 持续发挥胸苷酸合酶活性抑制作用, 且心脏毒性低, 是不适合氟尿嘧啶药物治疗的GC患者的替代药. 研究表明, 雷替曲塞可以和伊立替康代谢的喜树碱衍生物SN-38协同发挥抗肿瘤药效, 因此, 两药联用时先给予伊立替康再给予雷替曲塞, 可发挥更好的抗肿瘤效果[17]. 本研究第一天伊立替康180 mg/m2; 第二天雷替曲塞3 mg/m2, 客观有效率为23.64%, 疾病抑制率为74.55%, 中位肿瘤进展时间6.1 mo, 中位生存时间为9.4 mo, 表明两药联合使用可有效改善病情, 减缓肿瘤进展, 提高存活时间. 分析认为这与两药协同作用、增加药物疗效密切相关. 李玉梅等[18]人研究也表明雷替曲塞和伊立替康联用在晚期结直肠癌患者中具有较高的治疗有效率.
随着早期诊断技术的发展, 人们发现了很多肿瘤标志物, 这些标志物与肿瘤的发生发展密切相关, 不仅可以用于疾病的筛查, 对于疾病病情发展的评估易具有重要意义. 目前临床上关于GC的标志物主要有癌胚抗原、多种糖类抗原、胰蛋白酶抑制剂前体、血管生成素样蛋白等, 此类标志物虽在GC的诊断中具有一定价值, 但在转移性GC的病情评估上灵敏度较小、特异性不高. ESM-1是进来新发现的癌症预后标志物. 其主要存在于血管网中, 与血管生成密切相关, GC作为一个血流丰富的实体瘤, 其生长、侵袭和转移与血管生成具有重要联系. 研究表明[19], ESM-1可以通过促进肿瘤的血管生成加快肿瘤的远处转移. 刘晖杰等[20]人研究表明, 存在远处转移的GC患者血清ESM-1水平要显著高于未发生转移的GC患者, 且该指标与GC患者的存活期具有一定关联, 生存期长的患者血清ESM-1水平要明显低于生存期短的. 本次研究中, 治疗后患者血清ESM-1水平显著低于治疗前, 表明雷替曲塞联合伊立替康可降低患者血清ESM-1的表达, 抑制肿瘤血管的生成, 减少癌细胞的扩散, 从而实现较好的治疗效果. 此外, 本研究还考察了治疗前后患者IGFBP3的表达. IGFBP3基因为染色体7p12-14, 具有调节肿瘤细胞生长的作用, 与肿瘤细胞的增殖、死亡密切相关. 其作为一种GC标志物, 有研究表明, 其肿瘤的分期、大小及转移显著相关, 存在转移的患者IGFBP3表达水平要显著低于未转移患者[21]. 本研究结果显示: 治疗后患者血清IGFBP3表达水平显著高于治疗前, 表明雷替曲塞联合伊立替康可提高IGFBP3表达水平, 证实该化疗方案可以抑制癌细胞的继续转移和扩散. 结合上述ESM-1检测结果, 进一步证实了雷替曲塞联合伊立替康可有效控制病情的发展, 提高患者存活期.
除了考察化疗方案的临床效果, 药物是否安全、不良反应发生情况亦是本研究的重点. 以往已有研究将雷替曲塞与伊立替康联合化疗用于晚期结直肠癌的治疗, 但存在较高的腹泻发生率, 严重者导致死亡, 这与药物剂量密切相关[22]. 伊立替康的主要不良反应为腹泻, 且与剂量呈现正相关. 本研究中伊立替康剂量为180 mg/m2, 是前者研究的一半, 配合雷替曲塞增加药物的协同作用. 结果显示: 腹泻患者发生率为9.09%. 本研究中主要的不良反应为中性粒细胞减少(34.55%)、肝功能异常(27.27%)、贫血(32.73%)及恶心呕吐(25.45%), 针对中性粒细胞减少患者采用重组人粒细胞刺激因子治疗后, 病症好转; 对于本研究肝功能异常发生率较高, 可能与雷替曲塞会增加转氨酶水平有关. 本研究未有严重腹泻者, 对于腹泻患者及时给予盐酸洛哌丁胺可有效缓解症状. 本研究患者未出现心脏毒性、神经毒性、肾毒性等严重致死性不良反应, 总体安全性较好.
总之, 雷替曲塞联合伊立替康治疗转移性GC, 可降低患者血清ESM-1的表达, 抑制肿瘤血管的生成, 并提高IGFBP3表达水平, 减少癌细胞的扩散, 从而有效控制病情的发展, 提高患者存活期, 且不良反应较少, 安全性高, 可为临床转移性GC患者的治疗提供前期治疗方案参考.
近年来有研究报道, 血清内皮细胞特异性分子-1(endo-thelial cell specific molecule-1, ESM-1)与癌细胞的转移密切相关, 胰岛素样生长因子结合蛋白3(insulin-like growth factor binding protein 3, IGFBP3)与肿瘤的增殖有相关性, 二者的血清水平能够在一定程度上评价胃癌(gastric cancer, GC)的病情进展, 伊立替康与雷替曲塞联合用药可有效改善晚期GC患者病情, 但将其应用于转移性GC的治疗报道较少.
研究雷替曲塞联合伊立替康疗治疗转移性GC的近远期疗效、血清ESM-1、IGFBP3的表达并评价化疗方案安全性, 以期为临床转移性GC患者的治疗提供前期研究基础.
雷替曲塞联合伊立替康治疗转移性GC, 可降低患者血清ESM-1的表达, 抑制肿瘤血管的生成, 并提高IGFBP3表达水平, 减少癌细胞的扩散, 从而有效控制病情的发展, 提高患者存活期.
采用雷替曲塞联合伊立替康对转移性GC患者进行治疗, 并分别于治疗前和治疗后采用酶联免疫吸附法测定患者的ESM-1和IGFBP3水平并进行比较, 同时对近远期疗效及安全性进行评价.
通过分析发现, 治疗后患者的ESM-1表达水平降低, IGFBP3表达水平升高, 患者病情得到控制.
雷替曲塞联合伊立替康治疗转移性GC, 可降低患者血清ESM-1的表达, 抑制肿瘤血管的生成, 并提高IGFBP3表达水平, 减少癌细胞的扩散, 从而有效控制病情的发展, 提高患者存活期, 且不良反应较少, 安全性高, 可为临床转移性GC患者的治疗提供前期治疗方案参考.
本研究对患者治疗前后的ESM-1和IGFBP3水平进行了比较, 今后将进一步研究不同肿瘤进展患者与化疗有效患者的ESM-1和IGFBP3变化水平是否有差异, ESM-1和IGFBP3是否可以作为疗效评价的指标, 以及与其他治疗方案相比, 本研究治疗方案是否具有疗效优势.
学科分类: 胃肠病学和肝病学
手稿来源地: 浙江省
同行评议报告分类
A级 (优秀): 0
B级 (非常好): 0
C级 (良好): C, C, C
D级 (一般): 0
E级 (差): 0
编辑: 崔丽君 电编:张砚梁
| 1. | Chen W, Zheng R, Baade PD, Zhang S, Zeng H, Bray F, Jemal A, Yu XQ, He J. Cancer statistics in China, 2015. CA Cancer J Clin. 2016;66:115-132. [PubMed] [DOI] |
| 4. | 姚 玮, 张 君儒, 陈 连锁, 巩 祥胜, 郭 丽, 张 振山, 王 旭初, 冯 娜娜. 雷替曲塞TACE治疗胃癌术后肝转移的近期疗效观察. 介入放射学杂志. 2016;25:125-128. [DOI] |
| 9. | Eisenhauer EA, Verweij J, Eisenhauer EA. 11 New response evaluation criteria in solid tumors: RECIST GUIDELINE VERSION 1.1. Eur J Cancer. 2009;7:5. [DOI] |
| 12. | 张 功平. 替吉奥同步放疗序贯化疗治疗胃癌根治术后腹腔淋巴结转移瘤的疗效. 临床医药文献电子杂志. 2017;4:4903-4904. [DOI] |