修回日期: 2018-12-20
接受日期: 2019-01-10
在线出版日期: 2019-02-08
探讨D-二聚体对急性胰腺炎(acute pancreatitis, AP)患者预后预测价值.
计算机检索Medline、EMBASE、Cochrane图书馆、CBM网络版和CNKI等数据库, 收集D-二聚体水平升高对AP患者预后影响的临床研究, 对符合纳入标准的研究进行质量评价和资料提取后, 采用MetaDisc软件进行Meta分析.
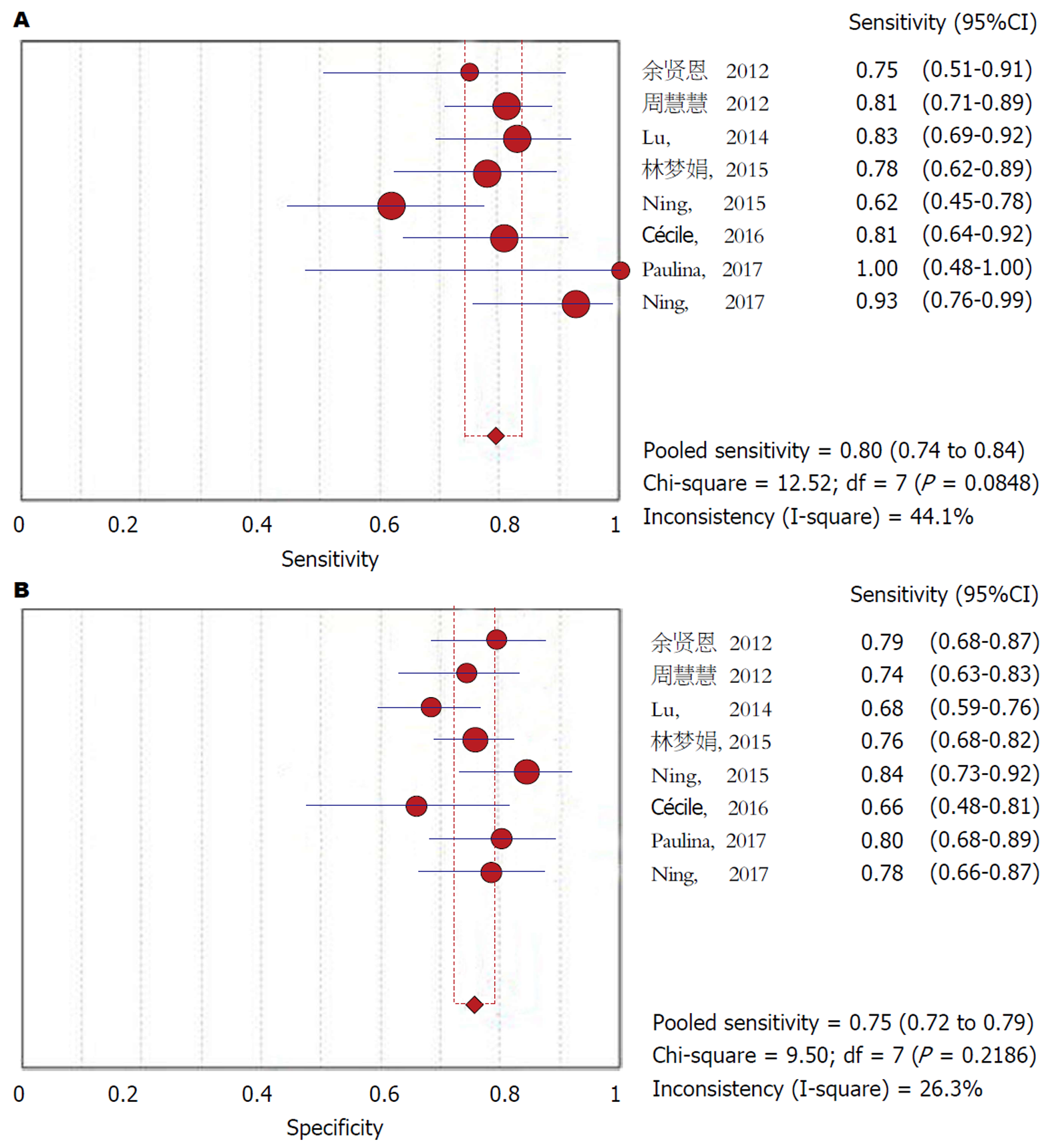
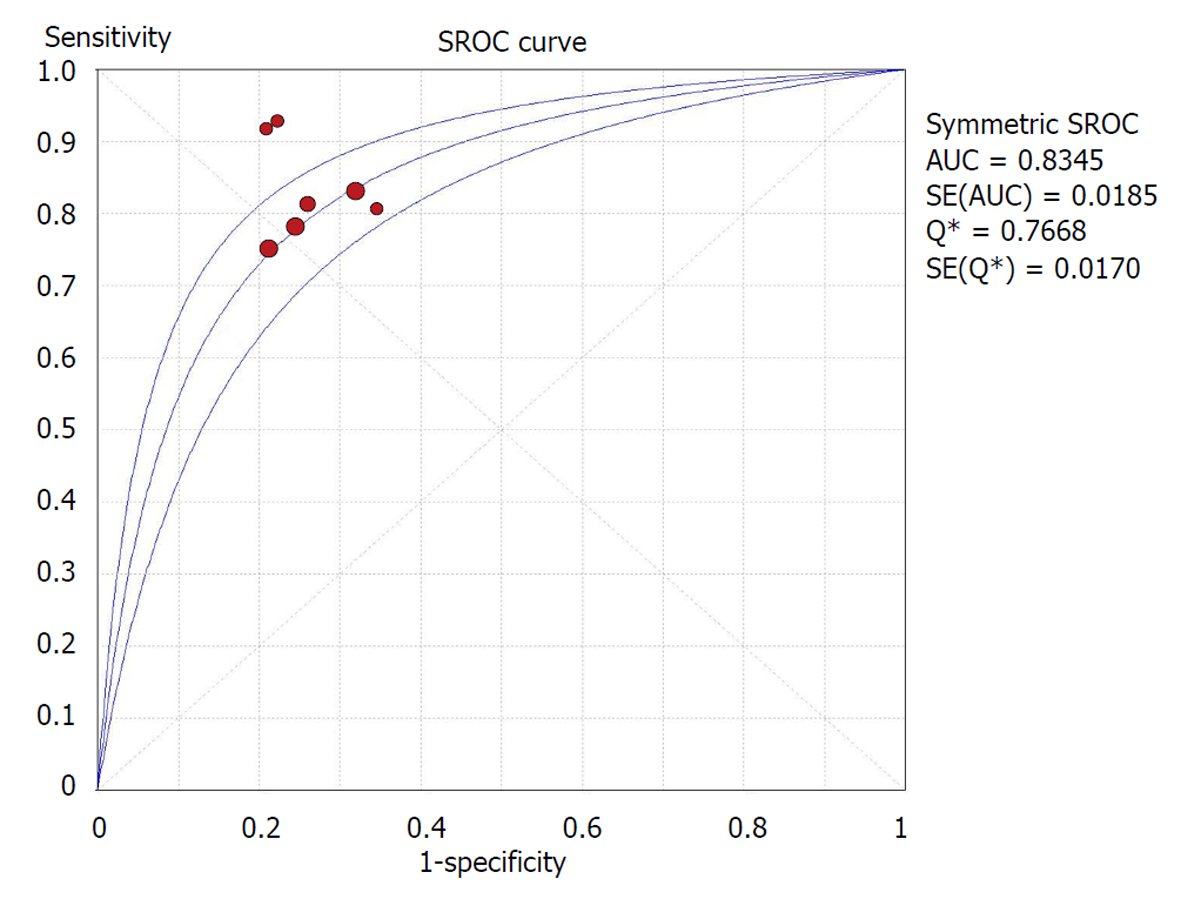
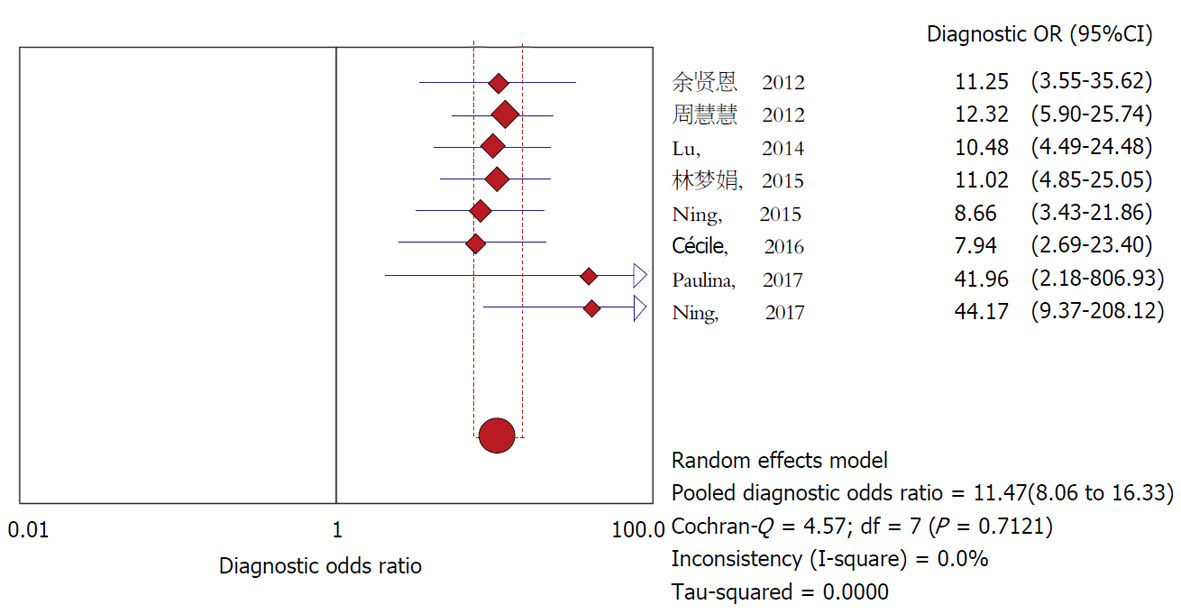
共纳入8项关于D-二聚体对AP患者预后的研究. Meta分析结果显示: D-二聚体对于AP患者严重程度的预测价值合并的敏感度为0.80(95%CI: 0.74-0.80), 特异度为0.75(95%CI: 0.72-0.79), 阳性似然比为3.17(95%CI: 2.74-3.66), 阴性似然比为0.30(95%CI: 0.23-0.38), 合并的受试者工作特征曲线的曲线下面积为0.8345(诊断比值比 = 11.47; 95%CI: 8.06-16.33), 且无显著的异质性(Q = 4.57, I2 = 0.0%, P>0.1).
D-二聚体水平升高有助于早期鉴别不同严重程度的AP患者.
核心提要: 本研究荟萃分析了D-二聚体对急性胰腺炎(acute pancreatitis, AP)患者的预后预测价值, 表明D-二聚体预测AP患者严重程度有较高的敏感度、特异度和准确性. D-二聚体水平升高有助于临床早期鉴别不同严重程度的AP患者.
引文著录: 邓峰, 洪军波, 周迷, 陈智鑫, 段敦柱, 周小江. D-二聚体对急性胰腺炎预后预测价值的Meta分析. 世界华人消化杂志 2019; 27(3): 167-174
Revised: December 20, 2018
Accepted: January 10, 2019
Published online: February 8, 2019
To investigate the prognostic value of D-dimer in patients with acute pancreatitis (AP).
Medline, EMBASE, Cochrane library, CBM, CNKI and other resources (from the date of their establishment to October 2017) were searched systematically. Eligible cohort studies on the predictive value of D-dimer in AP patients were collected. Quality assessment and data extraction were performed in those clinical trials in line with the inclusion criteria. Meta Disc software was applied to carry out meta-analysis.
Eight studies were included in the quantitative analysis. The pooled sensitivity, specificity, positive likelihood ratio, and negative likelihood ratio with corresponding 95%CI for prediction of severity of AP were 0.80 (0.74-0.80), 0.75 (0.72-0.79), 3.17 (2.74-3.66), and 0.30 (0.23-0.38), respectively. The area under the receiver operating characteristic curve was 0.8345 (diagnostic odds ratio = 11.47; 95%CI: 8.06-16.33), albeit with no significant heterogeneity (Q = 4.57, I2 = 0.0%, P > 0.1).
D-dimer has the potential to serve as a prognostic marker on admission for differentiating disease severity of AP.
- Citation: Deng F, Hong JB, Zhou M, Chen ZX, Duan DZ, Zhou XJ. Prognostic value of D-dimer in acute pancreatitis: A systematic review and meta-analysis. Shijie Huaren Xiaohua Zazhi 2019; 27(3): 167-174
- URL: https://www.wjgnet.com/1009-3079/full/v27/i3/167.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v27.i3.167
急性胰腺炎(acute pancreatitis, AP)是常见的急腹症[1]. 大多数AP患者的病程呈自限性, 另有20%-30%的患者病情危重. AP的总体病死率为5%-10%, 而重度AP的病死率高达30%-50%[2]. 因此, 早期评估AP患者的严重程度, 有助于指导临床干预和预后.
炎症活动可以激活凝血系统, 降低抗凝系统的活性, 破坏纤溶系统的功能, 导致微血管血栓的形成[3-5]. 在AP患者中, 炎症过程中可产生大量细胞因子, 如白介素-6、白介素-18和肿瘤坏死因子等, 这种瀑布式炎症反应不仅可以导致全身炎症反应综合征和多器官功能障碍综合征, 还可以激活内源性和外源性凝血系统, 破坏凝血系统和抗凝纤溶系统之间的平衡[6,7]. 轻症AP患者中, 可在胰腺微循环中形成血栓. 在重度AP患者中, 因严重的全身炎症反应, 可形成弥散性血管内凝血[8,9]. AP患者中, 凝血功能障碍与预后不良相关.
D-二聚体是纤维蛋白单体和凝血因子XIII相互连接后纤维蛋白的特异性降解产物. 临床上, D-二聚体主要用于协助判断深静脉血栓形成以及肺栓塞[10,11]. 在凝血系统激活后纤溶系统被激活, 导致纤维蛋白/纤维蛋白原降解产物的增加, 如D-二聚体, 这和炎症指标的升高以及AP的病情发生发展明显相关. 多项研究表明D-二聚体可用于AP患者的预后, 包括死亡[12,13]、器官衰竭[13,14]、胰腺感染[15,16]和严重程度[17-24]. 但是, 尚无Meta分析系统的评估D-二聚体在AP患者中的预后价值.
本Meta分析是按照PRISMA(Preferred Reporting Items for Systematic Reviews and Meta-Analysis)申明进行的[25]. 纳入与排除标准: (1)已确诊AP的患者, 使用D-二聚体作为检验指标; (2)观察终点为患者的预后指标; (3)可提取四格表数据; (4)排除纳入患者少于20例的研究; (5)排除重复数据、动物研究、综述、病例报道和会议摘要(补充材料表1).
| 研究(年份) | 研究类型 | 发表语言 | 总患者例数(男/女) | 年龄, 岁 | 病因(胆源性/ 酒精性/高甘油三酯血症性/其他) | 起病至入院时间 | D-二聚体检测时间 | D-二聚体检测方法 | D-二聚体的临界值, μg/L1 | 观察终点 | 敏感度/特异度/ 曲线下面积 |
| 余贤恩等[17] (2012) | 回顾性 | 中文 | 96 (77/19) | -(22-81) | - | - | 入院24 h内 | Optical turbidi-metric test | 616 | 严重程度 | 0.75/0.79/0.808 |
| 周慧慧等[18] (2012) | 回顾性 | 中文 | 166 (104/ 62) | 45 (15) | - | 72 h内 | 入院24 h内 | - | 418 | 严重程度 | 0.81/0.74/- |
| Lu等 [19](2014) | 前瞻性 | 英语 | 173 (105/ 68) | 48.45 (-) | 93/18/38/24 | 96 h内 | 入院时 | - | 670 | 严重程度 | 0.83/0.68/0.81 |
| 林梦娟等[20] (2015) | - | 中文 | 205 (104/ 101) | 52.3 (-) | 85/27/61/32 | 120 h内 | 入院48 h内 | - | 2660 | 严重程度 | 0.78/0.75/0.83 |
| Ning等[21] (2015) | - | 英语 | 106 (72/34) | 51.73 (-) | 30/45/31/0 | 24 h内 | 入院24 h内 | ELISA | >910 | 严重程度 | 0.62/0.84/0.747 |
| Cécile等[22] (2016) | 前瞻性 | 英语 | 71 (48/23) | 53.3 (-) | 30/26/-/15 | 48 h内 | 入院时 | ELISA | 1474 | 严重程度 | 0.81/0.66/0.76 |
| Paulina等[23] (2017) | 前瞻性 | 英语 | 69 (35/34) | 69 (18) | 35/18/7/9 | - | 入院24 h内 | 2 | 6550 | 严重程度 | 0.94/0.80/- |
| Ning等[24] (2017) | - | 英语 | 95 (65/30) | 47.6 (15.5) | 45/0/50/0 | - | 入院48 h内 | 2 | >1870 | 严重程度 | 0.93/0.78/0.922 |
1.1.1 数据库: 计算机检索Medline、EMbase、Cochrane图书馆、CBM网络版和CNKI等数据库, 检索时间均从建库至2017-10.
1.1.2 检索策略: 英文检索词: D-dimer or D-D, acute pancreatitis or pancreatitis or AP. 中文检索词: D-二聚体, 急性胰腺炎, 胰腺炎.
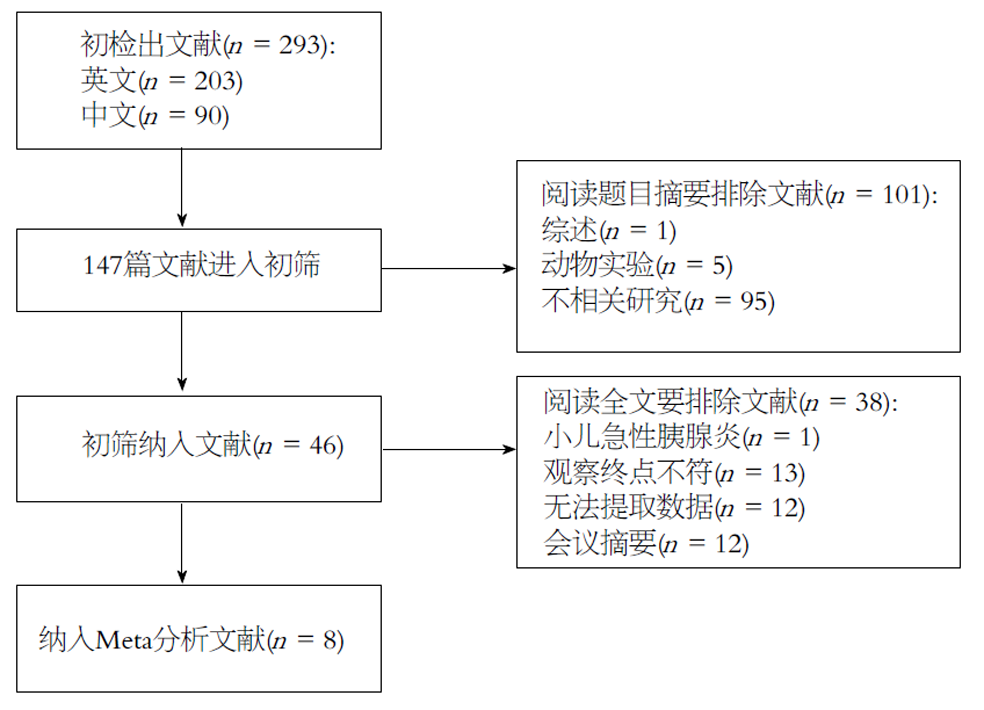
1.1.3 文献筛选: 文献筛选流程见图1.
1.2.1 质量评价: 采用QUADAS-2(Quality Assessment of Diagnostic Accuracy Studies 2)[26]评价纳入研究的质量. 该评价工具包括4个部分: 病例选择、待评价试验、金标准、病例流程和进展情况. 所有组成部分在偏倚风险方面都会被评估, 前3部分也会在临床适用性方面被评估.
1.2.2 资料提取: 由两位研究者独立对每篇符合纳入标准的文献进行资料提取. 如有分歧, 通过讨论或由第三位研究者协助解决. 提取的资料包括: 第一作者、出版年份、出版语言、研究类型、年龄、性别、病因、发病到入院时间、检测D-二聚体的时间、方法和临界值、观察终点的定义和结果以及用于质量评估的信息.
统计学处理 采用合并的敏感度、特异度、阳性似然比、阴性似然比和诊断比值比评估D-二聚体的预测价值. 构建合并的受试者工作曲线, 曲线下面积评估预测的准确性[27]. 采用DerSimonian and Laird随机效应模型进行Meta分析[28]. 各纳入研究结果间的异质性检验采用Cochran's Q test, 当P>0.10时则有统计学异质性[29]. 采用I2 statistics评估研究中由于异质性产生的总变异的百分比, 当I2>50%时则有统计学异质性[30]. 异质性的原因主要包括阈值效应和非阈值效应. 阈值效应采用Spearman相关系数分析, 当P<0.05表明存在阈值效应[31]. Meta回归分析和敏感性分析可进一步评估异质性. 使用Meta-Disc version 1.4 statistical software(西班牙马德里Ramon y Cajal医院临床生物统计学单位)进行统计学分析[32]. 使用STATA software(版本12.0; 德克萨斯州大学城Stata公司)进行Deek's漏斗图, 以评估发表偏倚[33]. 不对称的漏斗图且P<0.05表明存在发表偏倚.
初检出相关文献203篇. 经阅读题目和摘要后排除157篇重复的、不相关的、综述或者动物研究. 进一步阅读全文后排除38篇研究, 最终纳入8篇研究进一步进行Meta分析. 纳入研究的流程图见图1.
当使用QUADAS-2工具评估8项研究的偏倚风险时, 5项研究显示病例选择和待评价试验存在问题, 主要原因是信息不清楚. 所有研究中金标准均存在问题, 病例流程和进展情况均没有问题. 此外, 当考虑适用性问题时, 所有研究中病例选择均适用, 待评价试验和金标准适用于一半的病例(补充材料图1和补充材料表2). 当对采用QUADAS-2评估的高质量研究进行亚组分析, 显示没有显著差异(表2).
| 研究亚组 | 研究数(患者数) | 敏感度 | 特异度 | 诊断比值比 (95%CI) | 曲线下面积 | Q | P值 |
| 所有研究 | 8 (981) | 0.80 | 0.75 | 11.47 | 0.8345 | 4.57 | 0.7121 |
| 亚组 | |||||||
| 前瞻性研究 | 3 (313) | 0.83 | 0.71 | 10.14 (5.29-19.43) | 0.8346 | 1.10 | 0.5573 |
| 高质量研究1 | 3 (313) | 0.83 | 0.71 | 10.14 (5.29-19.43) | 0.8346 | 1.10 | 0.5573 |
| 英语 | 5 (514) | 0.80 | 0.75 | 11.57 (6.66-20.1) | 0.8319 | 4.56 | 0.9508 |
| 研究例数>100例 | 4 (650) | 0.78 | 0.75 | 10.75 (7.12-16.24) | 0.8324 | 0.35 | 0.3901 |
| 临界值>1000 μg/L | 4 (440) | 0.83 | 0.76 | 13.89 (6.62-29.13) | 0.8010 | 4.02 | 0.2598 |
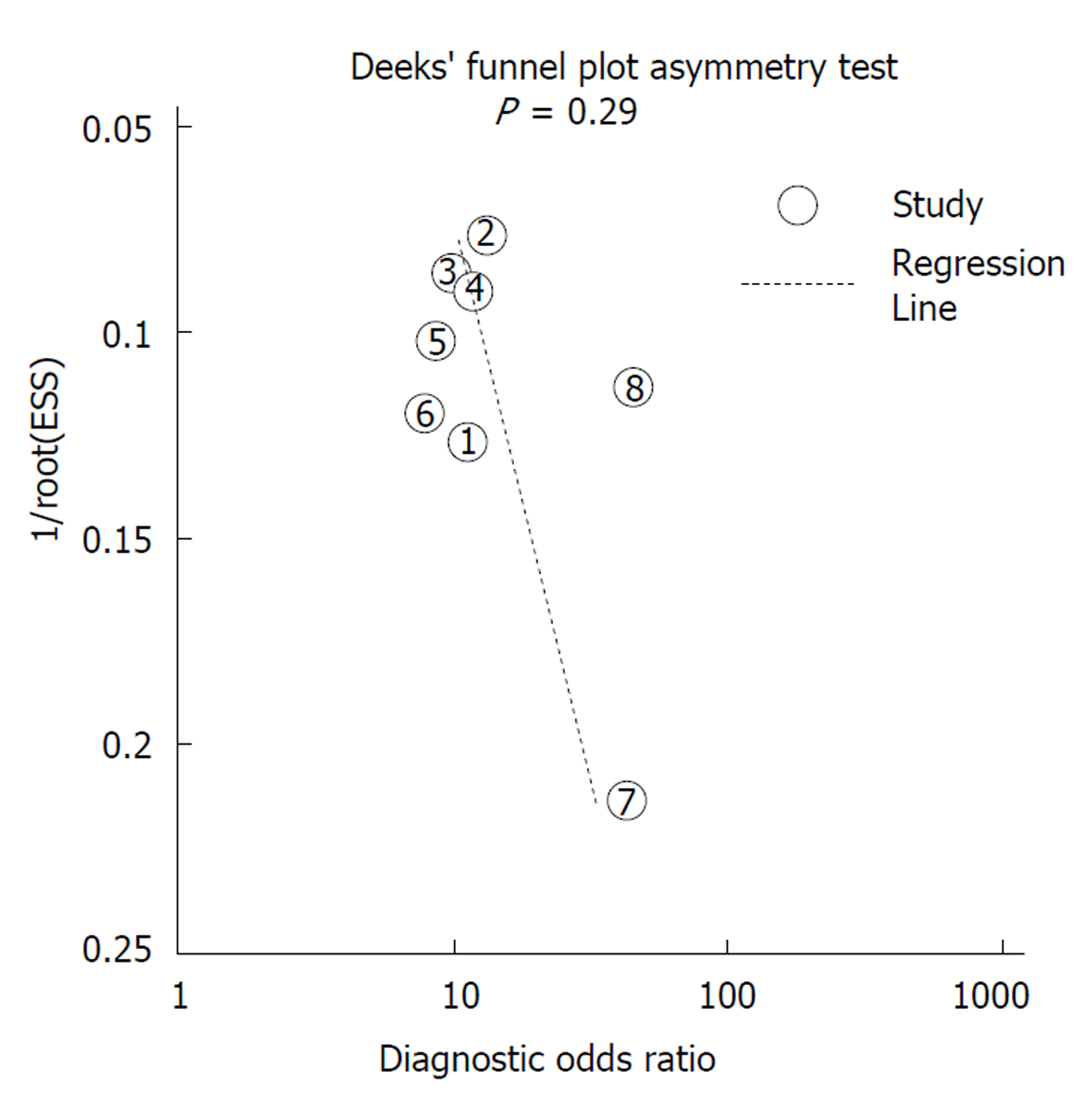
D-二聚体水平升高对于AP的严重程度的预测的合并的敏感度为0.80(95%CI: 0.74-0.84), 合并的特异度为0.75(95%CI: 0.72-0.79), 合并的阳性似然比为3.17(95%CI: 2.74-3.66), 合并的阴性似然比为0.30(95%CI: 0.23-0.38)(图2和补充材料图2). 受试者工作特征曲线的曲线下面积为0.8345 (图3). 合并的诊断比值比为11.47(95CI: 8.06-16.3), 且无显著的异质性(Q = 4.57, I2 = 0.0%, P>0.1)(图4). Spearman相关系数为0.238(P = 0.57), 表明无阈值效应. Meta回归分析显示无显著的异质性(P>0.1). 当D-二聚体>1000g/L时, 敏感性分析显示合并的敏感度为0.83, 特异度为0.76, 受试者工作特征曲线的曲线下面积为0.8010, 合并的诊断比值比为13.89, 且无显著的异质性(Q = 4.02, P>0.1). 敏感性分析的结果见表2. 漏斗图表明无发表偏倚(P = 0.29)(图5).
血清D-二聚体在临床上检测方法简单, 应用广泛. 本研究表明D-二聚体可用于早期预测AP的严重程度. 纳入行Meta分析的研究一半为高质量, 且无显著的异质性.
不同研究得出不同的作为预后评价的D-二聚体的最佳临界浓度, 各研究间D-二聚体的浓度差别较大[17-24], 这导致D-二聚体的临床应用受限[34]. 本研究敏感性分析表明当D-二聚体>1000 g/L时预测的准确度较高. 但是, 准确的D-二聚体的预测临界值尚未确定. 因此, 需进一步行前瞻性研究确定D-二聚体的临界值, 以更好的确定它的预后价值.
D-二聚体的检测时间大多为入院时或入院24 h内. 但是, 大多数研究没有报道患者发病到入院的时间. 有研究报道D-二聚体的升高在发病的早期, 发病第2或3天检测的D-二聚体的值已较前下降[23]. 因此, 检测时间的不同也影响D-二聚体的预测准确度. 建议以后的临床研究考虑本研究的结果, 需尽早纳入AP患者, 并在纳入研究后24 h内检测相关生物标记物.
本研究有以下局限性: (1)尽管无发表偏倚, 但本研究纳入的研究数少, 可能会影响结果的准确性; (2)尽管异质性分析表明纳入的研究无显著的异质性, 但由于各研究间不同的D-二聚体的最佳临界值、检测试剂和时间, 导致结果的临床应用受限; (3)本研究未将D-二聚体与其它预测的生化指标或者评分系统对比.
总之, 本研究首次系统分析了D-二聚体在AP患者中的预后预测价值. 本研究表明D-二聚体是一项简单、可重复的早期生化指标, 可用于预测AP的严重程度. 仍需进一步研究D-二聚体预测的最佳临界值, 并与其它预测指标或评分系统联合, 以提高预测的准确度.
D-二聚体是纤维蛋白单体和凝血因子ⅩⅢ相互连接后纤维蛋白的特异性降解产物. 多项临床研究表明D-二聚体和炎症指标的升高以及急性胰腺炎(acute pancreatitis, AP)的病情发生发展明显相关.
在凝血系统激活后纤溶系统被激活, 导致纤维蛋白/纤维蛋白原降解产物的增加, 如D-二聚体, 这和炎症指标的升高以及AP的病情发生发展明显相关. 多项研究表明D-二聚体可用于AP患者的预后, 包括死亡、器官衰竭、胰腺感染和严重程度. 但是, 尚无Meta分析系统的评估D-二聚体在AP患者中的预后价值.
本研究首次以Meta分析的方式, 通过总结、分析以往文献, 进一步探讨D-二聚体对AP患者预后预测价值.
在国内外常用数据库中检索文献, 依据拟定文献纳入标准进行文献筛选, 最终对纳入文献进行异质性检验并最终进行Meta分析.
本研究对以往文献进行了Meta分析. 结果显示: D-二聚体对于AP患者严重程度的预测价值合并的敏感度为0.80, 特异度为0.75, 合并的受试者工作特征曲线的曲线下面积为0.8345(诊断比值比 = 11.47), 且无显著的异质性. 上述结果相比以往单一研究所获结果, 具有更高的循证医学价值.
本研究表明D-二聚体水平升高有助于早期鉴别不同严重程度的AP.
纳入文献质量不佳在客观上限制了本研究结果作为循证医学证据的质量. 各研究间D-二聚体的浓度差别较大, 这导致D-二聚体的临床应用受限. 因此, 仍需要进一步设计方法学水平更高、样本量更大的前瞻性研究, 以获得更进一步的研究成果.
学科分类: 胃肠病学和肝病学
手稿来源地: 江西省
同行评议报告分类
A级 (优秀): 0
B级 (非常好): B
C级 (良好): C, C, C
D级 (一般): D, D
E级 (差): 0
编辑: 崔丽君 电编:张砚梁
| 1. | Peery AF, Dellon ES, Lund J, Crockett SD, McGowan CE, Bulsiewicz WJ, Gangarosa LM, Thiny MT, Stizenberg K, Morgan DR, Ringel Y, Kim HP, DiBonaventura MD, Carroll CF, Allen JK, Cook SF, Sandler RS, Kappelman MD, Shaheen NJ. Burden of gastrointestinal disease in the United States: 2012 update. Gastroenterology. 2012;143:1179-1187.e3. [PubMed] [DOI] |
| 2. | Banks PA, Bollen TL, Dervenis C, Gooszen HG, Johnson CD, Sarr MG, Tsiotos GG, Vege SS; Acute Pancreatitis Classification Working Group. Classification of acute pancreatitis--2012: revision of the Atlanta classification and definitions by international consensus. Gut. 2013;62:102-111. [PubMed] [DOI] |
| 3. | Danckwardt S, Hentze MW, Kulozik AE. Pathologies at the nexus of blood coagulation and inflammation: thrombin in hemostasis, cancer, and beyond. J Mol Med (Berl). 2013;91:1257-1271. [PubMed] [DOI] |
| 4. | Esmon CT. Crosstalk between inflammation and thrombosis. Maturitas. 2004;47:305-314. [PubMed] [DOI] |
| 5. | Cuthbertson CM, Christophi C. Disturbances of the microcirculation in acute pancreatitis. Br J Surg. 2006;93:518-530. [PubMed] [DOI] |
| 6. | Park J, Chang JH, Park SH, Lee HJ, Lim YS, Kim TH, Kim CW, Han SW. Interleukin-6 is associated with obesity, central fat distribution, and disease severity in patients with acute pancreatitis. Pancreatology. 2015;15:59-63. [PubMed] [DOI] |
| 7. | Janiak A, Leśniowski B, Jasińska A, Pietruczuk M, Małecka-Panas E. Interleukin 18 as an early marker or prognostic factor in acute pancreatitis. Prz Gastroenterol. 2015;10:203-207. [PubMed] [DOI] |
| 8. | Saif MW. DIC secondary to acute pancreatitis. Clin Lab Haematol. 2005;27:278-282. [PubMed] [DOI] |
| 9. | Kakafika A, Papadopoulos V, Mimidis K, Mikhailidis DP. Coagulation, platelets, and acute pancreatitis. Pancreas. 2007;34:15-20. [PubMed] [DOI] |
| 10. | Wells PS, Anderson DR, Rodger M, Forgie M, Kearon C, Dreyer J, Kovacs G, Mitchell M, Lewandowski B, Kovacs MJ. Evaluation of D-dimer in the diagnosis of suspected deep-vein thrombosis. N Engl J Med. 2003;349:1227-1235. [PubMed] [DOI] |
| 11. | van Belle A, Büller HR, Huisman MV, Huisman PM, Kaasjager K, Kamphuisen PW, Kramer MH, Kruip MJ, Kwakkel-van Erp JM, Leebeek FW, Nijkeuter M, Prins MH, Sohne M, Tick LW; Christopher Study Investigators. Effectiveness of managing suspected pulmonary embolism using an algorithm combining clinical probability, D-dimer testing, and computed tomography. JAMA. 2006;295:172-179. [PubMed] [DOI] |
| 12. | Maeda K, Hirota M, Ichihara A, Ohmuraya M, Hashimoto D, Sugita H, Takamori H, Kanemitsu K, Baba H. Applicability of disseminated intravascular coagulation parameters in the assessment of the severity of acute pancreatitis. Pancreas. 2006;32:87-92. [PubMed] [DOI] |
| 13. | Badhal SS, Sharma S, Saraya A, Mukhopadhyay AK. Prognostic significance of D-dimer, natural anticoagulants and routine coagulation parameters in acute pancreatitis. Trop Gastroenterol. 2012;33:193-199. [PubMed] [DOI] |
| 14. | Radenkovic D, Bajec D, Ivancevic N, Milic N, Bumbasirevic V, Jeremic V, Djukic V, Stefanovic B, Stefanovic B, Milosevic-Zbutega G, Gregoric P. D-dimer in acute pancreatitis: a new approach for an early assessment of organ failure. Pancreas. 2009;38:655-660. [PubMed] [DOI] |
| 15. | Ke L, Ni HB, Tong ZH, Li WQ, Li N, Li JS. D-dimer as a marker of severity in patients with severe acute pancreatitis. J Hepatobiliary Pancreat Sci. 2012;19:259-265. [PubMed] [DOI] |
| 16. | Ji L, Lv JC, Song ZF, Jiang MT, Li L, Sun B. Risk factors of infected pancreatic necrosis secondary to severe acute pancreatitis. Hepatobiliary Pancreat Dis Int. 2016;15:428-433. [PubMed] [DOI] |
| 18. | 周 慧慧, 林 连捷, 郑 长青, 林 艳, 张 静洁, 张 立伟. BISAP联合凝血指标对急性胰腺炎严重程度评估的意义. 世界华人消化杂志. 2012;20:1638-1643. [DOI] |
| 19. | Ke L, Tong ZH, Li WQ, Wu C, Li N, Windsor JA, Li JS, Petrov MS. Predictors of critical acute pancreatitis: a prospective cohort study. Medicine (Baltimore). 2014;93:e108. [PubMed] [DOI] |
| 21. | Yang N, Zhang DL, Hao JY. Coagulopathy and the prognostic potential of D-dimer in hyperlipidemia-induced acute pancreatitis. Hepatobiliary Pancreat Dis Int. 2015;14:633-641. [PubMed] [DOI] |
| 22. | Gomercic C, Gelsi E, Van Gysel D, Frin AC, Ouvrier D, Tonohouan M, Antunes O, Lombardi L, De Galleani L, Vanbiervliet G, Filippi J, Schneider S, Tran A, Hébuterne X. Assessment of D-Dimers for the Early Prediction of Complications in Acute Pancreatitis. Pancreas. 2016;45:980-985. [PubMed] [DOI] |
| 23. | Dumnicka P, Kuśnierz-Cabala B, Sporek M, Mazur-Laskowska M, Gil K, Kuźniewski M, Ceranowicz P, Warzecha Z, Dembiński A, Bonior J, Drożdż R. Serum Concentrations of Angiopoietin-2 and Soluble fms-Like Tyrosine Kinase 1 (sFlt-1) Are Associated with Coagulopathy among Patients with Acute Pancreatitis. Int J Mol Sci. 2017;18. [PubMed] [DOI] |
| 24. | Yang N, Hao J, Zhang D. Antithrombin III and D-dimer levels as indicators of disease severity in patients with hyperlipidaemic or biliary acute pancreatitis. J Int Med Res. 2017;45:147-158. [PubMed] [DOI] |
| 25. | Moher D, Liberati A, Tetzlaff J, Altman DG; PRISMA Group. Preferred reporting items for systematic reviews and meta-analyses: the PRISMA statement. J Clin Epidemiol. 2009;62:1006-1012. [PubMed] [DOI] |
| 26. | Whiting PF, Rutjes AW, Westwood ME, Mallett S, Deeks JJ, Reitsma JB, Leeflang MM, Sterne JA, Bossuyt PM; QUADAS-2 Group. QUADAS-2: a revised tool for the quality assessment of diagnostic accuracy studies. Ann Intern Med. 2011;155:529-536. [PubMed] [DOI] |
| 27. | Glas AS, Lijmer JG, Prins MH, Bonsel GJ, Bossuyt PM. The diagnostic odds ratio: a single indicator of test performance. J Clin Epidemiol. 2003;56:1129-1135. [PubMed] [DOI] |
| 28. | DerSimonian R, Laird N. Meta-analysis in clinical trials. Control Clin Trials. 1986;7:177-188. [PubMed] [DOI] |
| 29. | Melsen WG, Bootsma MC, Rovers MM, Bonten MJ. The effects of clinical and statistical heterogeneity on the predictive values of results from meta-analyses. Clin Microbiol Infect. 2014;20:123-129. [PubMed] [DOI] |
| 30. | Higgins JP, Thompson SG, Deeks JJ, Altman DG. Measuring inconsistency in meta-analyses. BMJ. 2003;327:557-560. [PubMed] [DOI] |
| 31. | Arends LR, Hamza TH, van Houwelingen JC, Heijenbrok-Kal MH, Hunink MG, Stijnen T. Bivariate random effects meta-analysis of ROC curves. Med Decis Making. 2008;28:621-638. [PubMed] [DOI] |
| 32. | Zamora J, Abraira V, Muriel A, Khan K, Coomarasamy A. Meta-DiSc: a software for meta-analysis of test accuracy data. BMC Med Res Methodol. 2006;6:31. [PubMed] [DOI] |
| 33. | Deeks JJ, Macaskill P, Irwig L. The performance of tests of publication bias and other sample size effects in systematic reviews of diagnostic test accuracy was assessed. J Clin Epidemiol. 2005;58:882-893. [PubMed] [DOI] |
| 34. | Sternby H, Hartman H, Johansen D, Thorlacius H, Regnér S. Predictive Capacity of Biomarkers for Severe Acute Pancreatitis. Eur Surg Res. 2016;56:154-163. [PubMed] [DOI] |