修回日期: 2019-11-22
接受日期: 2019-12-03
在线出版日期: 2019-12-08
粪便钙卫蛋白(fecal calprotectin, FC)是一种由肠腔内炎性细胞分泌的生物活性蛋白, 有抗微生物活性、抗感染等作用, 通过其含量高低可反映肠道的炎症状态, 其在炎性肠病中的作用已被应用于临床实践. 近年来, 关于FC在结直肠癌(colorectal cancer, CRC)中的应用研究逐渐增多, 相关研究结果显示FC可用于CRC的筛查以及和其他肠道器质性疾病的鉴别, 同时, FC的浓度与CRC的分期、发生部位以及手术可能有一定的相关性, 但仍需要进一步通过高质量、大样本研究以明确. 本文就FC在CRC中的研究进展作一综述.
核心提要: 粪便钙卫蛋白(fecal calprotectin, FC)是一种生物活性蛋白, 可反映肠道炎症. 本文是一篇关于FC在结直肠癌(colorectal cancer, CRC)中最新研究进展的文献综述, 总结了FC可用于CRC的筛查、鉴别, 以及其浓度与CRC的分期、手术等的关系.
引文著录: 陈宗冉, 刘刚. 粪便钙卫蛋白在结直肠癌中的研究进展. 世界华人消化杂志 2019; 27(23): 1436-1440
Revised: November 22, 2019
Accepted: December 3, 2019
Published online: December 8, 2019
Fecal calprotectin (FC) is a bioactive protein secreted by inflammatory cells in the intestine, having anti-microbial and anti-infection activities. The content of FC reflects the inflammatory state of the intestine, and its role in inflammatory bowel disease has been translated into clinical practice. In recent years, the application of FC in colorectal cancer (CRC) has been increasing. Previous research results show that FC can be used to screen colorectal cancer and differentiate it from other intestinal diseases, and the concentration of FC may be related to the stage, location, and resectability of CRC. However, its role still needs to be further clarified through high-quality, large-sample research. This paper reviews the application of FC in colorectal cancer.
- Citation: Chen ZR, Liu G. Fecal calprotectin and colorectal cancer. Shijie Huaren Xiaohua Zazhi 2019; 27(23): 1436-1440
- URL: https://www.wjgnet.com/1009-3079/full/v27/i23/1436.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v27.i23.1436
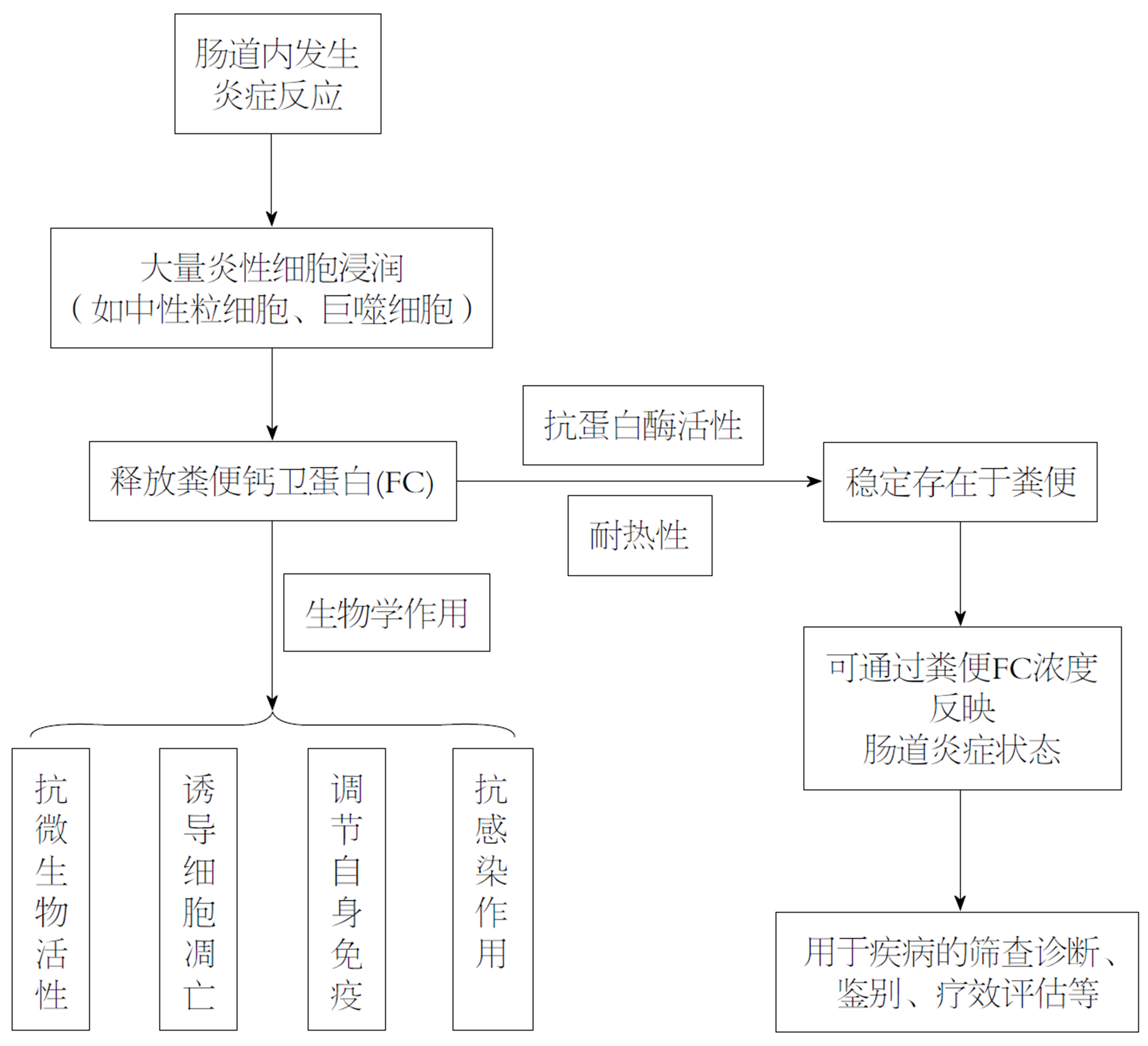
1980年, Fagerhol等[1,2]从中性粒细胞中分离出一种与钙离子结合的蛋白, 命名为钙卫蛋白, 相关研究[3,4]显示, 钙卫蛋白存在于中性粒细胞及巨噬细胞等炎性细胞中, 具有抗微生物活性、诱导细胞凋亡、抗感染等生物学作用, 在血浆、尿液、粪便中均可被检测到[5]. 当肠道处于炎症状态时可经炎性细胞脱颗粒排至肠腔, 称为粪便钙卫蛋白(fecal calprotectin, FC)(图1), 含量约为血浆中的6倍[6], 在室温下可稳定存在数天[7]. 结直肠癌(colorectal cancer, CRC)是一种常见的消化道恶性肿瘤, 发病率和死亡率均位居我国恶性肿瘤前五位[8]. 目前主要的筛查指标包括便潜血、血红蛋白、肿瘤标志物等, 由于粪便检查[9]的无创性, 便潜血试验在CRC筛查中使用最普遍.
一项多中心前瞻性研究[10]发现85%的CRC患者和81%的炎性肠病(inflammatory bowel disease, IBD)患者的FC水平明显高于结肠镜检查正常或病变轻微者, 因此通过其含量高低可反映肠道的炎症状态. 目前已有大量研究[11,12]明确了FC在IBD中较好的应用价值, 为IBD患者的诊治提供了新的检测手段. 近些年来, 随着对FC的研究逐渐深入, 关于FC在CRC中的应用研究逐渐增多, 相关研究结果显示出FC对CRC的筛查及鉴别作用, 同时, FC可能与CRC分期、部位及手术等具有一定的关系. 本文就FC在CRC中的研究进展作一综述.
对于目前CRC的筛查指标, 各自有一定的不足之处, 便潜血作为最常用的筛查指标, 其敏感性与失血量及肿瘤间歇性出血有关[13], 可能由于肿瘤间断出血, 低于潜血试验的检测阈值等原因, 使便潜血试验的敏感性较差; 关于肿瘤标志物, 有关研究结果显示癌胚抗原诊断CRC的敏感性只有30%-50%[14], 并且对于早期患者, 阳性率相对较低, 不利于CRC的早期诊断.
CRC是一种发生在消化道的恶性肿瘤, 肿瘤细胞向周边组织浸润并释放趋化因子, 诱导中性粒细胞等炎性细胞聚集, 从而可引起FC的释放[15], 目前相关研究结果已经证实FC在CRC患者中的升高. 在国内, 岳林等[16]的临床研究纳入了87例CRC患者和60例健康对照, 正常对照组FC浓度的中位数是5.3 μg/g, CRC组FC浓度的中位数是121 μg/g, 两者差异有统计学意义(P<0.0001), FC检测CRC的敏感性为88.51%、特异性为88.33%. 在国外, Damms等[17]的研究也显示CRC患者的FC水平(164 μg/g)相比于健康对照组(25.8 μg/g)明显升高(P<0.05). Widlak等[18]的研究结果显示FC检测CRC的敏感性为68%, 特异性为84%, 曲线下面积(area under the cure, AUC)为0.82(95%CI: 0.71-0.92), 阴性预测值(negative predictive value, NPV)为98%(95%CI: 96-99%). 另一项前瞻性研究[19]通过纳入373名受试者, 发现FC检测CRC的灵敏度在79%到95%之间.
与便潜血类似, FC也不是CRC特异性的标志物, 肿瘤组织破溃出血导致便潜血阳性, 向周边浸润引起肠道炎症, 导致FC的升高, 因此两者联合可能提高对CRC的诊断率. Tibble等[13]纳入62例CRC患者分别对FC和便潜血的筛查作用进行评价, 结果显示CRC患者的FC中位数为101 mg/L(95%CI: 57-133 mg/L), 而纳入的96名健康受试者的FC中位数为2.3 mg/L(95%CI: 1.6-5.0 mg/L), 两者有统计学差异(P<0.05); FC的筛查阳性率为90%, 而便潜血只有58%(36/62)呈阳性(P<0.05), 可见FC对CRC的筛查作用优于便潜血. 在另一项Kim等[20]的研究中, 当对CRC患者单纯使用便潜血模型时, 诊断的敏感性为75.31%, 特异性为90.2%, 当使用FC+便潜血时, 在相同的特异性(90.2%)下, 联合指标对CRC的敏感性更高(82.72%). 其他研究[21]显示FC联合免疫化学法检测粪便血红蛋白(fecal immunochemical test, FIT)诊断CRC的敏感性为0.80, 特异性为0.93, NPV为0.99, 阳性预测值为0.43, AUC为0.91. 近期还有一项横断面诊断研究[22]的结果也证实了在结直肠疾病的诊断模型中进行FC试验的益处, 联合应用FC和便潜血试验可提高疾病筛查的准确性. 但也有的研究结果[23]发现FC对CRC的诊断准确性比FIT检测低, 联合使用两者时未发现明显益处, 因此对于两者在CRC筛查中的作用仍需要通过进一步的研究以明确.
CRC的临床表现主要包括腹痛、便血、排便习惯改变等非特异性的消化道症状[10], 相关研究结果显示不同肠道疾病的FC浓度有所差异, 因此FC还可用于CRC与其他肠道疾病的鉴别. Summerton等[24]通过研究不同肠道疾病患者FC的大小, 发现正常受试者的FC中位数为4.5 mg/L、胃溃疡患者的中位数为6.5 mg/L、胃炎/十二指肠炎患者的FC中位数为5.2 mg/L, 均无明显统计学差异; 对于克罗恩病和溃疡性结肠炎患者, FC的中位数分别为31.2 mg/L和116.2 mg/L, 差异有统计学意义(P<0.05); 在结直肠疾病中, 结肠息肉组的FC中位数为3.7 mg/L、腺瘤组为3.8 mg/L, CRC组的FC中位数则为53.4 mg/L(P<0.05), 由此可见, FC在炎性肠病和CRC中明显升高(P<0.05), 而在结肠息肉和腺瘤中未见明显升高.
秦宝山等[25]通过免疫组化的方法检测了正常大肠黏膜(28例)、大肠腺瘤(41例)及CRC(41例)标本中钙卫蛋白的浓度, 发现钙卫蛋白表达于上述三种组织的间质细胞, 主要为中性粒细胞胞质中, 三者的阳性表达率分别为3.57%(1/28)、4.87%(2/41)、75.61%(31/41), CRC标本中钙卫蛋白表达显著高于前两者(P<0.05), 可能与CRC组织可向周围组织浸润有关. Ye等[26]发表的Meta分析纳入了20项前瞻性研究, 包括CRC 427例、腺瘤1806例, 其中18项研究评估了FC对CRC的诊断效能, 合并敏感性为0.83、AUC为0.81, 其中15项研究评估了FC对结直肠腺瘤的诊断效能, 合并敏感性仅为0.49、AUC为0.55. 因此相比于结直肠腺瘤, FC对CRC的诊断效能更高.
同时, 关于FC在CRC和IBD中的作用比较, von Roon等[27]的一项荟萃分析纳入了30项前瞻性研究, 其中12项有关FC诊断CRC准确性的研究, 发现与非癌对照组相比, CRC患者的FC水平升高132.2 μg/g、IBD患者的FC水平比非IBD患者高219.2 μg/g(P<0.001), 由此可见CRC患者的FC升高水平相比于IBD略低. 另一项苏连明等[28]的研究纳入了CRC患者、IBD患者及肠易激综合症(irritable bowel syndrome, IBS)患者各30例, 于术前或肠镜活检前检测上述3组的FC值, 结果显示: IBD组的FC中位数为811.43 μg/g, CRC组的FC中位数为211.23 μg/g, IBS组的FC中位数为29.97 μg/g, 差异均有统计学意义; 通过绘制ROC曲线, 确定诊断IBD的FC最佳截断值为378.8 μg/g, 此时AUC为0.939, 灵敏度和特异度分别为86.7%和90.0%; 诊断CRC的FC最佳截断值为55.99 μg/g, 此时AUC为0.516, 灵敏度和特异度分别为83.3%和50.0%. 因此可根据FC截断值的不同用于CRC和其他肠道疾病的鉴别, 但基于引起肠道炎症的疾病种类较多, 应联合其他指标(如ESR、CRP)及临床症状综合评估.
目前, 较多研究已证实FC在CRC患者中升高, 并且可用于CRC的筛查以及和其他肠道疾病的鉴别, 同时, 部分研究还发现CRC的分期、发生部位及手术等可能对FC浓度有所影响. Lehmann等[29]的研究纳入了80例CRC患者, 发现T3、T4期患者的FC值明显高于T1、T2期患者(P = 0.022), 可能是由于肿瘤分期越高, 浸润的深度越深, 从而吸引更多的炎性细胞以释放FC[30]; 而对于其他肿瘤参数(如位置、大小), FC浓度无显著差异. 除了FC, 尿中钙卫蛋白水平还可作为膀胱癌诊断和分期的标志物[31], 与健康对照组相比, 患者尿钙卫蛋白水平显著升高, 肌肉浸润性肿瘤(T2-4)的尿钙卫蛋白水平明显高于低分期肿瘤(Ta和T1).
但也有相关研究未显示出不同肿瘤分期的FC差异, 一项临床研究[16]纳入了87例CRC患者, 依据不同分期(Dukes分期)及不同部位分组, 结果显示: 在不同分期的患者中, FC的阳性率没有明显差异; 不同部位的CRC与FC检测的阳性率也无显著差异. 国外Tibble等[13]的研究纳入了62例CRC患者, 通过检测粪便中的FC, 发现FC的浓度与肿瘤分期、肿瘤部位也无明显相关性. Widlak等[18]的研究结果显示左半结肠癌和右半结肠癌的FC浓度分别为143 μg/g和175 μg/g, 两者无显著差异(P = 0.7068). Kristinsson等[32]的研究纳入了155例新诊断的CRC患者, 发现不同肿瘤阶段的FC浓度无显著差异, 而与肿瘤的部位、大小和组织学分级也没有差异. 因此关于FC水平与肿瘤分期等的关系仍需要通过高质量、大样本的试验研究以明确.
对于CRC, 通过对术后患者的随访, 有关研究显示术后FC的浓度呈下降趋势. Lehmann等[29]的研究纳入了80例CRC患者, 分别检测其术前及术后3 mo时的FC浓度, 结果显示术前有57例(71.2%)患者的FC呈阳性(注: 将FC≥50 μg/g认定为阳性), 中位数为205 μg/g, 范围为50-2405 μg/g, 术后3 mo时FC的水平显著下降, FC中位数降为46 μg/g, 范围为10-384 μg/g, 差异有统计学意义(P<0.05). Kristinsson等[32]的研究显示FC浓度从术前的45 mg/L下降到术后的14 mg/L(P<0.05). 日本的Koga等[33]的研究结果也显示: CRC患者在接受手术治疗后, FC水平明显下降. 但对于FC在CRC患者术后的趋势变化以及应用价值仍需要相关研究进一步明确.
除此之外, 其他研究还显示了FC与CRC相关生活方式危险因素之间的相关性, Poullis等[34]招募了320名具有CRC相关生活方式危险因素的受试者, 通过测定每名受试者的FC浓度以反映肠道炎症, 结果显示: FC与年龄增长(P = 0.002)、肥胖(P = 0.04)、缺乏运动(P = 0.01)呈显著正相关, 而与纤维摄入量(P = 0.02)、蔬菜消费量(P = 0.04)呈负相关, 低水平无症状性肠道炎症可能是生活方式与CRC发病机制之间的联系.
FC作为一种反映肠道炎症的指标, 在CRC患者中的浓度有所升高, 相关研究结果显示出FC对CRC的筛查作用, 并可根据截断值的不同和其他肠道疾病进行鉴别; 同时, 通过对术后患者的随访, 发现术后患者的FC水平相比于术前会有所降低, 分析术后的病理分期发现FC浓度可能与肿瘤浸润的深度相关, 但也有研究显示FC水平与CRC分期及部位无关. 因此, 目前FC在CRC中的相关研究仍有所争议, 需要进一步通过高质量、大样本的临床试验以明确.
学科分类: 胃肠病学和肝病学
手稿来源地: 天津市
同行评议报告分类
A级 (优秀): 0
B级 (非常好): 0
C级 (良好): 0
D级 (一般): D, D, D, D
E级 (差): 0
编辑: 王禹乔 电编:刘继红
| 1. | Fagerhol MK, Dale I, Anderson T. Release and Quantitation of a Leucocyte Derived Protein (L1). Scand J Haematol. 1980;24:393-398. [DOI] |
| 2. | Fagerhol MK, Dale I, Andersson T. A radioimmunoassay for a granulocyte protein as a marker in studies on the turnover of such cells. Bull Eur Physiopathol Respir. 1980;16 Suppl:273-282. [PubMed] [DOI] |
| 3. | Zou X, Sorenson BS, Ross KF, Herzberg MC. Augmentation of epithelial resistance to invading bacteria by using mRNA transfections. Infect Immun. 2013;81:3975-3983. [PubMed] [DOI] |
| 4. | Hsu K, Champaiboon C, Guenther BD, Sorenson BS, Khammanivong A, Ross KF, Geczy CL, Herzberg MC. ANTI-INFECTIVE PROTECTIVE PROPERTIES OF S100 CALGRANULINS. Antiinflamm Antiallergy Agents Med Chem. 2009;8:290-305. [PubMed] [DOI] |
| 5. | Johne B, Fagerhol MK, Lyberg T, Prydz H, Brandtzaeg P, Naess-Andresen CF, Dale I. Functional and clinical aspects of the myelomonocyte protein calprotectin. Mol Pathol. 1997;50:113-123. [PubMed] [DOI] |
| 6. | Fagerberg UL, Lööf L, Merzoug RD, Hansson LO, Finkel Y. Fecal calprotectin levels in healthy children studied with an improved assay. J Pediatr Gastroenterol Nutr. 2003;37:468-472. [PubMed] [DOI] |
| 7. | Lasson A, Stotzer PO, Öhman L, Isaksson S, Sapnara M, Strid H. The intra-individual variability of faecal calprotectin: a prospective study in patients with active ulcerative colitis. J Crohns Colitis. 2015;9:26-32. [PubMed] [DOI] |
| 8. | Chen W, Zheng R, Baade PD, Zhang S, Zeng H, Bray F, Jemal A, Yu XQ, He J. Cancer statistics in China, 2015. CA Cancer J Clin. 2016;66:115-132. [PubMed] [DOI] |
| 9. | Davies RJ, Miller R, Coleman N. Colorectal cancer screening: prospects for molecular stool analysis. Nat Rev Cancer. 2005;5:199-209. [PubMed] [DOI] |
| 10. | Meucci G, D'Incà R, Maieron R, Orzes N, Vecchi M, Visentini D, Minoli G, Dal Pont E, Zilli M, Benedetti E, Virgilio T, Tonutti E. Diagnostic value of faecal calprotectin in unselected outpatients referred for colonoscopy: A multicenter prospective study. Dig Liver Dis. 2010;42:191-195. [PubMed] [DOI] |
| 11. | Heida A, Park KT, van Rheenen PF. Clinical Utility of Fecal Calprotectin Monitoring in Asymptomatic Patients with Inflammatory Bowel Disease: A Systematic Review and Practical Guide. Inflamm Bowel Dis. 2017;23:894-902. [PubMed] [DOI] |
| 12. | Wright EK, Kamm MA, De Cruz P, Hamilton AL, Ritchie KJ, Krejany EO, Leach S, Gorelik A, Liew D, Prideaux L, Lawrance IC, Andrews JM, Bampton PA, Jakobovits SL, Florin TH, Gibson PR, Debinski H, Macrae FA, Samuel D, Kronborg I, Radford-Smith G, Selby W, Johnston MJ, Woods R, Elliott PR, Bell SJ, Brown SJ, Connell WR, Day AS, Desmond PV, Gearry RB. Measurement of fecal calprotectin improves monitoring and detection of recurrence of Crohn's disease after surgery. Gastroenterology. 2015;148:938-947.e1. [PubMed] [DOI] |
| 13. | Tibble J, Sigthorsson G, Foster R, Sherwood R, Fagerhol M, Bjarnason I. Faecal calprotectin and faecal occult blood tests in the diagnosis of colorectal carcinoma and adenoma. Gut. 2001;49:402-408. [PubMed] [DOI] |
| 14. | Rai AJ, Chan DW. Cancer proteomics: Serum diagnostics for tumor marker discovery. Ann N Y Acad Sci. 2004;1022:286-294. [PubMed] [DOI] |
| 15. | Røseth AG, Kristinsson J, Fagerhol MK, Schjønsby H, Aadland E, Nygaard K, Roald B. Faecal calprotectin: a novel test for the diagnosis of colorectal cancer? Scand J Gastroenterol. 1993;28:1073-1076. [PubMed] [DOI] |
| 17. | Damms A, Bischoff SC. Validation and clinical significance of a new calprotectin rapid test for the diagnosis of gastrointestinal diseases. Int J Colorectal Dis. 2008;23:985-992. [PubMed] [DOI] |
| 18. | Widlak MM, Thomas CL, Thomas MG, Tomkins C, Smith S, O'Connell N, Wurie S, Burns L, Harmston C, Evans C, Nwokolo CU, Singh B, Arasaradnam RP. Diagnostic accuracy of faecal biomarkers in detecting colorectal cancer and adenoma in symptomatic patients. Aliment Pharmacol Ther. 2017;45:354-363. [PubMed] [DOI] |
| 19. | Högberg C, Karling P, Rutegård J, Lilja M. Diagnosing colorectal cancer and inflammatory bowel disease in primary care: The usefulness of tests for faecal haemoglobin, faecal calprotectin, anaemia and iron deficiency. A prospective study. Scand J Gastroenterol. 2017;52:69-75. [PubMed] [DOI] |
| 20. | Kim BC, Joo J, Chang HJ, Yeo HY, Yoo BC, Park B, Park JW, Sohn DK, Hong CW, Han KS. A predictive model combining fecal calgranulin B and fecal occult blood tests can improve the diagnosis of colorectal cancer. PLoS One. 2014;9:e106182. [PubMed] [DOI] |
| 21. | Widlak MM, Neal M, Daulton E, Thomas CL, Tomkins C, Singh B, Harmston C, Wicaksono A, Evans C, Smith S, Savage RS, Covington JA, Arasaradnam RP. Risk stratification of symptomatic patients suspected of colorectal cancer using faecal and urinary markers. Colorectal Dis. 2018;20:O335-O342. [PubMed] [DOI] |
| 22. | Elias SG, Kok L, de Wit NJ, Witteman BJ, Goedhard JG, Romberg-Camps MJ, Muris JW, Moons KG. Is there an added value of faecal calprotectin and haemoglobin in the diagnostic work-up for primary care patients suspected of significant colorectal disease? A cross-sectional diagnostic study. BMC Med. 2016;14:141. [PubMed] [DOI] |
| 23. | Turvill J, Mellen S, Jeffery L, Bevan S, Keding A, Turnock D. Diagnostic accuracy of one or two faecal haemoglobin and calprotectin measurements in patients with suspected colorectal cancer. Scand J Gastroenterol. 2018;53:1526-1534. [PubMed] [DOI] |
| 24. | Summerton CB, Longlands MG, Wiener K, Shreeve DR. Faecal calprotectin: a marker of inflammation throughout the intestinal tract. Eur J Gastroenterol Hepatol. 2002;14:841-845. [PubMed] [DOI] |
| 25. | 秦 宝山, 马 应杰, 王 水红. 钙卫蛋白在大肠癌中的表达及意义. 胃肠病学和肝病学杂志. 2010;19:1081-1083. [DOI] |
| 26. | Ye X, Huai J, Ding J. Diagnostic accuracy of fecal calprotectin for screening patients with colorectal cancer: A meta-analysis. Turk J Gastroenterol. 2018;29:397-405. [PubMed] [DOI] |
| 27. | von Roon AC, Karamountzos L, Purkayastha S, Reese GE, Darzi AW, Teare JP, Paraskeva P, Tekkis PP. Diagnostic precision of fecal calprotectin for inflammatory bowel disease and colorectal malignancy. Am J Gastroenterol. 2007;102:803-813. [PubMed] [DOI] |
| 28. | 苏 连明, 贾 红玲, 金 大伟, 董 爱莲, 刘 秋梅, 黄 丽红, 沙 瑞华, 刘 永梁, 冯 丹丹. 3种肠道疾病粪便钙卫蛋白水平变化及意义. 中华实用诊断与治疗杂志. 2018;32:761-763. [DOI] |
| 29. | Lehmann FS, Trapani F, Fueglistaler I, Terracciano LM, von Flüe M, Cathomas G, Zettl A, Benkert P, Oertli D, Beglinger C. Clinical and histopathological correlations of fecal calprotectin release in colorectal carcinoma. World J Gastroenterol. 2014;20:4994-4999. [PubMed] [DOI] |
| 30. | D'Incà R, Dal Pont E, Di Leo V, Ferronato A, Fries W, Vettorato MG, Martines D, Sturniolo GC. Calprotectin and lactoferrin in the assessment of intestinal inflammation and organic disease. Int J Colorectal Dis. 2007;22:429-437. [PubMed] [DOI] |
| 31. | Yasar O, Akcay T, Obek C, Turegun FA. Significance of S100A8, S100A9 and calprotectin levels in bladder cancer. Scand J Clin Lab Invest. 2017;77:437-441. [PubMed] [DOI] |
| 32. | Kristinsson J, Armbruster CH, Ugstad M, Kriwanek S, Nygaard K, Tøn H, Fuglerud P. Fecal excretion of calprotectin in colorectal cancer: relationship to tumor characteristics. Scand J Gastroenterol. 2001;36:202-207. [PubMed] [DOI] |
| 33. | Koga Y, Yamazaki N, Matsumura Y. [Fecal Biomarker for Colorectal Cancer Diagnosis]. Rinsho Byori. 2015;63:361-368. [PubMed] |
| 34. | Poullis A, Foster R, Shetty A, Fagerhol MK, Mendall MA. Bowel inflammation as measured by fecal calprotectin: a link between lifestyle factors and colorectal cancer risk. Cancer Epidemiol Biomarkers Prev. 2004;13:279-284. [PubMed] [DOI] |