修回日期: 2019-11-14
接受日期: 2019-11-24
在线出版日期: 2019-12-08
在胃癌(gastric cancer, GC)的发病和进展中, 已经发现许多miRNAs可发挥抑癌或促癌的作用. 但miRNAs数量众多, 在GC中仍有众多miRNAs的作用并不明确, 因此, 继续筛选具有影响GC细胞生长和转移的miRNAs仍十分必要.
探究miR-10a-5p对GC细胞生长和转移的影响及其机制.
采用实时荧光定量PCR(quantitative real-time PCR, RT-qPCR)检测GC组织和GC细胞(MGC-803和AGS)中miR-10a-5p表达; miR-10a-5p-inhibitor转染入MGC-803和AGS细胞, CCK-8实验, 集落形成实验和Transwell实验分别检测细胞的增殖, 集落形成, 迁移和侵袭. 采用Western-blot和RT-qPCR检测GC组织和GC细胞(MGC-803和AGS)中THBS2表达; 采用TargetScan在线软件筛选miR-10a-5p的潜在靶基因THBS2, 并进一步验证. NC+pcDNA-Con, miR-10a-5p-inhibitor+pcDNA-Con和miR-10a-5p-inhibitor+pcDNA-THBS2共转染入MGC-803细胞, CCK-8实验, 集落形成实验和Transwell实验分别检测各组细胞的增殖, 集落形成, 迁移和侵袭.
miR-10a-5p在GC组织, MGC-803和AGS细胞中表达异常上调; miR-10a-5p敲低显著降低了MGC-803和AGS细胞的增殖, 集落形成和侵袭. THBS2 mRNA和蛋白水平在GC组织、MGC-803和AGS细胞中表达均异常下调; THBS2是miR-10a-5p的靶基因; 过表达THBS2能逆转miR-10a-5p敲低对MGC-803细胞增殖, 集落形成, 迁移和侵袭的抑制作用.
miR-10a-5p敲低通过靶基因THBS2来抑制GC细胞的生长和转移.
核心提要: miR-10a-5p在胃癌中高表达. miR-10a-5p敲低通过靶向THBS2抑制MGC-803和AGS细胞的增殖, 集落形成, 迁移和侵袭.
引文著录: 任玲玲, 王立明, 朱雅碧. miR-10a-5p敲低通过靶向THBS2抑制胃癌细胞的生长和转移. 世界华人消化杂志 2019; 27(23): 1419-1426
Revised: November 14, 2019
Accepted: November 24, 2019
Published online: December 8, 2019
Many microRNAs (miRNAs) have been found to play a role in inhibiting or promoting the pathogenesis and progression of gastric cancer (GC). However, there are a large number of miRNAs whose roles in GC are still unclear. Therefore, it is still necessary to continue screening miRNAs that affect the growth and metastasis of GC cells.
To investigate the effect of miR-10a-5p on the growth and metastasis of GC cells and the underlying mechanism.
The expression levels of miR-10a-5p in GC tissues and GC cells (MGC-803 and AGS) were detected by real-time quantitative PCR (RT-qPCR). After transfecting miR-10a-5p-inhibitor into MGC-803 and AGS cells, the proliferation, colony formation, migration, and invasion of GC cells were detected by CCK-8 assay, colony formation assay, and transwell assay. The protein and mRNA expression levels of THBS2 in GC tissues and GC cells (MGC-803 and AGS) were detected by Western blot and RT-qPCR, respectively. The potential target genes of miR-10a-5p were predicted with TargetScan software and further verified. After NC + pcDNA-Con, miR-10a-5p inhibitor + pcDNA-Con, or miR-10a-5p inhibitor + pcDNA-THBS2 were co-transfected into MGC-803 cells, the proliferation, colony formation, migration, and invasion of MGC-803 cells were detected by CCK-8 assay, colony formation assay, and transwell assay.
The expression levels of miR-10a-5p were up-regulated in GC tissues as well as MGC-803 and AGS cells. Knockdown of miR-10a-5p significantly decreased the proliferation, colony formation, and migration and invasion of MGC-803 and AGS cells. THBS2 mRNA and protein levels were down-regulated in GC tissues as well as MGC-803 cells and AGS cells. THBS2 was identified to be a target gene of miR-10a-5p. Overexpression of THBS2 could reverse the inhibitory effect of miR-10a-5p knockdown on the proliferation, colony formation, migration, and invasion of MGC-803 cells.
Knockdown of miR-10a-5p inhibits the growth and metastasis of GC cells by targeting THBS2.
- Citation: Ren LL, Wang LM, Zhu YB. Knockdown of miR-10a-5p inhibits gastric cancer cell growth and metastasis by targeting THBS2. Shijie Huaren Xiaohua Zazhi 2019; 27(23): 1419-1426
- URL: https://www.wjgnet.com/1009-3079/full/v27/i23/1419.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v27.i23.1419
胃癌(gastric cancer, GC)是一种常见的消化肿瘤[1]. 近年来我国GC的发病率呈增高趋势[2]. 探索GC的进展机制对于开发新的治疗方法至关重要. miRNA是短的(约19-24 nt)非编码单链RNA, 可通过调节其靶基因参与多种生物过程, 如增殖, 分化, 凋亡, 发育, 血管生成和免疫应答[3,4]. 目前, miRNA在肿瘤进展中的作用也得到了广泛的研究, 如, miR-10b和miR-126分别通过调节同源盒蛋白b3(Homeobox b3, HOXB3)和sry相关HMG盒蛋白2(sry-related HMG box 2, Sox2)表达来控制子宫内膜癌和肝细胞癌的细胞凋亡, 增殖, 迁移和侵袭[5,6]. 据报道[7,8], miR-137, miR-421, miR-337-3p和miR-1等许多miRNAs可调节GC的发展. 因此, 发现调节GC细胞生长和转移能力的miRNAs是至关重要的, 这将为治疗该疾病提供有价值的靶标. 有文献[9,10]发现, 肝癌组织和肝癌细胞中miR-10a-5p高表达, 在肝癌细胞中过表达miR-10a-5p可影响肝癌细胞增殖与迁移. 而miR-10a-5p在GC中作用报道尚少.
因此, 本研究旨在探讨miR-10a-5p在GC中的表达以及其对GC细胞生长和转移的影响及其分子机制, 期望基于miR-10a-5p功能极其分子机制能为GC的治疗提供有用的线索.
1.1.1 主要试剂: 胎牛血清(FBS), Opti-MEM培养基(Gibco公司, 美国); RPMI-1640培养基, Lipofectamine 2000试剂和SYBER绿色探针(Invitrogen公司, 美国); Trizol试剂(Sigma公司, 美国); AMV逆转录酶(TaKaRa公司, 日本); 血小板反应蛋白2(thrombospondin 2, THBS2)抗体和GAPDH抗体(Santa Cruz公司, 美国); miR-10a-5p抑制剂(miR-10a-5p inhibitor), miRNA阴性对照(NC), 人THBS2全长cDNA序列和对照乱码序列(上海吉凯基因公司); CCK-8试剂盒, RIPA裂解缓冲液, BCA蛋白质测定试剂盒和ECL化学发光试剂(上海碧云天生物技术公司); 快速点定向突变试剂盒(Agilent公司, 美国); 双荧光素酶报告分析试剂盒(Promega公司, 美国).
1.1.2 人GC组织和细胞系: 在浙江省丽水市人民医院随机选取10例接受GC切除术的GC患者, 所有患者均提供书面同意, 本研究的各个方面均经过医院伦理委员会批准(No. 201812006). 收集GC组织和癌旁正常组织, 将组织储存在-80 ℃备用. 人正常胃上皮细胞(GES)和GC细胞(MGC-803和AGS)购自中国科学院上海细胞生物学研究所. 将细胞在补充有10%FBS的RPMI-1640培养基中在5%CO2的细胞培养箱中培养.
1.2.1 miR-10a-5p-inhibitor转染: 将GC细胞(MGC-803和AGS)接种在6孔板中, 用补充有10%FBS的RPMI-1640培养基培养, 当细胞约60%-70%汇合时, 更换无血清Opti-MEM培养基培养6 h, 用Lipofectamine 2000试剂分别将miR-10a-5p inhibitor和NC转染入细胞. 6 h后, 更换为补充有10% FBS的RPMI-1640培养基, 继续培养48 h后, 收集细胞.
1.2.2 共转染细胞系构建: 将人全长THBS2 cDNA序列和乱码序列克隆入pcDNA3.1质粒, 并分别构建pcDNA-THBS2和pcDNA-Con质粒. 使用Lipofectamine 2000试剂分别将NC+pcDNA-Con, miR-10a-5p inhibitor+pcDNA-Con和miR-10a-5p inhibitor+pcDNA-THBS2共转染入MGC-803细胞.
1.2.3 RNA提取和RT-qPCR: 使用Trizol试剂分别从GC组织, 癌旁组织, GES细胞, MGC-803细胞和AGS细胞中提取总RNA. 使用光度计(Eppendorf, 德国)测定总RNA浓度. 使用oligo dT和AMV逆转录酶在反应中将1 μg总RNA逆转录成cDNA. SYBER绿色探针和miR-10a-5p, THBS2和GAPDH的特异性引物和cDNA使用Applied Biosystems 7300检测系统进行实时荧光定量PCR(quantitative real-time PCR, RT-qPCR)反应. 反应条件为95 ℃温育5 min, 然后进行40个循环: 95 ℃ 30 s, 60 ℃ 30 s和72 ℃ 30 s. 引物的序列: miR-10a-5p F: 5′-CGCTACCCTGTAGATCCGAA-3′, R: 5′-GTGCAGGGTCCGAGGT-3′; THBS2 F: 5′-GGGGACACTTTGGACCTCAAC-3′, R: 5′-GCAGCCCACATACAGGCTA-3′; GAPDH F:5′-ACAACTTTGGTATCGTGGAAGG-3′, R: 5′-GCCATCACGCCACAGTTTC-3′; U6 F: 5′-CTCGCTTCGGCAGCACA-3′, R: 5′-AACGCTTCACGAATTTGCGT-3′. 使用2-△△CT法计算miR-10a-5p相对于内部对照U6的表达量和THBS2 mRNA的相对于内部对照GAPDH mRNA的表达量. 实验一式三份独立进行.
1.2.4 细胞增殖测定: 将仅转染miR-10a-inhibitor或NC的MGC-803或AGS细胞和共转染的 MGC-803细胞接种到96孔板, 每孔接种5000个细胞, 继续培养24和48 h. 每孔添加10 μL CCK-8检测试剂, 孵育2 h后, 用酶标仪检测(波长450 nm)吸光度. 实验一式三份独立进行.
1.2.5 集落形成测定: 将仅转染miR-10a-5p inhibitor或NC的MGC-803或AGS细胞和共转染的MGC-803细胞接种到24孔板中并孵育12 d后, 用4%多聚甲醛固定细胞并用结晶紫染色, 对集落进行计数并拍照. 实验一式三份独立进行.
1.2.6 细胞迁移与侵袭测定: 使用Transwell法检测细胞的迁移与侵袭. 收集仅转染miR-10a-5p inhibitor或NC的MGC-803或AGS细胞和共转染的MGC-803细胞, 用无血清的RPMI-1640培养基制备单细胞悬浮液. 将100 μL细胞悬浮液以5×105细胞/mL的密度接种到Transwell的上室(matrigel基质胶包被滤膜用于侵袭测定; 仅滤膜用于迁移测定)中, 将500 μL含补充有10% FBS的RPMI-1640培养基加入底室. 孵育24后, 用PBS除去未通过滤膜的细胞, 用95%乙醇固定5 min, 结晶紫染色. 在显微镜(200×)下对细胞计数并拍照. 实验一式三份独立进行.
1.2.7 蛋白提取和Western blot: 使用RIPA裂解缓冲液从GC组织, 癌旁组织, GES细胞, MGC-803细胞, AGS细胞和已转染的细胞中提取总蛋白. 通过10%SDS-PAGE分离蛋白并转至PVDF膜. 在室温下用5%脱脂乳封闭1 h后, 将膜用一抗(THBS2和GAPDH)在4 ℃下免疫反应过夜, 在TBST中洗涤三次, 然后在室温下与二抗孵育1 h. 用增强的化学发光试剂检测条带信号. 使用Image J软件量化每个条带的强度. 通过用GAPDH标准化THBS2蛋白的相对表达.
1.2.8 荧光素酶活性测定: TargetScan在线软件预测的与miR-10a-5p具有结合效应的THBS2 3'UTR区域, 根据快速点定向突变试剂盒说明书步骤, 对该区域进行进行点突变, 并将THBS2 3'UTR点突变后的序列克隆至萤火虫荧光素酶基因的上游, 构建pGL3-Mut-THBS2 3'UTR荧光素酶报告质粒. 用同样的方法, 将野生型THBS2的序列构建pGL3-WT-THBS2 3'UTR荧光素酶报告质粒. 用Lipofectamine 2000试剂将miR-10a-5p inhibitor, NC, WT-THBS2 3'UTR, Mut-THBS2 3'UTR和海肾荧光素酶基因(phRL-TK)质粒共转染到MGC-803细胞中. 转染48 h后, 通过双荧光素酶报告分析试剂盒分析荧光素酶活性.
统计学处理 本实验数据用mean±SD表示, 采用SPSS 18.0软件将实验中所得的数据进行统计分析. 多组之间比较采用单因素方差分析. 以P<0.05为界定差异有统计学意义.
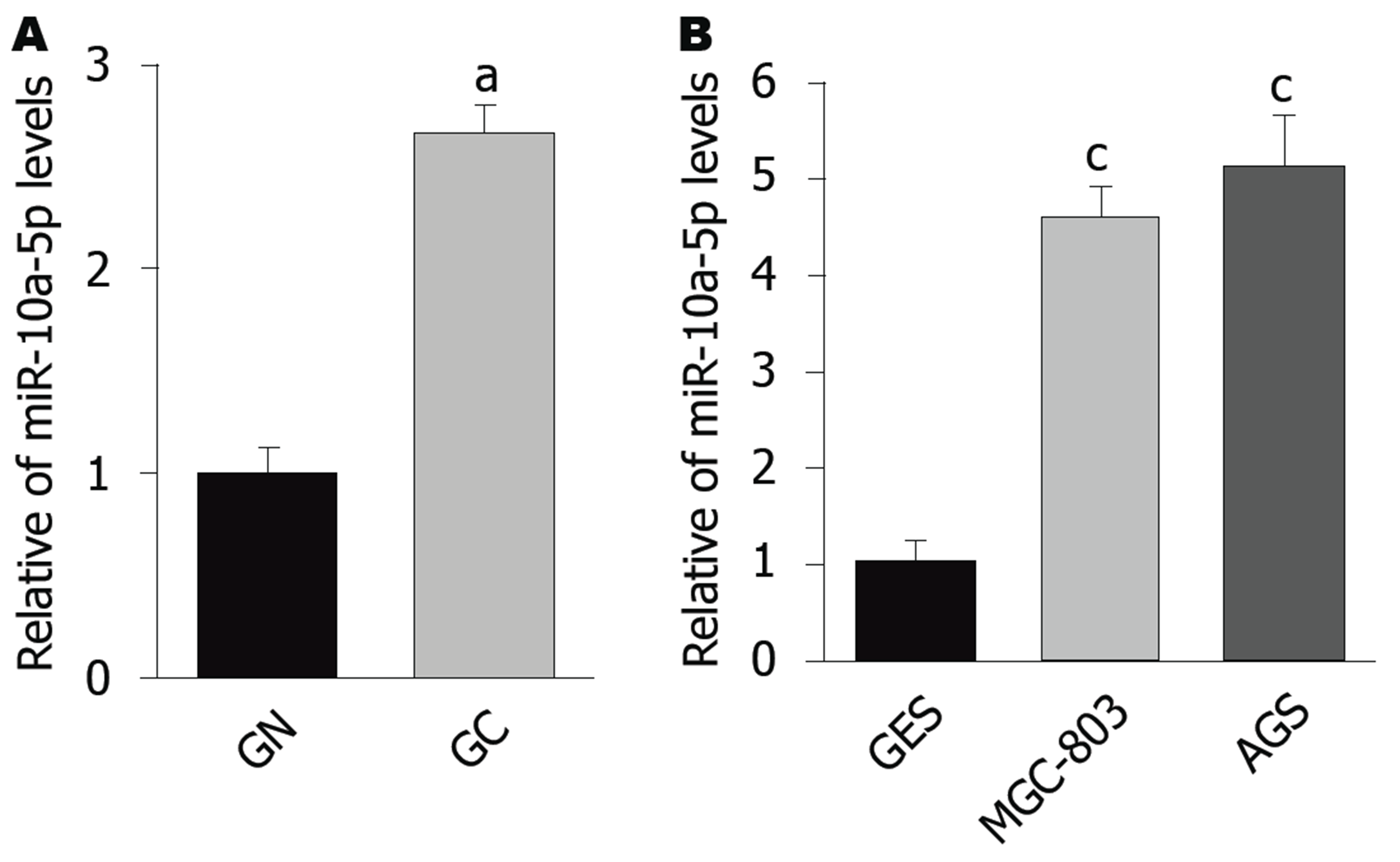
如图1A显示, 与癌旁正常组织相比, miR-10a-5p在GC中的表达显著上调(P<0.05). 在细胞中(图1B), 与GES细胞比较, miR-10a-5p在GC细胞(MGC-803和AGS)中也显著上调(P<0.05).
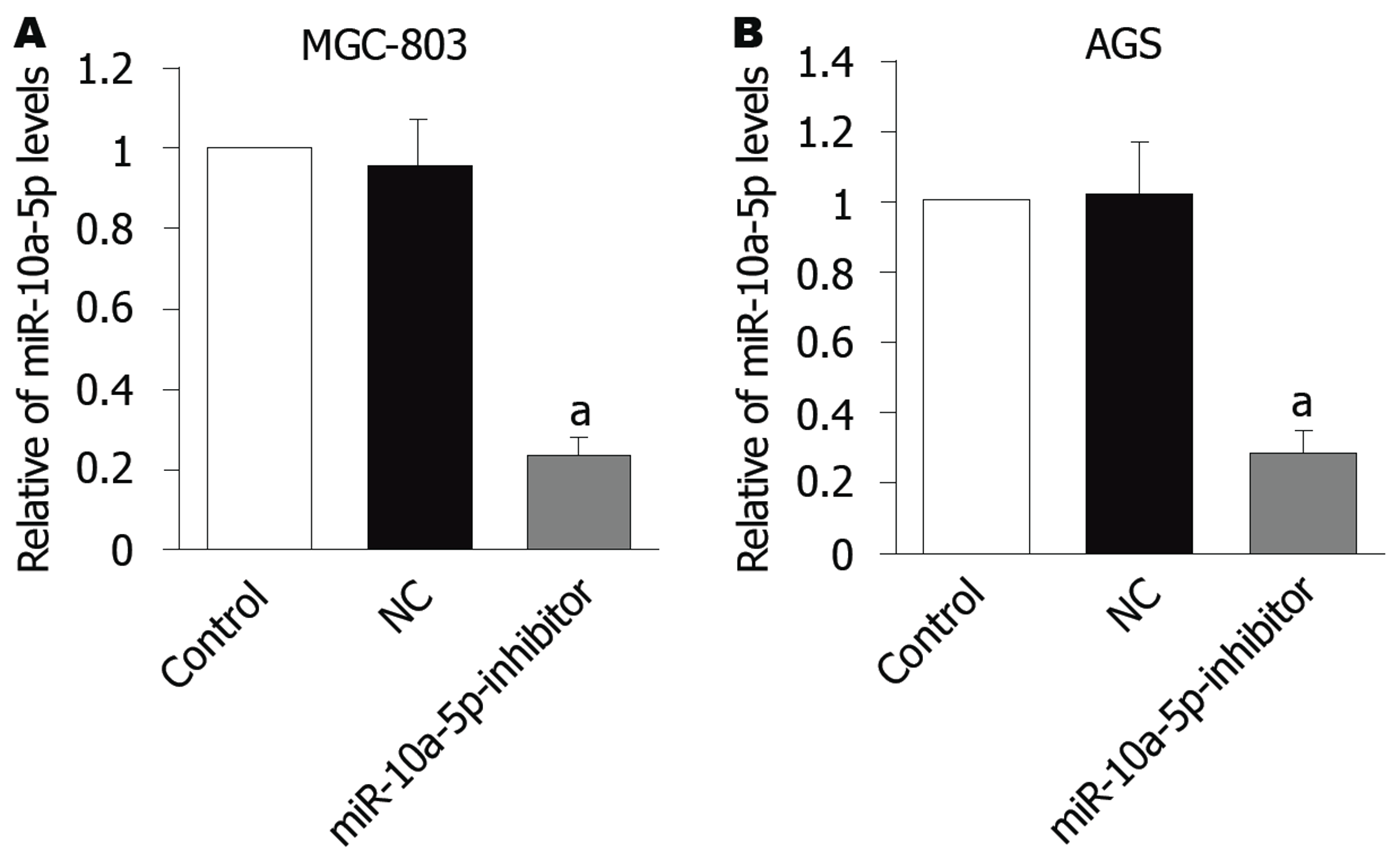
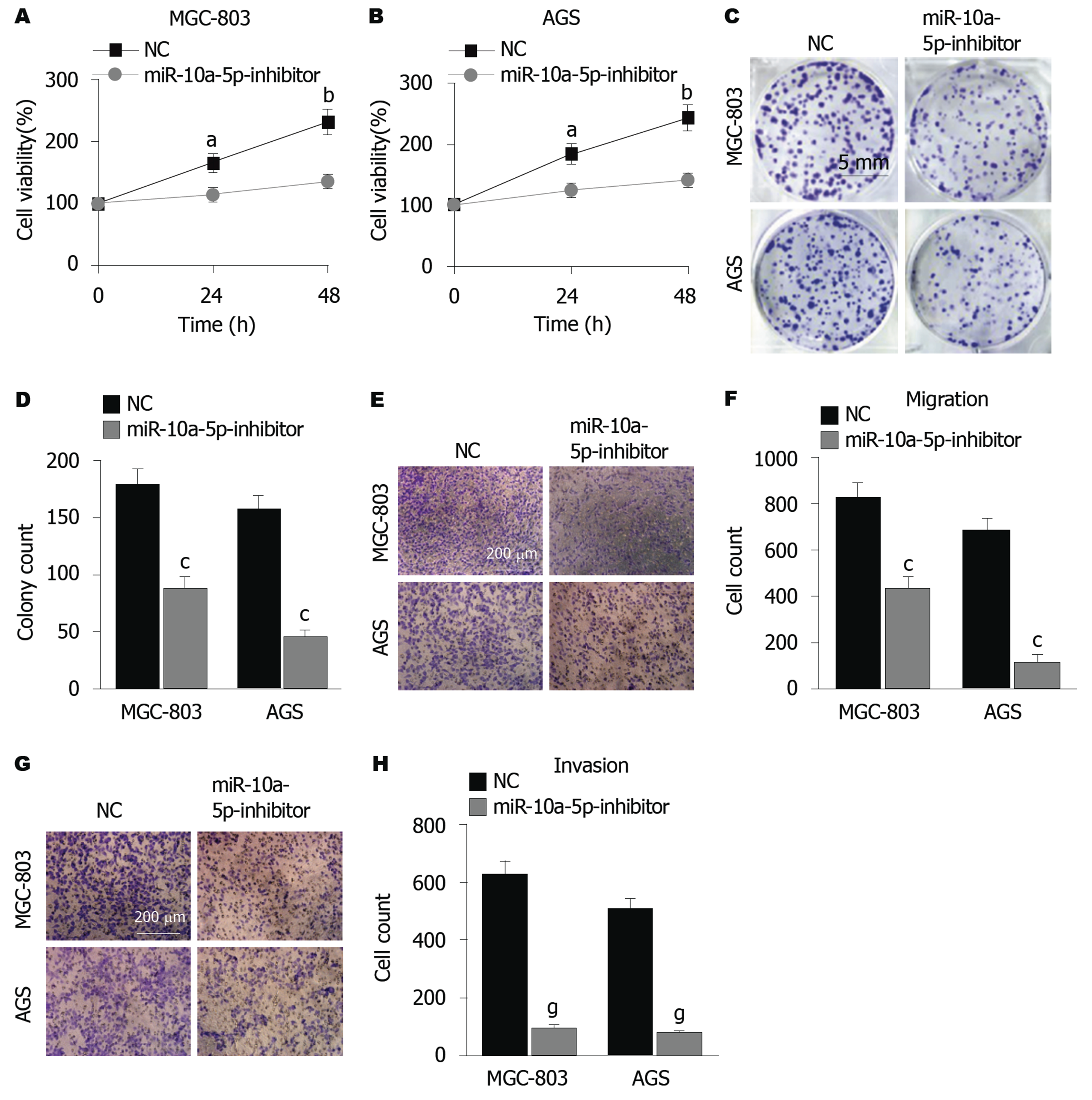
将miR-10a-5p-inhibitor转染到GC细胞(MGC-803和AGS)中, 抑制细胞中miR-10a-5p的表达(图2)后, 检测miR-10a-5p敲低后细胞的增殖, 集落形成, 迁移和侵袭, 结果显示, 相对于NC组, 转染 miR-10a-5p-inhibitor组中细胞的增殖(图3A、B), 集落数(图3C、D), 迁移细胞数(图3E、F)和侵袭细胞数(图3G、H)均显著降低(P<0.05或P<0.01).
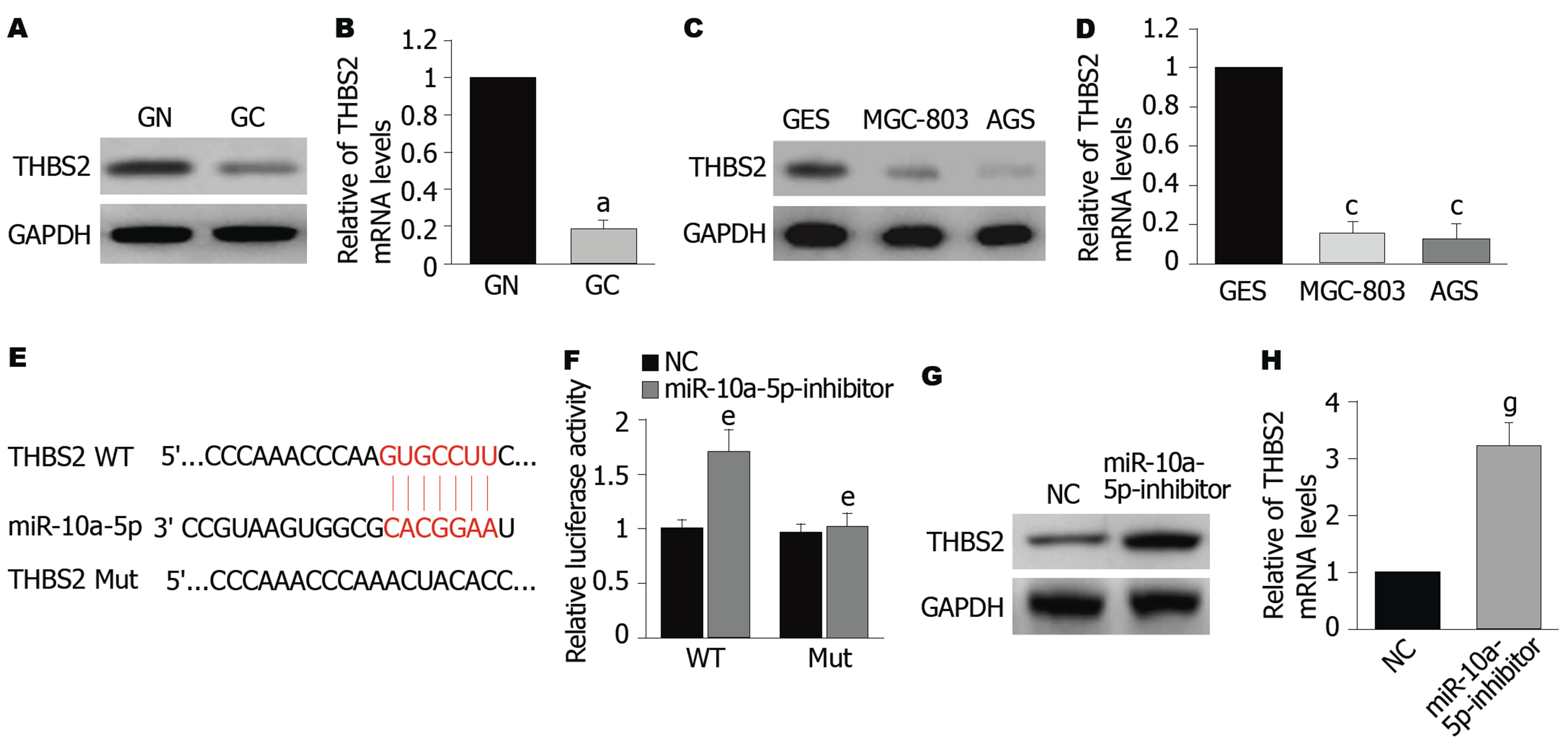
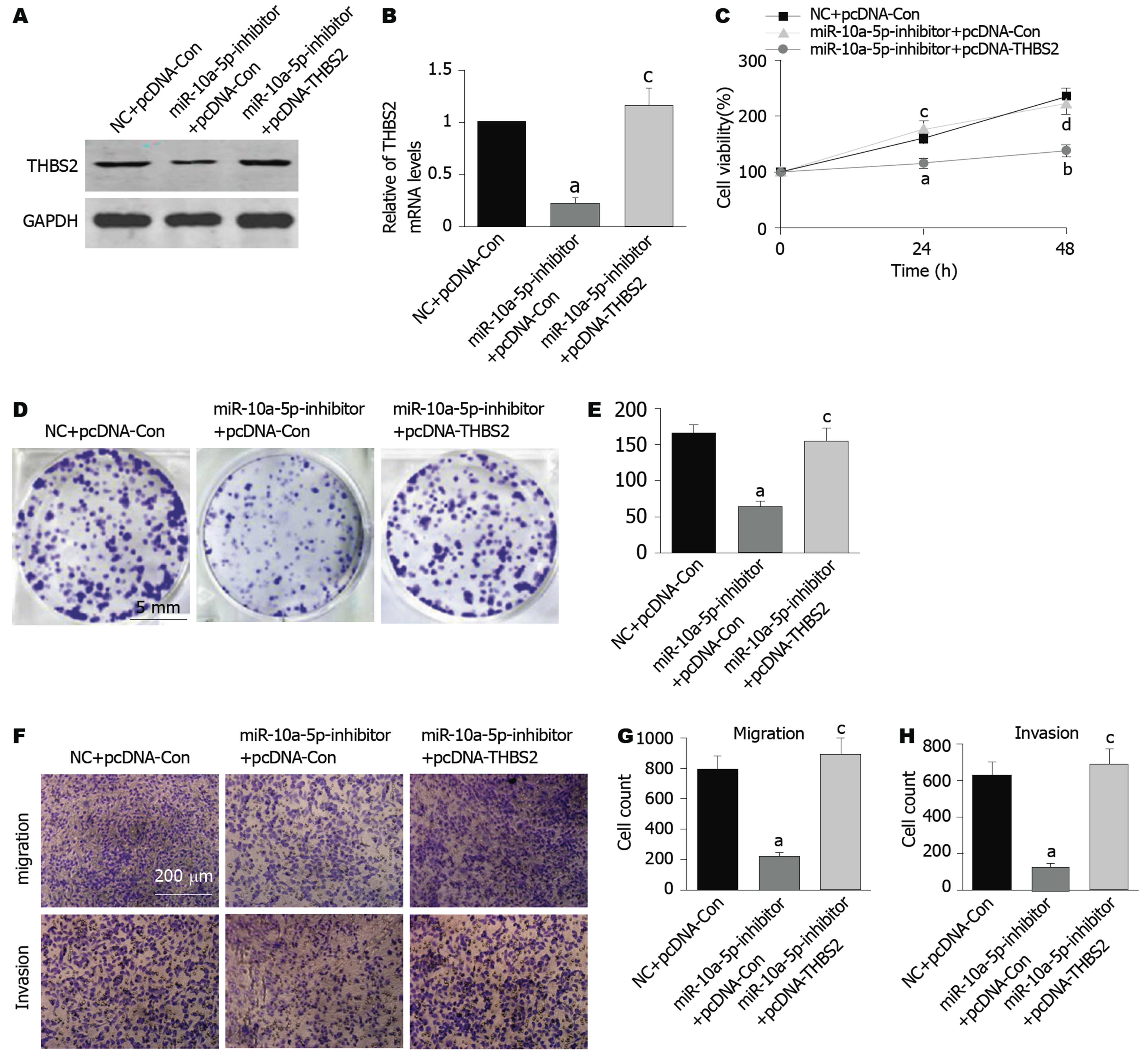
在组织中, 相对于癌旁正常组织, GC组织中THBS2的蛋白和mRNA的表达水平均显著降低(P<0.05)(图4A、B). 在细胞中,相对于GES细胞, MGC-803细胞和AGS细胞中THBS2的蛋白和mRNA的表达水平也降低(P<0.05)(图4C、D). TargetScan在线软件结果显示, THBS2 3'UTR预测存在miR-10a-5p的结合序列(图4E); 双荧光素酶报告基因检测结果显示(图4F), 在WT组中, miR-10a-5p inhibitor组的THBS2相对荧光素酶活性较NC组显著增加(P<0.05); 而Mut组中, 两组的THBS2相对荧光素酶活性无统计学意义, 证明 THBS2是miR-10a-5p的靶基因. 结果显示, 相对于NC组, miR-10a-5p inhibitor组THBS2蛋白和mRNA水平均显著增加(P<0.05)(图4G、H). 综上所述, 在人GC细胞系中, THBS2是miR-10a-5p的靶基因.
将miRNA-10a-5p inhibitor和pcDNA-THBS2共转入MGC-803细胞, 检测过表达THBS2(图5A、B)对已转染miR-10a-5p inhibitor细胞的增殖, 集落形成, 迁移和侵袭的影响, 结果显示, 相对于转染miR-10a-5p inhibitor+pcDNA-Con组, 转染miR-10a-5p inhibitor+pcDNA-THBS2组中细胞的增殖(图5C), 集落数(图5D、E), 迁移细胞数和侵袭细胞数(图5F-H)均显著增加(P<0.05或P<0.01), 说明miR-10a-5p敲低通过靶向THBS2抑制人GC细胞的生长和转移.
GC是全球癌症相关死亡的主要原因, 由于缺乏特异性和敏感性的生物标志物, 总体5年生存率低于20%[11,12]. 因此, 对GC患者迫切需要一种可靠有效的治疗方法.
文献[13]报道, 在人体中约30%的基因表达受miRNAs控制, 广泛地参与细胞发育和生理过程. miRNAs的表达经常在肿瘤中失调[14,15]. 此外, miRNAs在肿瘤的诊断和治疗中均发挥了举足轻重的作用[16,17]. 其中, miR-10a-5p可影响肝癌[9]和乳头状甲状腺癌[18]等癌症的进展. miR-10a-5p可通过丝裂原活化蛋白激酶8相互作用蛋白1(mitogen-activated protein kinase 8 interacting protein 1, MAPK8IP1)促进GC转移[19]. 而miRNA的作用是多样的, 机制也是复杂的, 因此, miR-10a-5p在GC中的具体作用和机制仍需进一步鉴定. 在本研究中, 我们采用RT-qPCR检测了GC组织和GC细胞中miR-10a-5p的表达情况, 结果显示, miR-10a-5p在GC组织和GC细胞系中表达均显著上调. 接下来, 我们将miR-10a-5p-inhibitor转染入GC细胞MGC-803和AGS中, 结果显示, 敲低miR-10a-5p能抑制 MGC-803和AGS细胞的增殖, 集落形成, 迁移与侵袭.
miRNAs可通过靶基因发挥后续生物学作用[20]. 我们采用TargetScan在线软件筛选出THBS2为miR-10a-5p的潜在靶点之一. THBS2是基质细胞Ca2+结合糖蛋白家族的成员之一, 发现其与多种细胞受体, 生长因子和细胞外基质(extracellular matrix, ECM)蛋白相互作用, 从而导致其在细胞粘附, 增殖和细胞凋亡中发挥功能[21]. THBS2在肿瘤中的表达与血管分布, 进展和转移的减少有关[22]. 有研究[23]发现, THBS2水平较高的GC患者预后较好, 而THBS2表达减少与较差的GC组织学分级和预后不良相关. 然而, 很少有研究探讨GC中miR-10a-5p与THBS2的关系. 我们采用双荧光素酶基因证明了THBS2是miR-10a-5p的靶基因. THBS2高表达有助于GC的进展[23]. 在本实验中, 敲低miR-10a-5p能促进THBS2表达; 我们进一步将miR-10a-5p inhibitor和THBS2共转染入MGC-803细胞, 结果显示, 转染THBS2后逆转了miR-10a-5p敲低对MGC-803细胞的增殖, 集落形成, 迁移与侵袭的抑制作用. 总之, 我们的数据进一步表明在GC中THBS2是miR-10a-5p的功能靶标.
本研究依然存在不足之处: 比如收集的临床样本量相对少, 造成无法分析miR-10a-5p与GC临床特征(临床分期、肿瘤分化、肿瘤大小、肿瘤位置和是否淋巴结转移)的关系; THBS2下游与GC细胞生长与转移相关的具体信号通路尚未明了. 这些未知的研究方向值得我们后期持续研究.
综上所述, 我们目前的结果显示, 敲低miR-10a-5p通过上调靶基因THBS2表达来发挥抑制GC细胞生长和转移的能力, miR-10a-5p可能是治疗GC的潜在靶点.
我国胃癌(gastric cancer, GC)的发病率呈逐年增加趋势和低龄化趋势. 而筛选影响GC进展的生物学靶点, 有助于对GC治疗方法开发提供线索. miRNAs在GC的发病和进展中发挥重要作用.
miR-10a-5p在肝癌组织高表达, 且其可促进肝癌细胞增殖与转移, 而miR-10a-5p对GC细胞增殖, 克隆集落形成, 迁移与侵袭的作用尚不清楚.
本研究旨在检测miR-10a-5p在GC组织和GC细胞的表达, 并探索miR-10a-5p对GC细胞增殖, 克隆集落形成, 迁移与侵袭的影响, 并分析其中的机制.
用实时荧光定量PCR(quantitative real-time PCR, RT-qPCR)检测miR-10a-5p在GC组织和细胞中表达. 用CCK-8法, 集落形成法和Transwell法评估miR-10a-5p敲低对GC细胞增殖, 集落形成, 迁移和侵袭的影响. 预测miR-10a-5p的靶基因, 并验证. 最后, 检测miR-10a-5p是否通过此靶基因在GC细胞上发挥作用.
miR-10a-5p在GC组织和细胞中高表达; miR-10a-5p敲低能通过其靶基因THBS2发挥抑制GC细胞增殖. 克隆形成, 迁移与侵袭的作用.
抑制miR-10a-5p表达能通过靶基因THBS2发挥抑制GC细胞生长和转移的作用.
本研究为GC的治疗提供了参考靶点.
学科分类: 胃肠病学和肝病学
手稿来源地: 浙江省
同行评议报告分类
A级 (优秀): A
B级 (非常好): 0
C级 (良好): C, C
D级 (一般): D
E级 (差): 0
编辑: 王禹乔 电编:刘继红
| 1. | Siegel RL, Miller KD, Jemal A. Cancer statistics, 2018. CA Cancer J Clin. 2018;68:7-30. [PubMed] [DOI] |
| 2. | Bray F, Ferlay J, Soerjomataram I, Siegel RL, Torre LA, Jemal A. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin. 2018;68:394-424. [PubMed] [DOI] |
| 3. | Xiao Y, Xu J, Yin W. Aberrant Epigenetic Modifications of Non-coding RNAs in Human Disease. Adv Exp Med Biol. 2018;1094:65-75. [PubMed] [DOI] |
| 4. | Ideozu JE, Zhang X, Rangaraj V, McColley S, Levy H. Microarray profiling identifies extracellular circulating miRNAs dysregulated in cystic fibrosis. Sci Rep. 2019;9:15483. [PubMed] [DOI] |
| 5. | Chen H, Fan Y, Xu W, Chen J, Xu C, Wei X, Fang D, Feng Y. miR-10b Inhibits Apoptosis and Promotes Proliferation and Invasion of Endometrial Cancer Cells via Targeting HOXB3. Cancer Biother Radiopharm. 2016;31:225-231. [PubMed] [DOI] |
| 6. | Zhao C, Li Y, Zhang M, Yang Y, Chang L. miR-126 inhibits cell proliferation and induces cell apoptosis of hepatocellular carcinoma cells partially by targeting Sox2. Hum Cell. 2015;28:91-99. [PubMed] [DOI] |
| 7. | Ge X, Liu X, Lin F, Li P, Liu K, Geng R, Dai C, Lin Y, Tang W, Wu Z, Chang J, Lu J, Li J. MicroRNA-421 regulated by HIF-1α promotes metastasis, inhibits apoptosis, and induces cisplatin resistance by targeting E-cadherin and caspase-3 in gastric cancer. Oncotarget. 2016;7:24466-24482. [PubMed] [DOI] |
| 8. | Zheng L, Jiao W, Mei H, Song H, Li D, Xiang X, Chen Y, Yang F, Li H, Huang K, Tong Q. miRNA-337-3p inhibits gastric cancer progression through repressing myeloid zinc finger 1-facilitated expression of matrix metalloproteinase 14. Oncotarget. 2016;7:40314-40328. [PubMed] [DOI] |
| 9. | Wu Y, Zhou Y, Huan L, Xu L, Shen M, Huang S, Liang L. LncRNA MIR22HG inhibits growth, migration and invasion through regulating the miR-10a-5p/NCOR2 axis in hepatocellular carcinoma cells. Cancer Sci. 2019;110:973-984. [PubMed] [DOI] |
| 10. | Zhang Y, Liu J, Lv Y, Zhang C, Guo S. LncRNA meg3 suppresses hepatocellular carcinoma in vitro and vivo studies. Am J Transl Res. 2019;11:4089-4099. [PubMed] |
| 11. | Song Z, Wu Y, Yang J, Yang D, Fang X. Progress in the treatment of advanced gastric cancer. Tumour Biol. 2017;39:1010428317714626. [PubMed] [DOI] |
| 12. | Ang TL, Fock KM. Clinical epidemiology of gastric cancer. Singapore Med J. 2014;55:621-628. [PubMed] [DOI] |
| 13. | Vishnoi A, Rani S. MiRNA Biogenesis and Regulation of Diseases: An Overview. Methods Mol Biol. 2017;1509:1-10. [PubMed] [DOI] |
| 14. | Rupaimoole R, Slack FJ. MicroRNA therapeutics: towards a new era for the management of cancer and other diseases. Nat Rev Drug Discov. 2017;16:203-222. [PubMed] [DOI] |
| 15. | Abreu FB, Liu X, Tsongalis GJ. miRNA analysis in pancreatic cancer: the Dartmouth experience. Clin Chem Lab Med. 2017;55:755-762. [PubMed] [DOI] |
| 16. | Qadir MI, Faheem A. miRNA: A Diagnostic and Therapeutic Tool for Pancreatic Cancer. Crit Rev Eukaryot Gene Expr. 2017;27:197-204. [PubMed] [DOI] |
| 17. | Mansoori B, Mohammadi A, Shirjang S, Baradaran B. MicroRNAs in the Diagnosis and Treatment of Cancer. Immunol Invest. 2017;46:880-897. [PubMed] [DOI] |
| 18. | Wang Z, Lv J, Zou X, Huang Z, Zhang H, Liu Q, Jiang L, Zhou X, Zhu W. A three plasma microRNA signature for papillary thyroid carcinoma diagnosis in Chinese patients. Gene. 2019;693:37-45. [PubMed] [DOI] |
| 19. | Lu Y, Wei G, Liu L, Mo Y, Chen Q, Xu L, Liao R, Zeng D, Zhang K. Direct targeting of MAPK8IP1 by miR-10a-5p is a major mechanism for gastric cancer metastasis. Oncol Lett. 2017;13:1131-1136. [PubMed] [DOI] |
| 20. | Bartel DP. MicroRNAs: target recognition and regulatory functions. Cell. 2009;136:215-233. [PubMed] [DOI] |
| 21. | Zhuo C, Li X, Zhuang H, Tian S, Cui H, Jiang R, Liu C, Tao R, Lin X. Elevated THBS2, COL1A2, and SPP1 Expression Levels as Predictors of Gastric Cancer Prognosis. Cell Physiol Biochem. 2016;40:1316-1324. [PubMed] [DOI] |
| 22. | Meng H, Zhang X, Hankenson KD, Wang MM. Thrombospondin 2 potentiates notch3/jagged1 signaling. J Biol Chem. 2009;284:7866-7874. [PubMed] [DOI] |
| 23. | Sun R, Wu J, Chen Y, Lu M, Zhang S, Lu D, Li Y. Down regulation of Thrombospondin2 predicts poor prognosis in patients with gastric cancer. Mol Cancer. 2014;13:225. [PubMed] [DOI] |