修回日期: 2019-11-05
接受日期: 2019-11-12
在线出版日期: 2019-11-28
早期胃癌阶段机体多项血清因子异常, 其中血清胃泌素-17(gastrin-17, G-17)、胃蛋白酶原Ⅰ(pepsinogen Ⅰ, PG I)、胃蛋白酶原Ⅱ(pepsinogen Ⅱ, PG Ⅱ)、同型半胱氨酸(homocysteine, Hcy)广受临床关注, 推测四者联合检测可作为早期胃癌的诊断参考依据.
检测血清G-17、PG I、PG II、Hcy在早期胃癌中的表达水平, 并分析其对早期胃癌诊断的临床价值.
回顾性分析本院230例高度怀疑为胃癌的患者的临床资料, 根据胃镜及病理诊断结果将患者分为胃良性病变组(136例), 早期胃癌组(53例), 进展期胃癌组(41例). 另回顾性分析同期118例健康受试者的临床资料, 将其设置为健康组. 比较4组血清G-17、PG I、PG II、Hcy水平; 对比胃癌组、非胃癌组可能影响因素的差异, 并采用Logistic回归分析法分析导致胃癌的危险因素; 通过绘制受试者工作曲线(receiver operating curve, ROC), 分析血清G-17、PG I、PG II、Hcy单独及联合检测对早期胃癌、进展期胃癌的诊断价值.
进展期胃癌组、早期胃癌组、胃良性病变组、健康组血清G-17、PG II、Hcy呈降低趋势(P<0.05), 血清PG I呈升高趋势(P<0.05), 组间比较差异均有统计学意义(P<0.05); 胃癌组喜食烫食占比、高盐饮食占比, 血清G-17、PG II、Hcy水平均显著高于非胃癌组, 血清PG I显著低于非胃癌组(P<0.05), 经Logistic回归分析证实均为导致胃癌的危险因素; ROC结果显示, 血清G-17、PG I、PG II、Hcy单独检测诊断早期胃癌的最佳截断点分别为13.46 pmol/L、60.98 ng/mL、27.56 ng/mL、23.01 μmol/L, 曲线下面积(area under the curve, AUC)分别为0.71、0.70、0.71、0.78、0.83; 血清G-17、PG I、PG II、Hcy单独检测诊断进展期胃癌的最佳截断点分别为18.53 pmol/L、47.56 ng/mL、28.41 ng/mL、27.63 μmol/L, AUC分别为0.71、0.68、0.73、0.75、0.80.
血清G-17、PG II、Hcy在早期胃癌中呈异常高表达, 血清PG I呈异常低表达, 四者联合检测对早期胃癌的诊断具有一定临床价值.
核心提要: 本研究通过分析血清G-17、PG I、PG II、Hcy在胃癌中的变化, 得出对上述指标进行检测可用于早期胃癌筛查的结论, 为临床早期确诊提供帮助.
引文著录: 南寿山, 靳荣, 贾惠娟, 王珏磊, 赵春美, 王柏清. 血清G-17、PG I、PG II、Hcy在胃黏膜癌变进展中的表达及临床意义. 世界华人消化杂志 2019; 27(22): 1383-1390
Revised: November 5, 2019
Accepted: November 12, 2019
Published online: November 28, 2019
Abnormalities of multiple serum factors occur in the early stage of gastric cancer. Among them, serum gastrin-17 (G-17), pepsinogen I (PG I), pepsinogen II (PG II), and homocysteine (Hcy) have attracted wide attention. The combined detection of these four factors may be of important clinical significance for the diagnosis of early gastric cancer.
To detect the levels of serum G-17, PG I, PG II, and Hcy in early gastric cancer and analyze their clinical value in the diagnosis of early gastric cancer.
The clinical data of 230 patients with suspected gastric cancer were retrospectively analyzed. According to the results of endoscopy and pathological diagnosis, the patients were divided into three groups: patients with benign gastric lesions (136 cases), those with early gastric cancer (53 cases), and those with advanced gastric cancer (41 cases). The clinical data of 118 healthy subjects were included as a healthy control group. The levels of serum G-17, PG I, PG II, and Hcy were compared between the four groups. The differences in possible factors between the gastric cancer and non-gastric cancer group were compared. Logistic regression analysis was used to analyze the risk factors for gastric cancer. The diagnostic value of serum G-17, PG I, PG II, and Hcy, alone or in combination, for early gastric cancer and advanced gastric cancer were assessed by receiver operating curve (ROC) analysis.
Serum G-17, PG II, and Hcy showed a decreasing trend from the advanced gastric cancer group to early gastric cancer group, benign gastric lesion group, and healthy control group (P < 0.05), while serum PG I showed an increasing trend (P < 0.05). The proportions of patients with intake of hot food and high-salt diet as well as serum levels of G-17, PG II, and Hcy in the gastric cancer group were significantly higher than those in the non-gastric cancer group (P < 0.05), while serum PG I was significantly lower than that in the non-gastric cancer group (P < 0.05). Logistic regression analysis confirmed that all of these were risk factors for gastric cancer. ROC analysis showed that the best cut-off points for serum G-17, PG I, PG II, and Hcy for the diagnosis of early gastric cancer were 13.46 pmol/L, 60.98 ng/mL, 27.56 ng/mL, and 23.01 μmol/L, respectively, and the corresponding areas under the curves (AUCs) were 0.71, 0.70, 0.71, and 0.78, respectively. The best cutoff points for serum G-17, PG I, PG II, and Hcy for the diagnosis of advanced gastric cancer were 18.53 pmol/L, 47.56 ng/mL, 28.41 ng/mL, and 27.63 μmol/L, respectively, and the corresponding AUCs were 0.71, 0.68, 0.73, and 0.75, respectively. The AUCs of combined detection of the four factors for the diagnosis of early gastric cancer and advanced gastric cancer were 0.83 and 0.80, respectively.
Serum G-17, PG II, and Hcy show abnormally high expression in early gastric cancer, and serum PG I shows abnormally low expression. The combined detection of the four factors has appreciated clinical value for the diagnosis of early gastric cancer.
- Citation: Nan SS, Jin R, Jia HJ, Wang JL, Zhao CM, Wang BQ. Clinical significance of expression of serum gastrin-17, pepsinogen I, pepsinogen II, and homocysteine in evolution of gastric cancer. Shijie Huaren Xiaohua Zazhi 2019; 27(22): 1383-1390
- URL: https://www.wjgnet.com/1009-3079/full/v27/i22/1383.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v27.i22.1383
胃癌为高发消化系统疾病, 发病率、致死率均居恶性肿瘤前列[1]. 该病早期无特异性症状, 部分患者在确诊时已处于进展期, 错失最佳治疗时机, 预后不良. 因此, 早期确诊并对应治疗是延长患者生存期限、改善预后的关键. 目前胃镜筛查是胃癌诊断的可靠方式, 但具有侵入性, 且费用较高, 患者接受度低. 故探究更为安全、经济的诊断方式是临床亟待解决的问题. 胃泌素-17(gastrin-17, G-17)、胃蛋白酶原(pepsinogen, PG)均由胃黏膜分泌, 其含量可反映出胃部变化, 已有研究证实胃黏膜病变时其浓度将随之变化[2]. 同型半胱氨酸(homocysteine, Hcy)为蛋氨酸代谢途径的中间产物, 国内外学者认为其在结肠癌、肝癌、肺癌等恶性肿瘤中表达异常[3-5], 且高水平Hcy可增加胃癌患病风险. 鉴于此, 本研究将测定早期胃癌中血清G-17、胃蛋白酶原Ⅰ(pepsinogen I, PG I)、胃蛋白酶原Ⅱ(pepsinogen II, PG II)、Hcy表达水平, 并探究其单独与联合检测对该病的诊断价值. 报道如下.
回顾性分析2014-08/2018-08期间本院230例高度怀疑为胃癌的患者的临床资料, 均接受胃镜及病理诊断, 根据诊断结果将患者分为胃良性病变组(136例), 早期胃癌组(53例), 进展期胃癌组(41例). 另回顾性分析同期118例健康受试者的临床资料, 将其设置为健康组. 4组性别、年龄、体质量指数(body mass index, BMI)临床资料比较差异均无统计学意义(P>0.05)(表1). 纳入标准: (1)230例高度怀疑为胃癌的患者均表现为上腹部疼痛、嗳气、反酸等上消化道症状, 有胃息肉、萎缩性胃炎等病史; (2)健康组无消化道、胃痛病史, 幽门螺杆菌感染史, 经体检各项指标正常; (3)近1 mo未使用过质子泵抑制剂、H+拮抗剂及胃黏膜保护药物、抗凝药物; (4)胃癌患者经病理诊断证实,并经3位具有相关资质病理专家审核; (5)早期胃癌符合《早期胃癌内镜鉴别诊断手册》中诊断标准,癌组织限于胃黏膜层及黏膜下层; (6)进展期胃癌癌组织浸润到黏膜下层, 进入肌层或已穿过肌层达浆膜,经内镜检查确诊. 排除标准: (1)入组前2 wk内服用质子泵抑制剂、H+受体拮抗剂等对本研究造成影响的药物; (2)肝、肾、心等器官功能异常; (3)胃部手术史(包括内镜下手术及外科手术); (4)精神分裂、抑郁症、妄想症等精神疾病; (5)临床资料缺失. 本研究开展前获本院伦理委员会批准(批号: TJWZXYXEC-2019-03).
| 组别 | 例数 | 性别(%) | 年龄(岁) | BMI (kg/m2) | |
| 男 | 女 | ||||
| 进展期胃癌组 | 41 | 29(70.73) | 12(29.27) | 60.01±6.47 | 23.90±3.01 |
| 早期胃癌组 | 53 | 36(67.92) | 17(32.08) | 59.96±5.18 | 23.35±1.50 |
| 胃良性病变组 | 136 | 79(58.09) | 57(41.91) | 59.33±5.23 | 23.36±1.70 |
| 健康组 | 118 | 74(62.71) | 44(37.29) | 58.88±5.93 | 23.10±2.49 |
| χ2/F值 | 0.653 | 0.672 | 1.416 | ||
| P值 | 0.741 | 0.570 | 0.238 | ||
血清G-17、PG I、PG II、Hcy检测: 在所有受试者空腹状态下采集其5 mL左右静脉血, 2800 r/s离心15 min, 取上清置于-80 ℃环境中待用. 血清G-17、PG I、PG II采用双抗体夹心酶联免疫法检测, 严格按照试剂盒要求操作, 酶联免疫试剂盒购自上海沪鼎生物科技有限公司, 采用THERMO Multiskan FC全自动酶标仪(美国Thermo Scientific)测定吸光光度值, 根据标准曲线计算样本浓度. 血清G-17、PG I、PG II参考值分别为: 1.00-15.00 pmol/L、60.00-240.00 ng/mL、0-20.00 ng/mL; 血清Hcy采用循环酶法检测, Hcy诊断试剂盒购自武汉默沙克生物科技有限公司, 采用AU5800全自动生化分析仪(美国Beckman Coulter)测定样本浓度. 血清Hcy参考值为: 5-15 μmol/L. 联合检测: 血清G-17、PG I、PG II、Hcy四者水平均异常视为阳性.
临床资料调查: 将进展期胃癌与早期胃癌患者设置为胃癌组, 将胃良性病变患者与健康受试者分为非胃癌组, 收集2组临床资料, 包括性别、年龄、BMI、家族史、抽烟(每天>1支, 且连续6 mo以上)、饮酒(每周>1次, 且连续6 mo以上)、饮食不规律(三餐不按时, 用餐时间不固定)、喜食烫食(入口食物超过60 ℃, 且连续6 mo以上)、高盐饮食(摄入食盐>6 g/d)、高血压、糖尿病, 血清G-17、PG I、PG II、Hcy. 对上述可能导致胃癌的因素进行赋值, 性别(女 = 0、男 = 1)、家族史(否 = 0、是 = 1)、抽烟(否 = 0、是 = 1)、饮酒(否 = 0、是 = 1)、饮食不规律(女 = 0、男 = 1)、喜食烫食(否 = 0、是 = 1)、高盐饮食(否 = 0、是 = 1)、高血压(否 = 0、是 = 1)、糖尿病(否 = 0、是 = 1),以年龄、BMI、血清G-17、血清PG I、血清PG II、血清Hcy为连续变量, 以是否发生胃癌(否 = 0、是 = 1)为因变量进行Logistic回归分析.
观察指标: (1)进展期胃癌组、早期胃癌组、胃良性病变组、健康组基线资料比较; (2)进展期胃癌组、早期胃癌组、胃良性病变组、健康组血清G-17、PG I、PG II、Hcy水平比较; (3)胃癌组、非胃癌组可能影响因素的差异对比; (4)Logistic回归分析法分析导致胃癌的危险因素; (5)血清G-17、PG I、PG II、Hcy单独与联合检测诊断早期胃癌的价值; (6)血清G-17、PG I、PG II、Hcy单独与联合检测诊断进展期胃癌的价值.
统计学处理 数据的处理与分析采用SPSS 26.0, 计量资料均采用mean±SD表示, 两两样本比较采用独立样本t检验; 多样本计量资料比较用单因素方差分析, 进一步两两比较采用SNK-q检验; 计数资料均采用n(%)表示及χ2检验; 经Logistic回归分析法计算导致胃癌的危险因素比值比(odd ratio, OR)及95%可信区间(credibility interval, CI). P<0.05有统计学意义; 建立受试者工作特征曲线(receiver operating curve, ROC)分析血清因子对早期胃癌、进展期胃癌的诊断价值, 并计算曲线下面积(area under curve, AUC), AUC>0.5提示该模型对早期胃癌有诊断价值, 且该值越大, 诊断价值越高. 采用Z检验比较AUC, P<0.05差异有统计学意义.
4组性别、年龄、BMI资料比较差异均无统计学意义(P>0.05)(表1).
4组血清G-17、PG I、PG II、Hcy水平比较差异有统计学意义(P<0.05); 进展期胃癌组、早期胃癌组、胃良性病变组、健康组血清G-17、PG II、Hcy呈降低趋势(P<0.05), 血清PG I呈升高趋势(P<0.05), 组间比较差异均有统计学意义(P<0.05)(表2). 胃良性病变组中低级别上皮内瘤变(low grade intraepithelial neoplasia, LGIN)42例, 经4年随访发现其中28例病变消失, 血清G-17、PG II、Hcy水平呈降低趋势最终平稳; 10例发展为高级别上皮内瘤变(high grade intraepithelial neoplasia, HGIN), 4例发生癌变, 血清G-17、PG II、Hcy水平均呈上升趋势.
| 组别 | 例数 | G-17 (pmol/L) | PG I (ng/mL) | PG II (ng/mL) | Hcy (μmol/L) |
| 进展期胃癌组 | 41 | 17.16±2.36 | 42.85±5.21 | 27.30±3.52 | 25.40±4.53 |
| 早期胃癌组 | 53 | 12.15±3.09a | 59.95±6.43a | 24.54±3.01a | 21.58±3.71a |
| 胃良性病变组 | 136 | 8.12±1.64ac | 62.33±9.17ac | 20.50±2.69ac | 15.26±3.06ac |
| 健康组 | 118 | 6.40±0.89ace | 93.58±14.76ace | 14.71±2.33ace | 10.31±1.97ace |
| F值 | 404.263 | 312.326 | 294.033 | 322.154 | |
| P值 | 0.000 | 0.000 | 0.000 | 0.000 |
胃癌组、非胃癌组年龄、性别、BMI、家族史、抽烟、饮酒、饮食不规律、高血压、糖尿病临床资料比较差异无统计学意义(P>0.05); 胃癌组喜食烫食占比、高盐饮食占比, 血清G-17、PG II、Hcy水平均显著高于非胃癌组, 血清PG I显著低于非胃癌组(P<0.05)(表3).
| 可能影响因素 | 胃癌组(n = 94) | 非胃癌组(n = 254) | t/χ2 | P值 |
| 年龄(岁) | 60.42±6.15 | 59.12±6.21 | 1.738 | 0.083 |
| 性别(男) | 65(69.15) | 153(60.24) | 2.329 | 0.127 |
| BMI (kg/m2) | 23.59±1.74 | 23.24±1.83 | 1.605 | 0.109 |
| 家族史(%) | 16(17.02) | 26(10.24) | 2.976 | 0.084 |
| 抽烟(%) | 33(35.11) | 64(25.20) | 3.351 | 0.067 |
| 饮酒(%) | 39(41.49) | 80(31.50) | 3.045 | 0.081 |
| 饮食不规律(%) | 65(69.15) | 148(58.27) | 3.421 | 0.064 |
| 喜食烫食(%) | 42(44.68) | 72(28.35) | 8.310 | 0.004 |
| 高盐饮食(%) | 39(41.49) | 71(27.95) | 5.816 | 0.016 |
| 高血压(%) | 19(20.21) | 32(12.60) | 3.180 | 0.075 |
| 糖尿病(%) | 25(26.60) | 45(17.72) | 3.366 | 0.067 |
| 血清G-17 (pmol/L) | 14.34±2.04 | 7.32±0.96 | 43.431 | 0.000 |
| 血清PG I (ng/mL) | 52.49±6.95 | 76.85±8.54 | 24.778 | 0.000 |
| 血清PG II (ng/mL) | 25.74±3.06 | 17.81±2.03 | 27.932 | 0.000 |
| 血清Hcy (μmol/L) | 23.25±3.14 | 12.96±1.02 | 46.150 | 0.000 |
经Logistic回归分析, 喜食烫食、高盐饮食, 血清G-17、PG I、PG II、Hcy均为导致胃癌的危险因素(P<0.05)(表4).
| 变量 | β | SE | Wald χ2 | P值 | OR | 95%CI |
| 喜食烫食 | 1.76 | 0.53 | 10.90 | 0.004 | 5.79 | 2.56-5.96 |
| 高盐饮食 | 1.06 | 0.39 | 7.62 | 0.006 | 2.90 | 1.86-3.52 |
| 血清G-17 | 1.23 | 0.26 | 22.55 | 0.000 | 1.15 | 1.02-2.56 |
| 血清PG I | 1.36 | 0.40 | 11.44 | 0.002 | 3.88 | 3.01-5.86 |
| 血清PG II | 1.13 | 0.33 | 11.98 | 0.002 | 3.08 | 1.53-4.96 |
| 血清Hcy | 0.96 | 0.20 | 23.66 | 0.000 | 2.62 | 2.01-4.68 |
| 常数项 | -0.96 | 0.33 | 0.002 | 0.00 |
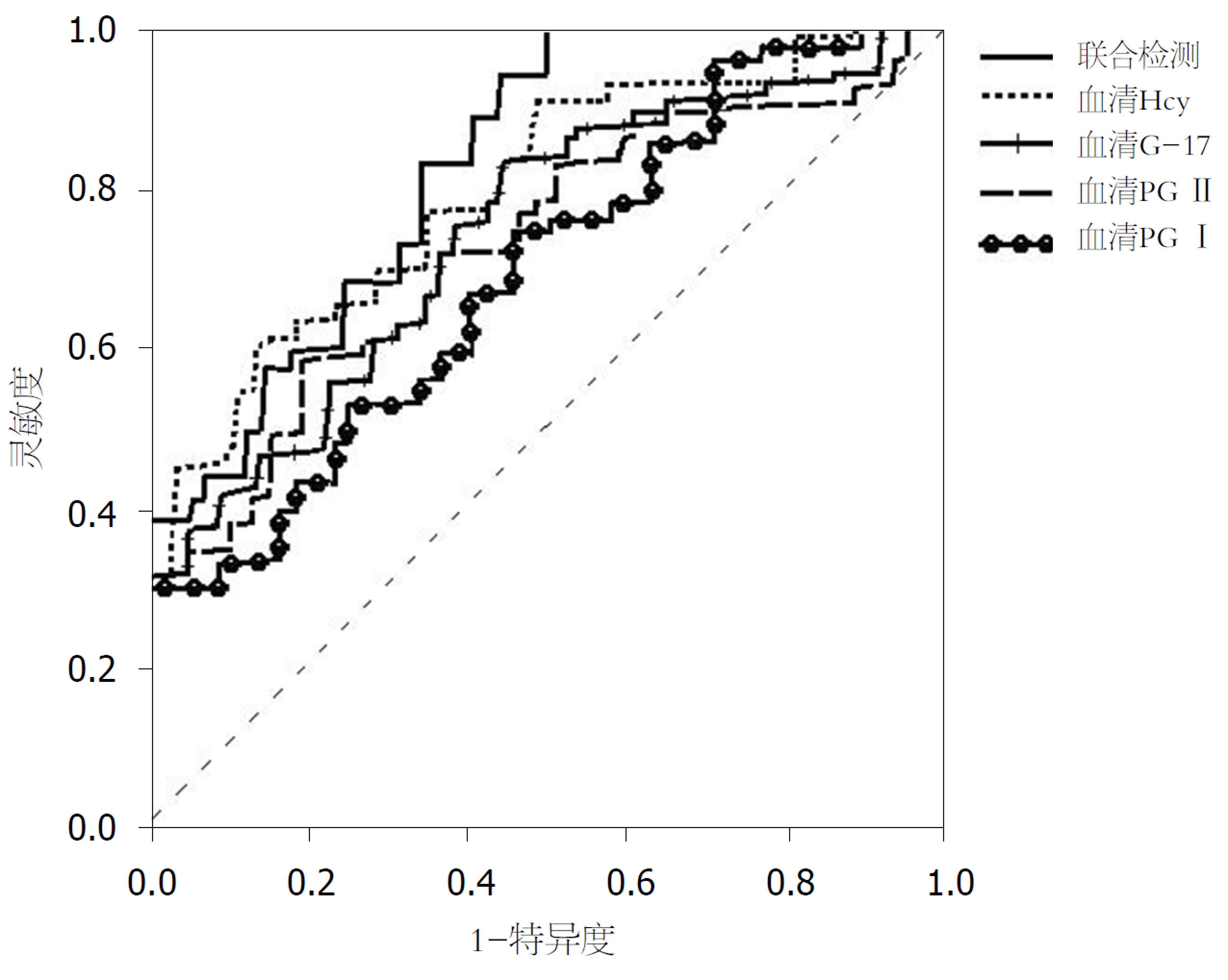
ROC结果显示, 血清G-17、PG I、PG II、Hcy单独检测诊断早期胃癌的最佳截断点分别为13.46 pmol/L、60.98 ng/mL、27.56 ng/mL、23.01 μmol/L, 单独检测与联合检测的AUC分别为0.71、0.70、0.71、0.78、0.83. 四者单独检测的AUC与联合检测差异具有统计学意义(P<0.01)(表5、图1).
| 项目 | 最佳截断点 | 灵敏度(%) | 特异度(%) | 准确度(%) | AUC | 95%CI |
| G-17 | 13.46 pmol/L | 77.36(41/53) | 77.97(138/177) | 77.83(179/230) | 0.71 | 0.62-0.85 |
| PG I | 60.98 ng/mL | 71.70(38/53) | 77.40(137/177) | 76.09(175/230) | 0.70 | 0.61-0.74 |
| PG II | 27.56 ng/mL | 73.58(39/53) | 77.97(138/177) | 76.96(177/230) | 0.71 | 0.69-0.72 |
| Hcy | 23.01 μmol/L | 79.25(42/53) | 79.10(140/177) | 79.13(182/230) | 0.78 | 0.75-0.81 |
| 联合检测 | - | 81.13(43/53) | 79.66(141/177) | 80.00(184/230) | 0.83 | 0.78-0.84 |
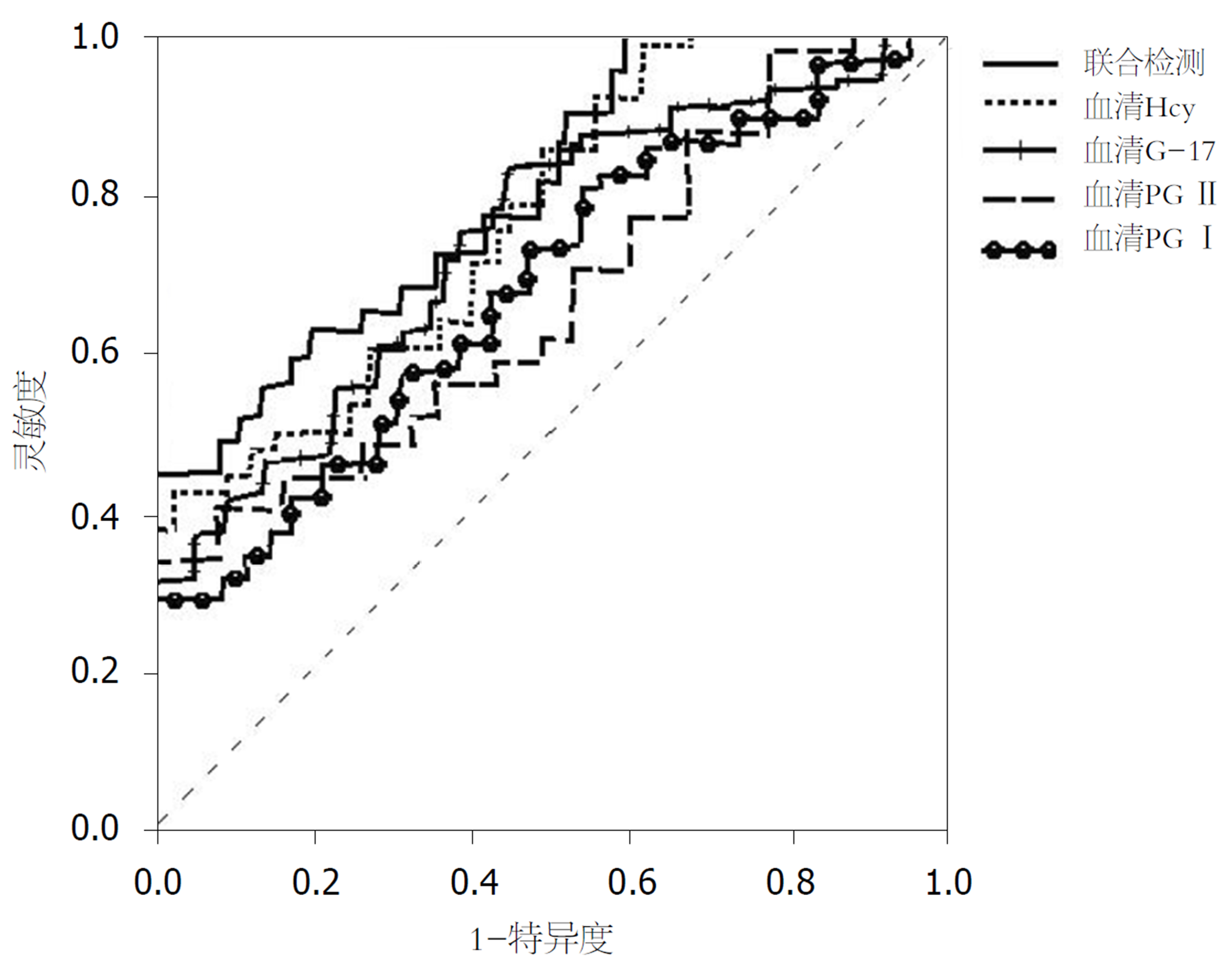
ROC结果显示, 血清G-17、PG I、PG II、Hcy单独诊断进展期胃癌的最佳截断点分别为18.53 pmol/L、47.56 ng/mL、28.41 ng/mL、27.63 μmol/L, 单独检测与联合检测的AUC分别为0.71、0.68、0.73、0.75、0.80. 四者单独检测的AUC与联合检测差异具有统计学意义(P<0.01)(表6、图2).
| 项目 | 最佳截断点 | 灵敏度(%) | 特异度(%) | 准确度(%) | AUC | 95%CI |
| G-17 | 18.53 pmol/L | 73.17(30/41) | 79.37(150/189) | 78.26(180/230) | 0.71 | 0.65-0.81 |
| PG I | 47.56 ng/mL | 70.73(29/41) | 77.25(146/189) | 76.09(175/230) | 0.68 | 0.65-0.74 |
| PG II | 28.41 ng/mL | 70.73(29/41) | 78.31(148/189) | 76.96(177/230) | 0.73 | 0.70-0.78 |
| Hcy | 27.63 μmol/L | 75.61(31/41) | 79.37(150/189) | 78.70(181/230) | 0.75 | 0.71-0.77 |
| 联合检测 | - | 80.49(33/41) | 80.42(152/189) | 80.43(185/230) | 0.80 | 0.75-0.82 |
胃癌起源于胃黏膜上皮, 恶性程度较高, 且具侵袭性与转移性, 患者面临着很高的死亡风险[6]. 早期胃癌阶段癌细胞仅存在于黏膜及黏膜下层, 经手术切除后5年生存率可达90%, 随着癌细胞侵袭至肌层间质发展至进展期, 实行化疗及胃大部分切除术等综合治疗后, 5年生存率仅为30%-50%[7]. 由此可见, 确诊时机与胃癌预后关系密切. 目前胃癌诊断主要依靠内镜筛查, 但该诊断方式存在操作难度高、过程痛苦等劣势, 大规模普查受限[8]. 因此, 临床研究人员逐渐将研究重点转向血清学肿瘤标志物水平的检测, 为早期胃癌筛查提供新的途径.
本研究中, 进展期胃癌组、早期胃癌组、胃良性病变组、健康组血清G-17、PG II、Hcy呈降低趋势, 血清PG I呈升高趋势, 提示早期胃癌血清G-17、PG II、Hcy水平异常升高, PG I水平异常降低. G-17是十二指肠、胃窦、胃肠黏膜中G细胞分泌的酰胺化肠胃激素[9], 主要生理功能为促进胃酸分泌、维持消化道解剖结构, 并可为黏膜提供营养, 促进其生长, 调节胃肠功能. 胃黏膜萎缩性病变将减少G细胞数量, 血清G-17水平降低. 近年来有研究显示[10,11], G-17与胃癌的发生、发展关系密切, 并可显著影响癌细胞的生长、恶性转化. PG为胃蛋白酶前体, 在适宜酸性条件下可被激活, 转化为胃蛋白酶, 分解蛋白质为机体提供营养, 其水平是胃黏膜形态与功能的反映[12]. 当胃黏膜与胃基底出现病变时, 部分胃腺、主细胞、胃窦G细胞数量显著减少, 相关功能丧失, PG基因突变, PG I分泌量明显减少, PG II分泌量增加, 且与病情严重程度相关[13,14]. PG II与PG I变化趋势不同的原因可能为分泌PG II的细胞及腺体分布广泛, 且推测与胃黏膜肠上皮化生及异型增生有关. Hcy属含硫氨基酸, 通常由蛋氨酸去甲基后合成. 由于恶性肿瘤分裂、增殖速度快, 叶酸与维生素B12消耗量大, 加上胃癌患者吸收、消化功能异常, 叶酸吸收率降低, 蛋氨酸循环速度受到影响, 导致血液中Hcy聚集[15]. 另有研究认为[16], Hcy代谢产物硫内酯毒性与细胞癌变密不可分, 提示Hcy在恶性肿瘤进程中的重要作用.
本研究采用Logistic回归分析法证实喜食烫食、高盐饮食, 血清G-17、PG I、PG II、Hcy均为导致胃癌的危险因素, 通过建立ROC曲线显示血清G-17、PG I、PG II、Hcy单独及联合检测诊断早期胃癌的AUC分别为0.71、0.70、0.71、0.78、0.83, 诊断进展期胃癌的AUC分别为0.71、0.68、0.73、0.75、0.80, 表明四者联合检测价值优于单独检测. 血清G-17、PG I、PG II、Hcy在进展期胃癌、早期胃癌及胃良性病变患者中均发生异常变化, 且多种恶性肿瘤, 高血压、脑梗死、慢性心衰等疾病中血清Hcy均异常升高, 故四者并非胃癌的特异性表达物质,单独诊断价值较低,故建议行四者联合检测, 为早期胃癌诊断提供更有价值的参考. 综上所述, 早期胃癌患者血清G-17、PG II、Hcy水平异常升高, 血清PG I水平异常降低, 四者联合检测可为早期胃癌的诊断提供参考.
胃癌为发病率高、致死率高的消化道恶性肿瘤, 早期无特异性症状, 难以被发现, 导致治疗时机延误. 当前临床上病理检查与胃镜筛查应用广泛, 但具有较多缺点. 为更好地筛查早期胃癌, 本研究特分析血清相关肿瘤标志物在早期胃癌中的表达水平及临床价值.
探究血清胃泌素-17(G-17)、胃蛋白酶原Ⅰ(PG I)、胃蛋白酶原Ⅱ(PG II)、同型半胱氨酸(Hcy)在早期胃癌中的表达水平及对其诊断价值, 为临床该病筛查提供依据.
早期胃癌患者血清G-17、PG I、PG II、Hcy水平异常, 可作为早期胃癌诊断的有效指标, 从而早期确诊并及时治疗, 改善预后.
采用双抗体夹心酶联免疫法测定受试者血清G-17、PG I、PG II水平, 采用循环酶法测定血清Hcy水平, 比较进展期胃癌组、早期胃癌组、胃良性病变组、健康组各指标水平变化, 建立ROC曲线比较各指标单独及联合检测诊断早期胃癌的价值.
早期胃癌患者血清G-17、PG I、PG II、Hcy水平异常, 联合检测可作为早期胃癌筛查的有效手段.
早期胃癌患者血清G-17、PG II、Hcy水平异常较高, 血清PG I水平异常较低,并通过ROC曲线得出四者联合检测对早期胃癌的诊断价值高于四者单独检测的结论,相较于目前临床上对两个或三个因子单独诊断早期胃癌所开展的研究而言更加全面,可进一步提升早期胃癌诊断的准确性. 此外, 本研究发现胃癌患者血清PG II水平异常, 与部分学者观点存在分歧,进而推测PG II水平对早期胃癌有一定诊断价值, 而非仅依靠PG I/PG II诊断该病.
探究其他血清肿瘤标志物与早期胃癌的关系, 以期获取更为灵敏、精确的检测标志物.
学科分类: 胃肠病学和肝病学
手稿来源地: 天津市
同行评议报告分类
A级 (优秀): A
B级 (非常好): B
C级 (良好): C, C
D级 (一般): D
E级 (差): E
编辑: 王禹乔 电编:刘继红
| 4. | Jin B, Gong Z, Yang N, Huang Z, Zeng S, Chen H, Hu S, Pan G. Downregulation of betaine homocysteine methyltransferase (BHMT) in hepatocellular carcinoma associates with poor prognosis. Tumour Biol. 2016;37:5911-5917. [PubMed] [DOI] |
| 5. | Yang J, Li H, Deng H, Wang Z. Association of One-Carbon Metabolism-Related Vitamins (Folate, B6, B12), Homocysteine and Methionine With the Risk of Lung Cancer: Systematic Review and Meta-Analysis. Front Oncol. 2018;8:493. [PubMed] [DOI] |
| 6. | Rahman R, Asombang AW, Ibdah JA. Characteristics of gastric cancer in Asia. World J Gastroenterol. 2014;20:4483-4490. [PubMed] [DOI] |
| 7. | Rajendran S, Benna C, Monticelli H, Spiro G, Menin C, Mocellin S. Germline variation of circadian pathway genes and prognosis of gastric cancer patients. Gut. 2018;67:779-780. [PubMed] [DOI] |
| 9. | Wang X, Ling L, Li S, Qin G, Cui W, Li X, Ni H. The Diagnostic Value of Gastrin-17 Detection in Atrophic Gastritis: A Meta-Analysis. Medicine (Baltimore). 2016;95:e3599. [PubMed] [DOI] |
| 10. | Zhao WX, Liu ZF, Li XL, Li Z. Correlations of serum homocysteine, VEGF and gastrin 17 with gastric cancer and precancerous lesions. Eur Rev Med Pharmacol Sci. 2019;23:4192-4198. [PubMed] [DOI] |
| 15. | Hasan T, Arora R, Bansal AK, Bhattacharya R, Sharma GS, Singh LR. Disturbed homocysteine metabolism is associated with cancer. Exp Mol Med. 2019;51:21. [PubMed] [DOI] |