修回日期: 2019-10-10
接受日期: 2019-11-12
在线出版日期: 2019-11-28
近年来, 有研究发现口服S-1方案较静脉注射FOLFOX4/FOLFIRI方案治疗转移性结直肠癌(metastatic colorectal cancer, mCRC)具有比较好的疗效. 本研究旨在运用Meta分析的研究方法系统性评价口服S-1方案在治疗mCRC中的治疗效果和安全性, 进而提供循证医学相关的依据.
运用Meta分析的研究方法系统性评价口服S-1方案在治疗mCRC中的治疗效果和安全性.
检索口服S-1方案治疗mCRC的对照试验, 时间范围2009-01/2019-01, 以Cochrane系统评价手册所制定的评价标准对于所选择的文献进行系统评价, 检索的数据库包括: 维普数据库、万方数据库、中国生物医学文献数据库、中国知网数据库、The Cochrane Library、PubMed、Embase, 用Revman 5.3软件对于所筛选的文献进行Meta分析, 以95%可信区间估计.
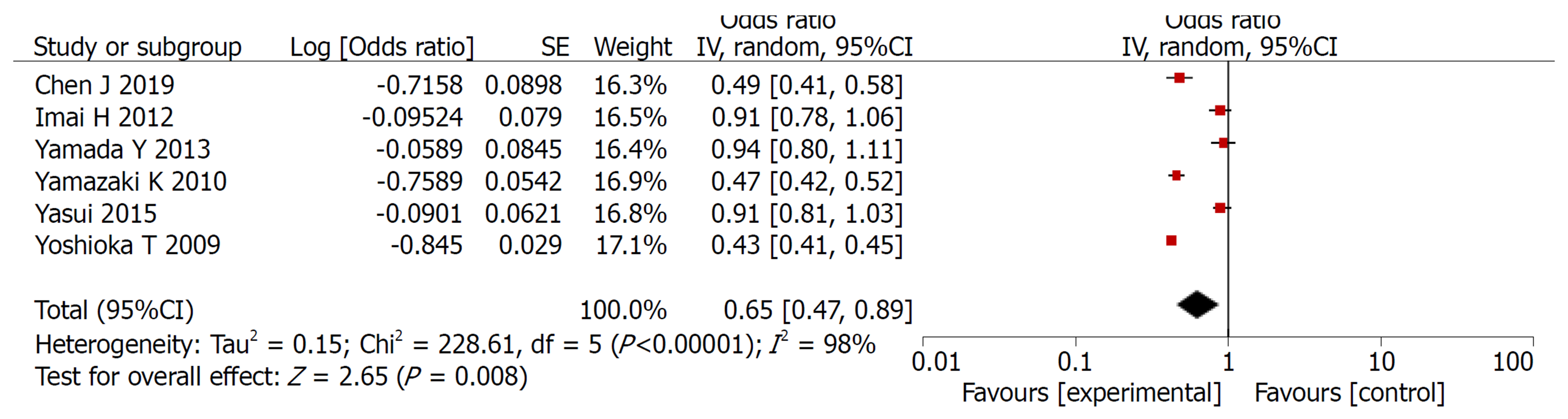
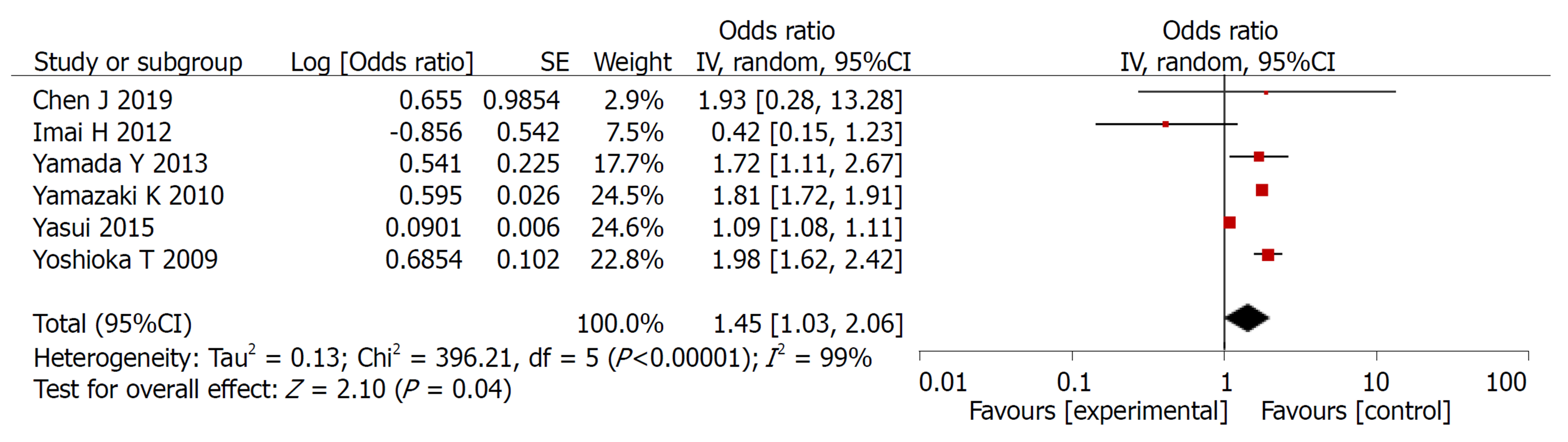
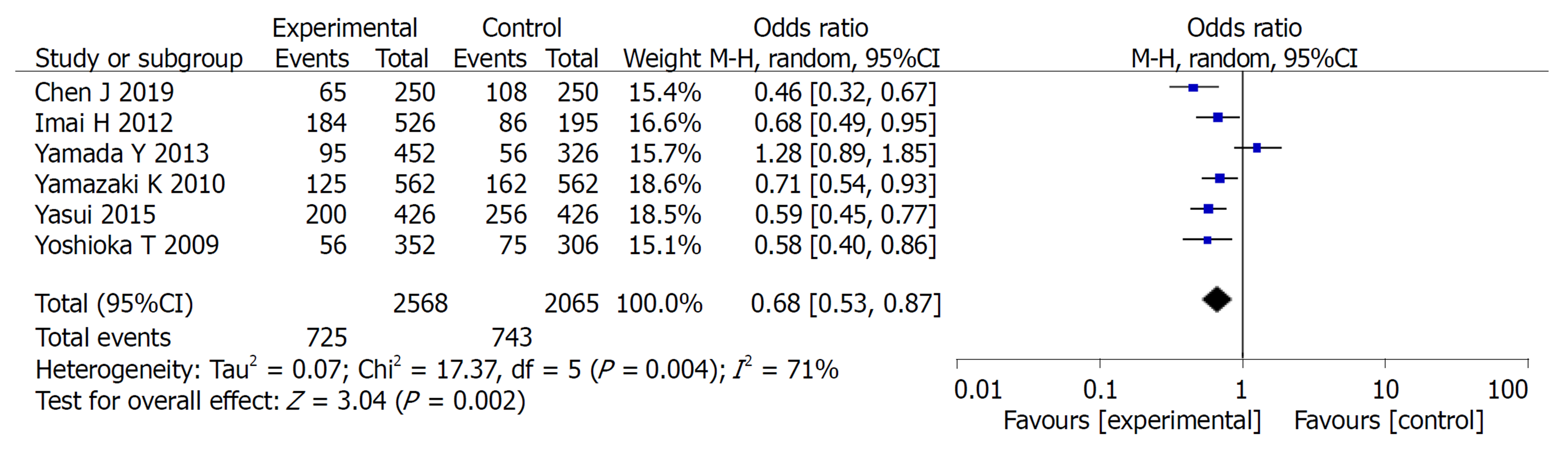
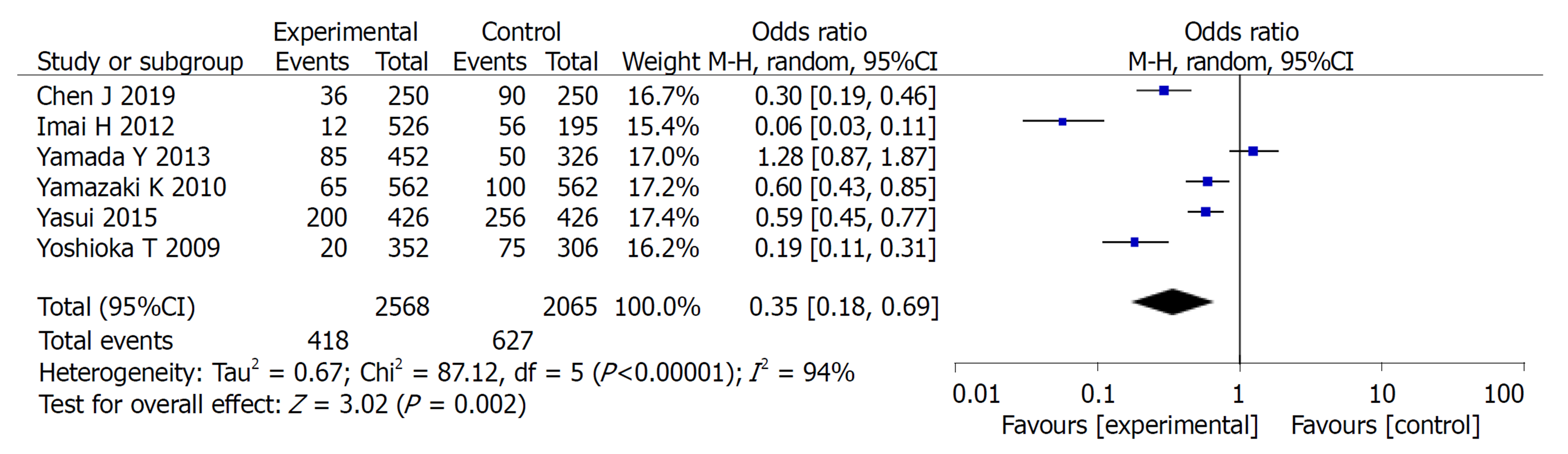
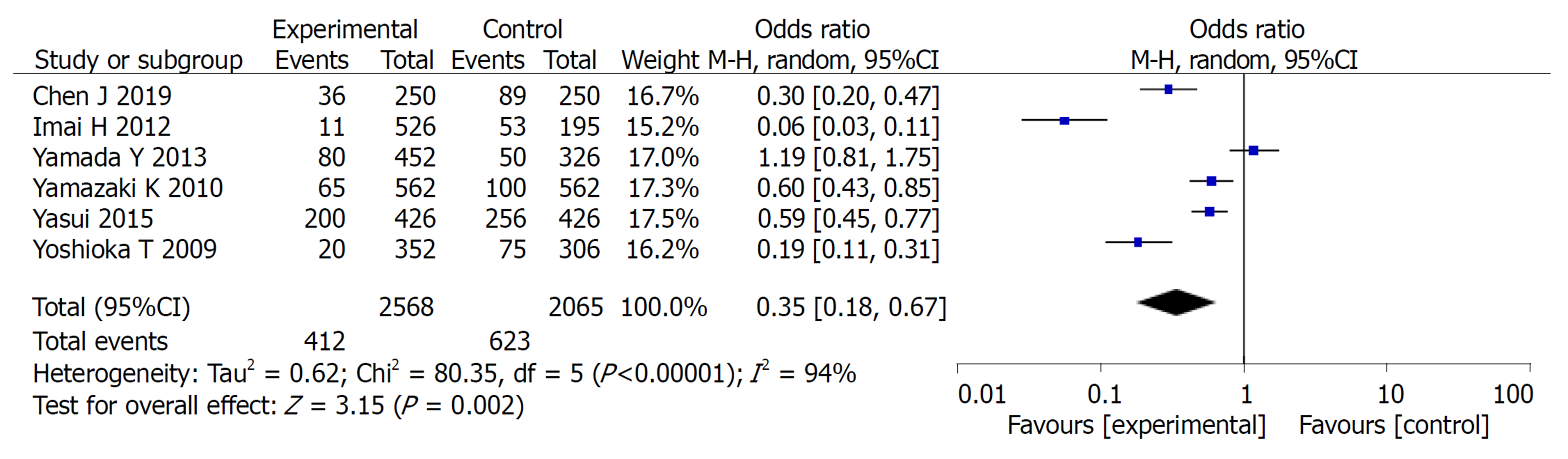
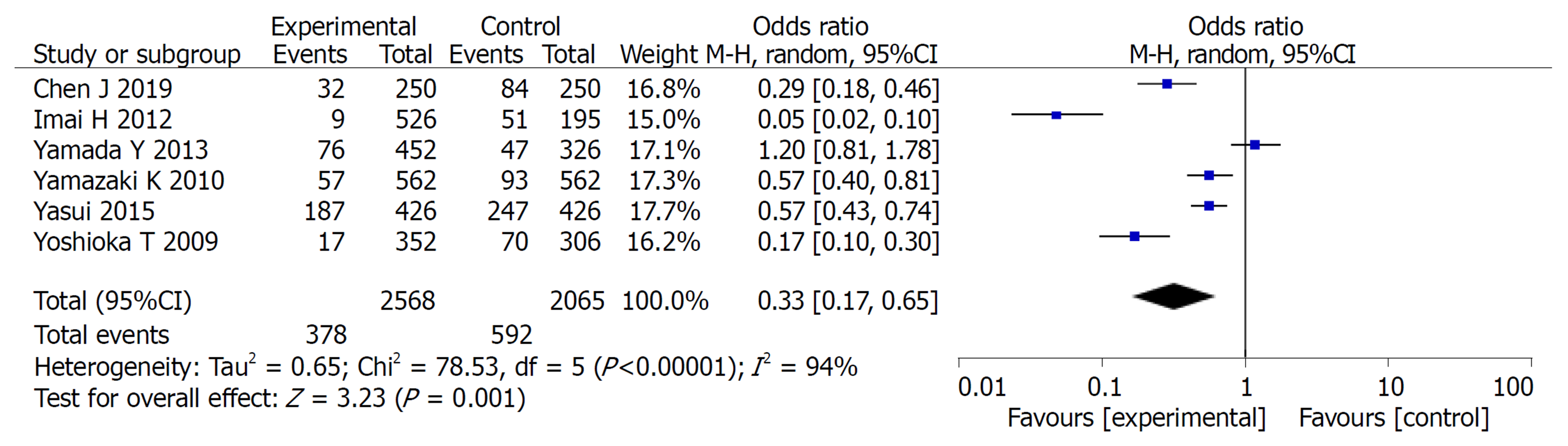
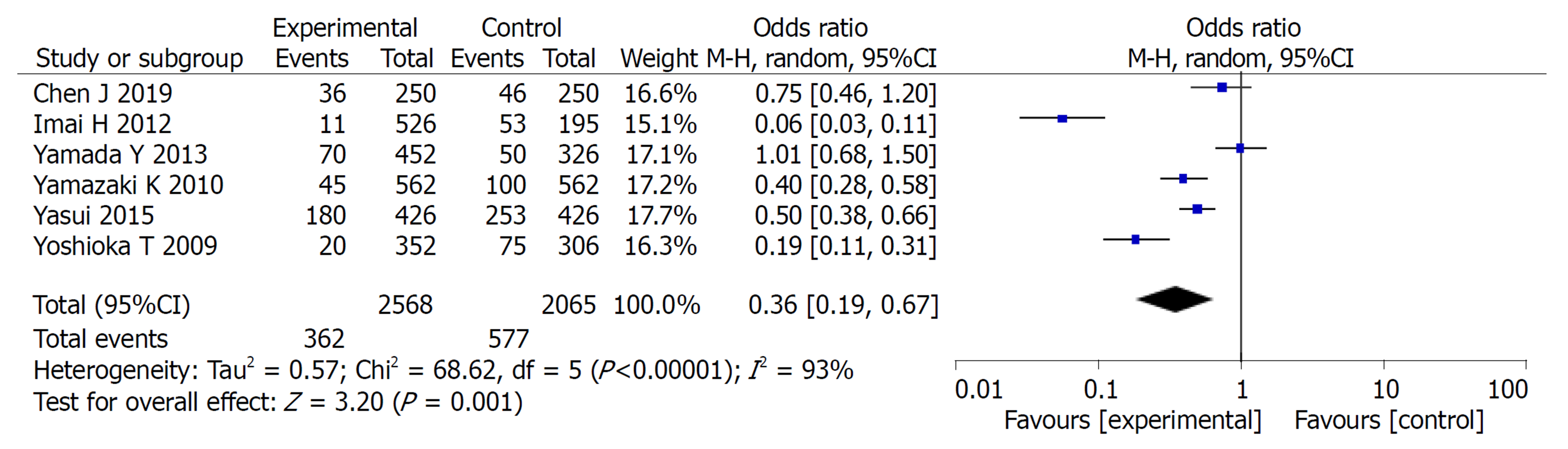
Meta分析结果表明: 实验组患者在3年总生存率和3年无瘤生存率方面的生存率高于对照组, 差异有统计学意义(OR = 0.65, 95%CI: 0.47, 0.89, P = 0.008)、(OR = 1.45, 95%CI: 1.03, 2.06, P = 0.04). 实验组患者在总不良反应方面的发生率低于对照组患者, 二者差异有统计学意义(OR = 0.68, 95%CI: 0.53, 0.87, P = 0.002), 在骨髓抑制、脱发、恶心呕吐、皮肤反应发生率均低于对照组, 二者差异有统计学意义(P<0.05).
口服S-1方案较静脉注射FOLFOX4/FOLFIR方案治疗mCRC的效果好且不良反应少、安全性较高.
核心提要: 近年来, 有研究发现口服S-1方案较静脉注射FOLFOX4/FOLFIRI方案治疗转移性结直肠癌(metastatic colorectal cancer, mCRC)具有比较好的疗效, 但此类研究样本量太少, 目前尚无多中心、双盲、大样本、随机的对照实验的出现且无国内关于此类的随机对照研究和系统性评价. 本研究旨在运用Meta分析的研究方法系统性评价口服S-1方案在治疗mCRC中的治疗效果和安全性, 进而提供循证医学相关的依据.
引文著录: 赵娟娟, 雷鑫明. 口服S-1方案治疗转移性结直肠癌疗效与安全性的Meta分析. 世界华人消化杂志 2019; 27(22): 1375-1382
Revised: October 10, 2019
Accepted: November 12, 2019
Published online: November 28, 2019
In recent years, some studies have found that oral S-1-based regimens are more effective than intravenous FOLFOX4/FOLFIRI regimen in the treatment of metastatic colorectal cancer (mCRC).
To systematically evaluate the clinical efficacy and safety of S-1-based regimens in the treatment of patients with refractory mCRC by meta-analysis, and to provide evidence-based medicine-related evidence.
Controlled trials evaluating S-1-based regimens for the treatment of mCRC from January 2009 to January 2019 were retrieved from VIP database, Wanfang Data, Chinese Biomedical Literature Database, CNKI database, The Cochrane Library, PubMed, and Embase. Meta-analysis of the included studies was conducted with Revman 5.3 software and estimated by odds ratio (OR) and 95% confidence interval (CI).
The results of meta-analysis showed that the 3-year overall survival rate and 3-year recurrence-free survival rate were significantly higher in the study group (OR = 0.65, 95%CI: 0.47-0.89, P = 0.008; OR = 1.45, 95%CI: 1.03-2.06, P = 0.04). The study group had less adverse events than the control group (OR = 0.68, 95%CI: 0.53-0.87, P = 0.002). The incidence of bone marrow suppression, alopecia, nausea and vomiting, and skin reactions in the study group was significantly lower than that in the control group (P < 0.05)
S-1-based regimens have better efficacy and adverse event profile in the treatment of refractory mCRC than FOLFOX4/FOLFIRI regimen.
- Citation: Zhao JJ, Lei XM. Meta-analysis of safety and efficacy of S-1-based regimens in treatment of metastatic colorectal cancer. Shijie Huaren Xiaohua Zazhi 2019; 27(22): 1375-1382
- URL: https://www.wjgnet.com/1009-3079/full/v27/i22/1375.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v27.i22.1375
结直肠癌(colorectal cancer, CRC)在全世界发病率极高, 仅次于肺癌和肝癌, 且新增病例在100万人以上, 死亡率也有逐渐上升的趋势[1]. 这是由于早期CRC并无明确特异性表现, 且人们尚缺乏体检意识, 故众多患者在确诊CRC后已伴有局部或全身转移, 这样就无法通过手术根治CRC[2]. 随着科学、医疗技术的飞速发展, 目前对于CRC的诊疗水平也在不断的提升, 对于转移性结直肠癌(metastatic colorectal cancer, mCRC)的患者来说, 主要的方案为化疗, 其中化疗方案主要以静脉注射FOLFOX4/FOLFIRI方案为代表, 然而疗效往往不尽如人意[3], 近年来, 有研究发现口服S-1方案较静脉注射FOLFOX4/FOLFIRI方案治疗mCRC具有比较好的疗效[4], 但此类研究样本量太少, 目前尚无多中心、双盲、大样本、随机的对照实验的出现且无国内关于此类的随机对照研究和系统性评价. 本研究旨在运用Meta分析的研究方法系统性评价口服S-1方案在治疗mCRC中的治疗效果和安全性, 进而提供循证医学相关的依据[5].
纳入标准: (1)所选择的研究对象必须有影像学检查, 且通过手术病理标本或肠镜病理标本, 确诊为CRC, 且必须为初诊患者; (2)所选择的研究对象必须远处转移无法手术; (3)所选择对象需排除其它治疗方式; 排除标准: (1)动物实验; (2)以往接受过手术治疗且不存在远处转移的患者; (3)非初诊或者非原发性CRC的患者; (4)随访时间过短, 失访率过高且观察指标过少, 样本量过小的研究对象.
检索国内外公开数据库, 检索时间范围为2009-01/2019-01, 检索词主要为: "S-1"、"结直肠癌"、"metastatic colorectal cancer". 检索员为2人, 检索的数据库主要包括: 中文数据库中国知网数据库、维普数据库、万方数据库、中国生物医学文献数据库, 国外数据库PubMed、The Cochrane Library、Embase. 检索语种主要为英文和中文, 且必须为随机对照实验. 将所选择的文献多次选择直至选出最佳的文献. 干预方法: 含口服S-1组为试验组; 静脉注射FOLFOX4/FOLFIRI组为对照组; 一般资料方面如: 性别、病理类型、年龄等方面差异无统计学意义(P>0.05)且两组患者具有可比性. 结局指标: 3年总生存率, 3年无瘤生存率, 不良反应(骨髓抑制、脱发、恶心呕吐、皮肤反应等)发生率.
相关文献评价: 以Cochrane系统评价手册为文献评价标准[6], 由2名研究者对选中的文献进行筛选和评价并相互核对, 对于结论不一致的文献, 通过征求第三方、文献作者的意见的方式得出最终结论. 评价标准主要包括6个方面: (1)随机方法是否正确; (2)是否做到分配隐藏, 分配方法是否正确; (3)是否实施盲法; (4)是否报告失访和退出情况; (5)基线是否可比; (6)是否存在其他影响真实性的因素.
统计学处理 用RevMan 5.3进行Meta分析. 采用OR值及其95%CI描述, 用I2表示其异质性, 当I2<50%, P>0.1时, 则提示各研究之间异质性较低或者异质性不存在, 此时Meta分析采用固定效应模型. 然而当I2≥50%, P≤0.1时, 则提示异质性较高, 此时Meta分析采用随机效应模型, 最终运用漏斗图进行偏倚评价.
在所有文献数据库中输入以上关键词, 得出总文献312篇, 剔除重复文献, 会议记录等得到文献19篇, 并筛选文章标题、摘要及全文内容后最终得到6篇文献[7-12]. 其中均为随机对照实验文献, 均为A级, 各文献质量评价见表1, 各文献中患者基本情况见表2, 具体搜索过程详见流程图(图1).
| 作者 | 治疗方法 | 每组人数(人) | 平均年龄(岁) | 随访时间(月) | 并发症人数(人) | 3年总生存率(%) | 3年无瘤生存率(%) |
| Yasui等[7] | S-1组 | 426 | 37(21-69) | 50 | 200 | 48 | 39 |
| FOLFOX4/FOLFIRI组 | 426 | 63(32-94) | 51 | 256 | 23 | 15 | |
| Chen等[8] | S-1组 | 250 | 56(34-85) | 33±15 | 65 | 47 | 39 |
| FOLFOX4/FOLFIRI组 | 250 | 53(26-76) | 45±15 | 108 | 43 | 22 | |
| Imai等[9] | S-1组 | 526 | 66(35-96) | 45±13 | 184 | 67 | 45 |
| FOLFOX4/FOLFIRI组 | 195 | 59(29-84) | 44±19 | 86 | 43 | 20 | |
| Yamada等[10] | S-1组 | 452 | 63(36-96) | 34 | 95 | 56 | 31 |
| FOLFOX4/FOLFIRI组 | 326 | 53(31-85) | 44 | 56 | 39 | 18 | |
| Yamazaki等[11] | S-1组 | 562 | 52(30-85) | 38.3 | 125 | 52 | 29 |
| FOLFOX4/FOLFIRI组 | 562 | 57(28-95) | 47.5 | 162 | 30 | 13 | |
| Yoshioka等[12] | S-1组 | 352 | 56(33-79) | 52.5 | 56 | 56 | 42 |
| FOLFOX4/FOLFIRI组 | 306 | 59(29-84) | 46.5 | 75 | 35 | 21 |
2.2.1 3年总生存率: 共纳入6篇文献, 对实验组和对照组组间异质性检测得出P<0.00001, I2 = 98%, 存在异质性, 则用随机效应模型进行Meta分析, 结果显示OR = 0.65, 95%CI: 0.47, 0.89, P =0.008, 两组差异有统计学意义(P<0.05)(图2).
2.2.2 3年无瘤生存率: 共纳入6篇文献, 对实验组和对照组组间异质性检测得出P<0.00001, I2 = 99%, 存在异质性, 则用随机效应模型进行Meta分析, 结果显示(OR = 1.45, 95%CI: 1.03-2.06, P = 0.04)两组差异有统计学意义(P<0.05)(图3).
2.2.3 不良反应: 共纳入6篇文献, 对实验组和对照组组间异质性检测得出P = 0.004, I2 = 71%, 存在异质性, 则用随机效应模型进行Meta分析, 结果显示OR = 0.68, 95%CI: 0.53, 0.87, P =0.002, 两组差异有统计学意义(P<0.05). 常见的不良反应主要包括: 骨髓抑制、脱发、恶心呕吐、皮肤反应. Meta分析提示: 实验组中以上不良反应的发生率均低于对照组, 两组差异均有统计学意义(P<0.05)(图4-8).
早期CRC并无明确特异性表现, 仅仅表现为排便习惯改变, 或者粪便隐血试验阳性, 且人们尚缺乏体检意识, 故众多患者在确诊CRC后已伴有局部或全身转移, 已经处于晚期, 对于mCRC的患者来说, 主要的方案为化疗, 其中化疗方案主要以静脉注射FOLFOX4/FOLFIRI方案为代表, 然而疗效往往不尽如人意[13,14].
S-1作为一种口服的氟嘧啶制剂, 是一种由替加氟、吉美嘧啶、氧嗪酸钾组成的复合制剂, 其合成比例为1:0.4:1. 目前S-1在国内外应用都非常广泛, 尤其是对于处于进展期、晚期的胃癌, 肺癌, 以及胰腺癌的患者疗效尚佳, 美国FDA和EMA已批准新型口服S-1制剂应用于mCRC患者的治疗, 仍有大量的相关研究正在进展当中[15].
已有多项研究证实S-1治疗mCRC具有较好的疗效. 在日本进行的一项临床研究发现, 运用S-1治疗mCRC的患者的中位生存期较运用FOLFOX4的中位生存期长, 此外, 在欧洲进行的另一项研究结果表明, 实验组S-1患者中位生存期为17.8 mo, 而对照组FOLFOX4患者的中位生存期为17.4 mo, 两者差异具有统计学意义(HR = 0.90, 95%CI: 0.728, 1.112, P = 0.001), 在一项有关S-1的Ⅰ期中, 研究者将实验组CRC的患者用口服S-1方案治疗, 对照组用FOLFIRI静脉注射治疗, 并观察两组患者的疾病控制率、无进展生存期, 结果发现实验组患者的疾病控制率为73%, 中位无进展生存时间(progression-free survival, PFS)为7.56 mo, 明显长于单纯FOLFIRI治疗晚期CRC的患者(HR = 0.80, 95%CI: 2.63-9.60, P = 0.003)[16-19]. 一项Ⅲ期一线临床试验的研究共收集1226例mCRC患者入组, 按照随机抽签分组的方法把符合入选标准的患者分别分配至试验组(口服S-1方案治疗)和对照组(FOLFOX4患者)中, 研究结果发现, 实验组中位OS、PFS相比于对照组中位OS、PFS明显延长(14.51 mo: 12.01 mo; HR = 0.807, 95%CI: 0.731-0.957, P = 0.002; 6.81 mo: 4.53 mo; HR = 0.745, 95%CI: 0.662-0.870, P<0.0001). 且实验组的肿瘤总缓解率较对照组明显提高(17.8%: 9.1%, P<0.001)[20]. 但目前国内关于此药物的疗效及安全性研究仍然较少, 本研究在国内外研究的基础上进行Meta分析, 进而提供循证医学相关的依据[21].
本研究共纳入6篇文献, Meta分析结果表明: 在3年总生存率和3年无瘤生存率方面, 实验组患者的生存率高于对照组, 差异有统计学意义(P<0.05). 在不良反应方面, 实验组患者发生率低于对照组患者, 二者差异有统计学意义(P<0.05). 笔者认为可能存在多种因素影响口服S-1方案的疗效, 有研究认为, S-1主要通过调节细胞色素P4502 A6(CYP2 A6)进而抑制肿瘤细胞的复制, 进而促进其凋亡, 从而提高患者的远期生存率[22]. 然而, 该研究对于S-1对于P4502 A6调控的机制尚未阐明, 故需要更进一步的研究. 另一种研究认为可能与化疗药物的剂量相关, 临床上应用口服S-1方案的治疗剂量为40 mg/mL每日两次, 较单纯使用FOLFOX4方案的剂量更佳, 故治疗效果较好, 但具体的机制仍然需要进一步的研究[23].
然而, 本研究也存在以下不足: (1)但由于此次研究文献数目少, 且总的样本量仅有2000例左右, 对结果的偏倚可能较大; (2)纳入的文献主要来源于欧洲; (3)纳入的每项研究中无法从获得每个患者的精确数据; (4)部分研究存在较大的异质性.
综上所述, 口服S-1对于mCRC的治疗具有良好的疗效和较高的安全性. 因此希望将来有更多的希望将来有更多的多中心、双盲、大样本、随机的对照研究出现, 为临床医师提供重要指导[24].
对于转移性结直肠癌(metastatic colorectal cancer, mCRC)的患者来说, 目前主要的方案为化疗, 其中化疗方案主要以静脉注射FOLFOX4/FOLFIRI方案为代表, 然而疗效往往不尽如人意, 近年来, 有研究发现口服S-1方案较静脉注射FOLFOX4/FOLFIRI方案治疗mCRC具有比较好的疗效, 但此类研究样本量太少, 目前尚无多中心、双盲、大样本、随机的对照实验的出现且无国内关于此类的随机对照研究和系统性评价.
本研究旨在运用Meta分析的研究方法系统性评价口服S-1方案在治疗mCRC中的治疗效果和安全性, 进而提供循证医学相关的依据.
本研究主要的目标在于通过搜集国内外大量文献, 口服S-1方案在治疗mCRC中的治疗效果和安全性比较进行Meta分析, 进而提供循证医学相关的依据. 进而对于临床医师在治疗结肠癌肺转移的患者上提供重要的参考.
检索口服S-1方案治疗mCRC的对照试验, 时间范围2009-01/2019-01, 以Cochrane系统评价手册内的质量评价标准进行筛选和评价, 用Revman 5.3软件进行系统Meta分析. 对于二分类变量而言, 采用OR值及其95%CI描述, 采用χ2检验检验各研究间异质性, 运用漏斗图进行偏倚评价.
Meta分析结果表明: 实验组患者在3年总生存率和3年无瘤生存率方面的生存率高于对照组, 差异有统计学意义(OR = 0.65, 95%CI: 0.47, 0.89, P = 0.008)、(OR = 1.45, 95%CI: 1.03, 2.06, P = 0.04). 实验组患者在总不良反应方面的发生率低于对照组患者, 二者差异有统计学意义(OR = 0.68, 95%CI: 0.53, 0.87, P = 0.002), 在骨髓抑制、脱发、恶心呕吐、皮肤反应发生率均低于对照组, 二者差异有统计学意义(P<0.05).基本达到实验目标.
口服S-1方案较静脉注射FOLFOX4/FOLFIR方案治疗mCRC的效果好且不良反应少、安全性较高.
此次研究纳入的文献数目仍较少,且无法对每一篇文献进行进一步的亚组分析, 因此希望将来有更多关于SBRT治疗结肠癌肺转移的双盲、多中心、随机、大样本的对照实验的出现.
学科分类: 胃肠病学和肝病学
手稿来源地: 浙江省
同行评议报告分类
A级 (优秀): 0
B级 (非常好): 0
C级 (良好): C
D级 (一般): D, D
E级 (差): 0
编辑: 王禹乔 电编:刘继红
| 1. | Okamura S, Murata K, Wada Y, Kato R, Makino S, Ohwada Y, Nishigaki T, Murakami M, Okada K, Yanagisawa T, Ebisui C, Yokouchi H, Kinuta M. [A case of peritoneal dissemination that exhibited a complete response to systemic chemotherapy following the resection of primary colon cancer]. Gan To Kagaku Ryoho. 2012;39:2270-2272. [PubMed] |
| 2. | Hong L, Guo Z, Yu H, Li B, Si T, Liu C. [Efficacy and safety of low-dose high intensity focused ultrasound combined with S-1 and oxaliplatin in metastatic colorectal patients with pelvic masses]. Zhonghua Yi Xue Za Zhi. 2014;94:1929-1932. [PubMed] |
| 3. | Harada K, Hatanaka K, Kinoshita K, Kawamoto Y, Yamato H, Ogawa K, Yamamoto Y, Naruse H. [Successful treatment of advanced sigmoid colon cancer with liver metastases with cetuximab monotherapy as first-line treatment-a case report]. Gan To Kagaku Ryoho. 2014;41:897-900. [PubMed] |
| 4. | Baba H, Yamada Y, Takahari D, Matsumoto H, Yoshida K, Nakamura M, Yoshida M, Iwamoto S, Shimada K, Komatsu Y, Sasaki Y, Satoh T, Takahashi K, Mishima H, Muro K, Watanabe M, Sakata Y, Morita S, Shimada Y, Sugihara K. S-1 and oxaliplatin (SOX) plus bevacizumab versus mFOLFOX6 plus bevacizumab as first-line treatment for patients with metastatic colorectal cancer: updated overall survival analyses of the open-label, non-inferiority, randomised phase III: SOFT study. ESMO Open. 2017;2:e000135. [PubMed] [DOI] |
| 5. | Koyama R, Maeda Y, Minagawa N, Shinohara T, Hamada T. Laparoscopic Resection of an Abdominal Wall Metastasis 5 Years after Primary Colorectal Cancer Resection. Case Rep Gastroenterol. 2019;13:78-84. [PubMed] [DOI] |
| 6. | Hsu HC, Chou WC, Kuan FC, Lee KD, Rau KM, Huang JS, Yang TS. A Phase II study of S-1 plus oral leucovorin in heavily treated metastatic colorectal cancer patients. Cancer Manag Res. 2018;10:6061-6070. [PubMed] [DOI] |
| 7. | Yasui H, Muro K, Shimada Y, Tsuji A, Sameshima S, Baba H, Satoh T, Denda T, Ina K, Nishina T, Yamaguchi K, Esaki T, Tokunaga S, Kuwano H, Boku N, Komatsu Y, Watanabe M, Hyodo I, Morita S, Sugihara K. A phase 3 non-inferiority study of 5-FU/l-leucovorin/irinotecan (FOLFIRI) versus irinotecan/S-1 (IRIS) as second-line chemotherapy for metastatic colorectal cancer: updated results of the FIRIS study. J Cancer Res Clin Oncol. 2015;141:153-160. [PubMed] [DOI] |
| 8. | Chen J, Wang J. Efficacy and safety assessment of S-1-based regimens comparing to intravenous fluorouracil-based ones in Asian patients with metastatic colorectal carcinoma: A system review and meta-analysis. Medicine (Baltimore). 2019;98:e15999. [PubMed] [DOI] |
| 9. | Imai H, Sawada K, Sato A, Nishi K, Sasaki T, Takahashi T, Ohori H. [Complete resection of liver metastases of colorectal cancer after high efficacy bevacizumab, S-1, and CPT -11 combination chemotherapy]. Gan To Kagaku Ryoho. 2015;42:101-104. [PubMed] |
| 10. | Yamada Y, Denda T, Gamoh M, Iwanaga I, Yuki S, Shimodaira H, Nakamura M, Yamaguchi T, Ohori H, Kobayashi K, Tsuda M, Kobayashi Y, Miyamoto Y, Kotake M, Shimada K, Sato A, Morita S, Takahashi S, Komatsu Y, Ishioka C. S-1 and irinotecan plus bevacizumab versus mFOLFOX6 or CapeOX plus bevacizumab as first-line treatment in patients with metastatic colorectal cancer (TRICOLORE): a randomized, open-label, phase III, noninferiority trial. Ann Oncol. 2018;29:624-631. [PubMed] [DOI] |
| 11. | Yamazaki K, Kuwano H, Ojima H, Otsuji T, Kato T, Shimada K, Hyodo I, Nishina T, Shirao K, Esaki T, Ohishi T, Denda T, Takeuchi M, Boku N. A randomized phase II study of combination therapy with S-1, oral leucovorin, and oxaliplatin (SOL) and mFOLFOX6 in patients with previously untreated metastatic colorectal cancer. Cancer Chemother Pharmacol. 2015;75:569-577. [PubMed] [DOI] |
| 12. | Yoshioka T, Kato S, Gamoh M, Chiba N, Suzuki T, Sakayori N, Kato S, Shibata H, Shimodaira H, Otsuka K, Kakudo Y, Takahashi S, Ishioka C. Phase I/II study of sequential therapy with irinotecan and S-1 for metastatic colorectal cancer. Br J Cancer. 2009;101:1972-1977. [PubMed] [DOI] |
| 13. | Tominaga K, Kurumiya Y, Sekoguchi E, Kobayashi S, Kawai K, Kiriyama M. [Severe Liver Injury Due to Sinusoidal Obstruction Syndrome Induced by Oxaliplatin in a Patient with Resectable Colorectal Liver Metastases]. Gan To Kagaku Ryoho. 2018;45:989-992. [PubMed] |
| 14. | Papadopoulos N, Martin J, Ruan Q, Rafique A, Rosconi MP, Shi E, Pyles EA, Yancopoulos GD, Stahl N, Wiegand SJ. Binding and neutralization of vascular endothelial growth factor (VEGF) and related ligands by VEGF Trap, ranibizumab and bevacizumab. Angiogenesis. 2012;15:171-185. [PubMed] [DOI] |
| 15. | Nagase S, Iyoda T, Kanno H, Akase T, Arakawa I, Inoue T, Uetsuka Y. [Comparison of the Cost-Effectiveness of the SOX and COX Regimens in Patients with Unresectable Advanced and Recurrent Colorectal Cancer Using a Clinical Decision Analysis Approach]. Gan To Kagaku Ryoho. 2016;43:1201-1205. [PubMed] |
| 16. | Yoshida M, Takagane A, Miyake Y, Shimada K, Nagata N, Sato A, Ogata Y, Fukunaga M, Otsuka K, Takahashi T, Matsumoto H, Kagimura T, Tsuji A. A Phase II Study of Third-Line Combination Chemotherapy with Bevacizumab Plus S-1 for Metastatic Colorectal Cancer with Mutated KRAS (SAVIOR Study). Oncology. 2016;91:24-30. [PubMed] [DOI] |
| 17. | Bai M, Deng T, Han R, Zhou L, Ba Y. Gemcitabine plus S-1 versus cetuximab as a third-line therapy in metastatic colorectal cancer: an observational trial. Int J Clin Exp Med. 2015;8:21159-21165. [PubMed] |
| 18. | Yoshida M, Muro K, Tsuji A, Hamamoto Y, Yoshino T, Yoshida K, Shirao K, Miyata Y, Takahari D, Takahashi T, Ohtsu A. Combination chemotherapy with bevacizumab and S-1 for elderly patients with metastatic colorectal cancer (BASIC trial). Eur J Cancer. 2015;51:935-941. [PubMed] [DOI] |
| 19. | Imagawa A, Okumura S, Toyoda S, Kawashima H, Yasuda H, Yamamoto K, Ito A, Mizumura N, Yoo K, Maehira H, Ogawa M, Kawasaki M, Kameyama M, Yoneda G. [A Case of Metastatic Carcinoma of Anal Fistula]. Gan To Kagaku Ryoho. 2018;45:148-150. [PubMed] |
| 20. | Kawahara T, Shimozuma K, Shiroiwa T, Hagiwara Y, Uemura Y, Watanabe T, Taira N, Fukuda T, Ohashi Y, Mukai H. Patient-Reported Outcome Results from the Open-Label Randomized Phase III SELECT BC Trial Evaluating First-Line S-1 Therapy for Metastatic Breast Cancer. Oncology. 2018;94:107-115. [PubMed] [DOI] |
| 21. | Shitara K, Yuki S, Yoshida M, Takahari D, Utsunomiya S, Yokota T, Sato Y, Inaba Y, Tajika M, Kawai H, Yamaura H, Kato M, Yamazaki K, Komatsu Y, Muro K. Phase II study of combination chemotherapy with biweekly cetuximab and irinotecan for wild-type KRAS metastatic colorectal cancer refractory to irinotecan, oxaliplatin, and fluoropyrimidines. Invest New Drugs. 2012;30:787-793. [PubMed] [DOI] |
| 22. | Matsuda Y, Saoo K, Yamakawa K, Yokohira M, Suzuki S, Kuno T, Kamataki T, Imaida K. Overexpression of CYP2A6 in human colorectal tumors. Cancer Sci. 2007;98:1582-1585. [PubMed] [DOI] |
| 23. | Boku N, Yamamoto S, Fukuda H, Shirao K, Doi T, Sawaki A, Koizumi W, Saito H, Yamaguchi K, Takiuchi H, Nasu J, Ohtsu A; Gastrointestinal Oncology Study Group of the Japan Clinical Oncology Group. Fluorouracil versus combination of irinotecan plus cisplatin versus S-1 in metastatic gastric cancer: a randomised phase 3 study. Lancet Oncol. 2009;10:1063-1069. [PubMed] [DOI] |
| 24. | Molina-Garrido MJ, Guillén-Ponce C. Letter to the editor: "Phase II trial of S-1 monotherapy in elderly or frail patients with metastatic colorectal cancer". Invest New Drugs. 2011;29:1515-1516. [PubMed] [DOI] |