修回日期: 2019-09-26
接受日期: 2019-10-16
在线出版日期: 2019-11-08
细胞信号转导是指信号分子通过刺激胞膜或者胞内受体, 引起细胞内发生信号转导, 从而影响细胞生物学功能的过程. 近年来研究发现, 某些细胞信号转导通路的激活或者抑制在肝癌(hepatocellular carcinoma, HCC)细胞的发生、发展中起着重要推动作用. 本文将对近年来有关HCC的热门细胞信号转导通路的研究进行综述.
核心提要: 近年来, 肝癌(hepatocellular carcinoma, HCC)的分子生物学研究取的许多新的成果, 尤其是了发现某些细胞信号转导通路的激活或者抑制在HCC细胞的发生、发展中起着重要推动作用, 本文综述了近年来HCC中信号转导通路的最新研究进展, 探讨其作用机制及与HCC的相关性.
引文著录: 陈椿, 杨哲, 黄赞松. 细胞信号转导通路与肝癌相关性研究进展. 世界华人消化杂志 2019; 27(21): 1330-1338
Revised: September 26, 2019
Accepted: October 16, 2019
Published online: November 8, 2019
Cell signal transduction refers to the process by which a signal molecule induces signal transduction in a cell by stimulating the cell membrane or intracellular receptor, thereby affecting the biological function of the cell. In recent years, studies have found that the activation or inhibition of certain cell signal transduction pathways plays an important role in the development and progression of hepatocellular carcinoma. This article will review the recent research progress in the understanding of the role of some common signal transduction pathways in hepatocellular carcinoma.
- Citation: Chen C, Yang Z, Huang ZS. Progress in research on association between cell signal transduction pathways and hepatocellular carcinoma. Shijie Huaren Xiaohua Zazhi 2019; 27(21): 1330-1338
- URL: https://www.wjgnet.com/1009-3079/full/v27/i21/1330.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v27.i21.1330
原发性肝癌(hepatocellular carcinoma, HCC)简称肝癌, 是全球导致死亡的第二大癌症, 据统计, 2015年全球HCC新发病例85.4万, 其中我国新发HCC病例数37万, 居全国恶性肿瘤发病数第4位, 发病率为26.92/10万, 其中男性发病率大于女性发病率[1,2]. 由于HCC发病隐匿, 早期无明显症状, 大多数HCC患者就诊时已发展至晚期, 虽然目前现有的治疗手段包括手术、介入、放疗、化疗在一定程度下能延缓HCC的发生、发展[3], 但往往疗效较差, 且预后不佳, 严重影响了国民身体健康以及加重国家经济负担. 目前已知, 在各种致癌因素作用下(如乙肝病毒、酒精、黄曲霉素、遗传因素等), HCC的发生呈现为肝细胞损伤、变性、纤维化, 进而癌变的多阶段复杂过程. 从分子生物学的角度看, HCC是正常细胞转化为变异的、细胞增殖失控和具有侵袭性的恶性肿瘤细胞, 或者是原癌基因激活与抑癌基因异常表达共同作用的最终结果[4]. 近年来研究表明[5-7], 信号转导通路可以通过调控原癌基因和抑癌基因表达, 影响细胞增殖周期、肿瘤血管生成、促进细胞凋亡等多个方面在HCC中发挥作用. 故探讨HCC细胞中细胞信号转导通路作用机制, 将对HCC的预防及治疗具有重要意义, 本文将对近年来有关HCC的细胞信号转导通路的研究做一综述.
丝裂原活化蛋白激酶(mitogen-activated protein kinase, MAPK)信号转导通路, 普遍存在于真核细胞内, 主要介导细胞外刺激信号, 如细胞因子、神经递质、激素等从细胞表面传导到细胞核内部, 与细胞的增殖、凋亡、自噬等生理过程密切相关, 是生物体内重要的信号转导通路之一.
目前在哺乳动物细胞中发现的MAPK信号转导通路主要有5条: 细胞外信号调节蛋白激酶(extrlacelular signal regulated protein kinase1/2, ERK1/2)、Jun氨基端激酶(c-Jun N-terminal kinase, JNK)、大丝裂素活化蛋白激酶1(big map kinase 1, BMK1)、p38MAPK(p38 mitogen-activated protein kinase)以及ERK3/4通路[8]. 其中ERK1/2, JNK, p38MAPK这三条信号转导通路研究最多, 有研究[9]表明, 各种HCC致病因素如肝炎病毒、酒精、化学致癌物等能异常激活MAPK信号转导通路, 从而促进HCC的发生、发展、转移以及肿瘤血管形成, 其中ERK信号转导通路主要参与HCC发生、增殖、转移以及肿瘤血管形成, JNK信号转导通路主要参与细胞的增殖、分化、凋亡等过程, p38MAPK信号转导通路主要参与细胞凋亡过程.
该通路激活是RAS/RAF/MEK/ERK信号级联反应的过程, 首先受多种细胞外信号刺激, 属于小分子GTP酶超家族的RAS-GTP直接与RAF结合并将其激活, 活化后的RAF进一步磷酸化MEK, 后者激活ERK1/2, 这一过程将细胞外信号传递到细胞核内, 促使细胞增殖、迁移和微血管形成[10].
目前可以在90%HCC组织中发现RAS/RAF/MEK/ERK信号转导通路被激活的现象[11]. Ras作为一种癌基因, 有研究发现[12]在Ras癌基因诱导的转基因小鼠肝肿瘤组织中, ERK蛋白表达较其他组织明显升高, 提示Ras的活化刺激了ERK信号转导通路. 丝氨酸/苏氨酸蛋白激酶4(serine/threonine protein kinase, STK4)对HCC侵袭、生长及转移具有促进作用, 赵小丽等[13]发现其机制可能是通过激活MAPK信号转导通路中的p-ERK蛋白表达, 进一步促进细胞因子的表达, 从而提高HCC细胞的增殖和侵袭能力.
JNK主要有三种亚型: JNK1, JNK2, JNK3. JNK1和JNK2分布在所有细胞中, 而JNK3主要分布在脑, 心脏和睾丸细胞中[14]. 细胞因子、生长因子、物理、化学应激等多种因素刺激作用下, 顺序激活MAP3K, MKK4和MKK7, 然后磷酸化JNK, 活化的JNK使c-JUN, ATF2, P53等转录因子磷酸化, 诱导形成转录因子激活蛋白-1(activator protein-1, AP-1), 进而调控细胞增殖、分化、调亡[15].
蒙丽恒等[16]研究发现晚期糖基化终末产物与其受体结合能激活JNK信号转导通路, 并在2型糖尿病合并HCC患者的癌组织中发现MKK7, JNK1高表达, 提示JNK信号转导通路的激活可能促进2型糖尿病患者HCC的发生、发展. 同时还有研究[17]发现在31例HCC样本中, 有55%活化的JNK1表达水平增高, 且与肿瘤大小、包膜有关, 提示JNK1活化促进HCC细胞增殖.
p38 MAPK家族有4个亚型p38α, p38β, p38γ和p38δ, 其中p38α最常见. 多种细胞因子和环境应激可激活并诱导p38 MAPK中酪氨酸和苏氨酸位点双磷酸化, 活化的p38 MAPK进入细胞核调节转录因子的活性.
除了在应激反应中的作用, 最近的研究[18]表明p38 MAPK还在介导细胞凋亡和生长抑制信号的通路中发挥作用. 孟燕等[19]研究发现, 在HCC中存在缺氧微环境, 适应缺氧成为HCC发生发展的重要过程. 在缺氧条件下, HCC细胞会通过下调p38 MAPK mRNA及p38 MAPK, P-p38MAPK蛋白的表达从而抑制细胞凋亡, 即通过抑制p38 MAPK信号转导通路抑制HCC细胞的凋亡. Song等[20]发现多环芳香烃能促进HCC HepG2细胞miRNA-181的表达, 抑制p38 MAPK信号转导通路, 从而抑制癌细胞的凋亡, 促进HCC的持续增殖. 上述研究都从反向证明了p38 MAPK信号转导通路的激活会促进HCC的凋亡.
Hippo信号转导通路是首先在果蝇体内中发现的一条高度保守的信号转导通路, 以果蝇激酶Hippo命名, 其核心分子包括Hpo、Sav、Wts、Mats, 在人类细胞中有对应的同源类似物, 分别为哺乳动物STE20蛋白激酶家族1/2(MST1/2)、萨尔瓦多家族1(SAVl)、大肿瘤抑制基因1/2激酶(LATSl/2)和MOB激酶激活物1A/1B(MOB1A/1B). 转录共激活因子相关蛋白(yes-associated protein, YAP)是Hippo信号转导通路下游效应分子, 被认为是一种癌基因[21]. 当YAP处于活性状态时, 它们转移到细胞核内结合TEAD转录因子家族, 诱导多种参与细胞增殖、生存和迁移的基因表达, 如CylinDl、cyclinE及CTGF等[22,23].
Wu等[24]研究发现, YAP表达与HBV阳性HCC样本中的乙型肝炎病毒X蛋白(hepatitis B virus X protein, HBX)表达呈正相关, 提示HBX能促进YAP转录和表达, 这可能是乙型肝炎致癌机制之一. Wu等[25]研究发现, 肝胆管癌YAP阳性表达率比肝细胞癌高, 高YAP表达与肿瘤大小、肝硬化、血管侵犯、肝内转移有密切联系. Li等[26]研究发现, YAP阴性的HCC患者行肝移植术后的无病生存率显著高于YAP阳性的, 且分析发现YAP是HCC肝移植术后肿瘤复发的独立预后指标.
Hippo信号转导通路核心作用就是让YAP失活, 当MST1/2在SAVl和MOB1A/1B辅助下依次磷酸化LATS1/2时, 活化的LATS1/2能抑制YAP进入细胞核内发挥作用. Wang等[27]发现HCC组织中YAP水平与LATS1水平呈负相关, 且与正常组织相比, HCC组织中表达的 YAP水平显著升高, 提示YAP活性下降进一步促进HCC形成. Lu等[28]研究发现, MST1/2功能均失活的突变小鼠肝脏进行性增大, 长期监测可发现多个肿瘤病灶, 在了Savl功能失活的小鼠上也出现类似的结果, 证明了MST1/2要靠Savl介导才可以活化, 而且肝细胞的恶性增殖与MST1/2和 Savl失活有关.
Notch信号转导通路与肝脏发育、损伤修复、纤维化密切相关, 在慢性损伤作用下, 促进病理性修复过程, 导致肝纤维化、结构破坏和HCC发生[29].
人类Notch信号转导通路由受体(Notch1-4)、配体(Jag1、2, DLL1、3、4)、细胞内效应分子(CSL-DNA结合蛋白)组成. 经典的Notch信号通路激活途径由两个相邻细胞的Notch受体与配体相互作用而激活, 由γ-分泌酶复合体酶和各种辅助因子裂解释放Notch受体的胞内结构域(the intracellular domain of Notch, ICN)至胞质中, 随后转运到细胞核中与CSL-DNA蛋白的结合使CSL蛋白由转录抑制物转变为转录激活物, 激活靶基因的转录, 发挥其在细胞增殖、分化、凋亡中的重要调节作用[30], 影响多个器官的发育和功能.
同时, Notch信号转导通路在调控HCC的侵袭、转移等方面也发挥重要作用. Banerjee等[31]研究发现, Notch1和Jag-1在HCC组织中的表达明显高于癌旁和正常组织, 且Notch信号转导通路与肿瘤的淋巴结转移、静脉侵犯和肿瘤分化程度密切相关. Sun等[32]研究显示HCC细胞中Notch1突变率比正常组织高, Notch信号转导通路相关分子在超过80%的HCC组织中高表达, 明确了Notch1等相关信号蛋白在HCC早期诊断中的价值. 胡广军等[33]使用Notch信号转导通路阻断剂能显著降低HCC细胞在Transwell小室中迁移侵袭能力, 说明通过阻断Notch信号转导通路能有效抑制HCC细胞的侵袭迁移过程, 其机制可能是通过调节下游相关蛋白的表达抑制HCC细胞的转移和侵袭. 杨永光等[34]发现Notch3在HCC组织中明显高表达, 当沉默HCC QGY7701细胞Notch3表达后, HCC细胞侵袭转移能力明显减弱, 提示Notch3与HCC发生密切相关, 并参与HCC侵袭及转移. 张勇等[35]研究显示HCC患者中Notchl阳性表达率与HCC分化程度、卫星灶、门静脉癌栓、淋巴结转移、AJCC分期呈正相关, 说明Notchl参与了HCC的发展、浸润及转移, 对患者预后生存具有独立预测作用.
Wnt信号转导通路在胚胎形成、细胞增殖、分化和血管生成中起着重要作用. 目前发现的Wnt信号转导通路主要分为经典Wnt途径和非经典Wnt途径, 经典Wnt途径也称为Wnt/β-catenin信号通路, 其中β-连接蛋白(β-catenin)是HCC发生发展转移的关键因子, 由CTNNB1突变基因编码[36]. 当Wnt蛋白与卷曲蛋白(frizzled, FZL)和低密度脂蛋白受体相关蛋白5/6(lipoprotein receptor-related protein 5/6, LRP5/6)结合后, 引起由结肠腺瘤样息肉病蛋白(adenomatous polyosis coli, APC)、糖原合成酶激酶3β(glycogen synthase kinase-3β, GSK-3β)、轴蛋白(axin)组成的GSK3β-APC- Axin蛋白酶体复合物裂解, 导致β-catenin在细胞质内积累并转移至细胞核内, 与cAMP应答元件结合因子结合蛋白(cyclic AMP response element binding factor binding protein, CBP)及T细胞转录因子/淋巴样增强因子(TCF/LEF)结合, 参与下游有关细胞增殖、迁移、细胞周期调控靶基因的转录, 其过表达诱导肿瘤的发生[37]. 相反, 在正常生理情况下, GSK3β-APC- Axin蛋白酶体复合物磷酸化β-catenin并将其降解, 维持细胞内β-catenin稳定.
闪海霞等[38]研究发现β-catenin在HCC细胞的胞浆和细胞核内聚集高表达, 同时其异常表达与HCC是否合并肝硬化、肿瘤大小、术后复发、转移等具有密切联系. 同时, β-catenin高表达也与CTNNB1突变基因有关, 研究[39]发现1/3的HCC中有CTNNB1突变基因, 导致了β-catenin过表达, 促进HCC发生. HCV可以通过诱导miR-155表达激活Wnt信号, 导致β-catenin在核内积聚促进肝细胞增殖, 从而诱导HCC发生[40]. 还有研究[41,42]发现Wnt3蛋白在大多数HCC组织中呈现高表达, 某些miRNAs可通过下调Wnt3表达抑制HCC的增殖和转移, 如miR-1247-5[43]等, 这都提示了Wnt蛋白与HCC发生有关.
但值得注意的是, 不是所有Wnt蛋白家族成员都促进HCC发生发展, 如目前已知的Wnt5a在HCC组织中低表达, 且Wnt3蛋白表达呈负相关[44], 其机制可能通过非经典Wnt信号途径起作用[45], 提示Wnt5a对HCC发生有抑制作用. 同时, APC在体内负性调节β-catenin水平, 对维持β-catenin水平有重要作用, 编码的APC基因在HCC中高度突变. 一项分析显示[46], APC基因启动子甲基化与HCC风险强关联. 另有研究[47,48]指出, 在HCC组织中APC基因启动子高度甲基化, 突变的APC基因无法编码APC蛋白, 致使APC蛋白表达下降, β-catenin水平升高, 诱导HCC发生. 还有研究[49]发现, LncRNA-H19能抑制HCC细胞HepG2的增殖, 促进HepG2细胞凋亡, 其机制可能与抑制Wnt信号通路有关[50]. 综上所述, 研究抑制经典Wnt/β-catenin信号转导通路的靶向药物可以为HCC靶向治疗提供方向.
慢性病毒性肝炎是导致HCC发生的主要病因, 由肝炎演变成HCC的长期慢性炎症过程中, 核转录因子-κB(nuclear factor-kappa B, NF-κB)信号转导通路是促进HCC形成的重要环节.
NF-κB信号转导通路是一条高度保守的进化通路, 首先在黑腹果蝇中发现, 在免疫和炎症反应的调节中起关键性作用, 人NF-κB家族由5个亚基组成: p50、p52、cRel、p65(也称为RelA)和RelB, 分别由NFKB1、NFKB2、REL、RELA和RELB基因编码[51]. 各亚基之间可组合成同源或异源二聚体发挥作用, 其中最常见的NF-κB二聚体是p65与p50组成的异源二聚体[52]. NF-κB抑制因子(inhibitor of kappaB, IκB)是一类NF-κB抑制蛋白, 其家族成员包括IκBα、IκBβ、IκBλ、IκBε、IκBNS、Bcl-3、IκBζ, 在无外界信号激活情况下, IκBα与NF-κB结合, 阻碍其进入细胞核内与DNA结合[53]. 经典NF-κB信号转导通路激活途径在炎症反应中最常见, 在病毒、细菌脂多糖、肿瘤坏死因子(tumor necrosis factor, TNF)和白介素(interleukin, IL)-1等各种炎症因子的刺激下, 激活IκB激酶(IκB kinase, IKK), 活化的IKK将IκB两个丝氨酸残基(Ser32和Ser36)磷酸化, 使其通过泛素酶途径降解, 游离的NF-κB进入细胞核, 激活下游基因转录.
顾星等[54]从鼠肝细胞恶性转化模型中研究发现, 在肝细胞进展到HCC过程中, 该通路关键分子NF-κB和TNFα表达呈进行性增加, 从良性肝病到HCC患者的血清NF-κB、TNFα表达水平显著增加, 其临床病理学特征显示两者表达与HBV感染显著相关, 提示NF-κB通路与HCC发生、发展关系十分密切. 同时, NF-κB信转导号通路不仅参与HCC自身免疫和慢性炎症, 还有HCC转移有关. 基质金属蛋白酶(matrix metallop roteinase, MMPs)是降解细胞外基质的重要物质, 在肿瘤的侵袭转移中起关键作用, Tang等[55]通过实验发现, 14-3-3β蛋白在HCC组织中过表达可激活 NF-κB信号通路, 从而进一步上调MMP-2和MMP-9的表达, 促进HCC的转移, 提示在治疗上可通过抑制NF-κB信号通路激活从而抑制HCC转移. 长期大量饮酒被认为是HCC的重要危险因素, 与HCC的进展和转移有关, 其机制可能与激活NF-κB信号通路, 从而导致血管内皮生长因子(vascular endothelial growth factor, VEGF)、单核细胞趋化蛋白-1(monocyte chemotactic protein-1, MCP-1)过表达, 促进HCC侵犯和转移[56].
VEGF信号转导通路是刺激肿瘤血管生成的重要通路, 首先由Ferrara和Henzel教授在牛垂体滤泡细胞中发现, 目前发现其家族成员包括VEGF-A, VEGF-B, VEGF-C, VEGF-D, VEGF-E和胎盘生长因子(placental growth factor, PLGF). VEGF通过与VEGF受体(VEGF receptor, VEGFR)结合发挥作用, VEGFR属于酪氨酸蛋白激酶家族, 主要包括3种类型: VEGFR-1、VEGFR-2、VEGFR-3. VEGFR-1和VEGFR-2主要表达在血管内皮细胞, 而VEGFR-3主要表达在淋巴细胞内[57].
当HCC迅速生长时, 需要大量的氧气和营养物质供应, 此时肿瘤血管生成不能满足HCC生长需要, 从而形成缺氧的微环境. 缺氧是肿瘤血管生成的关键微环境因子, 缺氧诱导因子(hypoxia inducible factor-1, HIF-1)的同分异构体 HIF-1α和HIF-1β二聚化形成转录因子结合到VEGF基因, 诱导VEGF转录和翻译, 活化的VEGF结合到VEGFR-1和VEGFR-2, 激活多条信号转导通路, 促使细胞增殖和迁移、新生血管形成[58,59]. 杨涛等[60]研究发现, HCC组织中HIF-1α和VEGF高度表达, 且两者间呈正相关, 与肿瘤分期、转移密切相关, 证实了HIF-1诱导VEGF表达. 王育蓉等[61]发现HCC细胞中的转录因子Sp1和VEGF表达在低氧后随着时间推移逐渐升高, 说明低氧可能通过促进核转录因子Sp1表达, 进而促进VEGF转录. 淋巴结转移也是HCC转移的重要形式, VEGF-C是HCC淋巴结转移的独立危险因素[62], VEGF-C与受体VEGFR-3结合促进癌周淋巴管形成, 导致HCC淋巴转移[63]. 还有研究表明[64-66], 通过下调VEGF表达, 可以明显抑制HCC细胞的增殖, 提示可以通过研究VEGF信号通路抑制剂, 为HCC靶向治疗提供方向. 目前, 针对阻断VEGFR的新型靶向药物索拉非尼已经广泛应用于临床, 为广大HCC晚期的患者带来福音, 临床研究显示, 搭配传统化疗药物联合使用能有效改善HCC患者病情, 提高患者生存率[67].
PI3K/Akt/mTOR信号转导通路包括磷脂酰肌醇3激酶(phosphatidylinositol 3 kinase, PI3K)、蛋白激酶B(protein kinase B, PKB)又称为Akt、哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin, mTOR), 其在细胞生长、代谢、存活、转移和对化疗耐药等许多重要细胞过程发挥重要调控作用. PI3K由p110催化亚基和p85调节亚基组成, 当其受到各类生长因子如表皮生长因子受体(epiderma lgrowth factor receptor, EGFR), RTK, c-Met等激活时, 在细胞膜上磷酸化磷脂酰肌醇-4, 5-二磷酸(phosphatidylinositol-4, 5-bisphosphate, PIP2)产生第二信使磷脂酰肌醇-3, 4, 5-三磷酸(phosphatidylinositol-3, 4, 5-bisphosphate, PIP3). Akt是一种丝氨酸/苏氨酸蛋白激酶, 包括Akt1、Akt2、Akt3. 活化后的PIP3将其募集到细胞膜上, 由磷酸肌醇依赖蛋白激酶1磷酸化激活, 进一步激活下游效应分子mTOR.
mTOR是一种高度保守的蛋白激酶, 包括两个蛋白复合物mTORC1和mTORC2, mTOR1通过调节p70核糖体蛋白S6激酶1和真核翻译因子4e结合蛋白1诱导蛋白合成和细胞生长[68]. PTEN是该通路的抑癌基因, 可以通过将PIP3去磷酸化负性调节Akt活性[69]. 大量研究[70]表明, HCC患者中PI3K/Akt/mTOR信号通路频繁激活, 约有半数的HCC PTEN失活和mTOR高表达. Bassullu等[71]研究发现, 50例HCC患者中全部都有PI3K表达, 有30% mTOR表达阳性, 56% PTEN基因缺失. 同样的, 于慧敏等[72]研究发现, 约71% HCC组织的AKT表达, 77% mTOR表达, 两者表达率显著高于癌旁组织, 并呈现正相关关系. 乙型肝炎病毒也可能通过激活PI3K/Akt/mTOR信号转导通路促进HCC形成, 研究发现[73]HBX在促进HCC细胞增殖的同时也上调P13K及AKT表达. 所有这些研究都提示PI3K/Akt/mTOR通路的激活可能在功能上促进HCC的进展. 目前, PI3K/Akt/mTOR在HCC中通路广泛激活的细胞机制尚未完全清楚. 然而, 上游受体激酶的激活被认为是一个关键的机制, 其中包括肝细胞生长因子受体(cellular-mesenchymal to epithelial transition factor, c-Met)和EGFR等过表达, 研究发现[74], 约80%的HCC患者c-Met过表达, 同样, 有约50% EGFR表达阳性[75]. c-Met和EGFR通过与其配体结合后激活包括PI3K/Akt/mTOR在内的其他信号转导通路介导HCC发生, 近年来, 一种作用于EGFR的新型酪氨酸酶抑制剂拉帕替尼被证实在HBX上存在敏感点[76], 这为进行大规模的临床试验提供了依据. 而c-Met的特异性抑制剂Tivantinib目前临床试验较少.
Hedgehog信号转导通路在研究果蝇时发现的一条高度保守的细胞信号通路, 该通路在胚胎发育过程中起了关键性作用, 参与细胞生长、分化、血管形成等生理过程[77]. 人类Hedgehog通路由配体、跨膜蛋白受体、核转录因子三部分组成, 配体是一种分泌性糖蛋白, 分别为Sonic Hedgehog(SHH)蛋白、Indian Hedgehog(IHH)蛋白和Desert Hedgehog(DHH)蛋白, 在人体分布和研究最多是SHH蛋白; 跨膜蛋白受体由Patched(PTCH)受体和Smoothened(SMO)蛋白组成[78]; 核转录因子由Glioma (Gli)蛋白家族组成, 分为Gli1、Gli2、Gli3, 激活后的Gli1和Gli2进入细胞核内参与转录激活, 而Gli3抑制转录[79]. 正常情况下, Hedgehog信号通路处于未激活状态, 细胞和组织中缺乏SHH配体, 此时PTCH通过与SMO结合, 抑制SMO蛋白活性, 从而抑制靶基因的转录. 当受到外来刺激信号或者细胞受损时, 细胞通过旁分泌或者自分泌形式释放SHH配体与PTCH结合, 解除对SMO蛋白对Gli的抑制作用, 激活Gli进入细胞核内继而激活下游靶基因启动转录过程.
研究发现[80], 肝脏在损伤状态下激活Hedgehog信号通路, 启动纤维化修复, 引起肝硬化甚至HCC的发生. SHH作为启动激活配体, 有多项研究发现[81-83], SHH在HCC组织和细胞中呈现高表达, 且与预后相关, 使用SHH配体阻断剂或者敲除SHH基因可有效抑制HCC细胞生长并诱导细胞凋亡. 此外, 研究表明[84,85]通路下游的Gli蛋白家族Gli1和Gli2可能通过促进细胞上皮-间质转化(epithelial-mesenchymal transition, EMT)和上调MMPs表达促进HCC侵袭和转移, 这与其他信号转导通路机制是类似的, Gli也可作为评估HCC预后的一项重要指标. 以上研究都进一步证实了Hedgehog信号通路激活在促进HCC增殖和转移方面发挥重要作用.
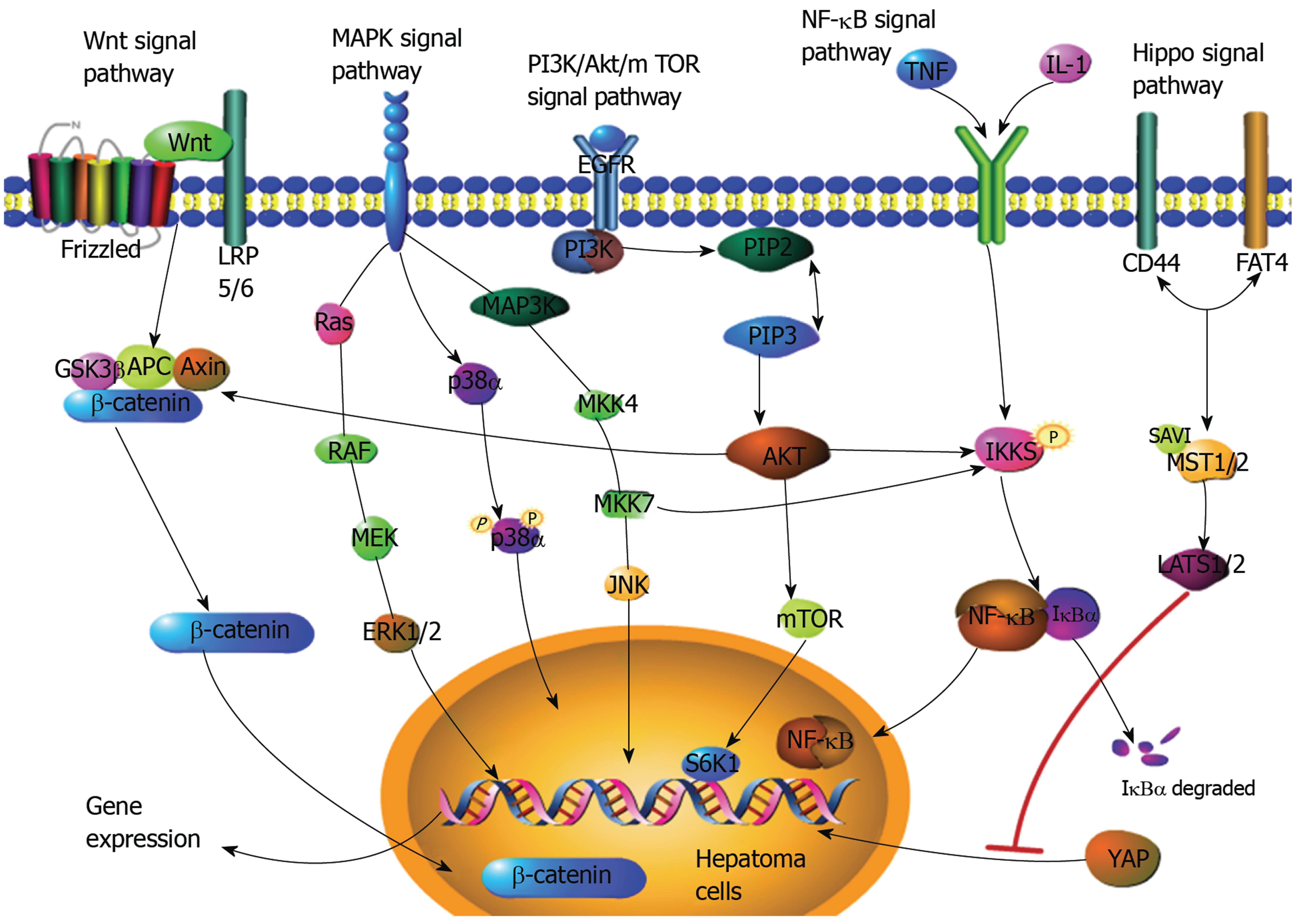
综上所述, HCC是一个多因素参与, 多途径形成的复杂病理发展过程. 过去有大量研究已发现许多信号通路参与了HCC形成的调控, 本文初步探讨了MAPK, Hippo, Notch, Wnt, NF-κB, VEGF和PI3K/Akt/mTOR, Hedgehog这八条信号通路与HCC的相关性. 正常情况下, 大部分信号通路都正常控制着肝细胞的自我更新和生理活动, 当各种致病因素激活或者抑制这些信号通路时, 它们就会在影响HCC细胞增殖、侵袭、转移、凋亡等方面发挥着不同作用. 然而实际上细胞中的信号转导通路网络异常复杂, 不仅受单个信号蛋白分子的调控, 还可能受到多个信号蛋白或信号通路网络的调控(图1). 因此, 随着分子生物学研究的深入和技术发展, 笔者认为今后HCC信号转导通路的研究工作重点, 可能是进一步深入地研究各个信号转导通路在肿瘤发生发展中的具体分子机制, 同时探讨各信号分子之间的相互联系以及在HCC形成过程中的共同作用. 相信这样的研究将有助于我们进一步了解HCC的发生发展机制以及发掘更多潜在的HCC靶向治疗途径, 为其治疗靶点提供新的科学依据, 更好地指导我们的临床工作.
学科分类: 胃肠病学和肝病学
手稿来源地: 广西壮族自治区
同行评议报告分类
A级 (优秀): 0
B级 (非常好): B, B, B
C级 (良好): 0
D级 (一般): D
E级 (差): 0
编辑: 王禹乔 电编:刘继红
| 2. | 郑 荣寿, 孙 可欣, 张 思维, 曾 红梅, 邹 小农, 陈 茹, 顾 秀瑛, 魏 文强, 赫 捷. 2015年中国恶性肿瘤流行情况分析. 中华肿瘤杂志. 2019;41:19-28. [DOI] |
| 4. | 杨 雪梅, 文 彬, 孙 海涛, 陈 冠新, 孙 嘉玲, 陈 炜聪, 贺 松其. 肝癌前病变与肝卵圆细胞上皮间质转化的相关研究进展. 广东医学. 2018;39:2236-2239. [DOI] |
| 7. | 黄 桂柳, 冯 巍巍, 黄 赞松, 周 喜汉, 覃 月秋. 苦参素通过线粒体凋亡通路影响肝癌耐药细胞株HepG2/ADM化学治疗的耐药性. 中华肝脏病杂志. 2019;27:216-218. [DOI] |
| 8. | Akasaka E, Takekoshi S, Horikoshi Y, Toriumi K, Ikoma N, Mabuchi T, Tamiya S, Matsuyama T, Ozawa A. Protein oxidative damage and heme oxygenase in sunlight-exposed human skin: roles of MAPK responses to oxidative stress. Tokai J Exp Clin Med. 2010;35:152-164. [PubMed] |
| 10. | Delire B, Stärkel P. The Ras/MAPK pathway and hepatocarcinoma: pathogenesis and therapeutic implications. Eur J Clin Invest. 2015;45:609-623. [PubMed] [DOI] |
| 11. | Kim JS, Choi GH, Jung Y, Kim KM, Jang SJ, Yu ES, Lee HC. Downregulation of Raf-1 kinase inhibitory protein as a sorafenib resistance mechanism in hepatocellular carcinoma cell lines. J Cancer Res Clin Oncol. 2018;144:1487-1501. [PubMed] [DOI] |
| 13. | 赵 小丽, 高 鹏, 刘 俊华, 周 凤蕊, 王 佳乐, 李 广明. MST4表达对MHCC97H肝癌细胞细胞因子、ERK蛋白、p-ERK蛋白表达的影响及其意义. 天津医科大学学报. 2019;25:124-127. |
| 14. | Seki E, Brenner DA, Karin M. A liver full of JNK: signaling in regulation of cell function and disease pathogenesis, and clinical approaches. Gastroenterology. 2012;143:307-320. [PubMed] [DOI] |
| 15. | Wang SN, Lee KT, Tsai CJ, Chen YJ, Yeh YT. Phosphorylated p38 and JNK MAPK proteins in hepatocellular carcinoma. Eur J Clin Invest. 2012;42:1295-1301. [PubMed] [DOI] |
| 17. | Chang Q, Zhang Y, Beezhold KJ, Bhatia D, Zhao H, Chen J, Castranova V, Shi X, Chen F. Sustained JNK1 activation is associated with altered histone H3 methylations in human liver cancer. J Hepatol. 2009;50:323-333. [PubMed] [DOI] |
| 18. | Koul HK, Pal M, Koul S. Role of p38 MAP Kinase Signal Transduction in Solid Tumors. Genes Cancer. 2013;4:342-359. [PubMed] [DOI] |
| 20. | Song MK, Park YK, Ryu JC. Polycyclic aromatic hydrocarbon (PAH)-mediated upregulation of hepatic microRNA-181 family promotes cancer cell migration by targeting MAPK phosphatase-5, regulating the activation of p38 MAPK. Toxicol Appl Pharmacol. 2013;273:130-139. [PubMed] |
| 21. | Liu AM, Xu MZ, Chen J, Poon RT, Luk JM. Targeting YAP and Hippo signaling pathway in liver cancer. Expert Opin Ther Targets. 2010;14:855-868. [PubMed] [DOI] |
| 22. | Meng Z, Moroishi T, Guan KL. Mechanisms of Hippo pathway regulation. Genes Dev. 2016;30:1-17. [PubMed] [DOI] |
| 24. | Wu Y, Zhang J, Zhang H, Zhai Y. Hepatitis B virus X protein mediates yes-associated protein 1 upregulation in hepatocellular carcinoma. Oncol Lett. 2016;12:1971-1974. [PubMed] [DOI] |
| 25. | Wu H, Liu Y, Jiang XW, Li WF, Guo G, Gong JP, Ding X. Clinicopathological and prognostic significance of Yes-associated protein expression in hepatocellular carcinoma and hepatic cholangiocarcinoma. Tumour Biol. 2016;37:13499-13508. [PubMed] [DOI] |
| 26. | Li H, Wang S, Wang G, Zhang Z, Wu X, Zhang T, Fu B, Chen G. Yes-associated protein expression is a predictive marker for recurrence of hepatocellular carcinoma after liver transplantation. Dig Surg. 2014;31:468-478. [PubMed] [DOI] |
| 27. | Wang C, Zhu ZM, Liu CL, He XJ, Zhang HY, Dong JH. Knockdown of yes-associated protein inhibits proliferation and downregulates large tumor suppressor 1 expression in MHCC97H human hepatocellular carcinoma cells. Mol Med Rep. 2015;11:4101-4108. [PubMed] [DOI] |
| 28. | Lu L, Li Y, Kim SM, Bossuyt W, Liu P, Qiu Q, Wang Y, Halder G, Finegold MJ, Lee JS, Johnson RL. Hippo signaling is a potent in vivo growth and tumor suppressor pathway in the mammalian liver. Proc Natl Acad Sci U S A. 2010;107:1437-1442. [PubMed] [DOI] |
| 29. | Geisler F, Strazzabosco M. Emerging roles of Notch signaling in liver disease. Hepatology. 2015;61:382-392. [PubMed] [DOI] |
| 30. | Huang Q, Li J, Zheng J, Wei A. The Carcinogenic Role of the Notch Signaling Pathway in the Development of Hepatocellular Carcinoma. J Cancer. 2019;10:1570-1579. [PubMed] [DOI] |
| 31. | Banerjee D, Hernandez SL, Garcia A, Kangsamaksin T, Sbiroli E, Andrews J, Forrester LA, Wei N, Kadenhe-Chiweshe A, Shawber CJ, Kitajewski JK, Kandel JJ, Yamashiro DJ. Notch suppresses angiogenesis and progression of hepatic metastases. Cancer Res. 2015;75:1592-1602. [PubMed] [DOI] |
| 32. | Sun L, Sun G, Yu Y, Coy DH. Is Notch Signaling a Specific Target in Hepatocellular Carcinoma? Anticancer Agents Med Chem. 2015;15:809-815. [PubMed] |
| 34. | 杨 永光, 鲁 才杰, 刘 丽娟, 贺 翊峰, 张 剑, 林 满洲, 李 明意. Notch3通过Wnt/β-连环蛋白通路介导基质金属蛋白酶-2/基质金属蛋白酶-9调控肝癌侵袭转移. 中华实验外科杂志. 2018;35:655-658. [DOI] |
| 35. | 张 勇, 王 德盛, 周 亮, 孙 伟, 王 建锋, 韩 炜, 苟 泽鹏, 祝 普利. Notch1在肝癌组织中的表达情况及其临床意义. 中华消化外科杂志. 2013;12:378-382. [DOI] |
| 37. | Khalaf AM, Fuentes D, Morshid AI, Burke MR, Kaseb AO, Hassan M, Hazle JD, Elsayes KM. Role of Wnt/β-catenin signaling in hepatocellular carcinoma, pathogenesis, and clinical significance. J Hepatocell Carcinoma. 2018;5:61-73. [PubMed] [DOI] |
| 39. | Dahmani R, Just PA, Perret C. The Wnt/β-catenin pathway as a therapeutic target in human hepatocellular carcinoma. Clin Res Hepatol Gastroenterol. 2011;35:709-713. [PubMed] [DOI] |
| 40. | Zhang Y, Wei W, Cheng N, Wang K, Li B, Jiang X, Sun S. Hepatitis C virus-induced up-regulation of microRNA-155 promotes hepatocarcinogenesis by activating Wnt signaling. Hepatology. 2012;56:1631-1640. [PubMed] [DOI] |
| 41. | Bengochea A, de Souza MM, Lefrançois L, Le Roux E, Galy O, Chemin I, Kim M, Wands JR, Trepo C, Hainaut P, Scoazec JY, Vitvitski L, Merle P. Common dysregulation of Wnt/Frizzled receptor elements in human hepatocellular carcinoma. Br J Cancer. 2008;99:143-150. [PubMed] [DOI] |
| 42. | Kim M, Lee HC, Tsedensodnom O, Hartley R, Lim YS, Yu E, Merle P, Wands JR. Functional interaction between Wnt3 and Frizzled-7 leads to activation of the Wnt/beta-catenin signaling pathway in hepatocellular carcinoma cells. J Hepatol. 2008;48:780-791. [PubMed] [DOI] |
| 43. | Chu Y, Fan W, Guo W, Zhang Y, Wang L, Guo L, Duan X, Wei J, Xu G. miR-1247-5p functions as a tumor suppressor in human hepatocellular carcinoma by targeting Wnt3. Oncol Rep. 2017;38:343-351. [PubMed] [DOI] |
| 44. | Wang L, Yao M, Fang M, Zheng WJ, Dong ZZ, Pan LH, Zhang HJ, Yao DF. Expression of hepatic Wnt5a and its clinicopathological features in patients with hepatocellular carcinoma. Hepatobiliary Pancreat Dis Int. 2018;17:227-232. [PubMed] [DOI] |
| 45. | Bi L, Liu X, Wang C, Cao Y, Mao R, Li P, Geng M. Wnt5a involved in regulation of the biological behavior of hepatocellular carcinoma. Int J Clin Exp Pathol. 2014;7:987-995. [PubMed] |
| 46. | Liu M, Cui LH, Li CC, Zhang L. Association of APC, GSTP1 and SOCS1 promoter methylation with the risk of hepatocellular carcinoma: a meta-analysis. Eur J Cancer Prev. 2015;24:470-483. [PubMed] [DOI] |
| 47. | Xu B, Nie Y, Liu X, Feng S, Yang Z, Wang Z, Zheng Q, Luo X. Quantitative analysis of APC promoter methylation in hepatocellular carcinoma and its prognostic implications. Oncol Lett. 2014;7:1683-1688. [PubMed] [DOI] |
| 48. | Csepregi A, Röcken C, Hoffmann J, Gu P, Saliger S, Müller O, Schneider-Stock R, Kutzner N, Roessner A, Malfertheiner P, Ebert MP. APC promoter methylation and protein expression in hepatocellular carcinoma. J Cancer Res Clin Oncol. 2008;134:579-589. [PubMed] [DOI] |
| 51. | Luedde T, Schwabe RF. NF-κB in the liver--linking injury, fibrosis and hepatocellular carcinoma. Nat Rev Gastroenterol Hepatol. 2011;8:108-118. [PubMed] [DOI] |
| 54. | 顾 星, 姚 敏, 王 司晔, 时 运, 董 志珍, 邱 历伟, 姚 登福. 肿瘤坏死因子α/核因子-κB信号通路活化干预对肝癌细胞增殖的抑制作用. 中华肝脏病杂志. 2014;22:434-439. [DOI] |
| 55. | Tang Y, Lv P, Sun Z, Han L, Zhou W. 14-3-3β Promotes Migration and Invasion of Human Hepatocellular Carcinoma Cells by Modulating Expression of MMP2 and MMP9 through PI3K/Akt/NF-κB Pathway. PLoS One. 2016;11:e0146070. [PubMed] [DOI] |
| 56. | Wang F, Yang JL, Yu KK, Xu M, Xu YZ, Chen L, Lu YM, Fang HS, Wang XY, Hu ZQ, Li FF, Kan L, Luo J, Wang SY. Activation of the NF-κB pathway as a mechanism of alcohol enhanced progression and metastasis of human hepatocellular carcinoma. Mol Cancer. 2015;14:10. [PubMed] [DOI] |
| 57. | Matsumoto T, Claesson-Welsh L. VEGF receptor signal transduction. Sci STKE. 2001;2001:re21. [PubMed] [DOI] |
| 62. | Xiang ZL, Zeng ZC, Tang ZY, Fan J, Sun HC, Wu WZ, Tan YS. [Nuclear accumulation of CXCR4 and overexpressions of VEGF-C and CK19 are associated with a higher risk of lymph node metastasis in hepatocellular carcinoma]. Zhonghua Zhong Liu Za Zhi. 2010;32:344-349. [PubMed] |
| 64. | Pan Z, Zhuang J, Ji C, Cai Z, Liao W, Huang Z. Curcumin inhibits hepatocellular carcinoma growth by targeting VEGF expression. Oncol Lett. 2018;15:4821-4826. [PubMed] [DOI] |
| 65. | Yu HB, Zhang HF, Zhang X, Li DY, Xue HZ, Pan CE, Zhao SH. Resveratrol inhibits VEGF expression of human hepatocellular carcinoma cells through a NF-kappa B-mediated mechanism. Hepatogastroenterology. 2010;57:1241-1246. [PubMed] |
| 66. | 赵 海亮, 黄 桂柳, 黄 赞松, 周 喜汉, 邓 志华, 覃 月秋. 苦参碱抑制人肝癌HepG2细胞增殖及其对VEGF、MMP-9表达的影响. 右江民族医学院学报. 2016;38:1-5. [DOI] |
| 68. | Matsuoka T, Yashiro M. The Role of PI3K/Akt/mTOR Signaling in Gastric Carcinoma. Cancers (Basel). 2014;6:1441-1463. [PubMed] [DOI] |
| 69. | Zhou Q, Lui VW, Yeo W. Targeting the PI3K/Akt/mTOR pathway in hepatocellular carcinoma. Future Oncol. 2011;7:1149-1167. [PubMed] [DOI] |
| 70. | Bhat M, Sonenberg N, Gores GJ. The mTOR pathway in hepatic malignancies. Hepatology. 2013;58:810-818. [PubMed] [DOI] |
| 71. | Bassullu N, Turkmen I, Dayangac M, Yagiz Korkmaz P, Yasar R, Akyildiz M, Yaprak O, Tokat Y, Yuzer Y, Bulbul Dogusoy G. The Predictive and Prognostic Significance of c-erb-B2, EGFR, PTEN, mTOR, PI3K, p27, and ERCC1 Expression in Hepatocellular Carcinoma. Hepat Mon. 2012;12:e7492. [PubMed] [DOI] |
| 73. | 张 斌, 丁 慎华, 徐 春江, 许 智玲, 朱 薇珊. HBx过表达对肝癌HepG2细胞AKT、PI3K表达的影响. 胃肠病学和肝病学杂志. 2019;28:159-162. [DOI] |
| 74. | Chu JS, Ge FJ, Zhang B, Wang Y, Silvestris N, Liu LJ, Zhao CH, Lin L, Brunetti AE, Fu YL, Wang J, Paradiso A, Xu JM. Expression and prognostic value of VEGFR-2, PDGFR-β, and c-Met in advanced hepatocellular carcinoma. J Exp Clin Cancer Res. 2013;32:16. [PubMed] [DOI] |
| 75. | 高 潺潺, 吴 平平, 金 潇潇. VEGF、EGFR在原发性肝癌中的表达及其临床意义. 南京医科大学学报(自然科学版). 2016;36:1436-1439. [DOI] |
| 76. | Chen JY, Huang WC, Wei CT, Chien PH, Chen YJ. The C-Terminus of Hepatitis B Virus-encoded X Protein Is Required for Lapatinib Sensitivity in Hepatocellular Carcinoma Cells. Anticancer Res. 2019;39:721-726. [PubMed] [DOI] |
| 77. | Kolluri A, Ho M. The Role of Glypican-3 in Regulating Wnt, YAP, and Hedgehog in Liver Cancer. Front Oncol. 2019;9:708. [PubMed] [DOI] |
| 79. | Carpenter BS, Barry RL, Verhey KJ, Allen BL. The heterotrimeric kinesin-2 complex interacts with and regulates GLI protein function. J Cell Sci. 2015;128:1034-1050. [PubMed] [DOI] |
| 82. | 倪 卓然, 谢 坤, 赵 红川, 朱 立新, 耿 小平. 肝细胞癌组织中Shh、Gli1、Snail、E-cadherin表达的临床研究. 安徽医科大学学报. 2016;51:536-541. [DOI] |
| 83. | Chen Y, Zhu W. Knockdown of the Sonic Hedgehog (SHH) Gene Inhibits Proliferation of Hep3B and SMMC-7721 Hepatocellular Carcinoma Cells via the PI3K/Akt/PCK1 Signaling Pathway. Med Sci Monit. 2019;25:6023-6033. [PubMed] [DOI] |
| 85. | 李 悦, 张 宇, 曹 良启, 薛 平, 胡 以则, 张 大伟. Hedgehog信号通路转录因子Gli2表达对肝癌进展和生存预后的影响. 中华普通外科学文献(电子版). 2016;10:174-178. |