修回日期: 2019-10-14
接受日期: 2019-10-25
在线出版日期: 2019-11-08
胆汁淤积性肝病(cholestatic liver disease, CSLD)是指能够引起胆汁淤积的多种肝病的集合和统称, 其病因复杂, 发病机制有待深入阐明, 尚缺乏足够有效的治疗手段. 近十余年来对CSLD的多个方面有了较多新认识, 为其精准诊治提供了更多层面和更为有效的手段, 同时许多问题仍然悬而未决, 亟需继续深入研究.
观察CSLD患者与正常人群中血清长链非编码RNA(long non coding RNA, LncRNA)-ATB水平的差异; 探索CSLD患者血清LncRNA-ATB的变化与疾病病情的变化及预后的相关性.
收集符合CSLD诊断标准的不同病因初诊肝病患者75例, 同时收集健康对照者30例, 采用qRT-PCR法检测LncRNA-ATB在上述研究对象血清标本中的表达; 在分析比较正常对照与胆汁淤积、胆汁淤积不同程度各组间LncRNA-ATB水平差异性, 采用线性相关分析LncRNA-ATB的变化与临床生化指标的相关性; 采用受试者特征曲线分析LncRNA-ATB的变化对CSLD病情判断的临床意义.
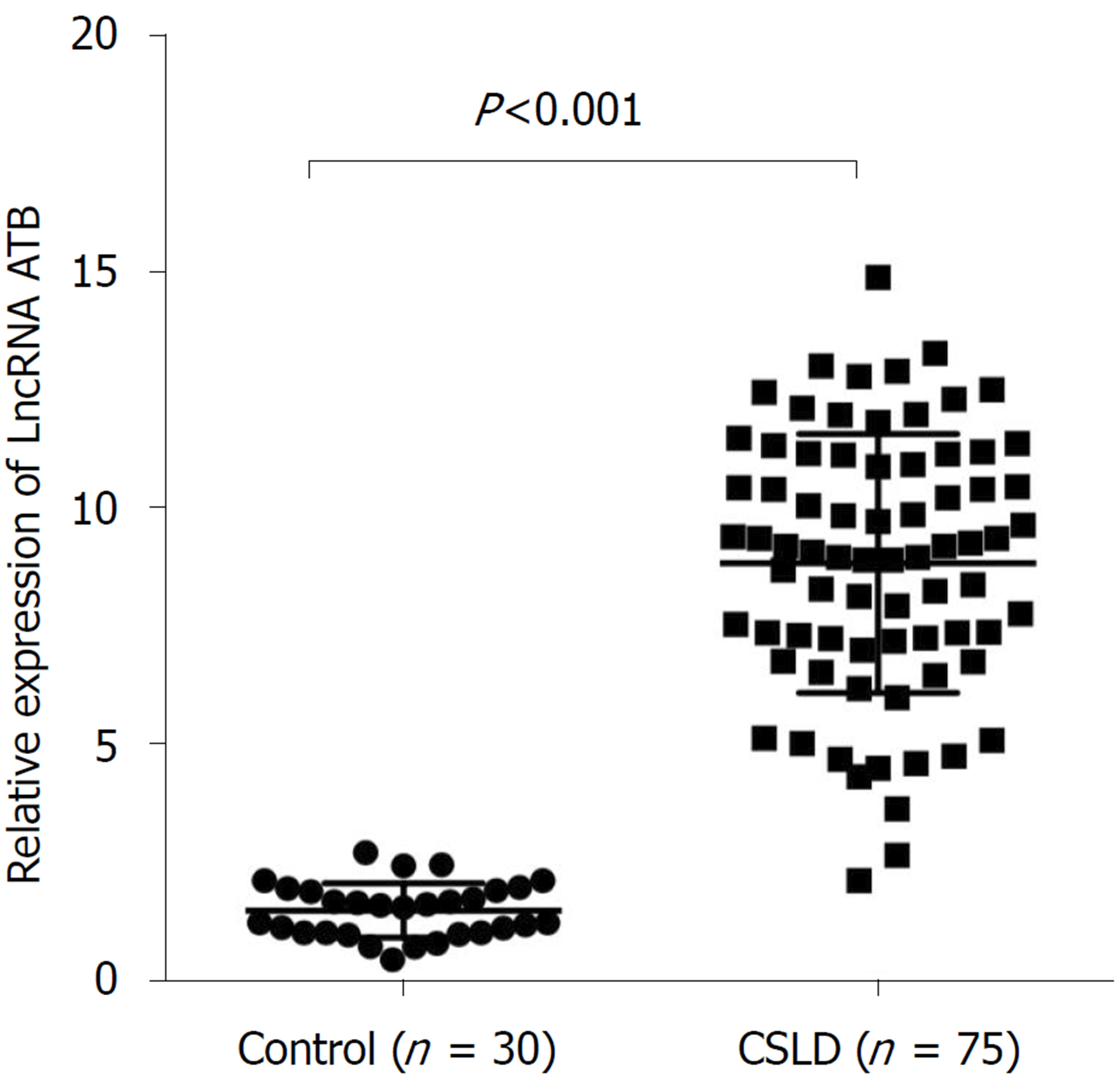
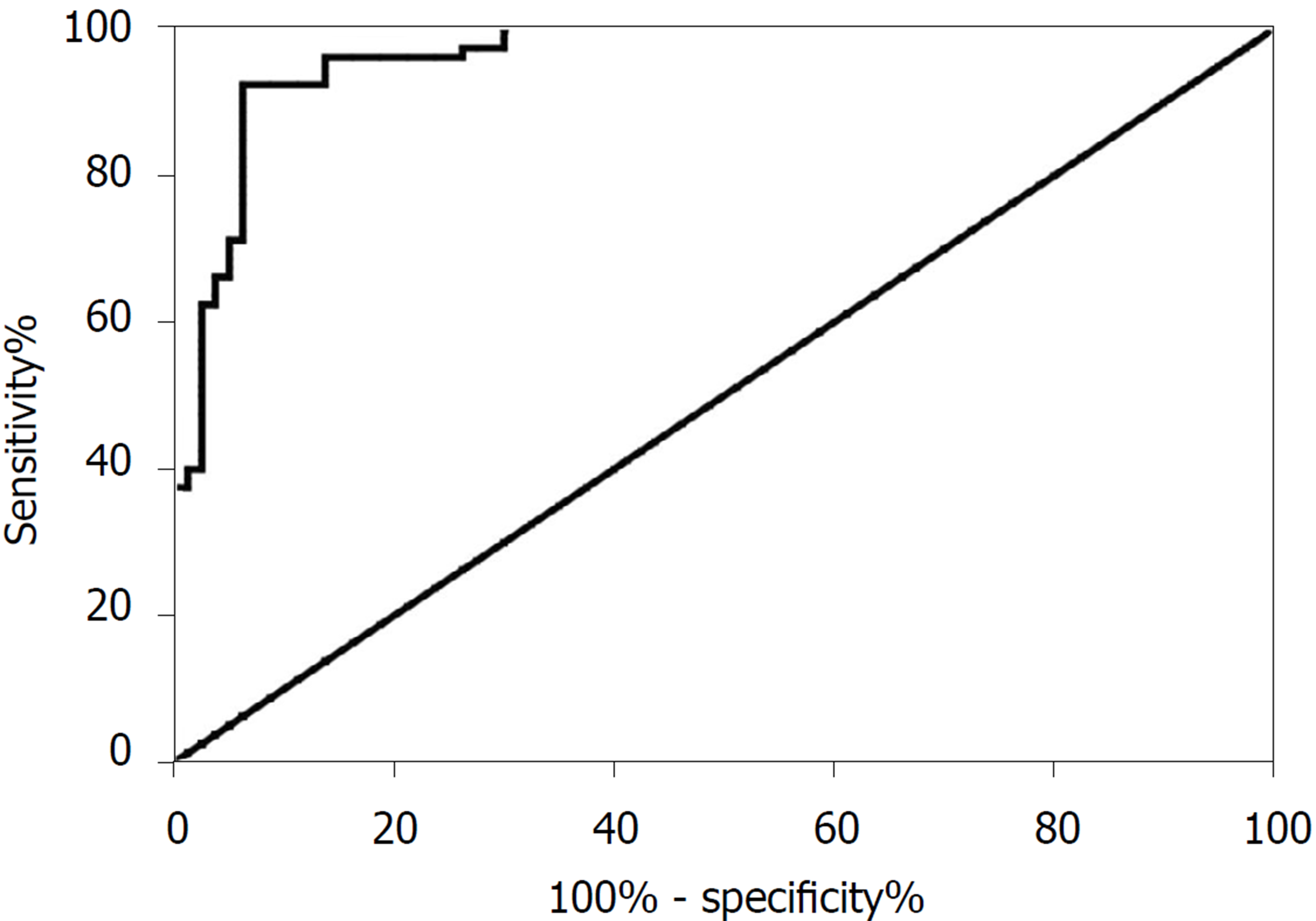
与健康对照组比较, LncRNA-ATB在CSLD患者中血清中明显增高, 差异具有统计学意义(P<0.05). LncRNA-ATB的表达水平在不同病因导致的CSLD及不同病程的胆汁淤积患者之间的表达无明显差异(P>0.05). 血清LncRNA-ATB随着胆汁淤积程度的加重而下降, 差异具有统计学意义(P<0.001); LncRNA-ATB与TBA的量呈负相关关系(r = -0.627, P<0.001), LncRNA-ATB诊断CSLD的曲线下面积为0.856, 敏感性为81.42%, 特异性则为73.45%(95%CI: 0.809-0.904, P<0.001).
LncRNA-ATB在肝内CSLD患者血清中的含量明显升高, 随着胆汁淤积程度的加重而下降, LncRNA-ATB的表达水平有望成为判断CSLD患者病情及预后的生物标志物.
核心提要: 胆汁淤积性肝病(cholestatic liver disease, CSLD)病因复杂,发病机制有待深入阐明, 尚缺乏足够有效的治疗手段. 本研究通过检测CSLD患者与正常人群中血清长链非编码RNA(long non coding RNA, LncRNA)-ATB的差异表达, 分析其临床意义. 研究发现LncRNA-ATB在CSLD患者中血清中高表达; LncRNA-ATB的表达与病情及胆汁淤积的程度相关, 随着胆汁淤积程度的加重血清LncRNA-ATB的表达下降, LncRNA-ATB与TBA的量呈负相关关系. LncRNA-ATB的表达水平有望成为判断CSLD患者病情及预后的生物标志物.
引文著录: 张向华, 李进英, 高金生. LncRNA-ATB在胆汁淤积性肝病患者血清中的表达及意义. 世界华人消化杂志 2019; 27(21): 1320-1325
Revised: October 14, 2019
Accepted: October 25, 2019
Published online: November 8, 2019
Cholestatic liver disease (CSLD) refers to a collection of liver diseases that can cause cholestasis. The etiology of CSLD is complex, the pathogenesis needs to be elucidated, and there is still a lack of effective treatment. Over the past decade, there has been a deep understanding of many aspects of CSLD, which provides more effective means for its accurate diagnosis and treatment. However, many problems are still pending, and further research is urgently needed.
To observe the difference of serum lncRNA-ATB levels between patients with intrahepatic cholestasis and normal people, and to explore the correlation between the changes of serum lncRNA-ATB and disease condition and prognosis in patients with intrahepatic cholestasis.
Seventy-five patients with intrahepatic cholestasis of different etiologies and 30 healthy controls were included. The expression of lncRNA-ATB in serum samples of the above subjects was detected by qRT-PCR. The levels of lncRNA-ATB between normal controls and patients with cholestasis and between patients with different degrees of cholestasis were analyzed. Linear correlation analysis was used to analyze the correlation between the changes of lncRNA-ATB and clinical biochemical indicators, and receiver operating characteristic curve analysis was performed to analyze the clinical significance of the changes of lncRNA-ATB in judging the condition of intrahepatic cholestasis.
Compared with the healthy control group, lncRNA-ATB increased significantly in the serum of patients with intrahepatic cholestasis (P < 0.05). There was no significant difference in the expression of lncRNA-ATB between patients with cholestatic liver disease caused by different etiologies and and between patients with different courses of cholestasis (P > 0.05). Serum lncRNA-ATB decreased with the aggravation of cholestasis (P < 0.001). There was a negative correlation between lncRNA-ATB and total bile acid (r = -0.627, P < 0.001). The area under the curve of lncRNA-ATB in the diagnosis of cholestasis liver disease was 0.856 (95%CI: 0.809-0.904, P < 0.001), with a sensitivity of 81.42% and specificity of 73.45%.
The level of lncRNA-ATB in serum of patients with intrahepatic cholestasis liver disease is significantly increased, and it decreases with the aggravation of cholestasis. The expression level of LncRNA-ATB is expected to be a biomarker for judging the condition and prognosis of patients with intrahepatic cholestasis.
- Citation: Zhang XH, Li JY, Gao JS. Significance of expression of lncRNA-ATB in serum of patients with cholestatic liver disease. Shijie Huaren Xiaohua Zazhi 2019; 27(21): 1320-1325
- URL: https://www.wjgnet.com/1009-3079/full/v27/i21/1320.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v27.i21.1320
胆汁淤积性肝病(cholestatic liver disease, CSLD)是临床上常见的一大类肝病, 是指由肝内外各种原因所致的胆汁形成、分泌和(或)排泄障碍, 胆汁不能正常流入十二指肠, 从而反流入血产生的临床病理状态, 临床可出现乏力、瘙痒、尿色加深和黄疸等表现[1-3]. 其主要的发病机制为在各种致肝损伤因素作用下, 肝脏内大量炎性因子浸润及氧化应激反应导致肝脏功能损伤[4,5]. 治疗上及时控制病因和通过药物治疗缓解或阻断胆汁淤积及相关病变是绝大多数CSLD患者的主要治疗手段. 熊去氧胆酸(ursodeoxycholic acid, UDCA)是美国食品药品监督管理局批准的可用于原发性胆汁性肝硬化(primary biliary cirrhosis, PBC)治疗的唯一有效药物[6], 但由于发病机制和疾病阶段的不同, 目前临床治疗中对UDCA应答不佳的患者逐渐增多. 因此, 探索CSLD发生发展的相关机制, 寻找CSLD诊治的生物标志物, 对于改善预后及提高生存具有十分重要的意义.
近年来的研究发现, 长链非编码RNA(long non coding RNA, LncRNA)的异常调控与多种疾病的发生发展密切相关. 近年来的研究发现LncRNA参与调节胆汁酸信号和胆汁淤积性肝纤维化的发生[7]. Xiao等[8]发现长链非编码RNA h19与胆道闭锁患者胆管细胞增殖和胆汁淤积性肝纤维化的发生相关. 还有研究提出转化生长因子(transforming growth factor, TGF)β激活的LncRNA(LncRNA-activated by TGFβ, LncRNA-ATB)表达增加与肝硬化呈正相关[9,10]. LncRNA-ATB是位于人第14号染色体, 长度约80 kb的长链非编码RNA, 主要参与肝细胞癌、胃癌、结肠癌等多种消化道恶性肿瘤的发生、进展及转移[11-14]. 目前关于LncRNA-ATB在CSLD中的作用及潜在的分子调控机制尚不清楚. 本研究通过检测LncRNA-ATB在CSLD患者血清中的表达情况, 分析血清LncRNA-ATB表达与CSLD的相关性, 判断血清LncRNA-ATB对CSLD的诊断价值, 为临床诊断CSLD提供新的生物学标记.
收集2017-01/2018-12就诊于我院消化科的肝内CSLD患者75例, 其中慢性乙型肝炎(chronic hepatitis B, CHB)10例, 自身免疫性肝病(autoimmune liver disease, AIH)10例, PBC 20例, 药物性肝损伤(drug-induced liver injury, DILI)10例, 酒精性肝病(alcoholic liver disease, ALD)12例, 其他不明原因者13例. 同时于我院检验科行肝功能相关的生化指标如丙氨酸转氨酶(alanine transaminase, ALT), 天门冬氨酸转氨酶(aspartate transaminase, AST), 碱性磷酸酶(alkaline phosphatase, ALP), γ-谷氨酰基转移酶(gamma-glutamyltransferase, GGT), 总胆红素(total bilirubin, TBIL), 直接胆红素(direct bilirubin, DBIL)及总胆汁酸(total bile acid, TBA)等指标检测. 所有患者均符合2009年欧洲肝病学会"胆汁淤积性肝病处理临床实践指南"及2015年我国发布的"胆汁淤积性肝病诊断与治疗共识"中推荐的胆汁淤积诊断标准[15]: ALP超过正常上限的1.5倍且GGT超过正常上限3倍, 然后可根据临床、生物化学、病毒血清学、免疫检测、影像学(超声、CT及MRI)和肝组织病理学检查排除肝外梗阻性疾病.所有研究对象诊断明确后次日清晨空腹采集静脉血5 mL, 静置2-4 h后进行离心, 转速2500-3000 r/min, 时间为10 min; 将离心获得的血清分装后用于各项指标检测. 本研究通过本院伦理委员会批准(伦理批件编号: 2016-009), 并且所有研究对象均签署知情同意书.
Real-time PCR分析LncRNA-ATB的表达水平: 采用TRIZOL(Invitrogen, Grand Island, NY)方法提取血清标本中总RNA. 将提取的总RNA, 参照AMV逆转录试剂盒说明书提供的方法将其反转录成cDNA. 采用2×SYBR Green PCR Master Mix, 以cDNA为摸板, 进行qRT-PCR. PCR反应在定量PCR反应仪上进行. 三次独立实验后得到的数据运用公式RQ = 2-ΔΔCt的方法进行分析.
统计学处理 采用SPSS 13.0统计软件进行数据分析. LncRNA-ATB在血清标本中的差异表达采用t检验分析. LncRNA-ATB与各临床病理参数之间的关系使用Chi-Square检验; 采用person相关分析LncRNA-ATB的表达与临床各指标的关系, 受试者工作特征曲线(receiver operating characteristic, ROC)分析LncRNA-ATB的临床意义及预测价值.
与健康对照组(1.473±0.105)比较, LncRNA-ATB在CSLD患者(8.823±0.316)中的表达显著增高, 差异具有统计学意义(t = 14.52, P<0.001)(图1).
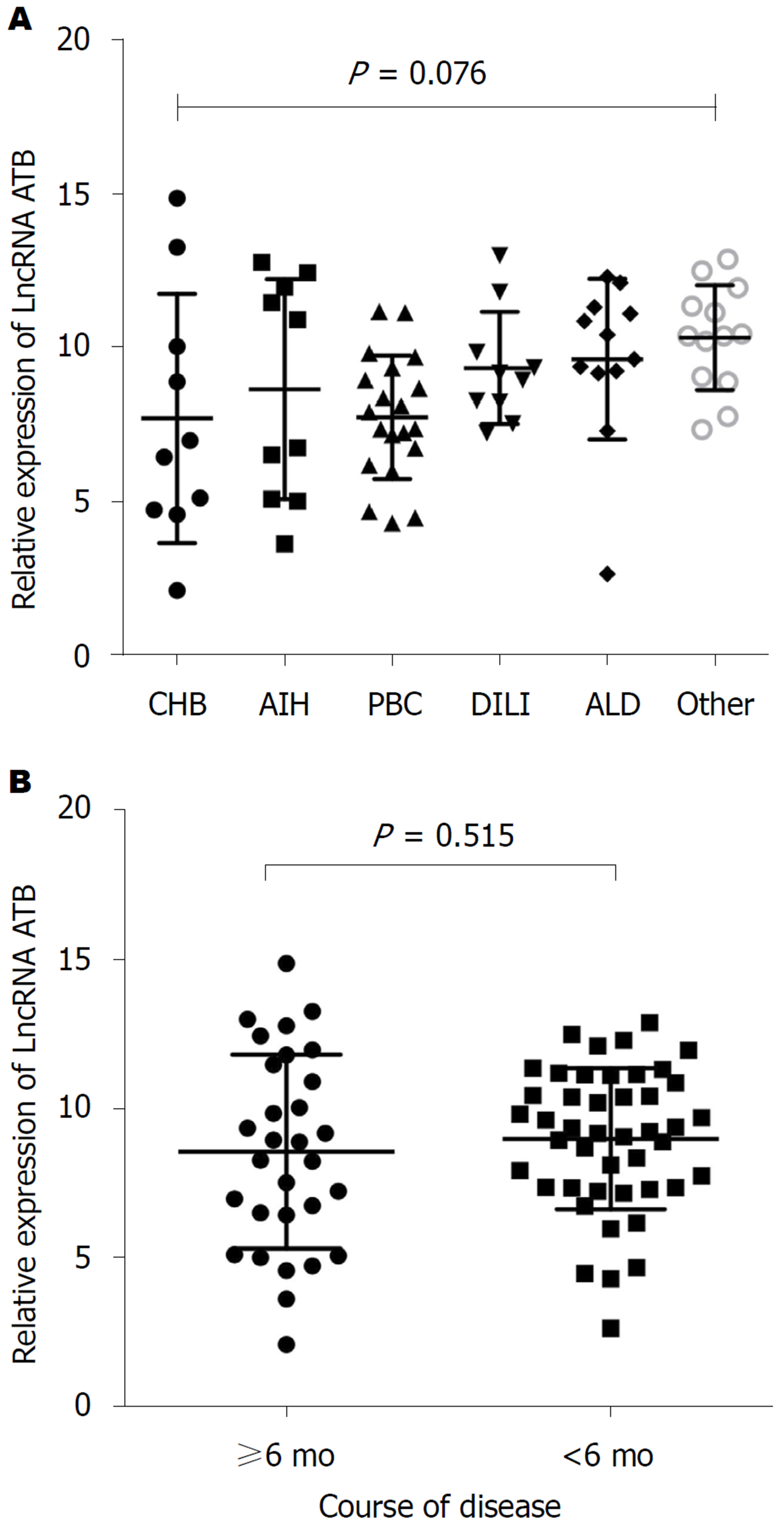
LncRNA-ATB的表达水平在不同病因疾病之间的差异无显著差异(P>0.05)(图2A); LncRNA-ATB在6 mo以内的CSLD患者与6 mo以上患者之间的表达差异无明显差异(P>0.05)(图2B).
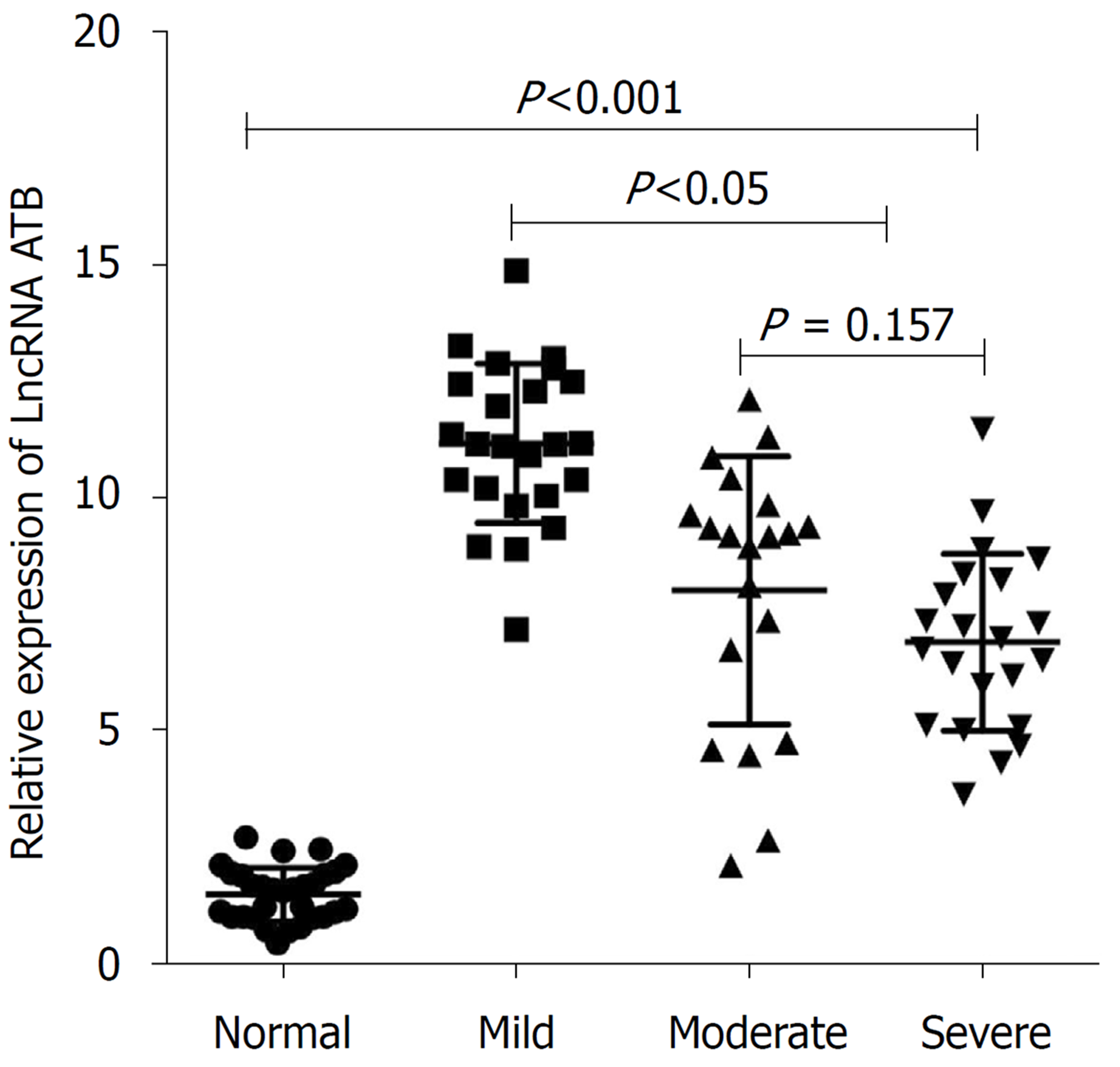
研究显示, LncRNA-ATB在轻、中、重度肝内CSLD患者血清中的表达均明显高于健康对照组, 差异具有统计学意义(P<0.001); LncRNA-ATB在中、重度CSLD患者血清中的表达较轻度CSLD患者降低, 差异具有统计学意义(P<0.001), 但中、重度CSLD患者血清LncRNA-ATB的表达差异无统计学意义(P>0.05)(图3).
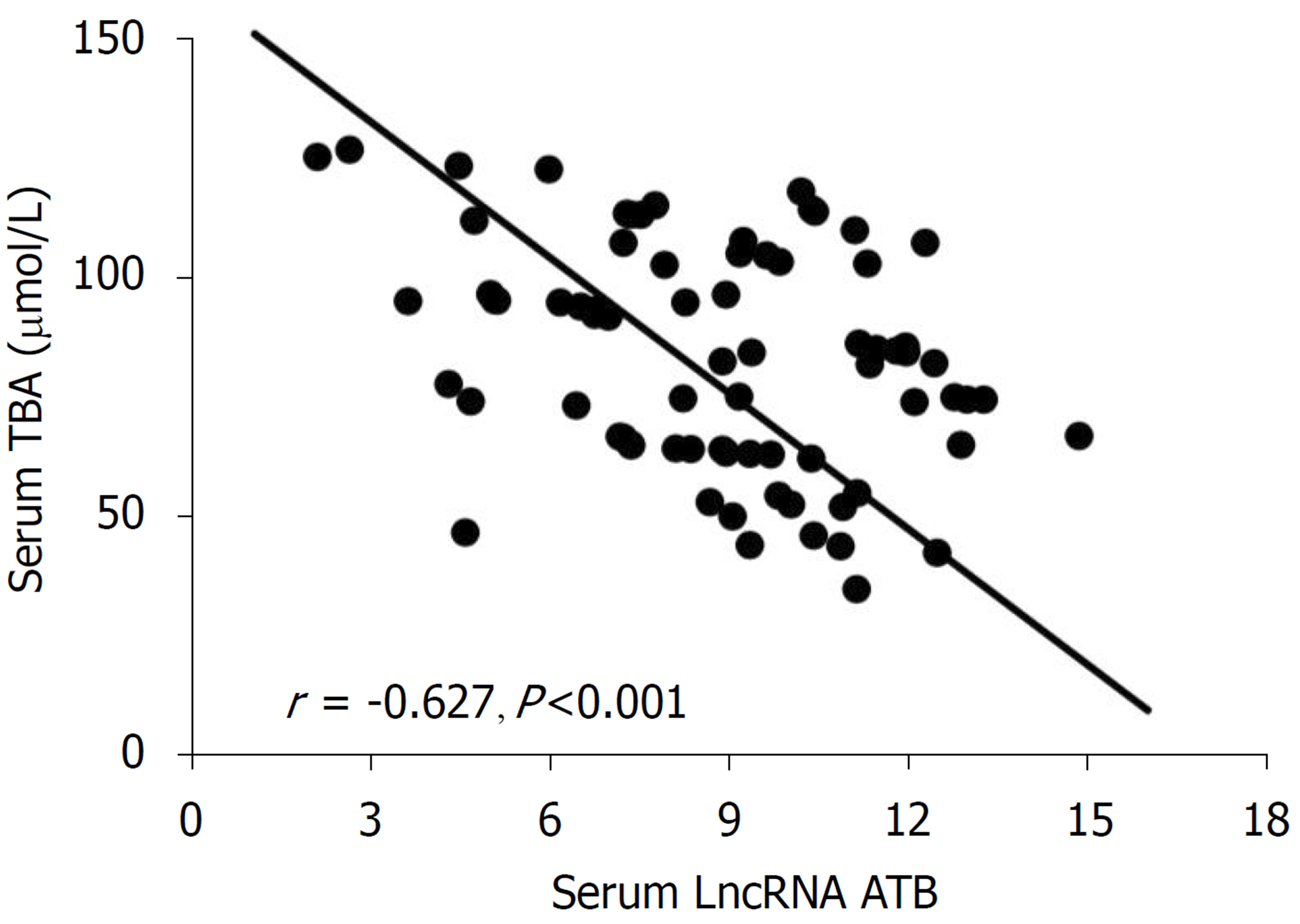
CSLD的形成与胆汁的合成、分泌相关, TBA是反映胆汁淤积程度的最直接指标. 进一步分析LncRNA-ATB与TBA的相关性发现, LncRNA-ATB与TBA的量呈负相关关系(r = -0.627, P<0.001)(图4).
我们拟通过ROC曲线来分析LncRNA-ATB水平变化对CSLD的疾病诊断价值. LncRNA-ATB诊断CSLD的曲线下面积为0.856, 诊断的敏感性为81.42%, 特异性则为73.45%(95%CI 0.809-0.904, P<0.001)(图5).
CSLD是指能够引起胆汁淤积的多种肝病的集合和统称[16], 其发病机制复杂, 多种导致肝损伤因素均可引起胆汁淤积, 长期胆汁淤积又是肝病持续进展的重要因素[17]. 随着对胆汁淤积症病理生理现象的认识, 在该领域的研究也越来越深入[18]. 但其发病机制有待深入阐明, 尚缺乏足够有效的治疗手段.
LncRNA是一类转录本长度超过200 nt的不具备编码蛋白功能的RNA分子, 可在表观遗传学调控、转录调控、转录后调控等多个层面调控蛋白编码基因的表达[19]. 近年研究表明, LncRNAs差异表达或功能失调参与多种疾病的发生及进展, 其与肝细胞再生、炎症反应、免疫反应以及肝癌的发生等密切相关[20]; 此外, LncRNAs还可以参与调节肝星状细胞功能, 影响肝纤维化的发病与进展[21]. 目前关于LncRNAs在CSLD方面的研究不多, 研究发现LncRNA H19通过阻止ZEB1介导的上皮细胞粘附分子抑制促进胆汁淤积性肝纤维化[22]. H19/miR-148a/USP4轴通过增强肝星状细胞和肝细胞的TGF-β信号传导促进肝纤维化[23]. LncRNA MEG3通过与PTBP1相互作用促进shp mRNA衰变, 诱导胆汁淤积性肝损伤. 然而, 关于LncRNA-ATB在CSLD患者中的表达及意义目前国内外尚未见相关报道. 课题组前期通过基因芯片在CSLD患者与正常人之间的差异表的LncRNA, 结果发现LncRNA-ATB在CSLD患者血清中的表达较正常对照组明显显著增加, 但是LncRNA-ATB在CSLD患者中的作用及分子机制尚不清楚. LncRNA-ATB被证实参与多种恶性肿瘤的发生、进展及转移, 并与肝硬化呈正相关[20,21]. 我们研究发现, LncRNA-ATB在CSLD患者血清中的表达较正常对照组明显增加, LncRNA-ATB的表达水平在不同病因疾病及不同病程的CSLD患者之间的表达差异无明显差异. 血清LncRNA-ATB随着胆汁淤积程度的加重而下降, LncRNA-ATB与TBA的量呈负相关关系, LncRNA-ATB诊断CSLD的曲线下面积为0.856, 诊断的敏感性为81.42%, 特异性则为73.45%. 以上研究结果提示LncRNA-ATB可能成为CSLD病情程度及动态变化转归较为敏感的预测指标.
胆汁淤积性肝病(cholestatic liver disease, CSLD)病因复杂,发病机制有待深入阐明,尚缺乏足够有效的治疗手段.
进一步明确CSLD的分子机制.
检测CSLD患者与正常人群中血清LncRNA-ATB的差异表达, 分析其临床意义.
Real-time PCR分析LncRNA-ATB的表达水平. 采用SPSS 13.0统计软件进行数据分析. LncRNA-ATB在血清标本中的差异表达采用t检验分析. LncRNA-ATB与各临床病理参数之间的关系使用Chi-Square检验; 采用person相关分析LncRNA-ATB的表达与临床各指标的关系, 受试者工作特征曲线分析LncRNA-ATB的临床意义及预测价值.
与健康对照组比较, LncRNA-ATB在CSLD患者中血清中明显增高, 差异具有统计学意义(P<0.05). LncRNA-ATB的表达水平在不同病因导致的CSLD及不同病程的CSLD患者之间的表达无明显差异(P>0.05). 血清LncRNA-ATB随着胆汁淤积程度的加重而下降, 差异具有统计学意义(P<0.001); LncRNA-ATB与TBA的量呈负相关关系(r = -0.627, P<0.001), LncRNA-ATB诊断CSLD的曲线下面积为0.856, 敏感性为81.42%, 特异性则为73.45%(95%CI: 0.809-0.904, P<0.001).
LncRNA-ATB在肝内CSLD患者血清中的含量明显升高, 随着胆汁淤积程度的加重而下降.
LncRNA-ATB的表达水平有望成为判断CSLD患者病情及预后的生物标志物质.
学科分类: 胃肠病学和肝病学
手稿来源地: 四川省
同行评议报告分类
A级 (优秀): 0
B级 (非常好): B
C级 (良好): C
D级 (一般): D
E级 (差): 0
编辑: 王禹乔 电编:刘继红
| 1. | Cuykx M, Beirnaert C, Rodrigues RM, Laukens K, Vanhaecke T, Covaci A. Untargeted liquid chromatography-mass spectrometry metabolomics to assess drug-induced cholestatic features in HepaRG® cells. Toxicol Appl Pharmacol. 2019;379:114666. [PubMed] [DOI] |
| 2. | Kyritsi K, Chen L, O'Brien A, Francis H, Hein TW, Venter J, Wu N, Ceci L, Zhou T, Zawieja D, Gashev AA, Meng F, Invernizzi P, Fabris L, Wu C, Skill NJ, Saxena R, Liangpunsakul S, Alpini G, Glaser S. Modulation of the TPH1/MAO-A/5HT/5HTR2A/2B/2C Axis Regulates Biliary Proliferation and Liver Fibrosis During Cholestasis. Hepatology. 2019;. [PubMed] [DOI] |
| 3. | Cabrera D, Arab JP, Arrese M. UDCA, NorUDCA, and TUDCA in Liver Diseases: A Review of Their Mechanisms of Action and Clinical Applications. Handb Exp Pharmacol. 2019;256:237-264. [PubMed] [DOI] |
| 4. | Wu SH, Hsu JS, Chen HL, Chien MM, Wu JF, Ni YH, Liou BY, Ho MC, Jeng YM, Chang MH, Chen PL, Chen HL. Plectin Mutations in Progressive Familial Intrahepatic Cholestasis. Hepatology. 2019;. [PubMed] [DOI] |
| 5. | Cheung AC, Lammers WJ, Murillo Perez CF, van Buuren HR, Gulamhusein A, Trivedi PJ, Lazaridis KN, Ponsioen CY, Floreani A, Hirschfield GM, Corpechot C, Mayo MJ, Invernizzi P, Battezzati PM, Parés A, Nevens F, Thorburn D, Mason AL, Carbone M, Kowdley KV, Bruns T, Dalekos GN, Gatselis NK, Verhelst X, Lindor KD, Lleo A, Poupon R, Janssen HLA, Hansen BE; Global PBC Study Group. Effects of Age and Sex of Response to Ursodeoxycholic Acid and Transplant-free Survival in Patients With Primary Biliary Cholangitis. Clin Gastroenterol Hepatol. 2019;17:2076-2084.e2. [PubMed] [DOI] |
| 6. | Palmieri LJ, Rainteau D, Sokol H, Beaugerie L, Dior M, Coffin B, Humbert L, Eguether T, Bado A, Hoys S, Janoir C, Duboc H. Inhibitory Effect of Ursodeoxycholic Acid on Clostridium difficile Germination Is Insufficient to Prevent Colitis: A Study in Hamsters and Humans. Front Microbiol. 2018;9:2849. [PubMed] [DOI] |
| 7. | Chiang JYL. Linking long noncoding RNA to control bile acid signaling and cholestatic liver fibrosis. Hepatology. 2017;66:1032-1035. [PubMed] [DOI] |
| 8. | Xiao Y, Liu R, Li X, Gurley EC, Hylemon PB, Lu Y, Zhou H, Cai W. Long Noncoding RNA H19 Contributes to Cholangiocyte Proliferation and Cholestatic Liver Fibrosis in Biliary Atresia. Hepatology. 2019;. [PubMed] [DOI] |
| 9. | Fu N, Zhao SX, Kong LB, Du JH, Ren WG, Han F, Zhang QS, Li WC, Cui P, Wang RQ, Zhang YG, Nan YM. LncRNA-ATB/microRNA-200a/β-catenin regulatory axis involved in the progression of HCV-related hepatic fibrosis. Gene. 2017;618:1-7. [PubMed] [DOI] |
| 10. | Liu Y, Li Y, Xu Q, Yao W, Wu Q, Yuan J, Yan W, Xu T, Ji X, Ni C. Long non-coding RNA-ATB promotes EMT during silica-induced pulmonary fibrosis by competitively binding miR-200c. Biochim Biophys Acta Mol Basis Dis. 2018;1864:420-431. [PubMed] [DOI] |
| 11. | Dang X, Lian L, Wu D. The diagnostic value and pathogenetic role of lncRNA-ATB in patients with osteoarthritis. Cell Mol Biol Lett. 2018;23:55. [PubMed] [DOI] |
| 12. | Gao Z, Zhou H, Wang Y, Chen J, Ou Y. Regulatory effects of lncRNA ATB targeting miR-200c on proliferation and apoptosis of colorectal cancer cells. J Cell Biochem. 2019;. [PubMed] [DOI] |
| 13. | Mou K, Liu B, Ding M, Mu X, Han D, Zhou Y, Wang LJ. lncRNA-ATB functions as a competing endogenous RNA to promote YAP1 by sponging miR-590-5p in malignant melanoma. Int J Oncol. 2018;53:1094-1104. [PubMed] [DOI] |
| 14. | Tang F, Wang H, Chen E, Bian E, Xu Y, Ji X, Yang Z, Hua X, Zhang Y, Zhao B. LncRNA-ATB promotes TGF-β-induced glioma cells invasion through NF-κB and P38/MAPK pathway. J Cell Physiol. 2019;234:23302-23314. [PubMed] [DOI] |
| 15. | European Association for the Study of the Liver. EASL Clinical Practice Guidelines: The diagnosis and management of patients with primary biliary cholangitis. J Hepatol. 2017;67:145-172. [PubMed] [DOI] |
| 16. | Fawcett LK, Widger J, Henry GM, Ooi CY. Case report: Cholecystoduodenostomy for cholestatic liver disease in a premature infant with cystic fibrosis and short gut syndrome. BMC Pediatr. 2019;19:78. [PubMed] [DOI] |
| 17. | Liberal R, Gaspar R, Lopes S, Macedo G. Primary biliary cholangitis in patients with inflammatory bowel disease. Clin Res Hepatol Gastroenterol. 2019;. [PubMed] [DOI] |
| 18. | Ge T, Zhang X, Xiao Y, Wang Y, Zhang T. Novel compound heterozygote mutations of TJP2 in a Chinese child with progressive cholestatic liver disease. BMC Med Genet. 2019;20:18. [PubMed] [DOI] |
| 19. | Xu K, Sun Y, Sheng B, Zheng Y, Wu X, Xu K. Role of identified RNA N6-methyladenosine methylation in liver. Anal Biochem. 2019;578:45-50. [PubMed] [DOI] |
| 20. | He Y, Meng XM, Huang C, Wu BM, Zhang L, Lv XW, Li J. Long noncoding RNAs: Novel insights into hepatocelluar carcinoma. Cancer Lett. 2014;344:20-27. [PubMed] [DOI] |
| 21. | Peng H, Wan LY, Liang JJ, Zhang YQ, Ai WB, Wu JF. The roles of lncRNA in hepatic fibrosis. Cell Biosci. 2018;8:63. [PubMed] [DOI] |
| 22. | Song Y, Liu C, Liu X, Trottier J, Beaudoin M, Zhang L, Pope C, Peng G, Barbier O, Zhong X, Li L, Wang L. H19 promotes cholestatic liver fibrosis by preventing ZEB1-mediated inhibition of epithelial cell adhesion molecule. Hepatology. 2017;66:1183-1196. [PubMed] [DOI] |
| 23. | Zhu J, Luo Z, Pan Y, Zheng W, Li W, Zhang Z, Xiong P, Xu D, Du M, Wang B, Yu J, Zhang J, Liu J. H19/miR-148a/USP4 axis facilitates liver fibrosis by enhancing TGF-β signaling in both hepatic stellate cells and hepatocytes. J Cell Physiol. 2019;234:9698-9710. [PubMed] [DOI] |