修回日期: 2019-08-16
接受日期: 2019-09-30
在线出版日期: 2019-10-28
各种基于客观营养指标的评分标准, 包括控制营养状况(control of nutritional status, CONUT)评分, 营养风险指数(nutritional risk index, NRI)和预后营养指数(prognostic nutritional index, PNI)与许多类型癌症患者的生存率相关.
本研究的目的是比较这些评分在肝细胞癌(hepato-cellular carcinoma, HCC)患者中的预后价值.
回顾性分析2007-01/2016-06在义乌市中心医院行HCC切除术的470例患者临床病理资料并比较CONUT评分, NRI, PNI与其预后的关系. 计算受试者工作特征曲线下面积(area under the curve, AUC), 用以比较每个评分系统的预测能力. 用COX比例风险模型进行单因素和多因素分析以确定与HCC总体生存率(overall survival, OS)相关的危险因素.
在单因素分析中, 白蛋白, PNI, NRI, CONUT评分, 组织学等与HCC患者的OS显著相关. PNI, NRI和CONUT评分与1年, 3年和5年HCC生存率显著相关. NRI总是具有比其他基于客观营养指标的评分标准更高的AUC值. 在多因素分析中, 谷草转氨酶(aspartate aminotransferase, AST)(HR = 1.503, P = 0.031), FIB状态(HR = 1.981, P = 0.001)和NRI(HR = 1.584, P = 0.014)是HCC患者预后的独立危险因素.
我们的研究表明, NRI在预测HCC根治术后患者的OS方面优于其他基于客观营养指标的评分标准, 具有一定的临床价值.
核心提要: 控制营养状况评分, 营养风险指数(nutritional risk index, NRI)和预后营养指数与许多类型癌症患者的生存率相关, 包括肝细胞癌(hepatocellular carcinoma, HCC), 但鲜有比较各种营养指标对HCC术后生存率的价值, 本研究发现NRI在预测HCC术后患者的总体生存率方面优于其他营养指标.
引文著录: 王苗. 肝细胞癌根治性切除术前客观营养指标的预后价值比较. 世界华人消化杂志 2019; 27(20): 1263-1270
Revised: August 16, 2019
Accepted: September 30, 2019
Published online: October 28, 2019
Various nutrition-based prognostic scores, including control of nutritional status (CONUT) score, nutritional risk index (NRI), and prognostic nutritional index (PNI), are associated with survival rates in patients with various types of cancer.
To compare the prognostic value of the above-mentioned scores in patients with hepatocellular carcinoma (HCC) before radical resection.
A retrospective analysis of 470 patients who underwent radical resection for HCC at the Yiwu Central Hospital from January 2007 to June 2016 was performed. Clinical pathological parameters, CONUT score, NRI, and PNI were collected and compared. The area under the receiver operating characteristic curve (AUC) was calculated to compare the predictive power of each scoring system. Univariate and multivariate analyses were performed using the COX proportional hazards model to identify risk factors associated with overall survival (OS).
In the univariate analysis, albumin, PNI, NRI, CONUT score, and histology were significantly associated with OS in patients with HCC. PNI, NRI, and CONUT score were significantly associated with 1-year, 3-year, and 5-year HCC survival rates. NRI always had a higher AUC value than other nutrition-based prognostic scores. In the multivariate analysis, AST (hazard ratio [HR] = 1.503, P = 0.031), FIB status (HR = 1.981, P = 0.001), and NRI (HR = 1.584, P = 0.014) were independent risk factors for prognosis in patients with HCC.
Our study suggests that NRI is superior to other nutrition-based prognostic scores in predicting overall survival in patients undergoing radical surgery for HCC.
- Citation: Wang M. Comparison of prognostic value of three objective nutritional indicators in patients with hepatocellular carcinoma before radical resection. Shijie Huaren Xiaohua Zazhi 2019; 27(20): 1263-1270
- URL: https://www.wjgnet.com/1009-3079/full/v27/i20/1263.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v27.i20.1263
肝细胞癌(hepatocellular carcinoma, HCC)是世界上癌症相关死亡的第五大常见病因, 也是最常见的原发性肝癌, 每年诊断出新病例超过50万例, 年死亡率为25万人[1]. 在过去的几十年中, HCC的治疗方法得到了明显提高. 到目前为止, 手术一直是HCC治愈性治疗的首选[2]. 尽管开发了复杂的诊断技术和外科手术, 肝脏切除HCC的结果仍然不能令人满意, 因为复发率很高[3]. 因此, 预测HCC的预后具有重要意义.
目前, 学者们已经提出了HCC的各种各样的分期系统, 如肿瘤淋巴结转移分期[4], 巴塞罗那临床肝癌(barcelona clinic liver cancer, BCLC)分期[5]和意大利肿瘤计划分期系统[6], 但是, 由于HCC患者的个体差异, 上述系统的准确性受到限制. 因此, 找到可靠且简单的预后生物标志物用于评估HCC患者预后, 可能对改善其生存率至关重要.
HCC最重要的危险因素是肝硬化, 其存在于70%-90%的HCC患者中. 据报道, 约有60%-90%的肝硬化患者营养不良[7,8]. 控制营养状况(control of nutritional status, CONUT), 营养风险指数(nutritional risk index, NRI)和预后营养指数(prognostic nutritional index, PNI)是广泛用于评估营养状况的客观指标. 研究表明, 术前营养状况不仅与术后并发症有关, 还与恶性肿瘤患者的长期预后有关[9-14], 如HCC等[15-20]. 本研究的目的是比较这些评分在HCC患者中的预后价值.
本研究回顾性分析了2007-01/2016-06 543例在义乌市中心医院接受根治术的HCC患者的临床病理资料. 45例患者随访失访, 28例没有完整的临床实验室数据的患者被排除在研究之外. 最终有470名HCC患者被纳入到我们的研究中, 其中有393名男性和77名女性(中位年龄: 57岁). 纳入标准: 病理结果证实为HCC并具有完整的临床、实验室、影像学和随访数据. 排除标准: 术前接受化疗、放疗、围手术期死亡, 或死于感染及其他炎症(如血管炎, 类风湿性关节炎)等疾病. 研究获得医院伦理委员会批准.
1.2.1 基础变量和基于客观营养指标的评分标准: HCC患者在根治性切除术前1 wk进行详细的病史, 体格检查, 术前常规实验室和影像学检查. 我们收集了可能与HCC预后相关的所有数据, 包括人口统计学数据, 全血细胞计数的实验室数据, 白蛋白和甲胎蛋白(alpha fetoprotein, AFP), 血清总胆红素, 谷草转氨酶(aspartate aminotransferase, AST), 谷丙转氨酶(alanine aminotransferase, ALT), 乙型肝炎病毒表面抗原(hepatitis B surface antigen, HBs-Ag), 以及生存时间等; 肿瘤相关变量包括肿瘤数量, 大小和肿瘤包膜, 以及术后病理变量(肿瘤分化, 血管侵犯, 淋巴结转移和肝内转移). 实验室数据的截止点采用我们医院实验室数据的正常值上限. CONUT评分标准总分大于3分为高CONUT组, 反之为低CONUT组(表1); PNI评分公式为10×白蛋白(g/dL)+0.005×淋巴细胞计数(×106/mL), 得分大于45分为高PNI组, 反之为低PNI组; NRI评分公式为1.519×白蛋白(g/L)+41.7×实际体重(kg)/理想体重(ideal body weight, IBW)(kg), 男性IBW(kg) = 50 kg+2.3kg/英尺(>5英尺, 1英尺 = 30.48 cm)和女性IBW(kg) = 48.67 kg+1.65 kg/英尺(超过5英尺, 1英尺 = 30.48 cm)[21], 实际体重大于IBW的患者, 我们将此比率设定为1[22,23], 得分大于100分为高NRI组, 反之为低NRI组. PNI, NRI和CONUT的临界值根据之前的研究结果确定[15,19,20].
| 变量 | 得分(分数) | |||
| 白蛋白(g/dL) | ≥3.5 (0) | 3.0-3.4 (2) | 2.5-2.9 (4) | <2.5 (6) |
| 淋巴细胞计数(×106/mL) | ≥1600 (0) | 1200-1599 (1) | 800-1199 (2) | <800 (3) |
| 总胆固醇(mg/dL) | ≥180(0) | 140-179 (1) | 100-139 (2) | <100 (3) |
1.2.2 术后随访: 所有患者均在术后前3 mo内每月复查一次, 之后每3 mo复查一次, 手术后3年, 每6 mo复查一次, 直至2018-07-01. 随访方式为门诊复查或电话随访. 从手术时间到死亡时间或者随访截止时间定义为总体生存时间.
统计学处理 连续变量表示为中位数(范围). 百分比(%)用于计数分类变量. t检验用来比较符合正态分布的连续变量, 对于不符合正态分布的连续变量, 通过Whitney U检验测试. χ2检验或Fisher精确检验用于评估分类变量. 受试者工作特征(receiver operating characteristic curve, ROC)曲线及受试者工作特征曲线下面积(area under the curve, AUC)用以评估每个评分系统的预测能力. COX比例风险回归模型用于预后因素的单因素及多因素分析. 选择单因素分析中对总体生存率(overall survival, OS)具有显着预后价值的变量(P<0.05)进行多因素分析. 使用IBM SPSS Statistics软件包v.21.0(IBM SPSS Inc., Chicago, IL, United States)进行统计学分析. P<0.05被认为具有统计学意义.
在我们的研究中, 我们纳入了393名(83.6%)男性和77名(16.4%)女性患者, 中位年龄为57岁(范围24-82岁). 中位随访时间为55.38 mo(范围1-103 mo), 在我们最后一次随访结束时, 229例(48.7%)患者死于HCC. 1年, 3年和5年生存率分别为86.6%, 69.4%和51.3%(表2).
| 变量 | 数值 |
| 年龄(岁) | 57 (24-82) |
| 性别(男) | 393 (83.6%) |
| 体重指数 | 22.5 (14.2-46.8) |
| 饮酒史(有) | 274 (58.3%) |
| 肝硬化(有) | 217 (46.2%) |
| 乙型肝炎表面抗原(阳性) | 373 (79.4%) |
| 白蛋白(g/L) | 40.2 (18.4-51.7) |
| 总胆固醇(mg/dL) | 162.03 (53.75-337.20) |
| 中性粒细胞(/μL) | 3200 (700-29000) |
| 淋巴细胞计数(/μL) | 1500 (100-3300) |
| 单核细胞计数(/μL) | 400 (0-2100) |
| 凝血酶原时间(s) | 13.8 (12.1-19.3) |
| 纤维蛋白原(g/L) | 2.84 (0.40-8.72) |
| 甲胎蛋白(ng/mL) | 32.05 (1-87500) |
| 总胆红素(mg/dL) | 0.64 (0.29-10.12) |
| 谷草转氨酶(IU/L) | 41.0 (4.0-1072.0) |
| 谷丙转氨酶(IU/L) | 37.0 (6.0-584.0) |
| PNI(高组) | 301 (64.0%) |
| NRI(高组) | 256 (54.5%) |
| CONUT(低组) | 344 (73.2%) |
| 肿瘤最大径(mm) | 40 (4-300) |
| 肿瘤数目(单发) | 255 (54.3%) |
| 肿瘤包膜(无) | 74 (15.7%) |
| 分化程度(高中分化) | 260 (55.3%) |
| 血管浸润(无) | 409 (87.0%) |
| 肝内转移(无) | 386 (82.1%) |
单因素分析显示AST, 总血清胆红素, PT, FIB, 白蛋白, 肝硬化, PNI, NRI, CONUT, 组织学(肿瘤最大径, 肿瘤数目, 肿瘤包膜, 分化程度, 血管浸润, 肝内转移与HCC患者OS显著相关(P<0.05). 考虑到PNI, NRI和CONUT评分均由白蛋白组成, 为避免相互干扰, 白蛋白不被纳入到多因素分析中. 多因素分析显示AST(HR = 1.503, 95%CI: 1.038-2.178, P = 0.031), FIB(HR = 1.981,95%CI: 1.344-2.920, P = 0.001)和NRI(HR = 1.584,95%CI: 1.096-2.291, P = 0.014)是HCC预后的独立危险因素(表3).
| 变量 | 单因素分析 | 多因素分析 | ||||||
| P值 | HR | 95%CI | P值 | HR | 95%CI | |||
| 年龄 | 0.642 | 1.064 | 0.819-1.383 | |||||
| 性别 | 0.924 | 1.017 | 0.715-1.446 | |||||
| BMI | 0.559 | 0.987 | 0.946-1.030 | |||||
| 饮酒史 | 0.380 | 0.888 | 0.682-1.157 | |||||
| AFP | 0.866 | 0.978 | 0.751-1.272 | |||||
| ALT | 0.060 | 1.302 | 0.998-1.714 | |||||
| AST | 0.002a | 1.554 | 1.177-2.051 | 0.031a | 1.503 | 1.038-2.178 | ||
| 总胆红素 | <0.001a | 2.115 | 1.549-2.890 | |||||
| PT | 0.004a | 1.554 | 1.154-2.092 | |||||
| FIB | <0.001a | 1.827 | 1.386-2.408 | 0.001a | 1.981 | 1.344-2.920 | ||
| 白蛋白 | <0.001a | 2.096 | 1.607-2.734 | |||||
| HBsAg | 0.615 | 0.922 | 0.672 | 1.265 | ||||
| 肝硬化 | 0.002a | 1.863 | 1.260 | 2.757 | ||||
| 肿瘤最大径 | <0.001a | 1.990 | 1.528 | 2.593 | ||||
| 肿瘤数目 | 0.001a | 1.562 | 1.192 | 2.049 | ||||
| 肿瘤包膜 | 0.013a | 1.534 | 1.095 | 2.149 | ||||
| 分化程度 | 0.002a | 1.636 | 1.204 | 2.222 | ||||
| 血管浸润 | 0.005a | 1.662 | 1.169 | 2.364 | ||||
| 肝内转移 | <0.001a | 1.816 | 1.475 | 2.235 | 0.053 | 0.562 | 0.314 | 1.006 |
| PNI (0/1) | <0.001a | 2.096 | 1.616 | 2.718 | ||||
| NRI (0/1) | <0.001a | 2.271 | 1.744 | 2.957 | 0.014a | 1.584 | 1.096 | 2.291 |
| CONUT (0/1) | 0.001a | 1.622 | 1.233 | 2.135 | ||||
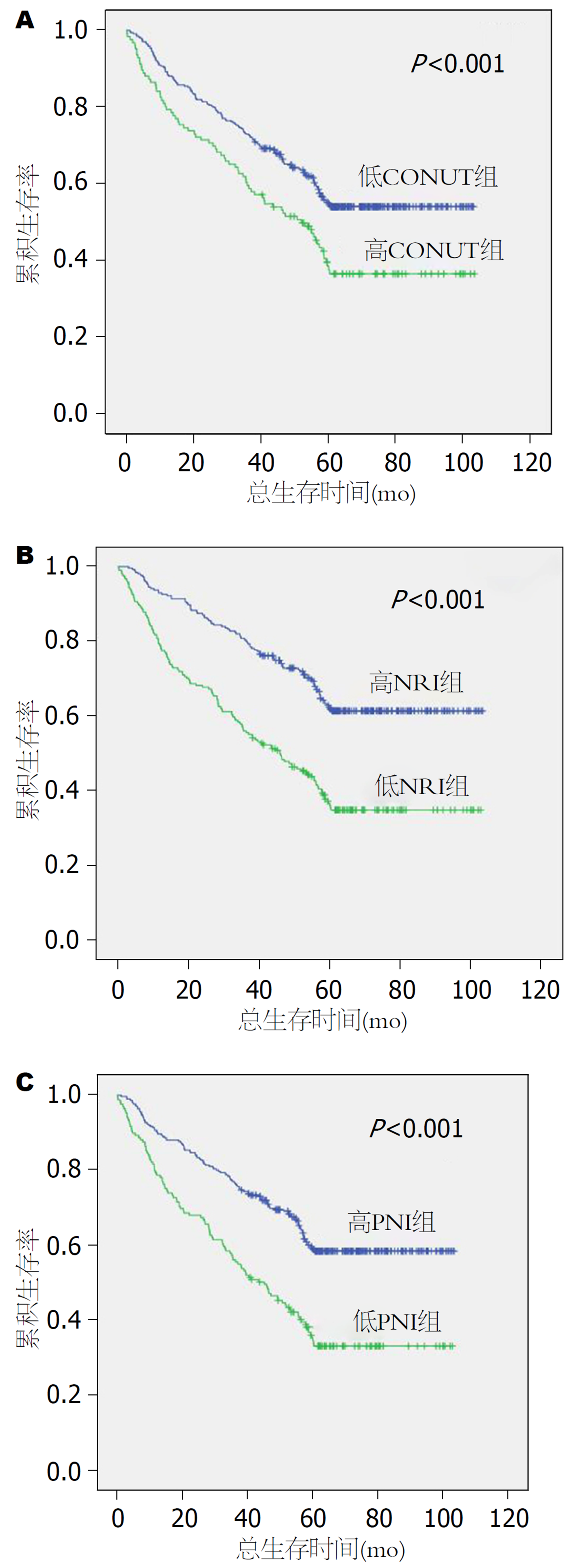
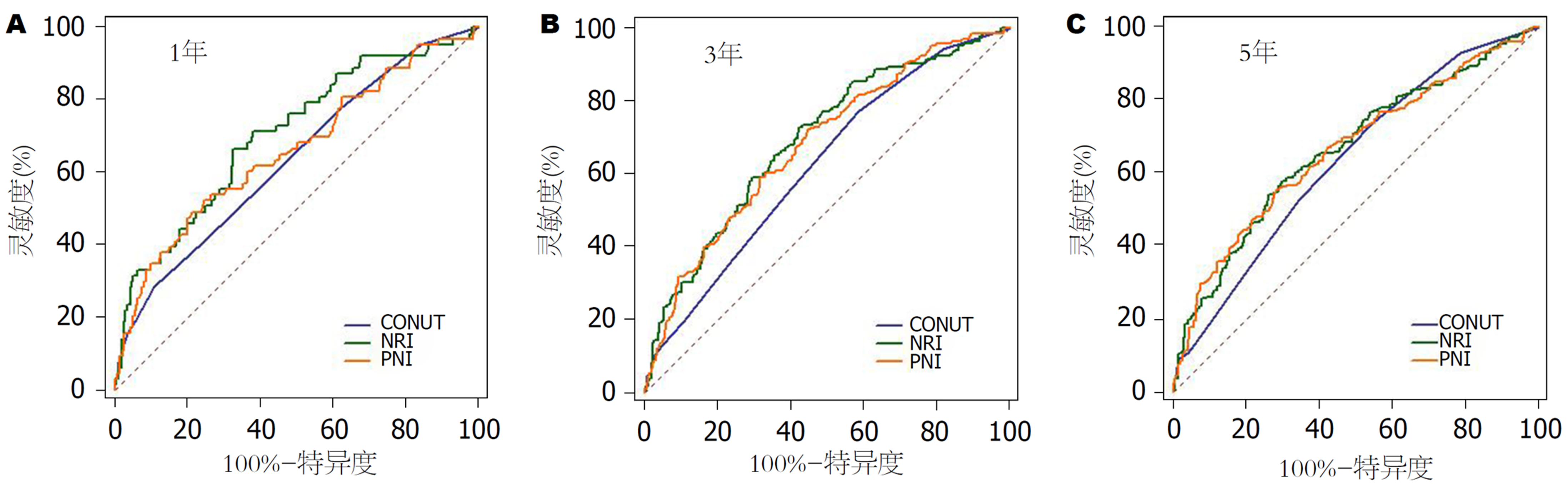
NRI, CONUT和PNI分组与HCC患者预后的Kaplan-Meier分析曲线结果表明患者的营养状态越差, OS越低(P<0.05)(图1). 术前客观营养指标之间的比较结果表明1年、3年及5年生存率比较中, NRI评分基本优于CONUT评分、PNI评分(P<0.05)(表4). 各评分之间的1年、3年和5年生存率ROC曲线显示NRI评分对应的AUC值分别为0.702、0.694及0.666, 均优于CONUT评分和PNI评分(图2).
| 变量 | P值 | AUC | 95%CI |
| 1年 | |||
| CONUT | <0.001 | 0.635 | 0.590-0.679 |
| NRI | <0.001 | 0.702 | 0.659-0.743 |
| PNI | <0.001 | 0.659 | 0.614-0.702 |
| CONUT vs NRI | 0.047a | ||
| CONUT vs PNI | 0.338 | ||
| PNI vs NRI | 0.035a | ||
| 3年 | |||
| CONUT | <0.001 | 0.624 | 0.579-0.668 |
| NRI | <0.001 | 0.694 | 0.650-0.735 |
| PNI | <0.001 | 0.681 | 0.637-0.723 |
| CONUT vs NRI | 0.011a | ||
| CONUT vs PNI | 0.003a | ||
| PNI vs NRI | 0.033a | ||
| 5年 | |||
| CONUT | <0.001a | 0.635 | 0.589-0.678 |
| NRI | <0.001a | 0.666 | 0.621-0.708 |
| PNI | <0.001 | 0.665 | 0.620-0.707 |
| CONUT vs NRI | 0.049a | ||
| CONUT vs PNI | 0.130 | ||
| PNI vs NRI | 0.946 | ||
据报道, PNI, NRI和CONUT的预后价值不仅与癌症相关并发症有关, 还与恶性肿瘤患者的远期预后有关[9-14]. 然而, 这些基于客观营养指标的评分标准在HCC患者的预后评价能力方面, 尚未有学者探究. 因此, 本研究的目的就是比较这些客观营养评分在HCC患者接受根治术后的预后价值.
在我们的研究中, 就客观营养评分来说, 单因素分析显示PNI, NRI和CONUT评分都与HCC患者的OS显著相关. 然而, 多因素分析显示, 只有NRI与HCC的OS密切相关, 说明NRI是HCC患者预后的独立危险因素. 此外, 比较这些基于客观营养指标的评分标准之间的AUC, NRI总是具有更高的AUC值, 也就是说, 在预测HCC的OS准确性方面, NRI优于其他营养预后评分. 据我们所知, 我们的研究首次比较了各种基于客观营养指标的评分标准在HCC患者中预后价值.
人们普遍认为, 全身营养状况与癌症的进展密切相关. 有研究表明, 营养状况受损与多种癌症患者(包括HCC)预后不良有关[13]. 营养状况反映了HCC患者的一般状况, 包括代谢水平, 免疫力和蛋白质代谢. PNI, NRI和CONUT评分均由白蛋白组成, 白蛋白是一种被临床广泛使用的营养标记物, 已被证明与许多癌症术后并发症有关[21-23]. HCC患者术后的低复发率与血清白蛋白水平升高有关[24]; 因此, 高水平的血清白蛋白是HCC术后OS的有利影响因素. 在本研究中, 我们发现所有病例中存在肝硬化病史的HCC患者占比很大, 众所周知, 肝硬化的严重程度会影响血清白蛋白水平, 导致低蛋白血症和营养不良. 据报道, 低蛋白血症是HCC患者的独立预后因素[25]. Nojiri等[26]研究表明白蛋白可以抑制HCC的增殖.
NRI除了需要计算血清白蛋白, 还需要计算患者的体重减轻程度. 许多研究表明, 体重减轻较少的癌症患者死亡率较低[27,28]. 其他研究表明, NRI与营养相关的癌症患者术后并发症和死亡率密切相关[29]. 尽管有报道称, PNI和CONUT评分与癌症患者预后相关, 但在我们的研究中, 它们并不能独立预测HCC患者的OS这一结果的差异, 可能与我们研究的HCC患者全部是接受根治性切除术有关, 具体原因还有待后来者进一步探究.
本研究存在一定局限性. 首先, 它是一个回顾性单中心研究, 所有样本均来源于同一地区及同一医院, 样本量也相对较小; 其次, 它无法控制可能影响营养状态的因素, 如住院期间的药物治疗, 并发症等; 最后, HCC患者的术后复发未纳入到我们的研究中. 鉴于HCC患者的病因学和生物学行为的多样性, NRI的与HCC患者预后的相关性, 应通过大样本或若干机构的多中心研究进行验证.
总之, 本研究发现, 在已知基于客观营养指标的评分标准(如PNI, NRI, CONUT评分)中, NRI是HCC患者根治性切除后OS的独立危险因素, 在预测HCC根治术后患者的预后方面优于其他基于客观营养指标的评分标准, 具有一定的临床价值.
肝细胞癌(hepatocellular carcinoma, HCC)目前在全球范围内发病率、复发率及死亡率均非常高, 因此为了提高HCC术后患者的生存率, 提出了很多评估HCC预后的评分系统及生物标志物, 众所周知, HCC的发生发展与肝硬化密切相关, 并且肝硬化与患者营养不良密不可分, 所以近些年客观营养指标与癌症患者预后的关系研究较多, 其中包括HCC. 不过鲜有学者比较各客观营养指标对HCC根治术后预后的价值.
本研究想通过比较各种客观营养指标与HCC根治术后的预后价值, 进而找出与HCC预后最为密切的生物标志物来指导临床医生的诊疗和提高患者的生活质量.
我们想通过回顾性分析, 找出HCC患者根治术后预后的影响因素, 并比较各客观营养指标的预测价值.
本文采用回顾性分析方法, 通过科学严密的统计方法比较各临床病理参数和评分指标.
我们的研究结果基本与预期相符, 我们发现各客观营养指标中, 营养风险指数(nutritional risk index, NRI)是HCC患者根治性切除后总体生存率(overall survival, OS)的独立危险因素, 在预测HCC根治术后患者的预后方面优于其他基于客观营养指标的评分标准, 我们的研究对HCC行根治术后患者的预后具有重要价值.
我们首次发现各客观营养指标中, NRI是HCC患者根治性切除后OS的独立危险因素, 在预测HCC根治术后患者的预后方面优于其他基于客观营养指标的评分标准, 这对于HCC患者的预后极其重要.
在我们的研究过程中, 由于各种因素导致病人失访率较高, 损失了一部分资源, 未来研究中, 我们希望能有更大的临床数据以验证本研究结果的可靠性.
学科分类: 胃肠病学和肝病学
手稿来源地: 浙江省
同行评议报告分类
A级 (优秀): 0
B级 (非常好): B, B
C级 (良好): C, C, C, C
D级 (一般): 0
E级 (差): 0
编辑: 王禹乔 电编:刘继红
| 1. | Steel JL, Nadeau K, Olek M, Carr BI. Preliminary results of an individually tailored psychosocial intervention for patients with advanced hepatobiliary carcinoma. J Psychosoc Oncol. 2007;25:19-42. [PubMed] [DOI] |
| 2. | Cheng JW, Lv Y. New progress of non-surgical treatments for hepatocellular carcinoma. Med Oncol. 2013;30:381. [PubMed] [DOI] |
| 3. | Liver Cancer Study Group of Japan. Primary liver cancer in Japan. Clinicopathologic features and results of surgical treatment. Ann Surg. 1990;211:277-287. [PubMed] |
| 4. | Zhou L, Rui JA, Wang SB, Chen SG, Qu Q. LCSGJ-T classification, 6th or 5th edition TNM staging did not independently predict the long-term prognosis of HBV-related hepatocellular carcinoma after radical hepatectomy. J Surg Res. 2010;159:538-544. [PubMed] [DOI] |
| 5. | Llovet JM, Brú C, Bruix J. Prognosis of hepatocellular carcinoma: the BCLC staging classification. Semin Liver Dis. 1999;19:329-338. [PubMed] [DOI] |
| 6. | A new prognostic system for hepatocellular carcinoma: a retrospective study of 435 patients: the Cancer of the Liver Italian Program (CLIP) investigators. Hepatology. 1998;28:751-755. [PubMed] [DOI] |
| 7. | Alberino F, Gatta A, Amodio P, Merkel C, Di Pascoli L, Boffo G, Caregaro L. Nutrition and survival in patients with liver cirrhosis. Nutrition. 2001;17:445-450. [PubMed] |
| 8. | Caregaro L, Alberino F, Amodio P, Merkel C, Bolognesi M, Angeli P, Gatta A. Malnutrition in alcoholic and virus-related cirrhosis. Am J Clin Nutr. 1996;63:602-609. [PubMed] [DOI] |
| 9. | Faramarzi E, Mahdavi R, Mohammad-Zadeh M, Nasirimotlagh B. Validation of nutritional risk index method against patient-generated subjective global assessment in screening malnutrition in colorectal cancer patients. Chin J Cancer Res. 2013;25:544-548. [PubMed] [DOI] |
| 10. | Schwegler I, von Holzen A, Gutzwiller JP, Schlumpf R, Mühlebach S, Stanga Z. Nutritional risk is a clinical predictor of postoperative mortality and morbidity in surgery for colorectal cancer. Br J Surg. 2010;97:92-97. [PubMed] [DOI] |
| 11. | Migita K, Takayama T, Saeki K, Matsumoto S, Wakatsuki K, Enomoto K, Tanaka T, Ito M, Kurumatani N, Nakajima Y. The prognostic nutritional index predicts long-term outcomes of gastric cancer patients independent of tumor stage. Ann Surg Oncol. 2013;20:2647-2654. [PubMed] [DOI] |
| 12. | Mohri Y, Inoue Y, Tanaka K, Hiro J, Uchida K, Kusunoki M. Prognostic nutritional index predicts postoperative outcome in colorectal cancer. World J Surg. 2013;37:2688-2692. [PubMed] [DOI] |
| 13. | Kanda M, Fujii T, Kodera Y, Nagai S, Takeda S, Nakao A. Nutritional predictors of postoperative outcome in pancreatic cancer. Br J Surg. 2011;98:268-274. [PubMed] [DOI] |
| 14. | Yoshida N, Baba Y, Shigaki H, Harada K, Iwatsuki M, Kurashige J, Sakamoto Y, Miyamoto Y, Ishimoto T, Kosumi K, Tokunaga R, Imamura Y, Ida S, Hiyoshi Y, Watanabe M, Baba H. Preoperative Nutritional Assessment by Controlling Nutritional Status (CONUT) is Useful to estimate Postoperative Morbidity After Esophagectomy for Esophageal Cancer. World J Surg. 2016;40:1910-1917. [PubMed] [DOI] |
| 15. | Pinato DJ, North BV, Sharma R. A novel, externally validated inflammation-based prognostic algorithm in hepatocellular carcinoma: the prognostic nutritional index (PNI). Br J Cancer. 2012;106:1439-1445. [PubMed] [DOI] |
| 16. | Chan AW, Chan SL, Wong GL, Wong VW, Chong CC, Lai PB, Chan HL, To KF. Prognostic Nutritional Index (PNI) Predicts Tumor Recurrence of Very Early/Early Stage Hepatocellular Carcinoma After Surgical Resection. Ann Surg Oncol. 2015;22:4138-4148. [PubMed] [DOI] |
| 17. | Okamura Y, Ashida R, Ito T, Sugiura T, Mori K, Uesaka K. Preoperative neutrophil to lymphocyte ratio and prognostic nutritional index predict overall survival after hepatectomy for hepatocellular carcinoma. World J Surg. 2015;39:1501-1509. [PubMed] [DOI] |
| 18. | Takagi K, Yagi T, Umeda Y, Shinoura S, Yoshida R, Nobuoka D, Kuise T, Araki H, Fujiwara T. Preoperative Controlling Nutritional Status (CONUT) Score for Assessment of Prognosis Following Hepatectomy for Hepatocellular Carcinoma. World J Surg. 2017;41:2353-2360. [PubMed] [DOI] |
| 19. | Harimoto N, Yoshizumi T, Sakata K, Nagatsu A, Motomura T, Itoh S, Harada N, Ikegami T, Uchiyama H, Soejima Y, Maehara Y. Prognostic Significance of Preoperative Controlling Nutritional Status (CONUT) Score in Patients Undergoing Hepatic Resection for Hepatocellular Carcinoma. World J Surg. 2017;41:2805-2812. [PubMed] [DOI] |
| 20. | Bo Y, Yao M, Zhang L, Bekalo W, Lu W, Lu Q. Preoperative Nutritional Risk Index to predict postoperative survival time in primary liver cancer patients. Asia Pac J Clin Nutr. 2015;24:591-597. [PubMed] [DOI] |
| 21. | Pai MP, Paloucek FP. The origin of the "ideal" body weight equations. Ann Pharmacother. 2000;34:1066-1069. [PubMed] [DOI] |
| 22. | Fujiwara Y, Shiba H, Furukawa K, Iida T, Haruki K, Gocho T, Wakiyama S, Hirohara S, Ishida Y, Misawa T, Ohashi T, Yanaga K. Glasgow prognostic score is related to blood transfusion requirements and post-operative complications in hepatic resection for hepatocellular carcinoma. Anticancer Res. 2010;30:5129-5136. [PubMed] |
| 23. | Lai CC, You JF, Yeh CY, Chen JS, Tang R, Wang JY, Chin CC. Low preoperative serum albumin in colon cancer: a risk factor for poor outcome. Int J Colorectal Dis. 2011;26:473-481. [PubMed] [DOI] |
| 24. | Nojiri S, Kusakabe A, Shinkai N, Matsuura K, Iio E, Miyaki T, Joh T. Factors influencing distant recurrence of hepatocellular carcinoma following combined radiofrequency ablation and transarterial chemoembolization therapy in patients with hepatitis C. Cancer Manag Res. 2011;3:267-272. [PubMed] [DOI] |
| 25. | Cho YK, Chung JW, Kim JK, Ahn YS, Kim MY, Park YO, Kim WT, Byun JH. Comparison of 7 staging systems for patients with hepatocellular carcinoma undergoing transarterial chemoembolization. Cancer. 2008;112:352-361. [PubMed] [DOI] |
| 26. | Nojiri S, Joh T. Albumin suppresses human hepatocellular carcinoma proliferation and the cell cycle. Int J Mol Sci. 2014;15:5163-5174. [PubMed] [DOI] |
| 27. | Allison DB, Zannolli R, Faith MS, Heo M, Pietrobelli A, VanItallie TB, Pi-Sunyer FX, Heymsfield SB. Weight loss increases and fat loss decreases all-cause mortality rate: results from two independent cohort studies. Int J Obes Relat Metab Disord. 1999;23:603-611. [PubMed] |
| 28. | Drøyvold WB, Lund Nilsen TI, Lydersen S, Midthjell K, Nilsson PM, Nilsson JA, Holmen J; Nord-Trøndelag Health Study. Weight change and mortality: the Nord-Trøndelag Health Study. J Intern Med. 2005;257:338-345. [PubMed] [DOI] |
| 29. | Dempsey DT, Mullen JL, Buzby GP. The link between nutritional status and clinical outcome: can nutritional intervention modify it? Am J Clin Nutr. 1988;47:352-356. [PubMed] [DOI] |