修回日期: 2019-09-23
接受日期: 2019-09-30
在线出版日期: 2019-10-28
研究报道大蒜素(diallyl trisulfide, DATS)可以促进胃癌细胞(gastric cancer cells, GCC)中期阻滞, 我们研究发现DATS引起细胞周期蛋白B1(cyclinB1, CCNB1)表达增加, 而多数报道CCNB1在药物处理后中期阻滞阶段表达降低, 也有少数报道过表达CCNB1可以促进肿瘤的化疗敏感性, 因此DATS是否可以通过CCNB1的过表达促进多西紫杉醇(docetaxel, DOC)对GCC的敏感性.
研究DATS对GCC化疗药物DOC的增敏作用及其作用机制.
体外培养并取对数生长期BGC823细胞进行实验;采用流式细胞术检测大蒜素对BGC823细胞的增殖情况的影响, 从而选择最佳药物浓度和作用时间; 运用流式细胞术检测技术分析对照组、DATS组、DOC组、DATS+DOC组各组中BGC823细胞的增殖以及凋亡情况; Western blotting法测定CCNB1的表达水平变化规律, 从而分析判断CCNB1在DATS介导的化疗增敏效应中的作用.
DATS具有抑制BGC823细胞增殖的作用, 其25 μmol/L DATS作用12 h对BGC823细胞增殖的抑制作用最明显, DATS作用于BGC823细胞过程中诱导CCNB1表达增加; DOC组、DATS组和联合组BGC823细胞凋亡率、G2/M期细胞比例、CCNB1表达水平均显著高于空白对照组, 具有统计学意义(P<0.05), 其中联合组作用分别显著高于DOC组与DATS组, 具有统计学意义(P<0.05).
DATS可抑制BGC823细胞的增殖, DATS可以协同增加GCC对DOC的化疗敏感性, 其作用机制可能与诱导CCNB1的蛋白的表达增加有关.
核心提要: 目前大量研究发现大蒜素(diallyl trisulfide, DATS)对胃癌细胞(gastric cancer cells, GCC)的增殖、分化有一定的抑制作用, 但具体作用机制尚不清楚. 本研究使用胃癌BGC823细胞系, 采用流式细胞术、Western blotting等方法发现DATS对GCC的多西紫杉醇化疗有增敏作用且与细胞周期蛋白B1的表达有关.
引文著录: 王浩冉, 潘元明, 张玲. 大蒜素对胃癌细胞化疗增敏机制研究. 世界华人消化杂志 2019; 27(20): 1248-1255
Revised: September 23, 2019
Accepted: September 30, 2019
Published online: October 28, 2019
It is reported that diallyl trisulfide (DATS) can promote metaphase arrest of gastric cancer cells (GCC). We found that DATS can increase the expression of cyclin B1 (CCNB1), and many studies reported that the expression of CCNB1 decreased after metaphase arrest induced by drug treatment. Moreover, a few studies reported that overexpression of CCNB1 can promote the sensitivity of GCC to docetaxel (DOC). However, whether DATS promotes the sensitivity of GCC to DOC through overexpression of CCNB1 is still unclear.
To investigate the sensitization effect of allicin on GCC to chemotherapeutic drug DOC and the underlying mechanism.
BGC823 cells at logarithmic growth phase were cultured in vitro. Flow cytometry was used to determine the effect of allicin on BGC823 cell proliferation to determine the optimal drug concentration and treatment duration. The proliferation and apoptosis of BGC823 cells in blank control cells, DATS treated cells, DOC treated cells, and DATS + DOC treated cells were analyzed by flow cytometry. The expression of CCNB1 was determined by Western blot to determine the role of CCNB1 in DATS-mediated sensitization of GCC to chemotherapy.
DATS can inhibit BGC823 cell proliferation, and the optimal contration and treatment duration were 25 mol/L and 12 hours, respectively. During the process of BGC823 cell proliferation, DATS induced the increase of CCNB1 expression. The apoptosis rate, G2/M cell ratio, and CCNB1 expression level in BGC823 cells treated with DOC alone, DATS alone, and DOC plus DATS were significantly higher than those in blank control cells (P < 0.05), and the effects in cells treated with DOC plus DATS were significantly higher than those in cells treated with DOC or DATS alone (P < 0.05).
DATS can inhibit the proliferation of BGC823 cells. DATS can synergistically increase the sensitivity of GCC to DOC chemotherapy via mechanisms possibly related to the increased expression of CCNB1 protein.
- Citation: Wang HR, Pan YM, Zhang L. Mechanism for allicin to sensitize gastric cancer cells to chemotherapy. Shijie Huaren Xiaohua Zazhi 2019; 27(20): 1248-1255
- URL: https://www.wjgnet.com/1009-3079/full/v27/i20/1248.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v27.i20.1248
胃癌(gastric cancer, GC)是最常见的恶性肿瘤之一, 根据国际癌症研究机构的统计数据, 我国的GC发病和死亡例数均约占世界的50%[1,2], 一般到典型临床症状出现的时候, 疾病已经发展到进展期[3], 因此GC严重威胁着我国人民群众的健康. 对于进展期GC的综合治疗中化疗仍是重要的方式, 其中多西紫杉醇(docetaxel, DOC)是应用最广泛的紫杉烷类化疗药物, 主要作用在细胞微管系统, 与微管的β-tubinlin 结合, 抑制微管解聚[4-6], 并可特异性作用于细胞周期的M期, 通过阻断细胞周期中的M期, 使细胞不能分化, 从而发挥其抗肿瘤作用[7], 但DOC的毒性比紫杉醇大, 而且经常与其他化疗药物一起使用, 化疗药物的毒副作用和耐药性一直是进展期肿瘤治疗领域中的热点、难点问题[8], 如何利用天然化合物来增加化疗药物的敏感性及降低毒性作用是一种潜在的治疗策略. 既往研究提示大蒜素(diallyl trisulfide, DATS)具有抗癌和抑癌作用[9,10], DATS是大蒜中主要的生物活性物质, 1944年, 曾有人首次在实验室中分离并研究了蒜氨酸[11], 蒜氨酸是由蒜氨酸上的蒜氨酸酶(S-烯丙基-半胱氨酸亚砜)形成的, 蒜氨酸具有手性, 仅作为外消旋酶存在, 当大蒜粉碎时, 蒜素与蒜氨酸酶相互作用, 形成大蒜素, 它是大蒜中存在的一种含硫化合物的特有成分, 是多种含硫化合物的复合体, 有大量研究发现DATS能够抑制包括乳腺癌、肺癌、前列腺癌、肝癌、结肠癌等多种肿瘤细胞的增殖[12,13], 近年来部分研究提示DATS可以抑制胃癌细胞(gastric cancer cells, GCC)的增殖, 本课题组的前期试验证实DATS可以阻止细胞进入有丝分裂期, 发生G2/M期阻滞, 因此可以起到抑制细胞增殖的作用.
真核细胞的细胞周期分为G0/G1期、S期和G2/M期, 质量控制检查点的失败或调控分子的失衡, 包括周期蛋白、周期蛋白依赖性激酶(cyclin dependent kinases, CDKs)和CDK抑制剂, 在癌症的发展中起着重要作用[14,15]. 细胞周期蛋白B1(cyclinB1, CCNB1)是一种重要的细胞周期调节蛋白, 特别是CCNB1和CDK2是有丝分裂促进因子的组成部分, 是G2-M转化的关键角色[16-19]. CDK2的表达水平在整个细胞周期中通常是恒定的, 而CCNB1的表达是循环的, 并在G2-M转变时达到峰值[16,20]. 另外有研究发现半胱氨酸天冬氨酸特异性蛋白酶(cysteine aspartic acid specific protease, Caspase-3)在细胞凋亡中发挥着重要作用, 与真核细胞的凋亡密切相关, 在细胞凋亡的级联反应过程中, Caspase-3是细胞凋亡的执行蛋白, 参与多种因素诱导的细胞凋亡, 是级联反应中最关键的效应蛋白酶, 在凋亡的病理过程中发挥重要作用[21]. 因此本研究通过体外培养人BGC823细胞并给予DATS+DOC联合作用, 观察DATS对BGC823细胞对DOC化疗敏感性的作用, 并初步探讨了CCNB1是否参与了DATS对GCC的化疗敏感性的作用, 为临床上进展期GC的化疗提供理论依据.
细胞株人胃腺癌细胞株BGC-823细胞(购自上海图赫实业公司), BGC823细胞培养于1640细胞培养基(美国Gibco公司); 多西紫杉醇(杭州赛诺菲制药公司, 批号: J20150083); 大蒜素注射液(购自上海禾丰制药公司, 批号: H31022371), 兔抗人FHIT单克隆抗体(Abcam公司), 辣根过氧化物酶标记羊抗兔IgG抗体(北京中杉金桥公司); 兔抗caspase-3单克隆抗体(北京百奥莱博科技公司); 4, 6-二脒基-2-苯基吲哚(DAPI溶液)(DAKE公司), PBS缓冲液(美国Gibco公司); 碘化丙啶(propidium iodide, PI)(北京百奥莱博科技公司); 诺考达唑(武汉欣欣佳丽生物科技公司); β-actin单克隆抗体(Cell Signaling Technology公司); SDS-PAGE试剂(Sigma公司); RIPA蛋白裂解液(Beyo time公司); Annexin Ⅴ-FITC/PI双染试剂盒(碧波公司); 蛋白定量试剂盒(上海碧云天生物公司); ECL超敏发光液(北京普利莱公司); Cell Analyzer CA-Ⅱ型流式细胞仪(德国Partec公司); Multicycle 流式细胞仪细胞(美国Phoenix Flow Systems公司); BX43型光学显微镜(日本Olympus公司); ChemDoc XRS型化学发光成像仪(美国Bio-red公司); 5804R型高速冷冻离心机(德国Eppendorf公司); Odyssey凝胶成像系统(美国Li-COR公司).
1.2.1 流式细胞术检测BGC823细胞周期分析: 取对数生长期的BGC823细胞, 按1×106 cells/mL以1 mL加至24孔板, 再加入1 mL/孔的0 μmol/L、25 μmol/L、50 μmol/L、100 μmol/L浓度的DATS, 每组分别作用0 h、12 h、24 h、48 h、72 h, 37 ℃培养后收获, 用PBS缓冲液(0.01 mol/L, pH7.4)洗涤, 离心弃上清, 沉淀的细胞在不断振荡下逐滴加入1 mL无水乙醇进行固定, 置4 ℃保存待测. 然后用将固定的细胞离心, 弃乙醇, 用PBS洗涤, 将细胞悬浮于1 mL预处理液(2.1%柠檬酸, 0.5% Tween 20)中, 37 ℃水浴轻摇10 min, 然后加入DAPI染液, 4 ℃避光孵育30 min以上, 并用流式细胞仪进行检测. 检测结果用专用分析软件进行细胞周期分析.
1.2.2 DATS与DOC单独及联合作用对BGC823细胞凋亡的影响: 各组细胞经胰酶消化, 4 ℃离心5 min收集细胞, 用预冷的PBS洗涤溶液洗涤2次后, 制备浓度约1×105的单细胞混悬液, 加入100 μL缓冲液, 再加入5 μL A nnexin V-FITC和5 μL PI混匀, 避光室温孵育10 min后, 分别加入400 μL缓冲液并混匀后1 h内通过流式细胞仪检测并分析细胞凋亡情况.
1.2.3 Western blotting法检测CCNB1蛋白的表达水平: 收集各组细胞, 加入RIPA蛋白裂解液, 4 ℃ 12000 g离心20 min, 取上清, BCA蛋白定量试剂盒检测各组细胞总蛋白浓度, 蛋白样品与5×上样缓冲液按4:1比例涡旋均匀, 煮沸10 min, 冷却至室温后, -20 ℃保存备用. 等量蛋白SDS-PAGE电泳分离蛋白, 80 V恒压电泳30 min, 换电压为120 V, 继续电泳150 min左右, 依据蛋白分子大小而定. 将蛋白转移到硝酸纤维素膜上, 5%脱脂奶粉的TBST液(Tris-缓冲盐溶液)封闭1 h, 洗膜后加入按照1:1000稀释的兔抗人FHIT多克隆抗体, 4 ℃孵育摇床过夜. TBST充分洗膜, 10 min/次, 洗3次. 洗膜后, 用1:3000的辣根过氧化物酶标记的羊抗兔IgG抗体、caspase-3(1:1000)一抗溶液, 室温条件下孵育1 h, TBST充分洗膜, 10 min/次, 洗3次, 使用ECL显色, 按照说明书进行显色、曝光、显影、定影, 同样方法, 以β-actn(1:56000稀释)作为内参照. 通过Odyssey凝胶成像系统对实验结果进行拍照记录, 并进行蛋白条带灰度分析.
统计学处理 均运用SPSS 17.0软件进行统计学分析, 计量资料以mean±SD表示, 组间均数两两比较采用t检验, 统计分析采用单因素方差分析或双因素方差分析及重复测量设计的方差分析, P<0.05为差异有统计学意义.
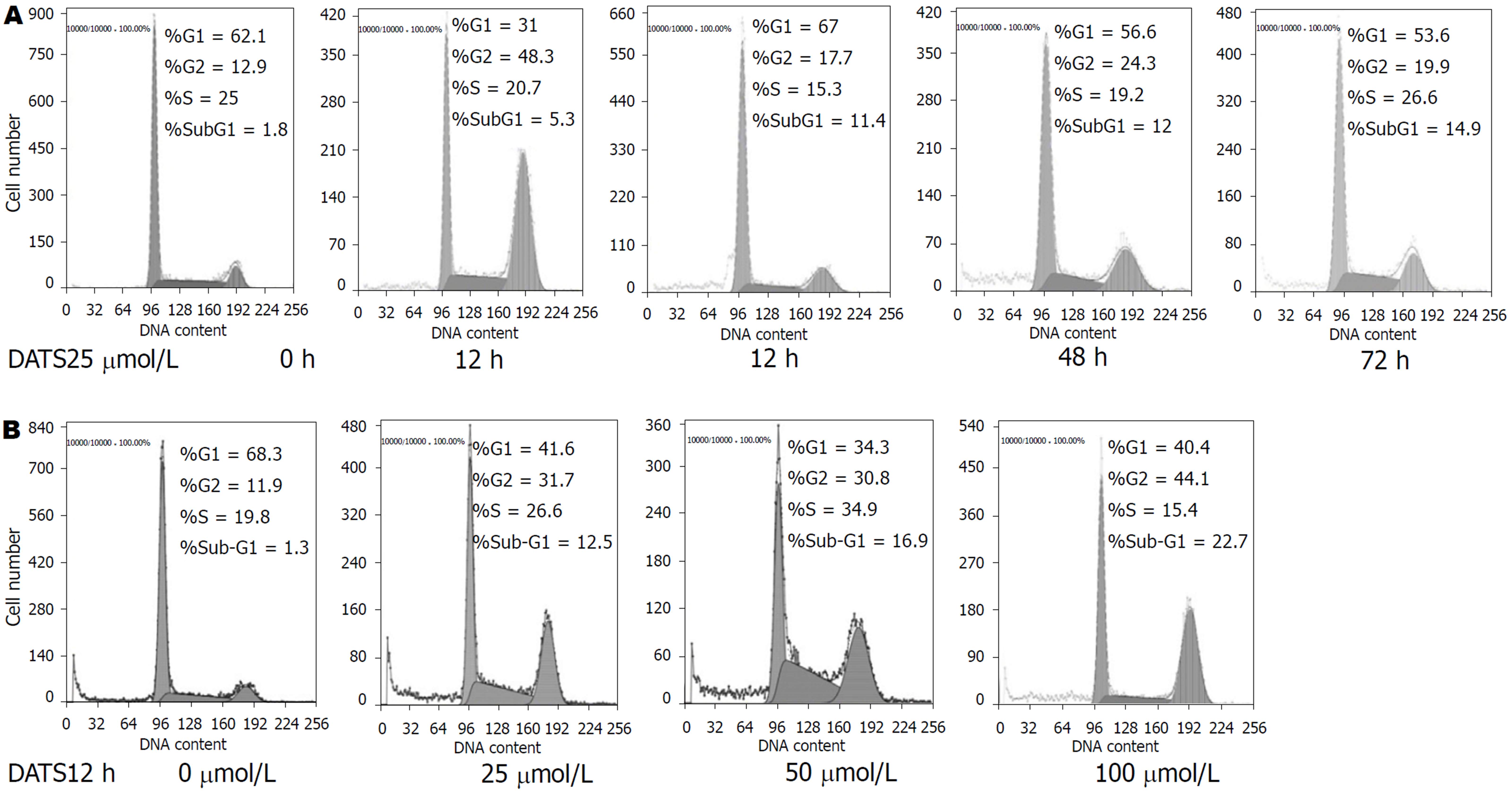
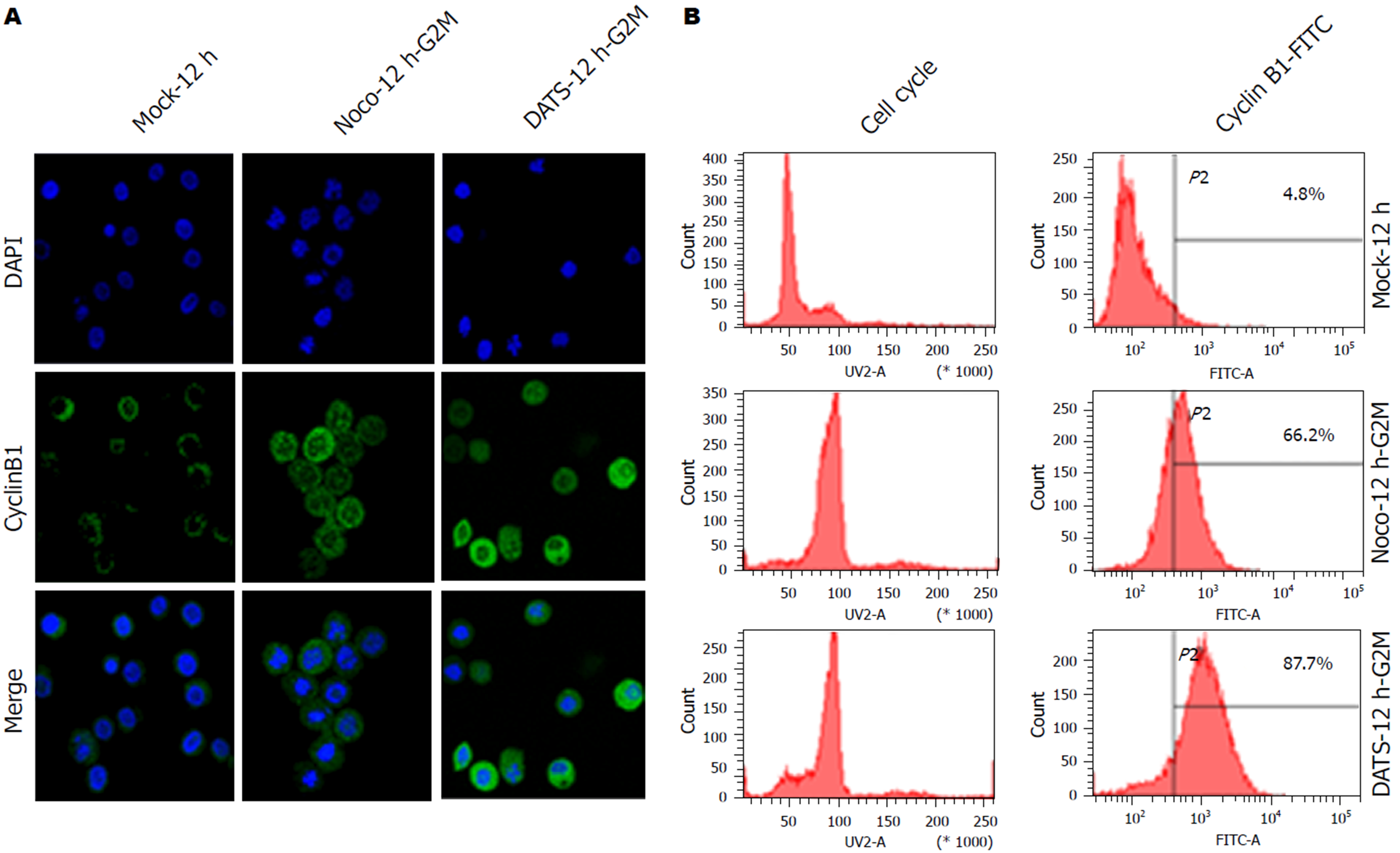
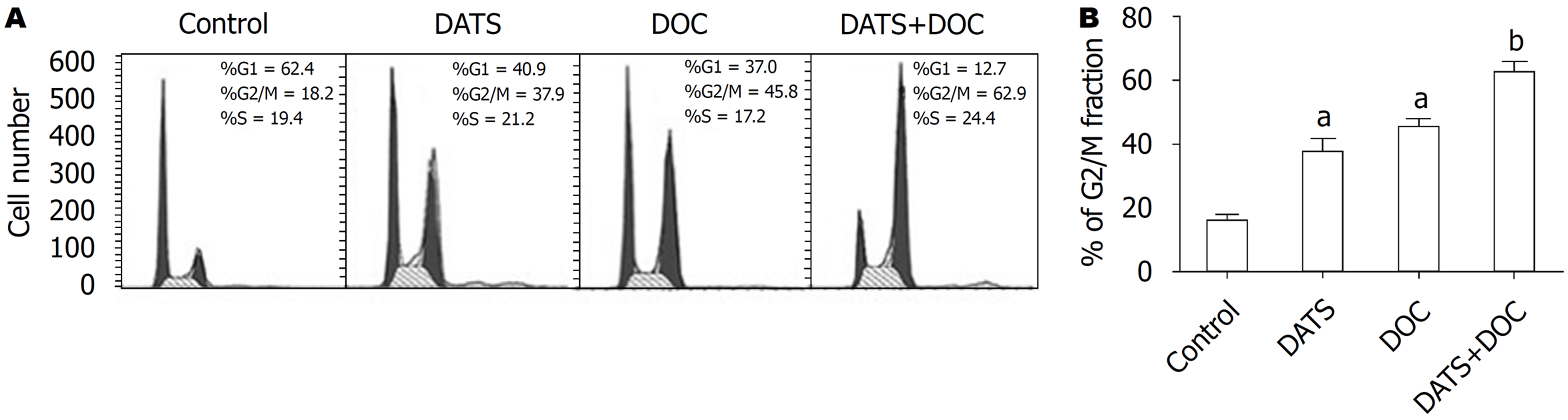
BGC823细胞的细胞周期经DATS处理后均发生了明显的变化, 与空白对照组相比主要表现为G1期细胞减少, G2/M期细胞增多, 表明BGC823细胞经DATS处理后细胞周期阻滞于G2/M期, 且大蒜素浓度为25 μmol/L、作用时间为12 h时对BGC823细胞的抑制作用最明显(图1). 在实验中进一步运用免疫荧光和流式细胞术对DATS作用后的BGC823细胞进行分析, 发现DATS作用于BGC823细胞后, 细胞内出现CCNB1的累积现象, 对BGC823细胞进行同步化处理后再次使用25 μmol/L DATS作用于BGC823细胞结果DATS组的CCNB1的蛋白表达水平升高(图2, 3). 同时也证实DATS处理后引起了细胞中期阻滞和凋亡的增加.
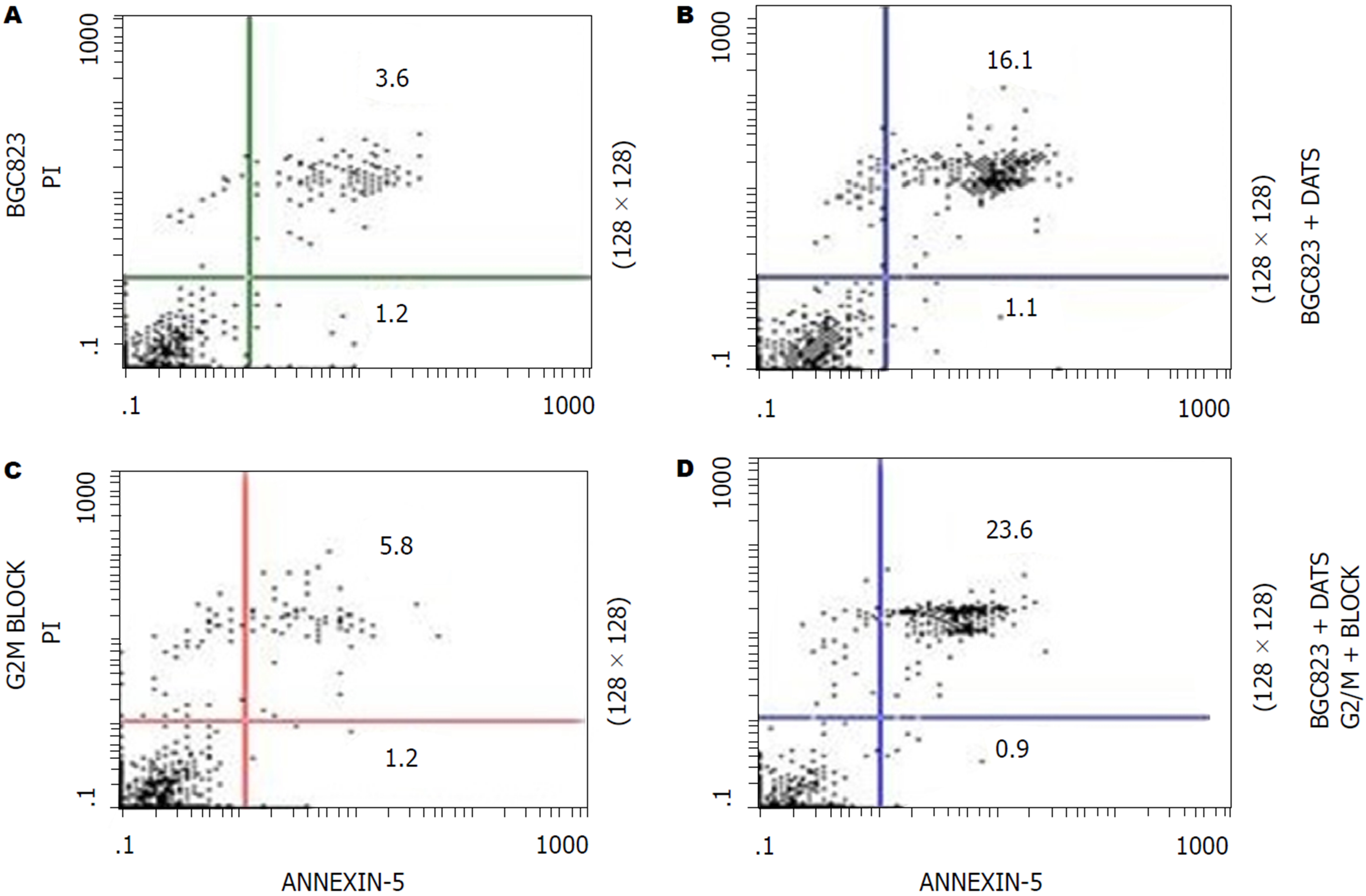
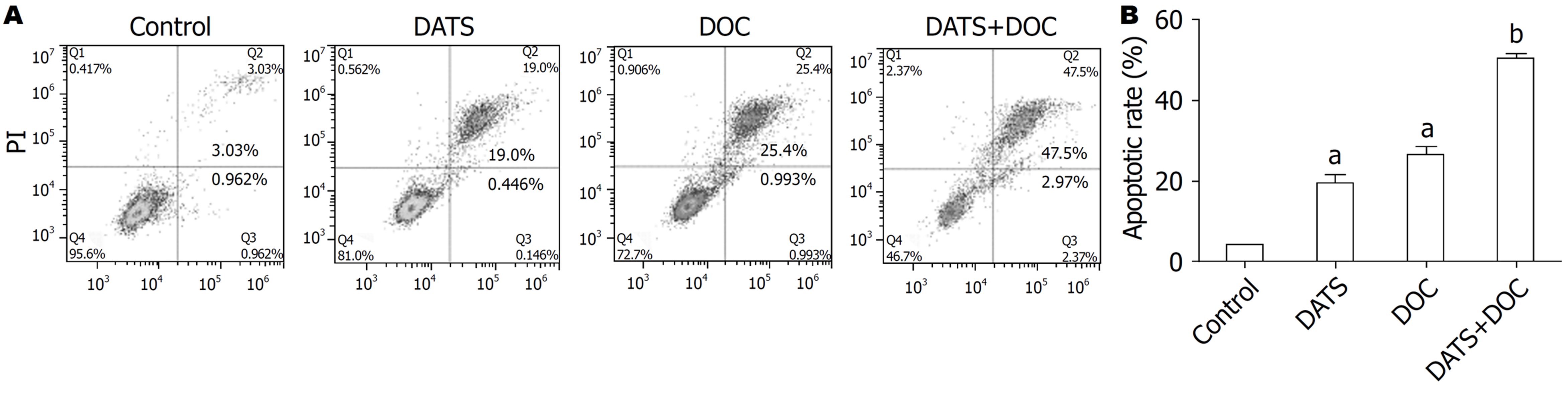
DATS组、DOC组和联合组细胞凋亡率均显著高于空白对照组(P<0.05), 且DATS+DOC联合组显著高于DOC组(P<0.05)(图4).
DATS组、DOC组和联合组BGC823细胞周期G2/M期比例显著高于空白对照组(P<0.05); DOC组和联合组BGC823细胞周期G1期比例显著低于空白对照组(P<0.05); 联合组胃癌BGC823细胞周期G1期比例显著低于DATS组和DOC组(P<0.05); G2/M期比例显著高于DATS组和DOC组(P<0.05)(图5).
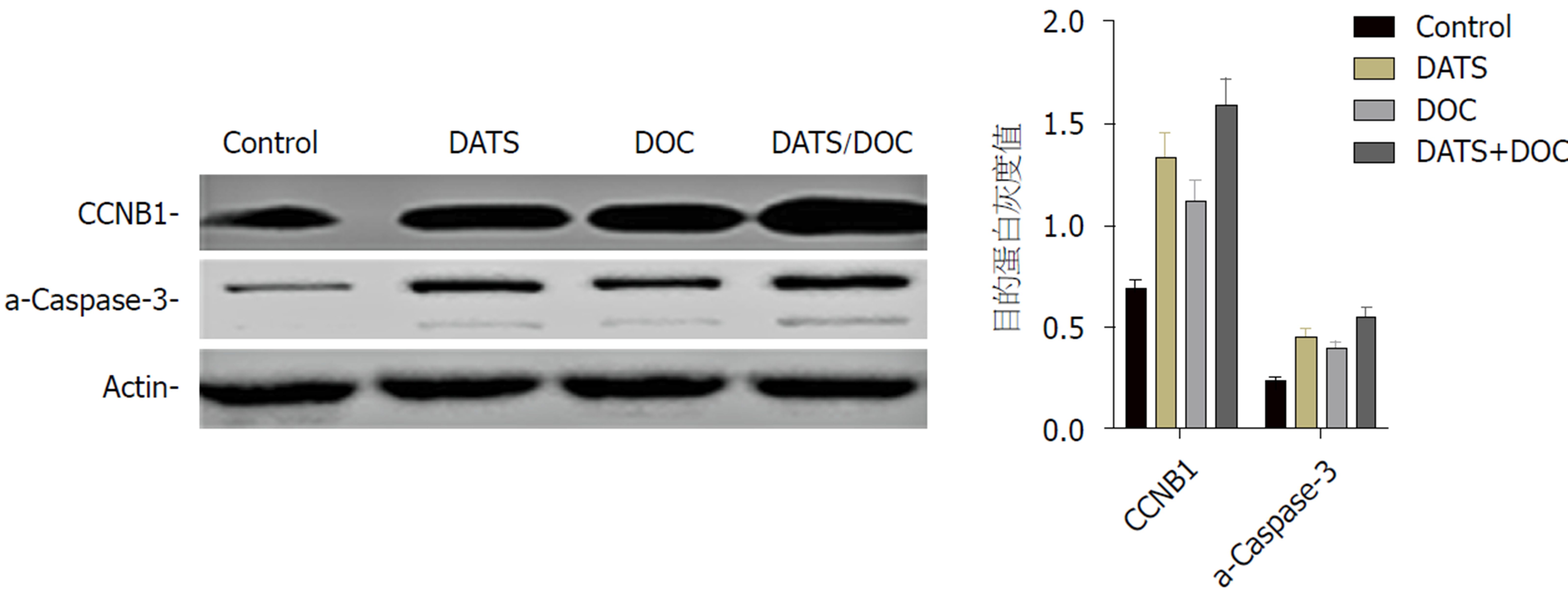
Western blotting结果显示各组分别给药后胃癌BGC823细胞中CCNB1表达在联合给药后表达显著增加, 活化型caspase-3表达增加(图6).
GC是消化道恶性肿瘤中最常见的肿瘤之一, 可在任何年龄段发病, 40-60岁之间居多, GC的病因不明, 可能与饮食、生活方式、环境因素、遗传、心理因素和幽门螺杆菌感染等许多因素有关[22,23]. 目前早期GC的治疗多通过手术方式进行治疗, 而进展期GC, 除手术治疗外还需要更多的综合治疗, 目前进展期GC的一线化疗大多是多种细胞毒性药物[24], 且单一化疗的效果有限, 需要研究新的更为有效的化疗药物或化疗方案. 本课题研究了DATS对BGC823细胞的抑制肿瘤细胞增殖的作用效果, 并探讨了DATS对GCC化疗药物DOC的增敏作用及其作用机制.
DATS是大蒜粉碎后加水蒸馏而得到的大蒜挥发油, 其主要成分为二烯丙三硫[25,26], 具有天然性和低毒性的特点, 已有研究发现, 较低浓度的DATS即可抑制肿瘤细胞迁移, 诱导细胞凋亡[27,28]. 目前有大量研究表明DATS对多种肿瘤细胞的生长、增殖、分化有一定的抑制作用[13,29-31], 本实验已证实不同浓度的DATS作用于BGC823细胞后, 细胞凋亡率测定结果显示, DATS浓度为25 μmol/L、作用时间为12 h时肿瘤细胞中期阻滞和凋亡增加, DATS作用于培养细胞后, 流式细胞仪检测及光镜下的形态学观察结果显示,细胞周期大多被阻滞于M期, 同时可以促进CCNB1的累积.
在临床上DATS作为治疗恶性肿瘤的辅助用药已经得到广泛的应用, Gao等[32]研究证明联合应用DATS后可以增强化疗药物环磷酰胺的药物作用, 明显降低肿瘤的生长. 谢军等[33]研究也发现, DATS联合环磷酰胺对肿瘤细胞增值抑制作用明显高于单一环磷酰胺用药组. 另外, 有研究发现DATS具有增强化疗药物5-氟尿嘧啶(5-fluorouracil, 5-FU)诱导肝癌细胞的细胞毒性[10]. 因此, 联合应用DATS对化疗药物的增敏作用在少许实验中已经证实, 本实验通过DATS与DOC单独或联合作用检测对BGC823细胞凋亡及细胞周期的结果显示: 与单用DOC组比较, 联合组能够更加显著的将胃癌BGC823细胞周期阻滞于G2/M期, 抑制细胞有丝分裂, 显著提高BGC823细胞凋亡率, 提示DATS能够增强胃癌BGC823细胞对DOC化疗敏感性, 即DATS对BGC823有化疗增敏作用. 进一步我们应用Western blotting检测DATS作用前后CCNB1表达的变化, 结果显示, 空白对照组、DATS组、DOC组中CCNB1表达量少, DATS+DOC组的CCNB1表达较前3组明显表达增多, 表明DATS都能够促进GCC的调亡, 且两者具有协同作用, 这种促凋亡作用可能与CCNB1过表达相关, 其具体机制有待于进一步阐明.
综上所述, DATS可增强BGC823细胞对DOC化疗敏感性, 可能与诱导CCNB1的蛋白的表达增加有关, 具体机制需进一步研究.
胃癌(gastric cancer, GC)是全球常见的恶性肿瘤, 晚期患者预后相对较差, 而进展期GC的治疗多通过手术或联合辅助化疗进行治疗, 目前临床中GC的化疗药物多种多样, 其中多西紫杉醇(docetaxel, DOC)是最常见的化疗药物之一. DOC为新一代紫杉醇类衍生物, 可特异性作用于细胞周期的M期, 通过阻断细胞周期中的M期, 使细胞不能分化, 从而发挥其抗肿瘤作用, 近年来部分研究提示大蒜素(diallyl trisulfide, DATS)可以抑制胃癌细胞(gastric cancer cells, GCC)的增殖, 发生G2/M期阻滞, 因此可以起到抑制细胞增殖的作用. 目前DOC的临床应用受耐药性的限制, 寻找耐药辅助增敏的研究倍受关注, 因此拟通过本课题研究探讨DATS对GCC化疗增敏的分子生物学机制.
本研究拟通过实验研究验证DATS是否可以增加GCC对于化疗药物DOC的敏感性, 明确细胞周期蛋白B1(cyclinB1, CCNB1)是否参与DATS抑制GCC增殖的作用, 为临床肿瘤化疗提供新的思路.
明确DATS抑制GCC增殖的作用机制. 明确DATS是否对DOC对GCC的化疗作用有增敏作用. 明确CCNB1是否参与了DATS 对GCC的化疗敏感作用.
从胃癌系中筛选出CCNB1表达阳性的BGC823 GCC, 然后细胞培养, 选择对数生长的细胞接种于培养瓶随机分成对照组和实验组, 利用流式细胞术、细胞凋亡、细胞周期分析等, 检测细胞周期分布比例变化. 设立空白对照组、加入DATS组、加入DOC组及加入DATS+DOC组, 应用流式细胞术实验方法检测DATS单独或联合DOC后BGC-823的增殖及细胞凋亡情况. 应用蛋白质印迹法检测上述各实验组分别给药后CCNB1的表达情况, 并应用免疫荧光与流式细胞术对比中期阻滞药诺考达唑处理后的BGC823细胞与富集大蒜素(DATS)诱导后的中期BGC823细胞中CCNB1的表达.
DATS可增强DOC对BGC823细胞的化疗敏感性, 且与诱导CCNB1的蛋白的表达增加有关, 为DATS在抑制肿瘤细胞增殖作用及抗癌机制提供理论依据, 且初步验证CCNB1参与DATS抑制肿瘤细胞增殖的作用.
我们研究结果发现, DATS可以明显抑制GCC增殖, 增加DOC的化疗敏感性, 其机制与诱导CCNB1的蛋白表达增加有关.
本研究首次通过实验研究验证DATS可以增加GCC疗药物DOC的敏感性, 初步证实DATS对化疗药物DOC的增敏作用与CCNB1的过表达有关, 后期将继续进一步探讨CCNB1表达调控的分子机制, 为临床表观遗传学干预治疗提供新的理论基础.
学科分类: 胃肠病学和肝病学
手稿来源地: 内蒙古自治区
同行评议报告分类
A级 (优秀): 0
B级 (非常好): 0
C级 (良好): C
D级 (一般): D
E级 (差): 0
编辑: 王禹乔 电编:刘继红
| 3. | Zhang W, Ha M, Gong Y, Xu Y, Dong N, Yuan Y. Allicin induces apoptosis in gastric cancer cells through activation of both extrinsic and intrinsic pathways. Oncol Rep. 2010;24:1585-1592. [PubMed] [DOI] |
| 4. | Vassilomanolakis M, Koumakis G, Barbounis V, Demiri M, Panopoulos C, Chrissohoou M, Apostolikas N, Efremidis AP. First-line chemotherapy with docetaxel and cisplatin in metastatic breast cancer. Breast. 2005;14:136-141. [PubMed] [DOI] |
| 5. | Giannakakou P, Villalba L, Li H, Poruchynsky M, Fojo T. Combinations of paclitaxel and vinblastine and their effects on tubulin polymerization and cellular cytotoxicity: characterization of a synergistic schedule. Int J Cancer. 1998;75:57-63. [PubMed] [DOI] |
| 6. | 多西紫杉醇对胃癌细胞作用及其机制的研究. 第四届中国肿瘤大会中国药理学会肿瘤药理专业委员会分会场学术会议论文摘要 2006. |
| 7. | 蒋 谦, 陈 环球, 周 晓明, 何 晓松, 戴 美红, 俞 军. 多西紫杉醇对人胃癌细胞BGC-823 hTERT启动子转录活性及其调控基因c-myc表达的研究. 中华肿瘤防治杂志. 2007;14:1531-1534. [DOI] |
| 8. | Lanza-Jacoby S, Cheng G. 3,3'-Diindolylmethane enhances apoptosis in docetaxel-treated breast cancer cells by generation of reactive oxygen species. Pharm Biol. 2018;56:407-414. [PubMed] [DOI] |
| 9. | Zhang X, Zhu Y, Duan W, Feng C, He X. Allicin induces apoptosis of the MGC-803 human gastric carcinoma cell line through the p38 mitogen-activated protein kinase/caspase-3 signaling pathway. Mol Med Rep. 2015;11:2755-2760. [PubMed] [DOI] |
| 10. | Zou X, Liang J, Sun J, Hu X, Lei L, Wu D, Liu L. Allicin sensitizes hepatocellular cancer cells to anti-tumor activity of 5-fluorouracil through ROS-mediated mitochondrial pathway. J Pharmacol Sci. 2016;131:233-240. [PubMed] [DOI] |
| 11. | Fujisawa H, Watanabe K, Suma K, Origuchi K, Matsufuji H, Seki T, Ariga T. Antibacterial potential of garlic-derived allicin and its cancellation by sulfhydryl compounds. Biosci Biotechnol Biochem. 2009;73:1948-1955. [PubMed] [DOI] |
| 12. | Gruhlke MCH, Antelmann H, Bernhardt J, Kloubert V, Rink L, Slusarenko AJ. The human allicin-proteome: S-thioallylation of proteins by the garlic defence substance allicin and its biological effects. Free Radic Biol Med. 2019;131:144-153. [PubMed] [DOI] |
| 13. | 陶 庆霞, 张 鹏, 吴 翠莹, 孙 恺, 郑 江华, 王 翀. 大蒜素抗肿瘤作用及其机制的研究进展. 中华神经创伤外科电子杂志. 2016;2:365-368. [DOI] |
| 14. | McDonald ER, El-Deiry WS. Cell cycle control as a basis for cancer drug development (Review). Int J Oncol. 2000;16:871-886. [PubMed] |
| 15. | Takizawa CG, Morgan DO. Control of mitosis by changes in the subcellular location of cyclin-B1-Cdk1 and Cdc25C. Curr Opin Cell Biol. 2000;12:658-665. [PubMed] |
| 16. | Norbury C, Nurse P. Animal cell cycles and their control. Annu Rev Biochem. 1992;61:441-470. [PubMed] [DOI] |
| 17. | Hiraoka D, Aono R, Hanada S, Okumura E, Kishimoto T. Two new competing pathways establish the threshold for cyclin-B-Cdk1 activation at the meiotic G2/M transition. J Cell Sci. 2016;129:3153-3166. [PubMed] [DOI] |
| 18. | Cho YC, Park JE, Park BC, Kim JH, Jeong DG, Park SG, Cho S. Cell cycle-dependent Cdc25C phosphatase determines cell survival by regulating apoptosis signal-regulating kinase 1. Cell Death Differ. 2015;22:1605-1617. [PubMed] [DOI] |
| 19. | Sun WJ, Huang H, He B, Hu DH, Li PH, Yu YJ, Zhou XH, Lv Z, Zhou L, Hu TY, Yao ZC, Lu MD, Shen X, Zheng ZQ. Romidepsin induces G2/M phase arrest via Erk/cdc25C/cdc2/cyclinB pathway and apoptosis induction through JNK/c-Jun/caspase3 pathway in hepatocellular carcinoma cells. Biochem Pharmacol. 2017;127:90-100. [PubMed] [DOI] |
| 20. | Hassan KA, Ang KK, El-Naggar AK, Story MD, Lee JI, Liu D, Hong WK, Mao L. Cyclin B1 overexpression and resistance to radiotherapy in head and neck squamous cell carcinoma. Cancer Res. 2002;62:6414-6417. [PubMed] |
| 21. | 张 亚利, 王 亚琼, 李 红. 平目方及其拆方含药血清对Graves眼病眼眶前脂肪细胞Caspase-3、Caspase-8和Caspase-9蛋白表达的影响. 中华中医药学刊. 2016;34:79-83. [DOI] |
| 22. | Zhang YW, Eom SY, Yim DH, Song YJ, Yun HY, Park JS, Youn SJ, Kim BS, Kim YD, Kim H. Evaluation of the relationship between dietary factors, CagA-positive Helicobacter pylori infection, and RUNX3 promoter hypermethylation in gastric cancer tissue. World J Gastroenterol. 2013;19:1778-1787. [PubMed] [DOI] |
| 23. | Massarrat S, Stolte M. Development of gastric cancer and its prevention. Arch Iran Med. 2014;17:514-520. [PubMed] |
| 26. | Wang CJ, Wang C, Han J, Wang YK, Tang L, Shen DW, Zhao Y, Xu RH, Zhang H. Effect of combined treatment with recombinant interleukin-2 and allicin on pancreatic cancer. Mol Biol Rep. 2013;40:6579-6585. [PubMed] [DOI] |
| 28. | Zhuang J, Li Y, Chi Y. Role of p38 MAPK activation and mitochondrial cytochrome-c release in allicin-induced apoptosis in SK-N-SH cells. Anticancer Drugs. 2016;27:312-317. [PubMed] [DOI] |
| 29. | Luo R, Fang D, Hang H, Tang Z. The Mechanism in Gastric Cancer Chemoprevention by Allicin. Anticancer Agents Med Chem. 2016;16:802-809. [PubMed] |
| 30. | Tao M, Gao L, Pan J, Wang X. Study on the inhibitory effect of allicin on human gastric cancer cell line SGC-7901 and its mechanism. Afr J Tradit Complement Altern Med. 2013;11:176-179. [PubMed] [DOI] |
| 32. | Gao XY, Geng XJ, Zhai WL, Zhang XW, Wei Y, Hou GJ. Effect of combined treatment with cyclophosphamidum and allicin on neuroblastoma-bearing mice. Asian Pac J Trop Med. 2015;8:137-141. [PubMed] [DOI] |