修回日期: 2018-11-23
接受日期: 2018-12-25
在线出版日期: 2019-01-28
肠嗜铬细胞(Enterochromaffin cell, EC)由肠上皮基底干细胞分化而来, 由于其特殊的组织化学染色特性而得名. EC主要分泌5-羟色胺, 并产生机体95%的5-羟色胺(5-hydroxytryptamine, 5-HT). EC作为化学感受器通过肠-脑回路与神经细胞建立直接突触联系, 感受胃肠道摄入的食物以及相关化学因子, 并以此调控胃肠道吸收营养物质. 另外, EC还参与肠道免疫调节功能. 值得注意的是EC数量以及其分泌的5-HT浓度的变化与多种肠道疾病密切相关. 总之, EC对胃肠道健康的作用不容小觑.
核心提要: 肠嗜铬细胞(Enterochromaffin cell, EC)由肠基底干细胞分化而来, 其分泌的5-羟色胺可促进促进肠道运动、上皮的分泌. EC可通过肠-脑回路与神经细胞建立直接突触联系, 感受胃肠道各种化学因子, 并以此调控胃肠道功能. EC对胃肠道健康具有非常重要的作用.
引文著录: 朱敏佳, 杨泽俊, 王菲菲, 狄治杉, 王跃秀, 李利生, 徐敬东. 肠嗜铬细胞与胃肠道疾病的研究进展. 世界华人消化杂志 2019; 27(2): 117-124
Revised: November 23, 2018
Accepted: December 25, 2018
Published online: January 28, 2019
Enterochromaffin cells (ECs), known for their special histochemical characteristics, originate from enteroblasts. For their important role in physiological and pathophysiological conditions, ECs in the gut could synthesize and secrete about 95% of 5-hydroxytryptamine (5-HT) in the body, which is an important humoral factor. As a chemosensor, ECs can regulate nutrition absorption and satiety through the sensory neural pathways. In addition, ECs participate in immune regulation. What's more, ECs and 5-HT are closely related to many kinds of gastrointestinal diseases.
- Citation: Zhu MJ, Yang ZJ, Wang FF, Di ZS, Wang YX, Li LS, Xu JD. Enterochromaffin cells and gastrointestinal diseases. Shijie Huaren Xiaohua Zazhi 2019; 27(2): 117-124
- URL: https://www.wjgnet.com/1009-3079/full/v27/i2/117.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v27.i2.117
肠嗜铬细胞[Enterochromaffin cell(EC), 又名嗜银细胞Kulchitsky]是一种肠上皮内分泌细胞, 尽管其散布于肠上皮细胞中, 占其总量的不到1%, 却在肠道内扮演了重要的角色. EC主要分泌5-羟色胺[5-hydroxytryptamine(5-HT)或serotonin, 血清素][1], 产生机体95%的5-HT; P物质等[2]. EC作为化学感受器通过肠-脑回路与神经细胞建立直接突触联系, 感受胃肠道摄入的食物以及相关化学因子, 调控胃肠道吸收营养物质. 除此之外, EC还参与肠道免疫调节功能, EC功能紊乱可导致多种肠道疾病. 基于此, 本文对EC结构、功能以及对肠道功能的调节角色重要性予以综述.
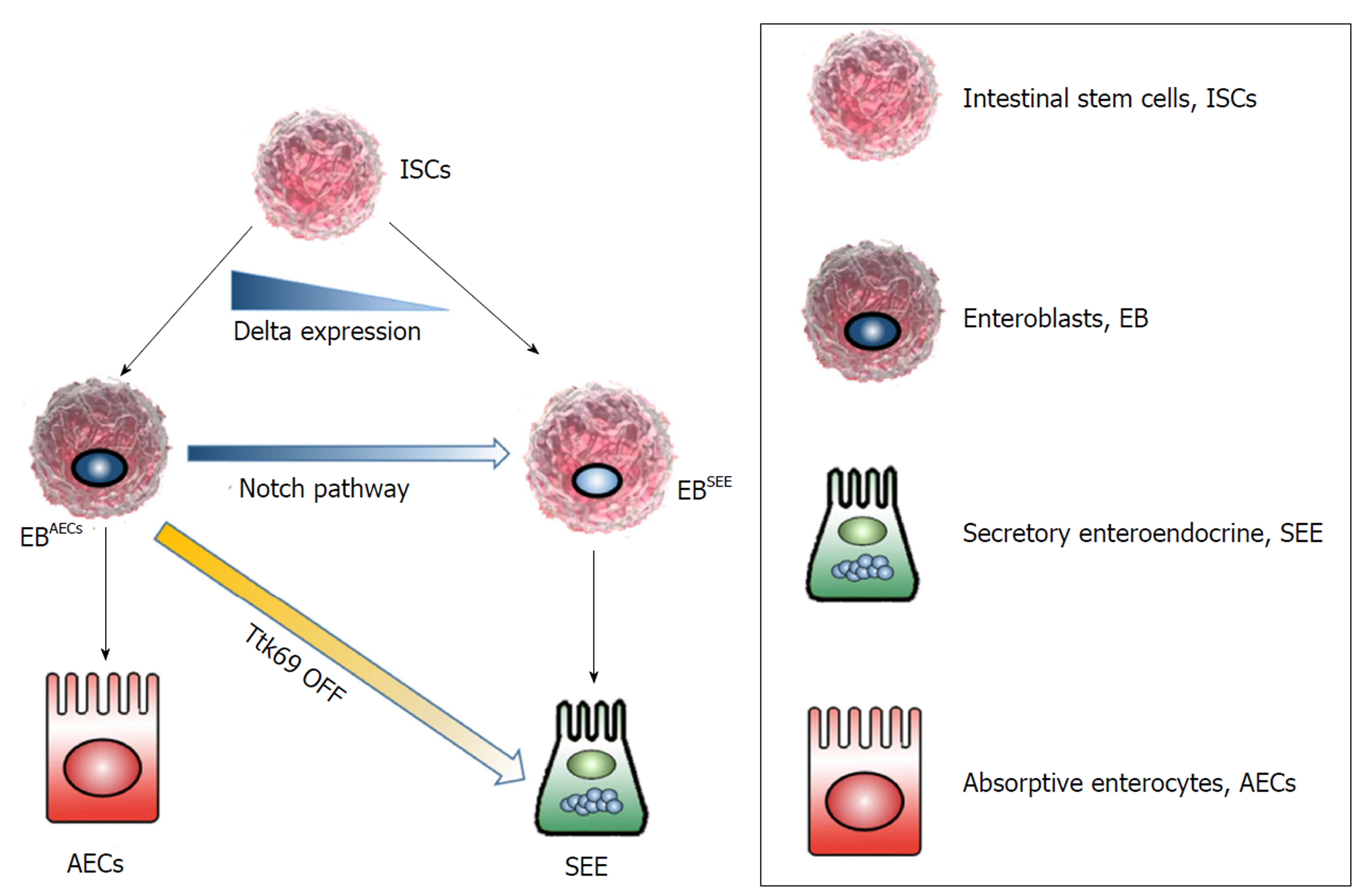
近150年以前, 研究[3]发现一种能够与铬盐结合的胃肠内分泌细胞, Ciaccio等给这种细胞起名为EC. 消化道EC散在分布于上皮及腺体细胞中, 位于肠绒毛间隐窝的小多角形(polygonal)细胞, 数量仅占肠上皮细胞的1%. 然而, EC却是肠内分泌细胞EEC中最常见的内分泌细胞. 尽管EC具有神经内分泌特性, 且在形态组织组成方面与肾上腺髓质细胞相似, 然而肾上腺髓质EC起源于神经嵴(neural crest), 而胃肠道EC起源于内胚层的胃肠腔干细胞(intestinal stem cells, ISCs)[4]. 嗜铬细胞的分化比较复杂, 通常分为两部分, 并且受到多种因素的调节. 上游通路通常由起源于内胚层的ISCs[4]在抑制Notch通路的情况下, 向内分泌细胞祖系的细胞分化, 即ISCs分化为肠内分泌细胞EEC的通路目前研究比较清楚, 主要是通过抑制Notch通路中的转录抑制因子Ttk69的BTB结构域等途径进行分化的(图1).
不同的ISCs由于其Notch信号通路的调控, Δ号通路的基因表达量不同而分化成不同的前体细胞肠上皮基底干细胞(Enteroblasts, EB)即EBAECs和EBSEE. 如果抑制TtK69基因, 则吸收型肠上皮细胞AECs的前体EB细胞会转化分化为SEE.
研究发现[5]ISC分化的前体细胞EB是个二元诱导分化的系统, 与Δ(Dl)基因表达有关. EB通过Notch通路的调控分化为吸收型肠上皮细胞(absorptive enterocytes, AECs), 而Notch通路受阻, 则分化为分泌型肠上皮细胞(secretory enteroendocrine, SEE)如EEC, 杯状细胞(goblet cell), 帕内特细胞(Paneth cell), M细胞(M cell)和簇细胞(tuft cell)等组成上皮隐窝-绒毛单元细胞. 除了Notch信号通路以外, 位于N端的BTB结构域, 由TtK基因座编码的转录抑制因子Ttk69也可调控EEC的分化. 研究发现[6], TtK69基因敲除鼠小肠中EEC细胞含量以及比例远大于野生型小鼠. 然而, 与以往认为Notch通路为EEC分化的最上游总通路的观点不同的是Ttk69在调控ISC的二元分化选择方面与Notch信号通路为平行关系, 即Ttk69基因的缺失并不影响Notch信号的激活, 而当Notch信号中断时, Ttk69蛋白的表达水平也基本不受影响, 且Ttk69基因缺失鼠即使过度激活Notch通路, 也不会降低EEC的分化. 虽然其下游通路, 即由EEC谱系定向分化为EC的研究报道较少, 目前少量研究仍旧认为这主要取决于胚胎中的bHLH蛋白神经源素3(Neurogenin3, Ngn3)的过度表达. Ngn3下游转录因子如Arx, Foxa1/2, Isl1, Insm1, Neurod1, Pax4和Pax6等可调控EEC的谱系亚群分化. 而Ngn3−/−敲除后动物缺乏有内分泌功能的EEC[7], 其中对十二指肠和结肠分泌Ghrelin细胞系和5-HT的EC细胞系影响最大. 同样Nkx2.2−/−后在小鼠胚胎水平上抑制Ngn3+祖细胞向EC分化. 有研究表明[8], Nkx2.2下游转录因子Lmx1a与EC的分化和功能具有密切联系, 这是由于Lmx1a缺陷小鼠体内TPH1蛋白的表达下降, 十二指肠和结肠5-HT的分泌减少.
EC具有嗜铬反应的特性[9,10], 除被重铬酸钾染成棕黄色鉴别, 亦可通过其他多种方法鉴定[11-14]EC在肠道中分布广泛, 在胃到直肠中均可以检测出来. 然而, EC在胃肠道不同位置甚至同一位置的不同区域的形态、受体以及相关转运体SERT均具有显著差异, 同时不同种属之间相比较, 各种不同特性EC比例也有显著性差别[11]. 十二指肠EC可以高表达TH-1, GLUT2(十二指肠含量富集后可高达结肠EC的400倍)、GLUT5和游离脂肪酸受体1、3(Free fatty acid receptor, FFAR1和FFAR3); 结肠EC则可以高表达GLUT1、FFAR2和FFAR4(结肠含量富集后可达十二指肠EC的4倍)[12,13], 可见EC的分布与胃肠道相关代谢功能息息相关[14]. 5-HT与缩胆囊素(cholecystokinin, CCK)的共区域化(colocalization)亦使得EC在十二指肠、空肠、回肠、盲肠、结肠中的重叠区域从结肠(15%)到盲肠(50%)呈现逐步上升的趋势, 而此趋势在结肠中断(结肠内无共区域化的重叠区域)[15]; 在肛管内EC也可以与分泌PYY和GLP-1的EEC共表达[16]. 同时, 不同种属之间EC的分布状态及其含量也不相同. 小鼠十二指肠内高达90%的内分泌细胞均为EC[17]; 在牛、猫和豚鼠中, EC主要存在于十二指肠和空肠; 而猪体内几乎不存在EC[18].
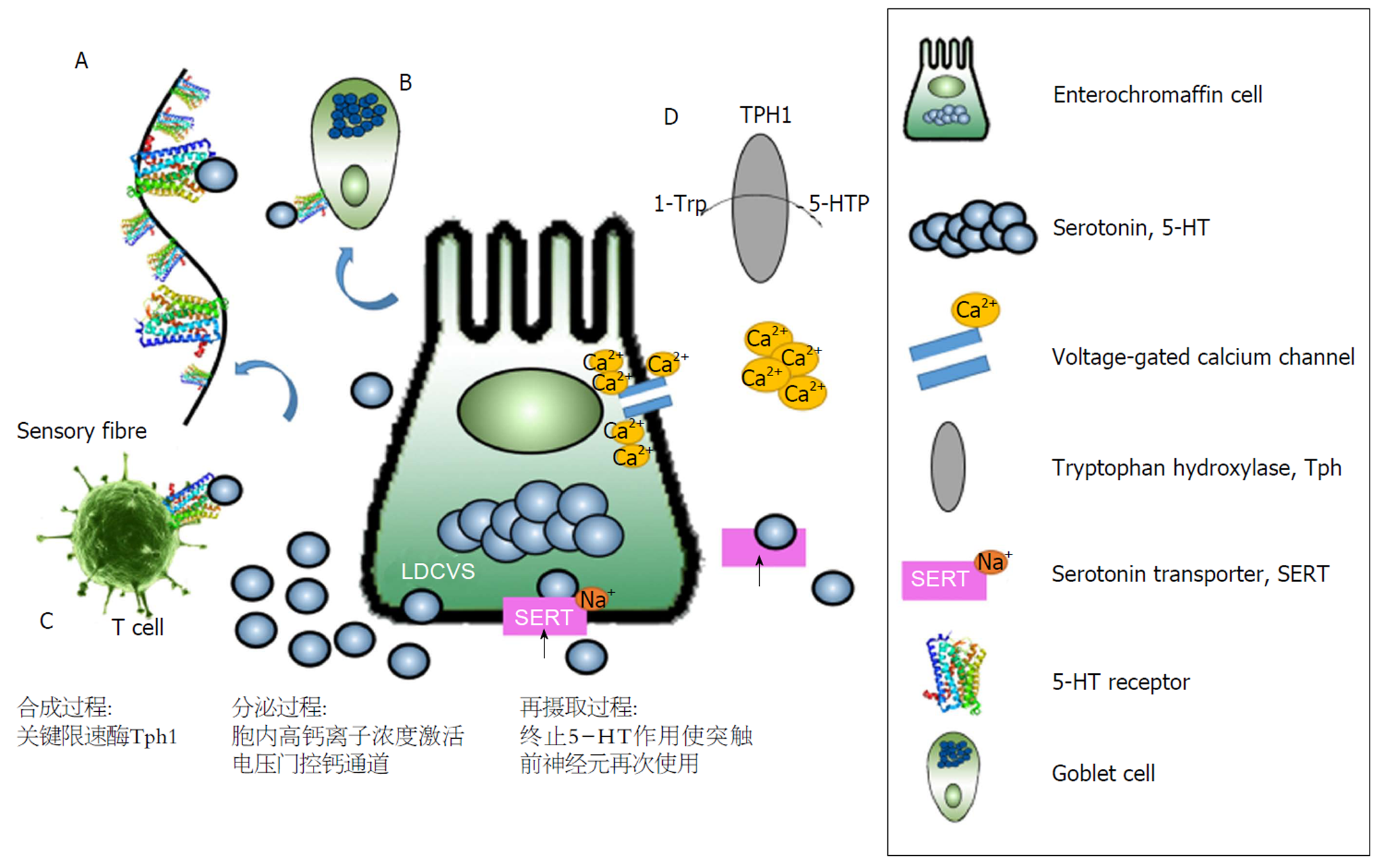
超过95%的5-HT由胃肠道中EC分泌产生, 5-HT的合成速率、释放量、释放速率、酶分解速率、细胞外扩散速率和再摄取速率可以由不同功能的蛋白质控制并实现相关调控[19], 其中最重要的介导蛋白为其合成相关限速酶, 具有多样性的受体, 迄今共发现14种5-HT受体亚型, 分为7个亚科, 而根据受体信号激活级联反应的细胞传导方式分为两类: 配体门控离子通道(ligand gated ion channel, LGIC)型和G蛋白偶联受体(G protein coupled receptor, GPCR)型, 其中通过LGIC进行第二信使激活的受体仅有一种(5-HT3 receptor)[20], 多富集在中枢和周围神经系统, 可以参与炎症反应[21]. 而其余均属于具有7个跨膜区段, 3个胞浆环和3个细胞外环的GPCR型[22], 主要包括: 5-HT1(5-HT1A、5-HT1B、5-HT1D、5-HT1E、5-HT1F)、5-HT2( 5-HT2A、5-HT2B, 5-HT2C)、5-HT4、5-HT5(5-HT5A、5-HT5B)、5-HT6、5-HT7. 多富集在其他分泌型EEC如GC以及感觉神经元上. 除以上哺乳动物常见5-HTR外, 还在马醉木属菜粉蝶的幼虫中发现新型无脊椎特异性受体Pr5-HT8(在蜜蜂和蚊子等昆虫的cDNA中同时存在)[23]. 不同的5-HT受体调节不同的机体功能, 由于其受体的多样性, 提示其作用具有复杂性. 而5-HT需要通过EC膜以及感觉神经元上的SERT介导细胞对5-HT的再摄取, 即从EC细胞周围以及突触间隙中去除5-HT, 使其重新进入突触小体回收、利用或者灭活, 以达到终止5-HT作用, 使突触前神经元再次使用的功能[24]. SERT是由SLC6A4基因[25]编码的蛋白质, SERT属于单胺转运蛋白(MATs), 通常以单体状态存在并发挥转运5-HT的功能, 然而最新研究表明[26], 在体外hSERT膜微环境中运用粗粒分子动力学研究方法, 通过测定基于自组装模型中二聚体的轨迹重构的平均力势(PMF)发现SERT的二聚体状态对其跨膜运输的功能具有特殊作用. 这个研究成果提示, 机体为提高5-HT通过EC膜的转运效率, 可以运用整合蛋白的低聚作用这一动态过程机制[27], 通过分子动力学模拟人类SERT(hSERT)二聚体, 发现在hSERT二聚体界面对称、涉及跨膜螺旋12(TM12)并存在类似于细菌同系物LeuT的晶体结构的情况下是最稳定的. 这一发现为神经递质再摄取相关的疾病提供了治疗的方向.
胃肠道通过肠神经系统自主、协调地完成蠕动、分泌反射. 肠嗜铬细胞释放5-HT, 激活黏膜下传入神经纤维, 通过肠神经系统调节局部的兴奋和抑制. 同时, 神经-体液-免疫调节系统发挥维持内环境稳态, 并发挥EC功能的作用.
5-HT的分泌有两条不同的通路, 即Ca2+依赖型和Ca2+非依赖型. Ca2+依赖型的胞外分泌依赖于电压门控钙通道的激活. 有研究表明[28], L-型钙通道(L-type calcium channel, LTCC)的选择性拮抗剂Amlodipine和Nifedipine能够有效抑制5-HT的分泌, 说明Ca2+依赖型分泌途径的存在. 然而, 阻断Ca2+依赖型通路后, EC的5-HT分泌功能也并没有完全消失, 提示还有可能有另外的途径存在. 研究表明[29]由Scn3a编码的钠通道NaV1.3可以通过Ca2+非依赖型通路影响EC的兴奋性和5-HT的释放. 在Tph1-CFP小鼠转基因模型, 即TPH阳性且表达CFP的小鼠小肠原代培养中发现, 通过膜片钳技术检测到EC有自发性锋电位爆发, 且伴随5-HT的释放, 即细胞去极化能够促进结肠EC大量释放5-HT. 人和小鼠结肠和小肠EC均表达电压门控钠通道, 给NaV1.3 ICA-121431(NaV1.3通道抑制剂)后5-HT的分泌减少; 但是使用NaV1.3通道激动剂BDS-1后5-HT分泌增加, 证明了Ca2+非依赖型通路的存在. 综上所述, 人体内同时存在这两种5-HT的分泌途径. 在EC发挥其分泌功能时, 由于细胞、组织、器官的特异性可能有所不同, 这两条通路所占的比例不同, 因此印证了EC纷繁复杂功能的特殊性. 在今后精准医疗的临床应用中, 由于EC分泌作用、机制的复杂性, 个体用药疗效可能会千差万别.
当然, 也有研究发现还有其他途径参与EC的分泌调节, 即5-HT的分泌也与多种因素的内环境稳态调控有关. 由于5-HT受体亚型多, 起作用复杂, 且相互之间甚至出现拮抗(主要为5-HT4受体)的现象, 由此引起了广大科学家的关注, 同时也是引起了临床医生用药治疗方面的高度重视. 5-HT分泌受多机制所控制[30], 5-HT与5-HTR3结合促进释放, 而5-HT4R抑制释放, 如药物5-HT4R激动剂替加色罗[31,32]和莫沙必利[33]抑制胃肠道分泌; 5-HT4R还可以通过胆碱能神经释放乙酰胆碱促进5-HT释放. 因此, 5-HT的调节作用是双向的, 体现了受体亚型之间调控的复杂性.
目前EC在肠道中的不可或缺的"第二感受器"的作用引起了广泛关注. 肠内分泌细胞存在一套特殊的细胞质系统, 即"肠道感受器", 能够使神经-上皮组织与神经系统建立直接突触联系. EECs可以直接与神经支配的神经细胞进行信息交换, 从而启动相应的功能性反应[34]. 为证实这种直接联系的存在, 在Cck-GFP, Pyy-GFP和Pyy-Cre小鼠的体内实验中, 将单向突触狂犬病病毒注入小鼠的结肠内腔, 实验结果发现这种嗜神经病毒通过感染肠内分泌细胞, 从而感染黏膜神经, 进而传递到小鼠的肠道、中枢神经系统, 构成神经-肠上皮回路[35,36]. EC是EEC感觉细胞中的重要组成部分, EC是一种感觉细胞, 它能够偶联营养物质、肠神经系统和肠道菌群[37]. 最新研究通过利用组织化培养EC, 显示其与神经感觉有直接联系[38]. 该项研究揭示了位于肠道上皮的EC可以作为直接感知来自体内和体外多种刺激的化学感受器, 并且可以与传入神经元建立突触连接从而进行信息传递, 从而实现对环境、代谢和稳态信息的检测和转导. 同时肠道微代谢产物可调节5-HT生物合成的[39], 并与某些病理生理状态有关[40]. 以上这些结果表明EC细胞确实可以作为有害化学刺激或其他影响胃肠道的损伤的前哨细胞. 然而, 目前对EC能够发挥传感器的功能有报道, 但它们对有些营养物质反应灵敏性的不同, 以及在胃肠道不同部位的变化情况的具体机制仍然不清, 且有关于对于其发挥功能的相关机制也有待于科研工作者揭开这一重要"第二感受器"神秘的面纱, 为今后与之相关的疾病提供理论基础.
目前肠道免疫与疾病的相关性研究已经成为医学热点. 而5-HT更是引起了关注. 有研究报道[41], 许多淋巴细胞上有5-HT受体的存在, 提示5-HT的分泌及其调节与肠道免疫功能息息相关. 5-HT可增强树突状细胞介导的T淋巴细胞活化[42,43]使其发挥增强免疫作用; 同时, 5-HT还可以提高巨噬细胞(macrophage, MM)的吞噬作用来提高肠道免疫功能等[44]. 更有趣的是, ENS与ECs之间神经-免疫的相互作用可体现在胆碱能抗炎通路中类似神经模式影响胃肠道内5-HT的水平, 说明胃肠道内复杂的神经免疫相互作用[45].
在肠道的炎症中, 急性炎症和慢性炎症对于5-HT水平与ECs数量的影响表现出不同的特点, 引起了科研工作者的广泛关注, 在UC患者中, 黏膜中EC减少, 5-HT含量减少, 但是每个EC分泌5-HT的功能并没有降低, 反而有所代偿性增加; 在活动性腹腔疾病的患者黏膜活检中发现EC细胞数和5-HT含量均有所升高; 在憩室炎患者中, 5-HT含量、EC数均未检出明显变化. 在这些不同的炎症性疾病中, EC分泌和再摄取对5-HT浓度的信号通路上游端变化各不相同, 上述所有情况均与上皮SERT表达水平降低有关. 但是, 尚未在炎症性疾病的儿童患者样本中检测到SERT的下降[46]. 然而, 与人类疾病相反的是在许多动物肠道炎症模型中[47-49], 包括豚鼠的TNBS结肠炎和回肠炎、小鼠的TNBS结肠炎、DSS结肠炎、柠檬酸杆菌肠炎和旋毛虫肠炎, 5-HT水平和ECs都有所增加, 5-HT的释放水平也相应增加. 同时, 其上皮SERT的表达减少. 虽然炎症反应的免疫调节与EC的5-HT信号通路机理尚不清楚, 但是人类疾病与动物模型的5-HT水平及EC数量上升下降趋势的不同可能与相应疾病的持续时间有关, 前者慢性疾病居多, 后者模型的建立则是人为诱导的急性炎症为主[46]. 这可能提示我们, 在不同的炎症阶段, 可启动不同的机体神经-体液调节的自我保护机制.
由于ECs在消化道具有重要的功能, EC功能失调, 例如5-HT信号系统异常可导致胃肠道动力及分泌功能异常、内脏高敏感性, 这些因素与功能性便秘、肠易激综合征(irritable bowel syndrome, IBS)、功能性腹泻及功能性消化不良(functional dyspepsia, FD)等胃肠道功能性疾病(functional gastrointestinal disorders, FGIDs)的发生密切相关. 相关临床研究[50]也发现功能性胃肠病患者的心理和精神状态异常远高于一般患者. 内脏高敏感和中枢感觉异常是IBS等FBD可能的潜在发病机制, 通过对SERT基因多态性的研究, 有可能揭示这些现象之间的内在联系并进一步阐明某些FBD的发病机制. 目前临床普遍认为肠道功能紊乱与EC数量及其分布的改变互为因果, 然而对于孰为起始因素, 孰为后续改变看法不一.
肠易激综合征(irritable bowel syndrome, IBS)是一种与慢性肠道不适和腹痛相关的疾病, 与胃肠道蠕动和分泌相关, 严重的IBS通常表现为慢性便秘或慢性腹泻. 研究表明[51], IBS患者常表现有5-HT浓度的异常和EC数量的异常. 腹泻型IBS(diarrhea-predominant IBS, IBS-D)患者体内5-HT水平升高, 反之在便秘型IBS(constipation-predominant IBS, IBS-C)患者体内5-HT水平降低. IBS患者的SERT表达水平和活性均表现为降低, TPH在基因层面的改变可以影响IBS患者体内5-HT水平, 进而调控其体内的排便习惯、炎症反应程度等.
虽然上述改变已成为经典治疗IBS的靶点的理论依据, 然而令人惊奇的是, 最新研究表明[52], TPH1基因表达的遗传变异如TPH1近端启动子变异体−347C/A; rs7130929可通过改变胃肠道中5-HT生物利用度而影响IBS患者的排便习惯倾向. 通过测定凝胶电泳迁移率判断-347C/A等位基因判断上游通路DNA核因子的结合, 发现早期生长响应因子1(EGR-1)可与高亲和力的位点如单核苷酸多态性(SNP)-347C/A的小A等位基因结合. 结果提示, TPH1启动子SNP-347 C/A与EGR-1的特殊亲和力与IBS患者排便习惯倾向以及结肠TPH1表达水平调控肠道5-HT信号通路相关. 在化学诱导的实验性结肠炎模型中, 缺乏TPH1的肠道炎症的严重程度均有所降低. 在小鼠肠道炎症模型中使用TPH抑制剂Telotristat etiprate(LX1032/LX1606)阻断由于5-HT合成引起肠道炎症IBS. 更有研究发现LX1606显著降低肠道5-HT水平, 延缓DSS诱导的急性和慢性结肠炎的发病及其严重程度[53]. 而经典治疗IBS的药物疗效可能出现反复发作等副作用. 目前最新研究有望成为治疗IBS的新模式, 新靶点的开发应用为临床新疗法的建立和提出打开了曙光.
乳糜泻(celiac disease, CD)是一种长期的自身免疫性疾病, 可诱发小肠的炎症反应, 导致小肠内绒毛缩短进而影响营养素的吸收, 故而CD患者常伴有贫血. CD是一种临床常见疾病, 给患者带来了长期慢性的痛苦, 尚无有效的治疗方法. 目前有研究表明[54], 尽管CD会造成绒毛萎缩, 而ECs数量却达到正常值的两倍及以上, 血浆5-HT水平的变化与消化不良症状显著相关, 且可能与类癌综合征和顺铂诱导的呕吐水平相当. 顽固性CD患者的十二指肠样本中TPH1基因表达量显著增加, 这为新药开发及治疗提供了新的思路, 值得科研及医务工作者关注.
当然, 除了替加色罗和莫沙必利等可以治疗IBS-C的药物外, 新一代高选择性5HT4受体激动剂普鲁卡必利和雷莫司琼被证实对于IBS治疗更具有特异性; 最新研究[55,56]发现5-HT受体药物也可以用于靶点治疗肺动脉高压(PAH)等呼吸系统疾病; 亦对消化系统肿瘤的靶向免疫疗法有所展望.
ECs不是一种简单的内分泌细胞, 其分泌的5-HT是肠道中重要的单胺类物质. 5-HT的合成、分泌以及再摄取过程(图2)与胃肠道的功能息息相关. 当5-HT与其他EEC以及感觉神经元上的5-HT受体结合并激活其下游调控功能, 同时EC的免疫调节功能可以与相关炎症反应疾病的组织形态学改变相互印证. 如果其数量、结构以及分泌功能呈现病理性改变, 则胃肠道的整体内环境稳态平衡会被打破. 由此可见, EC是实现肠-脑轴相关结构和功能的重要"调控者", 是形成相关反应回路的感受器以及效应器. 然而, EC分泌的5-HT具体的下游调控通路, 以及SERT再摄取对于后遗效应功能的改变等更多细节问题还有待进一步发现、研究和探讨.
学科分类: 胃肠病学和肝病学
手稿来源地: 北京市
同行评议报告分类
A级 (优秀): 0
B级 (非常好): 0
C级 (良好): C, C, C
D级 (一般): 0
E级 (差): 0
编辑: 崔丽君 电编:张砚梁
| 1. | Erspamer V, Asero B. Identification of enteramine, the specific hormone of the enterochromaffin cell system, as 5-hydroxytryptamine. Nature. 1952;169:800-801. [PubMed] |
| 2. | Heitz P, Polak JM, Kasper M, Timson CM, Pearse AG. Immunoelectron cytochemical localization of motilin and substance P in rabbit bile duct enterochromaffin (EC) cells. Histochemistry. 1977;50:319-325. [PubMed] |
| 3. | de Herder WW, Rehfeld JF, Kidd M, Modlin IM. A short history of neuroendocrine tumours and their peptide hormones. Best Pract Res Clin Endocrinol Metab. 2016;30:3-17. [PubMed] [DOI] |
| 4. | Thompson M, Fleming KA, Evans DJ, Fundele R, Surani MA, Wright NA. Gastric endocrine cells share a clonal origin with other gut cell lineages. Development. 1990;110:477-481. [PubMed] |
| 5. | Wang C, Xi R. Keeping intestinal stem cell differentiation on the Tramtrack. Fly (Austin). 2015;9:110-114. [PubMed] [DOI] |
| 6. | Wang C, Guo X, Dou K, Chen H, Xi R. Ttk69 acts as a master repressor of enteroendocrine cell specification in Drosophila intestinal stem cell lineages. Development. 2015;142:3321-3331. [PubMed] [DOI] |
| 7. | Jenny M, Uhl C, Roche C, Duluc I, Guillermin V, Guillemot F, Jensen J, Kedinger M, Gradwohl G. Neurogenin3 is differentially required for endocrine cell fate specification in the intestinal and gastric epithelium. EMBO J. 2002;21:6338-6347. [PubMed] |
| 8. | Gross S, Garofalo DC, Balderes DA, Mastracci TL, Dias JM, Perlmann T, Ericson J, Sussel L. The novel enterochromaffin marker Lmx1a regulates serotonin biosynthesis in enteroendocrine cell lineages downstream of Nkx2.2. Development. 2016;143:2616-2628. [PubMed] [DOI] |
| 9. | Carmichael SW. The adrenal chromaffin vesicle: an historical perspective. J Auton Nerv Syst. 1983;7:7-12. [PubMed] |
| 10. | Bausch B, Tischler AS, Schmid KW, Leijon H, Eng C, Neumann HPH. Max Schottelius: Pioneer in Pheochromocytoma. J Endocr Soc. 2017;1:957-964. [PubMed] [DOI] |
| 11. | Diwakarla S, Fothergill LJ, Fakhry J, Callaghan B, Furness JB. Heterogeneity of enterochromaffin cells within the gastrointestinal tract. Neurogastroenterol Motil. 2017;29. [PubMed] [DOI] |
| 12. | Martin AM, Lumsden AL, Young RL, Jessup CF, Spencer NJ, Keating DJ. Regional differences in nutrient-induced secretion of gut serotonin. Physiol Rep. 2017;5. [PubMed] [DOI] |
| 13. | Martin AM, Lumsden AL, Young RL, Jessup CF, Spencer NJ, Keating DJ. The nutrient-sensing repertoires of mouse enterochromaffin cells differ between duodenum and colon. Neurogastroenterol Motil. 2017;29. [PubMed] [DOI] |
| 14. | Philipsen A, Jørgensen ME, Vistisen D, Sandbaek A, Almdal TP, Christiansen JS, Lauritzen T, Witte DR. Associations between ultrasound measures of abdominal fat distribution and indices of glucose metabolism in a population at high risk of type 2 diabetes: the ADDITION-PRO study. PLoS One. 2015;10:e0123062. [PubMed] [DOI] |
| 15. | Fakhry J, Wang J, Martins P, Fothergill LJ, Hunne B, Prieur P, Shulkes A, Rehfeld JF, Callaghan B, Furness JB. Distribution and characterisation of CCK containing enteroendocrine cells of the mouse small and large intestine. Cell Tissue Res. 2017;369:245-253. [PubMed] [DOI] |
| 16. | Martins P, Fakhry J, de Oliveira EC, Hunne B, Fothergill LJ, Ringuet M, Reis DD, Rehfeld JF, Callaghan B, Furness JB. Analysis of enteroendocrine cell populations in the human colon. Cell Tissue Res. 2017;367:161-168. [PubMed] [DOI] |
| 17. | Roth KA, Gordon JI. Spatial differentiation of the intestinal epithelium: analysis of enteroendocrine cells containing immunoreactive serotonin, secretin, and substance P in normal and transgenic mice. Proc Natl Acad Sci USA. 1990;87:6408-6412. [PubMed] |
| 18. | Cetin Y. Secretin-cells of the mammalian intestine contain serotonin. Histochemistry. 1990;93:601-606. [PubMed] |
| 19. | Daws LC, Gould GG. Ontogeny and regulation of the serotonin transporter: providing insights into human disorders. Pharmacol Ther. 2011;131:61-79. [PubMed] [DOI] |
| 20. | Ito C, Isobe Y, Tsuchida K, Higuchi S. 5-Hydroxytryptamine3 receptor and regulation of gastric emptying in rats. Arch Int Pharmacodyn Ther. 1996;331:203-218. [PubMed] |
| 21. | Kato S. Role of serotonin 5-HT receptors in intestinal inflammation. Biol Pharm Bull. 2013;36:1406-1409. [PubMed] |
| 22. | Borroto-Escuela DO, Carlsson J, Ambrogini P, Narváez M, Wydra K, Tarakanov AO, Li X, Millón C, Ferraro L, Cuppini R, Tanganelli S, Liu F, Filip M, Diaz-Cabiale Z, Fuxe K. Understanding the Role of GPCR Heteroreceptor Complexes in Modulating the Brain Networks in Health and Disease. Front Cell Neurosci. 2017;11:37. [PubMed] [DOI] |
| 23. | Qi YX, Xia RY, Wu YS, Stanley D, Huang J, Ye GY. Larvae of the small white butterfly, Pieris rapae, express a novel serotonin receptor. J Neurochem. 2014;131:767-777. [PubMed] [DOI] |
| 24. | Worrall DM, Williams DC. Sodium ion-dependent transporters for neurotransmitters: a review of recent developments. Biochem J. 1994;29:425-436. [PubMed] |
| 25. | Okaty BW, Freret ME, Rood BD, Brust RD, Hennessy ML, deBairos D, Kim JC, Cook MN, Dymecki SM. Multi-Scale Molecular Deconstruction of the Serotonin Neuron System. Neuron. 2015;88:774-791. [PubMed] [DOI] |
| 26. | Periole X, Zeppelin T, Schiøtt B. Dimer Interface of the Human Serotonin Transporter and Effect of the Membrane Composition. Sci Rep. 2018;8:5080. [PubMed] [DOI] |
| 27. | Collingridge GL, Isaac JT, Wang YT. Receptor trafficking and synaptic plasticity. Nat Rev Neurosci. 2004;5:952-962. [PubMed] [DOI] |
| 28. | Hutchinson TE, Zhong W, Chebolu S, Wilson SM, Darmani NA. L-type calcium channels contribute to 5-HT3-receptor-evoked CaMKIIα and ERK activation and induction of emesis in the least shrew (Cryptotis parva). Eur J Pharmacol. 2015;755:110-118. [PubMed] [DOI] |
| 29. | Strege PR, Knutson K, Eggers SJ, Li JH, Wang F, Linden D, Szurszewski JH, Milescu L, Leiter AB, Farrugia G, Beyder A. Sodium channel NaV 1.3 is important for enterochromaffin cell excitability and serotonin release. Sci Rep. 2017;7:15650. [PubMed] [DOI] |
| 30. | Hagena H, Manahan-Vaughan D. The serotonergic 5-HT4 receptor: A unique modulator of hippocampal synaptic information processing and cognition. Neurobiol Learn Mem. 2017;138:145-153. [PubMed] [DOI] |
| 31. | Lyubashina OA, Busygina II, Panteleev SS, Nozdrachev AD. The 5HT4 receptor agonist prucalopride suppresses abdominal nociception. Dokl Biol Sci. 2015;461:76-79. [PubMed] [DOI] |
| 32. | Mine Y, Itakura T, Oku S, Asada R, Shimizu I. DSP-6952, a novel 5-HT4 receptor partial agonist, inhibits visceral hypersensitivity and ameliorates gastrointestinal dysfunction in experimental animals. Eur J Pharmacol. 2018;826:123-132. [PubMed] [DOI] |
| 33. | Li DY, Dai YK, Zhang YZ, Huang MX, Li RL, Ou-Yang J, Chen WJ, Hu L. Systematic review and meta-analysis of traditional Chinese medicine in the treatment of constipation-predominant irritable bowel syndrome. PLoS One. 2017;12:e0189491. [PubMed] [DOI] |
| 34. | Latorre R, Sternini C, De Giorgio R, Greenwood-Van Meerveld B. Enteroendocrine cells: a review of their role in brain-gut communication. Neurogastroenterol Motil. 2016;28:620-630. [PubMed] [DOI] |
| 35. | Shimko MJ, Zaccone EJ, Thompson JA, Schwegler-Berry D, Kashon ML, Fedan JS. Nerve growth factor reduces amiloride-sensitive Na+ transport in human airway epithelial cells. Physiol Rep. 2014;2. [PubMed] [DOI] |
| 36. | Bohórquez DV, Shahid RA, Erdmann A, Kreger AM, Wang Y, Calakos N, Wang F, Liddle RA. Neuroepithelial circuit formed by innervation of sensory enteroendocrine cells. J Clin Invest. 2015;125:782-786. [PubMed] [DOI] |
| 37. | Martin AM, Young RL, Leong L, Rogers GB, Spencer NJ, Jessup CF, Keating DJ. The Diverse Metabolic Roles of Peripheral Serotonin. Endocrinology. 2017;158:1049-1063. [PubMed] [DOI] |
| 38. | Bellono NW, Bayrer JR, Leitch DB, Castro J, Zhang C, O'Donnell TA, Brierley SM, Ingraham HA, Julius D. Enterochromaffin Cells Are Gut Chemosensors that Couple to Sensory Neural Pathways. Cell. 2017;170:185-198.e16. [PubMed] [DOI] |
| 39. | Yano JM, Yu K, Donaldson GP, Shastri GG, Ann P, Ma L, Nagler CR, Ismagilov RF, Mazmanian SK, Hsiao EY. Indigenous bacteria from the gut microbiota regulate host serotonin biosynthesis. Cell. 2015;161:264-276. [PubMed] [DOI] |
| 40. | Koh A, De Vadder F, Kovatcheva-Datchary P, Bäckhed F. From Dietary Fiber to Host Physiology: Short-Chain Fatty Acids as Key Bacterial Metabolites. Cell. 2016;165:1332-1345. [PubMed] [DOI] |
| 41. | Stefulj J, Jernej B, Cicin-Sain L, Rinner I, Schauenstein K. mRNA expression of serotonin receptors in cells of the immune tissues of the rat. Brain Behav Immun. 2000;14:219-224. [PubMed] [DOI] |
| 42. | O'Connell PJ, Wang X, Leon-Ponte M, Griffiths C, Pingle SC, Ahern GP. A novel form of immune signaling revealed by transmission of the inflammatory mediator serotonin between dendritic cells and T cells. Blood. 2006;107:1010-1017. [PubMed] [DOI] |
| 43. | León-Ponte M, Ahern GP, O'Connell PJ. Serotonin provides an accessory signal to enhance T-cell activation by signaling through the 5-HT7 receptor. Blood. 2007;109:3139-3146. [PubMed] [DOI] |
| 44. | Csaba G, Kapa E, Cserhalmi M. Hormone receptor studies on frog macrophage cells by means of histamine, serotonin and indoleacetic acid. Endokrinologie. 1975;65:219-223. [PubMed] |
| 45. | Yoo BB, Mazmanian SK. The Enteric Network: Interactions between the Immune and Nervous Systems of the Gut. Immunity. 2017;46:910-926. [PubMed] [DOI] |
| 46. | Faure C, Patey N, Gauthier C, Brooks EM, Mawe GM. Serotonin signaling is altered in irritable bowel syndrome with diarrhea but not in functional dyspepsia in pediatric age patients. Gastroenterology. 2010;139:249-258. [PubMed] [DOI] |
| 47. | Linden DR, Foley KF, McQuoid C, Simpson J, Sharkey KA, Mawe GM. Serotonin transporter function and expression are reduced in mice with TNBS-induced colitis. Neurogastroenterol Motil. 2005;17:565-574. [PubMed] [DOI] |
| 48. | O'Hara JR, Lomax AE, Mawe GM, Sharkey KA. Ileitis alters neuronal and enteroendocrine signalling in guinea pig distal colon. Gut. 2007;56:186-194. [PubMed] [DOI] |
| 49. | Bertrand PP, Barajas-Espinosa A, Neshat S, Bertrand RL, Lomax AE. Analysis of real-time serotonin (5-HT) availability during experimental colitis in mouse. Am J Physiol Gastrointest Liver Physiol. 2010;298:G446-G455. [PubMed] [DOI] |
| 50. | El-Gabalawy R, Mackenzie CS, Sareen J. Mental health service use among older Canadians with anxiety and comorbid physical conditions. Aging Ment Health. 2016;20:627-636. [PubMed] [DOI] |
| 51. | Mawe GM, Hoffman JM. Serotonin signalling in the gut--functions, dysfunctions and therapeutic targets. Nat Rev Gastroenterol Hepatol. 2013;10:473-486. [PubMed] [DOI] |
| 52. | Grasberger H, Chang L, Shih W, Presson AP, Sayuk GS, Newberry RD, Karagiannides I, Pothoulakis C, Mayer E, Merchant JL. Identification of a functional TPH1 polymorphism associated with irritable bowel syndrome bowel habit subtypes. Am J Gastroenterol. 2013;108:1766-1774. [PubMed] [DOI] |
| 53. | Kim JJ, Wang H, Terc JD, Zambrowicz B, Yang QM, Khan WI. Blocking peripheral serotonin synthesis by telotristat etiprate (LX1032/LX1606) reduces severity of both chemical- and infection-induced intestinal inflammation. Am J Physiol Gastrointest Liver Physiol. 2015;309:G455-G465. [PubMed] [DOI] |
| 54. | Di Sabatino A, Giuffrida P, Vanoli A, Luinetti O, Manca R, Biancheri P, Bergamaschi G, Alvisi C, Pasini A, Salvatore C, Biagi F, Solcia E, Corazza GR. Increase in neuroendocrine cells in the duodenal mucosa of patients with refractory celiac disease. Am J Gastroenterol. 2014;109:258-269. [PubMed] [DOI] |
| 55. | Kloza M, Baranowska-Kuczko M, Pędzińska-Betiuk A, Jackowski K, Kozłowska H. Serotonin hypothesis and pulmonary artery hypertension. Postepy Hig Med Dosw (Online). 2014;68:738-748. [PubMed] |