修回日期: 2019-07-03
接受日期: 2019-09-03
在线出版日期: 2019-10-08
随着研究的深入, 众多证据表明肠道屏障功能障碍是引起酒精性肝病(alcoholic liver disease, ALD)的关键机制. 本文就肠道屏障功能障碍的发生因素, 由此引起ALD的发病机制作一系统论述, 并就肠道功能障碍的治疗提出新的探索.
核心提要: 酒精性肝病(alcoholic liver disease, ALD)包括酒精性脂肪肝、酒精性肝炎、酒精性纤维化、酒精性肝硬化或并发肝癌一组疾病. 在世界范围内ALD是最常见肝脏疾病之一. 肠屏障功能障碍是促进ALD发病机制的关键因素. 酒精消耗会破坏肠道屏障, 增加肠道通透性, 并诱导细菌易位发生. 此外, 酒精消耗也导致肠道生态失调. 直至目前为止, 除戒酒外, ALD尚无有效的食品和药物治疗. 抗生素、益生元、益生菌和粪便微生物移植可恢复肠道屏障功能. 营养素治疗, 包括从膳食中补充锌、烟酸或饱和脂肪酸, 已被证明可调节紧密连接蛋白表达, 减轻肠道炎症, 并预防内毒素血症以及实验环境中由酒精引起的肝损伤. 总之, 临床和实验研究强调肠屏障在治疗ALD中的重要性和功效, 有待进一步研究与开发.
引文著录: 池肇春. 肠道屏障功能障碍与酒精性肝病研究进展. 世界华人消化杂志 2019; 27(19): 1179-1192
Revised: July 3, 2019
Accepted: September 3, 2019
Published online: October 8, 2019
Many studies have indicated that intestinal barrier dysfunction is the key mechanism of alcoholic liver disease (ALD). In this paper, we systematically review the causes of intestinal barrier dysfunction and the pathogenesis of ALD and discuss the treatment of intestinal barrier dysfunction.
- Citation: Chi ZC. Intestinal barrier dysfunction and alcoholic liver disease. Shijie Huaren Xiaohua Zazhi 2019; 27(19): 1179-1192
- URL: https://www.wjgnet.com/1009-3079/full/v27/i19/1179.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v27.i19.1179
在人类研究中, 大多数研究对象, 在20年或更长的时间里, 大量饮酒(超过100 g/d)可引起酒精性肝病(alcoholic liver disease, ALD). 过度(重度)饮酒定义为男性每周饮酒超过14次, 女性每周饮酒7次. 高达90%以上的饮酒过量的人会出现肝脂肪变性, 20%-40%发生肝纤维化, 进一步10%-20%发生肝硬化, 最后3%-10%发生肝细胞癌; 脂肪肝后有10%-20%患者发生酒精性肝炎. ALD最终因严重肝炎、肝衰竭、肝硬化并发病或肝癌导致死亡[1,2].
ALD包括广泛的临床-组织学谱系, 从单纯的脂肪变性、肝硬化、急性酒精性肝炎合并或不合并肝硬化到肝癌. 从概念上可以分为: (1)乙醇介导的肝损伤; (2)炎症性损伤免疫反应; (3)肠道通透性和微生物群的变化. 皮质类固醇可能改善结果, 但这是有争议的, 可能只影响短期生存.
ALD在我国尚无全国流行病学的调查报告, 但可肯定的说比西方欧美国家发病率要低. 但应当提出随着我国生产力的提高, 人民生活改善, 生活方式的改变, 伴随饮酒消费量的增加和饮酒人数的增多, ALD的流行率也在不断的上升, 应引起我们足够的重视. 根据世界卫生组织(世卫组织)发布的《2014年全球酒精与健康状况报告》, 酒精的使用已达到有害水平, 每年造成300多万人死亡, 占全世界死亡人数的5.9%. 由于酒精在机体中的代谢主要依赖于肝脏, 长期饮酒和过量饮酒会导致肝脏损伤, 并引发酒精性脂肪肝(alcoholic fatty liver disease, AFLD)[3], 有关ALD的发病机制错综复杂, 而且大部分研究是在动物模型中进行, 临床研究较少. 近10余年来研究显示, 除酒精引起肝损伤外 肠道微生物组成比例改变, 即生态失调、微生物及其代谢产物、细菌易位导致肠道屏障功能障碍、内毒素血症、机体免疫损伤是发生ALD的中心环节. 长期暴露于酒精中的动物和人类表现出机会性病原体的过度生长和有益肠道细菌的消耗. 肠道菌群的改变似乎在诱导和促进肝损伤进展中起着重要作用. 严重酒精性肝炎与肠道菌群的关键变化有关, 肠道菌群的改变似乎在诱导和促进肝损伤进展中起着重要作用.
ALD主要发病机制除酒精直接引起肝损伤外, 更重要的是酒精引起肠道微生物群的组成改变, 导致生态失调, 进而引起肠道屏障功能障碍, 致使肠黏膜通透性增加, 结果发生细菌易位, 同时大量的细菌、细菌代谢产物进入门静脉和肝, 而损伤相关分子包括三磷酸腺苷、尿酸、胆固醇晶体、β-淀粉样蛋白导致细胞分子的分泌, 造成肝脏的炎症、坏死和纤维化[4-6].
酒精通过多种方式导致肝脏损伤. 酒精被代谢成乙醛; 酒精和乙醛对肝细胞都有毒性作用. 受损的肝细胞反过来释放抑制物, 吸收先天和适应性免疫细胞, 使肝损伤永久化. 早期脂肪变性的酒精损伤是由酒精或脂肪生成和脂肪酸氧化作用介导的. 酒精对肠道微生物和肠道通透性也有直接影响, 使细菌产物到达肝脏, 并进一步刺激免疫反应和肝损伤. 最后, 尽管有免疫刺激, 免疫反应在对抗感染方面是无效的, 称为免疫麻痹.
乙醇在肝细胞中代谢的主要途径是通过胞质中的乙醛脱氢酶(aldehyde dehydrogenase, ALDH). 乙醛在线粒体中被ALDH代谢. 醛具有高度反应性, 可形成各种蛋白质和DNA加合物[7]. 由于ALDH2同工酶的相对缺乏导致乙醛的积累. 次要途径涉及微粒体乙醇氧化系统, 并产生更多的活性氧(reactive oxygen species, ROS)种类, 导致脂质过氧化、线粒体谷胱甘肽和S-腺苷甲硫氨酸耗尽. 慢性酒精中毒引起细胞色素p4502e1(cytochrome P4502E1, CYP2E1)进一步导致氧化应激和肝损伤.
酒精代谢导致氧化应激和肝细胞死亡. 受损的肝细胞释放内源性损伤相关分子模式(damage associated molecular patterns, DAMPs), 这些DAMPs通常隐藏在细胞外环境中. DAMPs激活细胞模式识别受体, 导致无菌炎症. 其特点包括产生促炎细胞因子, 将免疫细胞定位到损伤部位, 以及组装一种被称为"炎性小体"的细胞酚蛋白复合物, 将信号传递到促炎细胞因子中, 例如白细胞介素(interleukin-1, IL-1). 在正常情况下, DAMPs仍然隐藏在细胞外环境中, 并在组织受伤时释放. 已知几种DAMP包括三磷酸腺苷、尿酸、胆固醇晶体、β-淀粉样蛋白、焦磷酸钙脱水晶体和细胞溶质DNA会触发一种称为"炎症小体"的细胞溶质蛋白复合物的组装, 这种复合物激活含半胱氨酸的天冬氨酸蛋白水解酶(cysteinyl aspartate specific proteinasecaspase-1, Caspase-1), 并导致细胞因子如IL-1β和IL-18的分泌[4]. 炎症小体在ALD中的作用,炎症小体是通过核苷酸结合寡聚化域受体[通常称为NOD样受体(nucleotide binding oligomerization domain-like receptors, NLRs)]感知危险信号的多蛋白复合物. NLR包含配体识别域、负责寡聚化的中心域和N端激活域. 在炎症信号激活后, NLR与效应分子Caspase-1抗体前体形成复合物. 然后, 炎症小体可以低聚并激活Caspase-1, 从而导致促炎细胞因子pro-IL-1β和pro-IL-18成熟为IL-1β和IL-18[8]. 肝脏疾病中最典型的炎症激活信号是ATP、尿酸、棕榈酸、胆固醇晶体和ROS. 迄今为止, 有关尿酸、三磷酸腺苷和ROS与酒精诱导的肝脏炎症有关, 其它炎症激活信号在ALD中的作用尚待研究阐明.
1.2.1 肠道屏障: 肠黏膜由几种有助于其作为物理和免疫防御屏障的功能的元素组成. 主要包括具有共生肠道微生物群的外黏液层、抗菌蛋白(antimicrobic proteins, AMPs)和分泌免疫球蛋白A(secretory IgA, sIgA)分子、具有专门上皮细胞的中央单细胞层和先天及适应性免疫细胞(如T细胞、B细胞、巨噬细胞和树突状细胞)存在的内层固有层[9,10].
肠屏障是一种半透性结构, 允许吸收必需的营养素和免疫感应, 同时限制致病分子和细菌. 结构组分和分子组分共同作用以完成胃肠道这一复杂但重要的功能. 粘液层在肠上皮上形成筛子状结构. AMPs和SIgA作为免疫传感和调节蛋白在粘液层分泌. 肠上皮细胞(intestinal epithelial cells, IECs)形成一个连续的单层, 并通过连接复合物紧密相连. 紧密连接(tight junctions, TJs)位于细胞的顶端, 调节小分子和离子的转运. 黏附连接(adhesive junctions, AJs)和桥粒提供了严格的细胞黏附结合能力, 有助于维持肠屏障的完整性. 固有层包含来自适应性和先天免疫系统的免疫细胞(例如T细胞、B细胞、巨噬细胞和树突状细胞), 参与肠屏障的免疫防御机制.
粘液层是外部分子进入肠道时遇到的第一道物理防线, 它可以防止细菌直接接触上皮细胞[9]. 粘液层的主要构建块是高度糖化的粘蛋白, 其形成覆盖肠上皮的凝胶状筛网结构[11]. 在小肠和大肠中, 粘液蛋白2(mucin2, MUC2)是杯状细胞分泌的最丰富的粘液蛋白. MUC2的表达对于预防疾病至关重要, 因为MUC2敲除小鼠会自发患结肠炎[12]. IECs也表达附着在顶端表面的跨膜粘蛋白, 并与糖脂一起形成糖萼[11]. 值得注意的是, 小肠只有一层粘液凝胶层, 而结肠有两层: 一层松散的层, 允许结肠细菌的长期定植, 在结肠中至关重要, 而内部致密层没有细菌. 免疫调节剂, 如AMPs和sIgA分子, 被释放在粘液凝胶中, 以加强微生物的物理分离, 作为从上皮到管腔的梯度, 并显示在小肠中的最高浓度[13]. 粘液层的组成可以影响肠道中的微生物, 而微生物也决定粘液凝胶的特性[14].
在黏液层下面, 上皮细胞是迄今为止最强的肠屏障的决定因素. 位于地穴的多能干细胞池产生五种不同的细胞类型, 包括吸收性肠细胞、Paneth细胞、肠内分泌细胞、杯状细胞和微古细胞[15]. 这些细胞一起形成一个连续的极化单层, 将管腔与固有层分离. 由于细胞膜在没有特定转运体的情况下对亲水性溶质是不可渗透的, 因此这种分子通过IECs的通道受到高度限制[9]. 亲脂性或大分子的摄取主要依赖于扩散和内吞作用. 分子在IECs之间的传输是通过连接复合物的存在来调节的. 三个最重要的复合物是TJs、AJs和桥粒[16]. TJs是最顶端的粘合复合物, 主要封闭细胞间空间, 由跨膜蛋白(如Claudin)、周围膜蛋白[胞质小带闭塞蛋白(zonula occludens, ZO)-1、ZO-2]和调节蛋白组成. AJ位于TJs下方, 装配时需要. 与桥粒一起, AJs提供了强有力的粘合力, 以维持上皮的完整性. TJs和AJs都与肌动蛋白和肌球蛋白的连接环相连, 肌动蛋白和肌球蛋白允许通过细胞骨架来调节连接[9,16].
肠屏障是高度动态的, 对内外刺激(如细胞因子、细菌、饮食因素)都有反应[9].
IECs为肠道提供了物理和免疫防御屏障. 这种选择性的渗透性屏障可禁止微生物和毒素的通过, 同时允许营养和水的运输[17-19]. 肠道上皮的超细胞通透性是由紧密结合、粘连和脱粘体组成的顶端的紧密结合复合体来控制的. 紧密结合复合体位于上皮细胞的最顶端位置, 形成相邻细胞之间的密封. 是肠道上皮通透性的主要决定因素. 粘连结合和脱粘体提供了维持细胞-细胞相互作用所必需的黏合力, 并防止了对上皮细胞的机械破坏. 紧密结合体由跨膜蛋白组成, 包括闭塞蛋白、紧密连接蛋白、 连接粘附分子、三个相邻上皮细胞间紧密连接蛋白以及细胞质支架蛋白, 如ZO(ZO-1, ZO-2, ZO-3)[18,19]其中最关键的跨膜蛋白是包膜蛋白, 它定义了紧密结合的渗透性. 胶原分为屏障形成(胶原-1, -3, -4, -5, -8, -9, -11和-14)和通道孔隙形成(胶原-2, -7, -12和-15)亚型. 屏障形成使胶原降低, 而通道孔隙度的形成使胶原增加, 至于粘连蛋白对细胞旁通透性的作用迄今尚未充分阐明. 小鼠肠道闭合蛋白的降低提高了大分子的肠道通透性. 此外, 缺乏闭合蛋白的小鼠会出现慢性炎症和增生. ZO蛋白通过将紧密连接蛋白或包合物固定在细胞骨架上来调节TJs的组装和维护. 由于紧密连结的完整性的破坏导致肠道屏障的功能障碍和大分子从肠腔扩散到血液.
粘液主要由杯状细胞产生和分泌. 肠道粘液的主要结构是大的高糖基化糖蛋白. 跨膜粘液和分泌的粘液这两种主要的粘液在功能上是有区别的, 跨膜粘液和分泌的粘液, 包括粘液1, 粘液3, 粘液4, 粘液11-13, 粘液15-17, 粘液20和粘液21, 拥有单一的膜生成域, 是黏膜表面的糖花萼的必要组成部分, 并参与细胞内信号分泌的粘液, 特别是凝胶形成的粘液, 构成粘液层的骨架. 在小肠和结肠中, 粘液是由凝胶形成的粘液蛋白所构成, 与胃中的粘液蛋白相比, 粘蛋白可被认为是一把双刃剑, 由于它们的正常功能可以防止有害物质和微生物的侵入, 而粘液的功能障碍可能是导致疾病的一个原因. 除了粘液分泌外, 肠杯状细胞还可分泌一些其他粘液成分, 包括三叶因子肽3, 电阻类分子β, Fc-γ结合蛋白, 酶原颗粒蛋白16及钙活化氯化物通道调节器1[20,21], 所有这些都促成了高黏性的细胞外层.
IECs还通过产生细胞因子, 如IL-1β、IL-6, 进行免疫监视并向黏膜免疫系统发送信号, IL-18, 肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)和趋化因子, 包括趋化因子配体(chemotactic factor ligand, CXCL)8, CXCL10, CCXCL2, CXCL-6, CXCL-20和CXCL-25产生的细胞因子/趋化因子的主要作用是诱导免疫细胞迁移[22], 促进先天和适应性免疫. 值得注意的是, 包括肠道上皮衍生的CXCL-6(人类同系物CXCL-14和CXCL-15)在内的一个子集的趋化因子具有抗菌的特性.
肠具有完整的膜免疫系统. 肠道相关淋巴组织(gut-associated lymphoid tissue, GALT)是黏膜相关淋巴组织的一个重要组成部分, 它含有人体70%的免疫细胞. GALT含有多种免疫细胞, 包括树突状细胞、T和B淋巴细胞、浆细胞、先天性淋巴细胞(innate lymphoid cells, ILCs)、巨噬细胞和中性粒细胞[23]. 而残余巨噬细胞负责吞噬扩散到固有层的细菌, ILC通过分泌细胞因子保护黏膜免受细菌入侵[24]. 特别重要的是树突状细胞, 它们通过调节保护性免疫和免疫调节能力, 在形成肠道免疫反应中起着关键作用. 免疫耐受: 存在于固有层的T和B淋巴细胞是树突状细胞诱导和引导的适应性免疫反应的主要效应细胞. T细胞对来自肠腔的信号作出反应并启动免疫反应. B细胞, 特别是产生IgA的浆细胞, 有助于保护肠屏障. 值得注意的是, 免疫细胞也通过分泌细胞因子来调节肠屏障功能. 例如, 由3型ILC和CD4+T细胞产生的IL-22已被证明能够刺激IECs分泌AMP, 并上调上皮紧密连接蛋白的表达. 由调节性T细胞和巨噬细胞分泌的IL-10可促进黏膜伤口愈合并增强肠屏障功能[25].
1.2.2 酒精引起肠道通透性增高: 肠道通透性是描述控制大分子通过上皮进入全身循环的术语. 正常时, 肠道腔内的大分子无法渗入血液. 然而, 在疾病条件下, 当肠道屏障功能受损或破坏时, 则可导致大分子不受控制的被通过. 现已有多种方法被用于评估肠道的通透性, 包括体内大分子从肠道渗透到血液, 大分子通过肠道黏膜移植的体外分析, 对紧密结合结构和/或蛋白质进行形态和生化分析体内肠道通透性试验等.
酒精摄入可增加正常受试者和酗酒者对大分子的肠道通透性[26], 这表明肠道上皮屏障功能的破坏在酗酒者引起内毒素血症中起着重要作用. 目前尚不清楚乙醇引起的大分子通透性增加是由胃十二指肠屏障破坏引起的还是由肠屏障破坏引起的. 一项研究表明, 急性乙醇可以增加胃十二指肠通透性而不改变肠通透性, 而慢性乙醇可以提高肠通透性而不改变胃十二指肠通透性.
另一个重要问题是乙醇引起的肠道通透性是短暂的还是持续的. 研究表明, 戒酒3 d后, 酗酒者的肠道对乙二胺四乙酸的通透性升高, 而对于肝硬化的酗酒者, 即使戒酒两周后, 这种通透性仍持续存在. 因此, 乙醇对肠道屏障功能的影响在正常受试者和无肝硬化的酗酒者中似乎是短暂的, 而乙醇效应在肝病的酗酒者中可能持续更长时间. 由于IECs每48-72 h更新一次, 慢性乙醇喂养可能会导致细胞迁移和更新延迟.
在酒精性肝损伤的动物模型中也观察到肠对大分子的通透性增加[27]. 实验动物的急性和慢性乙醇给药后, 胃肠道对大分子标记物和脂多糖(lipopolysaccharide, LPS)的通透性均升高[28]. 很可能屏障破坏发生在肝损伤之前. 乙醇诱导的胃肠道通透增加与内毒素血症和肝损伤相关. 因此, 酒精性肝损伤的实验模型有助于了解酒精性肝损伤的发病机制.
酒精引起肠道通透性增加的一个潜在机制是破坏紧密连接蛋白的体内平衡. 氧化应激是紧密连接蛋白破坏的一种成熟机制. 氧化应激的一个重要潜在来源是肠内一氧化氮(nitric oxide, NO). 事实上, 酒精诱导的NO合成酶(inducible nitric-oxide synthase, iNOS)产生的NO过量会破坏屏障功能, 并防止酒精诱导的大鼠和Caco-2(是一种人克隆结肠腺癌细胞)单层中的NO过量产生, 从而恢复正常的屏障完整性. 此外, 还发现酒精引起的肠道通透性增加是由iNOS上调引起的氧化上皮组织损伤引起的[29]. 然而, 酒精诱导、iNOS介导、肠道渗漏的机制迄今还不完全明了.
Rao等[26]新近的发现揭示了一种新的机制, 并提示microRNA可能是这种信号级联的早期和关键因素. 小RNA是长度为18-25个核苷酸的小的非编码RNA, 可以控制基因的表达. 它以miRNAs为靶点, 引发翻译抑制或RNA降解. 小RNA调节与许多细胞过程有关, 包括细胞增殖、分化、凋亡和代谢. 异常的小RNA表达可能与许多人类疾病有关. 新近, Tang等[30]发现: (1)miR-212是一种在IECs中表达的小RNA; (2)ZO-1, 一种参与调节肠屏障的关键紧密粘连蛋白, 是miR-212的靶基因; (3)来自ALD患者的结肠活检样本中的miR-212水平高于健康对照组; (4)酒精诱导的miR-212在Caco-2 IECs中过度表达伴随着ZO-1蛋白表达的降低、ZO-1的破坏以及Caco-2细胞单层的通透性增加. 这一发现导致了一个新的假设, 即iNOS诱导的肠屏障破坏可能通过miR-212过度表达介导, 进而导致其靶基因ZO-1下调. 研究发现酒精喂养的小鼠呈现结肠通透性增高[31]. IECs中的鞘氨醇-1磷酸/鞘氨醇-1-磷酸受体2通过细胞外信号调节蛋白激酶途径介导CD4+T细胞活化和主要组织相容性复合体表达以调节肠屏障功能[32]. 果糖通过CYP2E1介导氧化和硝化应激促进肠道通透性增加 , 并显著增高内毒素血症和肝纤维化[33].
1.2.3 乙醇影响紧密连接蛋白的完整性: 肠黏膜屏障的功能和完整性取决于完整的细胞旁通路, 如前所述该通路主要受细胞间连接(即TJs、AJs和桥粒)]的调节[34]. 紧密连接是由跨膜蛋白(闭塞蛋白、紧密连接蛋白家族、三个肠上皮细胞间紧密连接蛋白、连接粘附分子等)组成的多蛋白复合体, 与细胞质斑块蛋白[如ZO-1、ZO-2、ZO-3、肌动蛋白丝6、结肠黏膜扣带蛋白相互作用, 进而与肌动蛋白相互作用以锚定闭合蛋白, 而其他跨膜蛋白则与细胞相互作用[35].
使用传统的二维细胞培养模型对过滤器上生长的肠道细胞单层进行的体外研究表明, 乙醇及其主要代谢物乙醛破坏了上皮TJs的完整性, 从而增加了细胞旁通透性[36]. 最近, 有报道称乙醇协同乙醛导致TJs断裂.
乙醛可诱导TJs和AJs的破坏. 通过免疫荧光显微镜在Caco-2细胞单层中发现乙醇和乙醛破坏TJs和AJs[37]. 乙醛诱导和ZO-1从细胞间连接处重新分布, 并将这些蛋白质与肌动蛋白细胞骨架分离[38]. 乙醛也引起了E-钙粘蛋白和β-连环蛋白在细胞间连接处的重新分布, 表明AJ被破坏. 对E-钙粘蛋白和β-连环蛋白重新分布的时间历程分析表明, 乙醛最早在10 min就破坏了AJs, 而闭塞蛋白和ZO-1的分布没有受到影响. 这一观察表明乙醛首先改变了AJ的完整性, 进而可能引发TJs的破坏. 乙醛诱导的TJs和AJs的破坏在人类结肠黏膜中得到进一步验证. 乙醛诱导人结肠黏膜活检中TJs和AJs的破坏, 这表明TJ和AJ蛋白从细胞间连接处重新分布, 并从肌动蛋白细胞骨架上分离.
1.2.4 乙醛诱导屏障功能障碍的机制: 信号素如蛋白激酶和蛋白磷酸酶调节不同上皮细胞中TJs的完整性[37]. 乙醛诱导的TJs和AJs的破坏与ZO-1、E-钙粘蛋白和β-连环蛋白的酪氨酸磷酸化快速增加有关, 酪氨酸激酶抑制剂可降低细胞旁通透性. 乙醛抑制蛋白酪氨酸磷酸酶(protein tyrosine phosphatase, PTPase)的活性, 这可能是酪氨酸磷酸化增加的原因. 乙醛抑制无细胞部分的PTPase活性, 表明它直接与PTPase相互作用. 乙醛不仅抑制了PTPase的活性, 而且破坏了其与E-钙粘蛋白的相互作用[39]. 目前的知识支持一个模型, 其中抑制和分离蛋白酪氨酸磷酸酶1b(protein tyrosine phosphatase 1b, PTP1b).
从E-钙粘蛋白导致E-钙粘蛋白和β-连环蛋白的酪氨酸磷酸化和这两个蛋白之间的相互作用的损失. 质谱分析表明乙醛增加了Y331、Y333、Y654和Y670上β-连环蛋白的磷酸化. 利用重组蛋白进行的体外蛋白-蛋白相互作用研究表明, β-连环蛋白的酪氨酸磷酸化降低了其与E-钙粘蛋白的相互作用, 但E-钙粘蛋白的酪氨酸磷酸化对这种相互作用没有影响. 另一方面, E-钙粘蛋白的酪氨酸磷酸化导致其与PTP1b的相互作用丧失, 因此乙醛通过磷酸化依赖机制破坏了E-钙粘蛋白与β-连环蛋白的相互作用.
AJs中断可能是导致TJs中断的信号. 尽管AJ介导的TJ破坏的确切机制尚不清楚, 但最近的研究表明乙醛诱导了ZO-1的酪氨酸磷酸化和闭塞蛋白的苏氨酸去磷酸化. 闭塞蛋白去磷酸化和ZO-1磷酸化的功能尚不清楚. 然而, 在TJs的破坏和其他介质的屏障功能过程中, 已经观察到了这种闭塞蛋白和ZO-1磷酸化状态的变化.
1.2.5 内毒素血症与ALD: 酒精引起屏障通透性功能增加后导致细菌易位、微生物生态失调和内毒素血症发生. 越来越多的证据表明内毒素血症与ALD密切相关. 内毒素通过Toll样受体-4(toll like receptor, TLR-4)介导的机制刺激肝脏释放细胞因子、趋化因子和ROS中的不同细胞. 肠道菌群是循环内毒素的来源, 导致肠道通透性升高的肠屏障功能障碍被认为是引起ALD内毒素血症的主要原因. 了解乙醇诱导肠屏障破坏的机制是一个重要的研究领域. 有证据表明, 肠道菌群、乙醇代谢和乙醛诱导的细胞信号传导与乙醇诱导的肠屏障功能障碍有关[40].
内毒素是从革兰氏阴性细菌的细胞壁中提取的LPS. 死细菌和从活生物体细胞壁上脱落的LPS有助于循环内毒素. 正常情况下, 肝内的库普弗细胞通过吞噬作用解毒内毒素. 当内毒素的流量超过了库普弗细胞的吞噬能力时, 内毒素溢出进入循环系统. 内毒素血症通常被认为是血浆内毒素水平上升到2.5EU(内毒素单位)/m以上的一种情况. 通过检测ALD患者血浆中大肠杆菌抗体, 首次发现ALD内毒素血症. 许多后续研究表明, ALD患者的血浆内毒素水平是健康受试者或非酒精性肝硬化患者的几倍. 酒精中毒者内毒素血症, 他们只表现出轻微的ALD症状, 因此, 内毒素血症似乎在该疾病的发病早期发生[41]. 据报告LPS刺激TLR4可激活NFκ-B,下调人胆管细胞3型肌醇三磷酸受体的表达, 引起胆汁淤积, 包括败血症和酒精性肝炎等严重病症发生[42].
正常受试者血浆内毒素水平为0.3-10.4 pg/mL, 而ALD患者的内毒素水平为8.5-20.6 pg/mL. 尽管内毒素值存在很大的变异性, 但ALD患者的血浆内毒素水平总是比正常受试者高5-20倍[43].
酒精性肝损伤实验模型证实了ALD内毒素血症. 急性或慢性乙醇使用后, 血浆内毒素水平升高, 且与肝损伤的发生密切相关. 急性乙醇给药引起的血浆内毒素水平升高表明内毒素血症发生在肝损伤早期. 虽然没有单一的动物模型来描述ALD的不同阶段, 但ALD患者血浆内毒素水平与乙醇喂养动物有着惊人的一致性. 没有证据表明酒精性内毒素血症中存在物种依赖性差异, 但观察到有性别依赖性差异[40].
酒精引起的内毒素血症和抗生素引起的肝损伤的减轻表明内毒素在酒精性肝损伤中起着关键作用. 一个新的证据表明, LPS和乙醇协同作用于肝细胞. LPS本身不能模拟乙醇诱导的脂肪变性或肝炎, 但是乙醇和LPS一起有效地诱导肝损伤. 乙醇喂养对实验动物的LPS诱导的细胞损伤敏感, 并可加剧LPS诱导的肝脏细胞因子的释放. 乙醇与LPS协同作用的机制可能涉及多种因素, 如下调IL-10介导的保护、还原型辅酶Ⅱ氧化酶依赖的ROS产生和肾上腺素刺激[44].
肝内LPS的细胞靶点包括Kupffer细胞、窦状内皮细胞、星状细胞、中性粒细胞和肝细胞. Kupffer细胞失活可预防乙醇诱导的大鼠肝损伤. LPS刺激窦状内皮细胞释放细胞因子和趋化因子. 在星状细胞中, LPS预处理可增强乙醇诱导的胶原分泌. LPS结合蛋白(lipopolysaccharide binding protein, LBP)表达LPS到一种55kDa糖蛋白CD1. CD14是LPS结合蛋白, CD14与LPS特异性结合并与TLR-4相互作用. LBP/CD14系统在机体识别内毒素和调控内毒素作用方面起到关键作用. 该系统包括血清LBP、细胞表面膜结合蛋白CD14和可溶性CD14. 慢性乙醇喂养的小鼠可增强LBP和LPS结合蛋白的表达, 在LBP、CD14和TLR-4敲除小鼠中不存在乙醇诱导的肝损伤. TLR-4介导的不同肝细胞刺激导致多种促炎因子的分泌, 如细胞因子、趋化因子和ROS[45].
肠道菌群是循环内毒素的来源. 通常情况下, 内毒素吸收受到黏膜屏障功能的阻碍. 三个主要因素可能导致酒精性内毒素血症: (1)延迟清除循环中的内毒素; (2)乙醇诱导的细菌过度生长; (3)肠道屏障功能障碍导致内毒素吸收升高.
有证据表明, 乙醇喂养可延迟从循环中清除LPS. 这是因乙醇损害了库普弗细胞的吞噬功能, 并减弱了这些细胞对内毒素的吸收, 库普弗细胞的过多的内毒素溢出到循环中, 导致内毒素血症. 与正常受试者相比, 有氧和无氧细菌的数量在酗酒者的空肠吸引物中都很高. 乙醇已被证明可延迟胃肠运动, 已知延迟胃肠转运可增加肠道细菌生长. 因此, 酒精中毒者肠道运动迟缓可能是细菌过度生长的原因[46]. 虽然延迟清除和细菌过度生长是潜在的原因, 但肠道对内毒素的通透性增强似乎是酒精性内毒素血症的主要原因.
新近研究肠道低氧诱导因子1α(hypoxia inducible factor-1α, HIF-1α)缺失通过诱导肠道生态失调和屏障功能障碍加剧了ALD, 缺乏肠道HIF-1α会加剧肠道泄漏的严重性, 导致细菌和细菌产物易位增加从而引起ALD[47], 而使用植物乳杆菌治疗, 通过表皮生长因子受体依赖性机制可预防和减轻酒精诱导的肠上皮TJs, 内毒素血症和肝损伤的破坏[48].
酒精对肠道微生物群结构和活性影响的研究还处于起步阶段, 特别是与其他酒精诱导作用相比. 众多的文献表明, 饮酒会导致啮齿动物和人类肠道微生物群的定量和定性失调. 这些研究表明, 类杆菌门和厚壁杆菌门的优势菌类群发生了变化, 在一些研究中, 变形杆菌门的细菌数量也有所增加[49].
肠道共生细菌在调节宿主免疫反应和维持肠道黏膜完整性方面起着重要作用. 酒精降低了胃肠道中作为微生物营养来源的短链脂肪酸(short chain fatty acids, SCFAs)和支链氨基酸. 因此酒精可以直接和/或间接地改变肠道微生物群的组成. 已有许多报告了肠道微生物群的定量(细菌过度生长)和定性变化. 有关酒精干扰微生物群的详细信息也在许多研究中进行了深入讨论. (1)微生物衍生乙醛可能代表微生物群如何参与ALD的发生机制. 如前所述, 众所周知, 乙醛通过分解紧密连接蛋白来破坏肠道屏障. 细菌过度生长会影响肠道乙醛水平, 进而提高肠道通透性. 大鼠口服甲硝唑可通过增加需氧菌增高和减少肠道中的厌氧细菌而导致肠道内乙醛水平升高. 用抗生素环丙沙星治疗可减少结肠微生物群并防止乙醛的积累; (2)酒精可诱导细菌膨胀, 在疾病条件下可增加细菌易位. 变形杆菌门包括革兰氏阴性菌, 其中大多数被认为是机会性病原体, 是LPS的主要来源. 据报道, ALD肝硬化患者和长期饮酒的小鼠中的肠道杆菌比例增加, 这表明酒精代谢异常与内毒素血症以及肝脏炎症之间存在因果关系; (3)肠道菌群可直接介导ALD的发生. 最近的一项研究表明, 含有酒精性肝炎患者肠道微生物群的小鼠会出现更严重的肝脏炎症、更大的肠道通透性和更高的细菌易位[49].
另一项研究报告说, 酒精增加了肠球菌属种, 肠球菌属种的易位导致了肝脏炎症和肝细胞死亡[50]. 此外, 肠道微生物群的另一部分真菌也可能介导ALD的发病机制. 最近有报道称, 长期饮酒会增加小鼠肠道真菌的数量, 并且随后真菌β-葡聚糖的易位导致了肝脏炎症[51]. 这些研究表明, 微生物群生态失衡有助于酒精性肝炎的发展, 因此需要进一步在机理方面进行研究.
ALD与细菌过度生长有关, 细菌和益生菌(如乳酸菌)的比例较低. 病因包括小肠功能障碍和胆汁酸池的改变. 乙醇破坏肠道TJs完整性. 患有慢性酒精滥用的患者, 无论是否有ALD, 都有一个"漏肠"发生, 研究还发现血浆内毒素水平高于健康对照组. 因此, 在动物模型中, 通过基因突变或抗生素, 或表达非功能性的TLR4(LPS受体), 保护细菌免受过度生长, 都可以减轻酒精引起的肝损伤.
暴露于酒精后, 周围循环中的LPS水平在人类中持续升高[52]. 肠源性LPS通过TLR4激活肝巨噬细胞: LPS进入门静脉血后, 肝巨噬细胞和其他肝脏免疫和实质细胞上表达的TLR4受体复合物可识别LPS. 在正常肝脏中, 肝巨噬细胞对少量肠道内毒素具有耐受性. 然而, 在ALD的发病机制中, 肝巨噬细胞失去其静止的表型并被激活. 多种证据表明, ALD中肝巨噬细胞的激活涉及由肠道来源的LPS激活的TLR4依赖机制. 尽管TLR4不能直接结合LPS, 但其共受体CD14和髓样分化蛋白-2结合LPS并在LPS结合后激活TLR4. LPS和CD14之间的联系是由LPS结合蛋白促进的, 这是一种可溶性穿梭蛋白[53]. 由此可见TLR4、CD14和LBP是酒精性肝损伤的关键因素.
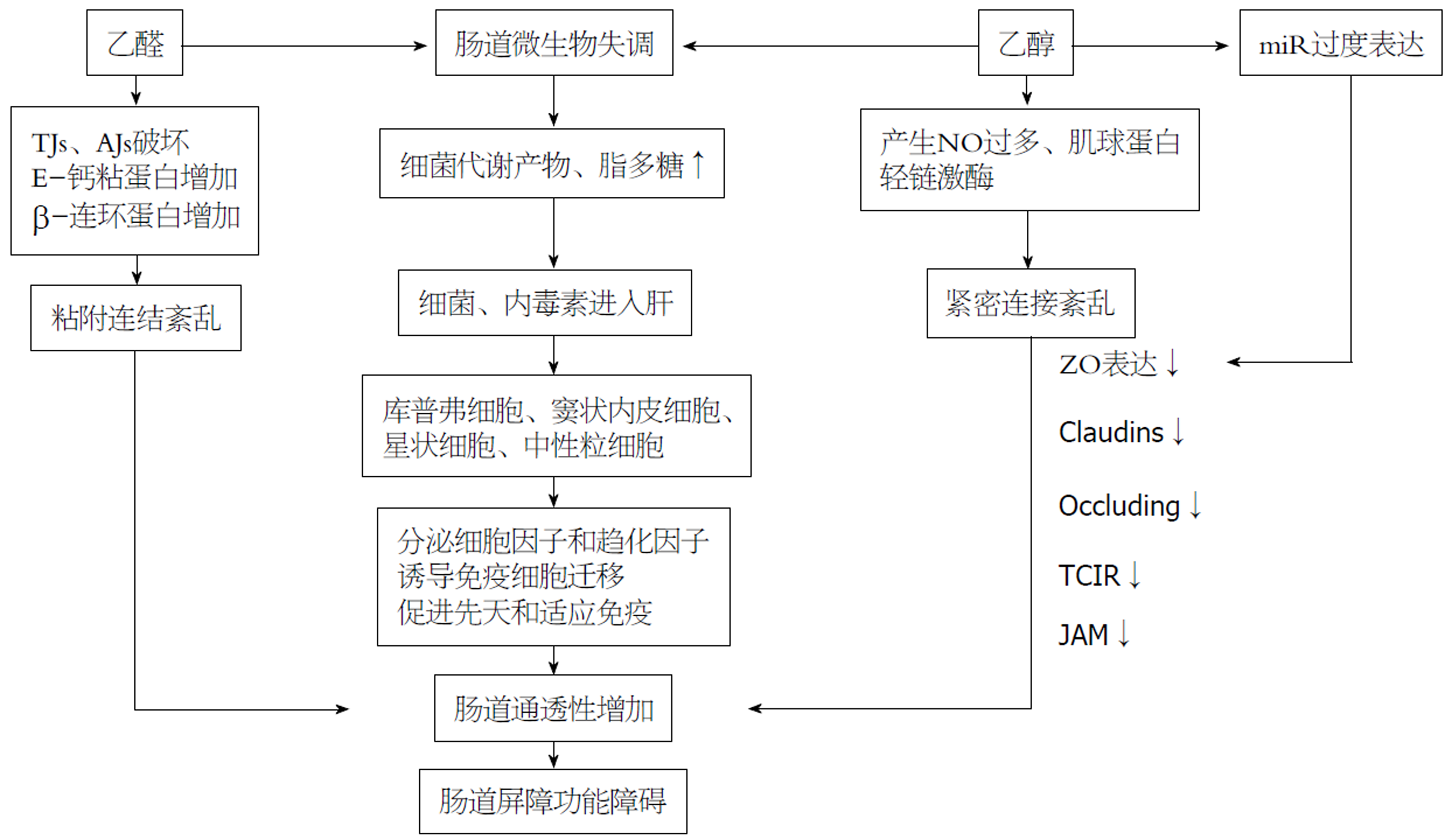
人类长期饮酒也会导致细菌过度生长和生态失调. Mutlu等[54]在研究中, 他们发现, 在一个有或无肝病的酗酒者亚组中, 微生物群落发生了显著变化, 其中类杆菌含量较低, 变形杆菌含量较高. 其他研究表明, 酗酒者体内的微生物群失调也与血液中的内毒素水平增高有关, 这表明, 细菌群失调可能导致肠道通透性增高和/或革兰氏阴性微生物产物从肠道转移到系统循环的机制. 乙醇或乙醛引起肠道屏障功能障碍机制小结见图1.
ALD除戒酒外无重要新的治疗进展, 而改善肠道屏障功能是重要的治疗组成部分, 当前正在积极探索研究中. 几十年来, 人们一直在努力探索潜在的药物治疗方法, 其中一个有希望的发现就是封闭肠漏. 正如前面所强调的, ALD的病理生理学与酒精引起的肠道屏障功能障碍有明显的联系. 事实上, 动物研究表明中和循环内毒素可以消除内毒素信号级联, 从而降低酒精引起的肝细胞因子产生、炎症细胞浸润和肝损伤. 敲除整合素3β或Reg 3γ都能增强细菌的易位和促进小鼠的进展. 因此, 有必要进一步探讨针对酒精引起的肠道屏障功能障碍的潜在的ALD疗法.
实验和临床前研究表明, 使用抗生素治疗会减少革兰氏阴性菌, 并在一项初步研究中证实预防了ALD发生. 服用抗生素(诺氟沙星、氧氟沙星和新霉素)后, 经过3 mo和6 mo的治疗, 儿童Child-Pugh评分有所提高. 但是, 由于害怕抗生素的抗药性和可能的肝脏副作用, 目前还缺乏进一步的研究, 以调查在ALD患者中的抗生素治疗情况. 利福昔明是一种具有广谱抗菌活性的不可吸收的抗生素, 是治疗ALD的一种替代药物. 的确, 利福昔明被发现能减少肠道净化引起的内毒素血症, 不仅能改善患者的预后, 还能改善与血液循环有关的血小板减少[55-57]. 利福昔明是利福平的一种不可吸收的衍生物, 目前正被用于治疗旅行者的腹泻和预防晚期肝病中肝性脑病复发. 利福昔明通过与细菌DNA依赖性RNA聚合酶的β亚单位结合, 对胃肠道细菌具有广谱杀菌作用[58]. 新近研究利福昔明有抗纤维化作用[59]. 如果肠道细菌是肝纤维化的重要因素, 调节肠道菌群可能是改善肝病预后的一种新方法.
与杀死或抑制细菌生长的抗生素相比, 使用益生元和/或益生菌的概念是为了恢复肠道微生物群的共生关系, 作为一种潜在的治疗方法值得研究. 益生菌是不能消化的膳食多糖, 只能通过共同的微生物群消化, 如双歧杆菌和乳杆菌可促进肠道微生物群的生长[60]. 通过改善大鼠肠道通透性和减少内毒素血症, 通过饮食补充燕麦, 减轻酒精所致的肝脏损害. 在利用小鼠进行的一项单独研究中, 给药前果糖恢复了宿主抗菌Rreg 3γ, 据报道, 肝硬化患者摄入的乳酸糖能有效治疗亚临床肝性脑病[61]. 然而, 探讨益生元对大鼠患者疗效的研究却有限.
益生菌是对宿主无害的活细菌, 特别是在肠道内稳态方面. 益生菌在治疗 ALD患者或啮齿动物的研究表明益生菌可以改善ALD的预后. 首次报告是由Nanji等[40]人所做的研究, 该研究表明, 补充乳酸杆菌可减少酒精引起的大鼠内毒素血症和肝损伤. 从那时起, 一些益生菌, 主要是乳杆菌和双歧杆菌, 已经在环境中进行了测试. 利用双歧杆菌和植物乳酸菌对降低血浆丙氨酸转氨酶和天冬氨酸转氨酶水平的患者进行为期5 d的短期治疗, 恢复肠道微生物群, 与仅使用标准疗法(戒断加维生素)治疗的患者相比, 改善了脂肪含量. 在酒精性肝炎患者中, 摄入乳杆菌、枯草链球菌7 d可减少LPS水平和肝脏损伤的严重程度[62]. 有报告使用乳杆菌每日三次, 持续4 wk, 微生物群平衡得到重新建立, 并恢复酒精性肝硬化患者的中性粒细胞的吞噬能力[48]. 一项长期研究表明, 用益生菌vsl#3治疗达三个月之久, 可显著减少氧化应激和细胞因子的产生, 改善患者的肝功能. 最近, 益生菌已被证明对减少或预防ALD的进展是有效的. 一个潜在的机制是益生菌改变肠道微生物群的组成, 从而减少酒精引起的生态失调、肠道通透性、细菌移位、内毒素血症, 从而使ALD获得改善. 益生菌转化肠道微生物群似乎是治疗肠屏障功能障碍的一种有前途的治疗策略[63], 研究提出了益生菌改善ALD症状的几种潜在机制. 服用益生菌可以通过降低内毒素水平、减少氧化损伤和改善对肠道病原体的免疫反应来增强肝功能. 补充小鼠乳酸菌已被证明可以增加肠道紧密连接蛋白的表达, 防止肠道泄漏. 重要的是, 益生菌的有益作用不仅通过活细菌, 而且还通过热灭活细菌或细菌培养剂来实现[64]. 更重要的是, 一项利用16s核糖体RNA测序的研究表明, 乳酸菌GG不仅减少了含酒精小鼠的细菌过生长, 而且还防止了酒精引起的变形菌和放线菌门的扩张. 这暗示了乳杆菌GG在组织肠道微生物群共生中的作用能力[48].
综上所述, 临床研究表明, 通过使用益生菌以肠道肝轴为靶点, 可能在从轻度酒精性肝炎患者到重度酒精性肝硬化患者的治疗中具有治疗作用. 如前所述, 还需要进一步研究更大的样本量, 以测试益生菌对ALD的影响. 对不同疾病阶段的患者, 开发新的益生菌菌株和相关产品, 包括分离具有抑制致病性细菌生长的改良效力的新益生菌、增强肠道屏障功能和改善免疫调节, 以及产生特定代谢产物的工程益生菌, 将为治疗提供更高的选择性[65].
应用的理想益生菌菌株应能抵抗胆汁、盐酸和胰液; 能够耐受胃和十二指肠条件和胃运输; 能够刺激免疫系统, 从而通过粘附和定植肠上皮来改善肠道功能. 此外, 益生菌菌株必须能够在生产和储存过程中存活, 以产生更好有益作用.
是将含有健康个体细菌的粪便材料移植给接受者的过程. 它是一种有效的治疗方法, 可以治疗各种疾病, 其特点是微生物群的生物机能丧失, 如溃疡性结肠炎, 粪便微生物群移植(fecal microbiota transplantation, FMT)的作用机制可能包括建立有益的细菌菌株和生产抗菌成分[66]. 最近首次尝试利用FMT治疗ALD.
酗酒往往与营养不良有关. 因此, 补充饮食是治疗ALD的有效策略. 相关研究表明, 以营养为基础的治疗不仅改善了肝脏本身的功能, 而且还通过调节肠道屏障功能来影响肠肝轴.
6.4.1 锌: 锌是体内第二丰富的微量元素. 它在维持生理过程中起着至关重要的作用, 如代谢、信号传导、细胞的生长和分化. 低锌血症(低血清锌水平)和肝锌水平的降低已被长期观察到, 血清锌水平与肝损伤的严重程度呈正相关[67]. 据报告, 除了血清和肝锌减少外, 在肠道, 特别是在小肠远端或回肠, 还可以发现酒精引起的锌缺乏症. 还发现饮食中锌的缺乏扩大了酒精引起的内毒素血症和肝损伤[68]. 这些观察表明锌在调节肠道屏障功能中的重要作用, 电子显微镜观察补充锌可减轻肠漏. 酒精中毒导致血浆内毒素水平升高, 引起病理性肝变化, 并被锌预处理所废除. 补充锌的饮食还降低了酒精增加回肠的通透性, 恢复了紧密连接蛋白的分布, 减轻了大鼠的肝内毒素信号, 修复肝损伤.
6.4.2 脂肪酸: SCFAs是一种含少于六个碳原子的脂肪酸, 是通过细菌发酵产生的. 补充丁二酸可减轻急性酒精中毒和慢性酒精中毒小鼠引起的肠道屏障功能紊乱和肝损伤. 中链甘油三酸酯中的脂肪酸主要由6-12的碳链长度饱和. 研究表明, 饮食中的甘油三酸酯通过多种机制改善了由酒精引起的肝脏组织学变化, 这些机制涉及肝脏和肠道[69,70]. 饱和增脂饮食改善了肠内紧密连接蛋白表达, 减轻了肠道炎症, 改善了肠黏膜表达, 并调节了中毒小鼠的肠道微生物群和代谢. 阻断蛋白和ZO-1, 防止内毒素血症, 减轻肝LPS信号的传递.
在人类和小鼠中, 酒精滥用降低了微生物体合成饱和长链脂肪酸(long chain fatty acids, LCFAs)的能力, 并降低了乳酸菌的比例, 一种已知能代谢饱和LCFAs的细菌给酒精喂养的小鼠服用饱和LCFAs, 增加了乳酸菌, 增强了肠道屏障功能, 减少了肠道炎症和肝损伤. 这些发现表明细菌代谢的改变导致了ALD的发病机制[71], 饱和LCFAs在肠道的保护作用也可能包括刺激肠激素的释放, 包括胰高糖素样肽(glucagonlike peptide 1, GLP-1)和GLP-2, 调节杯状细胞产生的粘液2和增强抗菌活性[72]. 未来的研究需要探讨这些机制是否参与饱和LCFA介导的对ALD的保护作用.
6.5.1 S-腺苷甲硫氨酸: 酒精影响蛋氨酸代谢的多个步骤. S-腺苷甲硫氨酸(S-adenosine methionine, SAM)是甲基化反应的底物. 在提供了甲基后, SAM被转化为S-腺苷同型半胱氨酸(S-adenosine homocysteine, SAH). SAM可以通过以甜菜碱为底物的叶酸依赖或独立途径进行再生. 据推测, 长期饮酒会降低SAH水平, 导致线粒体损伤和内质网应激. 在人类的研究中, 对SAM或安慰剂患者的治疗并没有导致组织病理学、脂类、AST、ALT或胆红素水平上的差异[73,74].
6.5.2 IL-1拮抗剂: Kupffer细胞产生损伤相关分子模式和LPS的受体, 并通过多种细胞因子激活先天免疫系统,包括INF-α、IL-6和IL-1β. IL-1受体拮抗剂阿那白滞素是拮抗剂可减轻肝细胞损伤.
6.5.3 细胞凋亡抑制: Caspase是TNF-α信号下游的死亡诱导分子. Caspase的抑制可以避免TNF-α阻断的免疫抑制和再生阻断作用, 并可以通过无菌坏死和DAMPs释放抑制先天免疫系统的激活级联. 临床试验表明, Caspase抑制改善了肝酶活性[75].
法尼酯衍生物受体(farnesoid X receptor, FXR)是胆汁酸受体,参与胆汁酸稳态负反馈回路. 它通过胆固醇调节元件结合蛋白和肝X受体对脂肪生成进行负调节, 并通过过氧化物酶体增殖物激活受体α对脂肪酸氧化进行正调节, 这样可能抵消脂肪变性的病理生理学. 更重要的是, FXR激活可能降低肝星状细胞的激活, 因此具有抗纤维化作用. 目前, FXR激动剂的研究仍在NASH和AFLD中进行.
IL-22是由Th17细胞和自然杀伤细胞产生的. 生物效应主要是通过IL-22R1(IL-22受体1)和IL-10R2(IL-10受体2)结合激活信号传导及转录激活因子(signal transducers and activators of transcription, STAT3)信号通路来介导的. 鼠类慢性酗酒喂养模型中, 用IL-22重组蛋白治疗可激活肝STAT 3, 改善AFLD、肝损伤和肝氧化应激. 在酒精性肝炎的患者中, IL-22R1的表达是升高的, 这表明IL-22治疗可能是一种潜在的治疗选择[76].
骨桥蛋白是一种多核白细胞的趋化引诱剂, 可促进ALD 中的纤维化. 骨桥蛋白的作用因实验模型的不同而引起争议. Lazaro等[77]人在严重脂肪变性的背景下国家酒精滥用和酒精中毒研究所使用模型, 并证明骨蛋白缺乏并不能预防, 而是促进了酒精性肝炎好转, 暗示了一个潜在的治疗靶.
虾青素是海洋生物中主要的叶黄素类胡萝卜素之一. 虾青素具有缓解脂质代谢紊乱和酒精性肝损伤的能力. 虾青素通过调节小鼠炎症基因表达减轻肝损伤. 在高脂肪饮食中摄入乙醇可显著诱导IL-1α、巨噬细胞炎症蛋白2、IL-6和TNF-α的mRNA表达. 然而, 补充虾青素可明显逆转这些作用. 虾青素还可改变的细菌丰度[78], 虾青素干预可以显著逆转乙醇诱导的类杆菌和变形杆菌的增加, 这表明虾青素的保护作用可能与其抗炎活性有关. 虾青素可以通过抑制炎症、纤维化和脂肪积累来预防肝损伤[78]. 虾青素由于具有抗炎和抗氧化能力, 已被证明可以保护患有酒精脂肪性肝病的小鼠免受肝损伤和小鼠的肝纤维化[79,80].
大蒜多糖(garlic polysaccharide, GP)对酒精性肝纤维化(alcoholic liver fibrosis, ALF)有显著的作用, 表现为肝脏相对重量降低, 丙二醛、总胆固醇、三酰甘油和低密度脂蛋白水平降低, 超氧化物歧化酶、谷胱甘肽过氧化物酶活性和GSH水平升高, 并且减轻了组织病理学变化. 此外, GP可有效降低转化生长因子-β1(transforming growth factor-β1, TGF-β1)、TNF-α的表达, 促进去整合素的表达, 抑制HSC的活化, 减少ECM的积累, 从而减轻肝纤维化. GP具有益生元样作用, 可诱导微生物竞争, 减少非有益肠道菌群的数量. GP通过调节脂质过氧化和氧化应激, 调节TGF-β1、TNF-α和去整合素信号通路, 抑制HSCs的活化, 降低ECM的产生, 对小鼠ALF具有显著的肝保护作用. 可用于治疗ALF和ALF诱导的肠道菌群失调[81].
亚麻籽油(flaxseed oil, FO)富含植物衍生的ω-3(n-3)多不饱和脂肪酸(ployunsaturated fatty acids, PUFAs), 主要是α-亚麻酸(linolenic acid; ALA, 18:3 n-3). 临床研究报告, 血清和肝脏组织中的n-3PUFAs水平较低是糖尿病患者的一个共同特征. 通过改善脂肪组织肝轴的脂质稳态来预防急性酒精性肝脂肪变性[82].
研究发现, 膳食FO减轻肝组织病理损伤和血浆LPS水平降低; 膳食FO降低ALD患者血浆炎症细胞因子水平和肝脏炎症细胞因子水平、FO饮食可调节 ALD时的肠道微生物.
Zhang等[83]调查了长期饮食的FO治疗慢性ALD的疗效. 通过对小鼠体内6 wk的ALD治疗, 我们的研究表明, 补充FO能更有效地减少肝损伤, 这表明这种廉价的干预措施具有预防和治疗的潜力. 进一步研究表明, 这种有效的治疗可能与肠道微生物群的改变和肝脏炎症的减少有关.
石榴(pomegranate, POM)对过量饮酒可通过增加氧化和硝化应激标记蛋白(如乙醇诱导的CYP2E1酶, 它是细胞色素P450酶体系的一员, 是药物代谢的核心体系成员、诱导NO合酶以及小肠和肝脏中的硝酸化蛋白)的水平, 显著提高血浆内毒素和炎症性脂肪肝, 从而诱发肠道渗漏发生. POM预处理通过抑制氧化应激和硝化应激标记蛋白的升高, 显著降低了酒精诱导的肠道屏障功能障碍、血浆内毒素和炎症性肝病. POM预处理显著恢复了饮酒后肠道TJ蛋白的水平, 如ZO-1、闭塞蛋白、紧密连接蛋白(claudin-1和claudin-3)显著降低. 此外, 过量饮酒大鼠肠道 AJ蛋白(如β-连环蛋白和E-钙粘蛋白)、桥粒、盘状球蛋白及相关蛋白α-微管蛋白水平明显降低, 但POM预处理后大鼠上述指标恢复到基础水平. 免疫沉淀和免疫印迹分析显示, 在酒精暴露的大鼠中, 肠claudin-1蛋白被硝化和泛素化, 而这些修饰被POM预处理显著阻断. 这些结果首次表明, POM可以通过抑制氧化应激和硝化应激来预防酒精引起的肠道渗漏和炎症性肝损伤[84].
槲皮素最近有人提出类黄酮槲皮素可能具有调节肠道微生物群组成的能力. 槲皮素通过调节脂质代谢基因表达、CYP2E1依赖性脂质过氧化和相关脂质毒性降低肝内脂质积累, 从而降低胰岛素抵抗和ALD活性评分. 元基因组研究显示, 肠道细菌在门、类和属水平上, 由于高纤维素饮食依赖性差异导致生态失调, 其特征是厚壁菌/拟杆菌比率和革兰氏阴性细菌增加, 螺旋杆菌属的检出率显著增加, 生态失调伴有内毒素血症、肠屏障功能障碍和肠肝轴改变以及随后的炎症基因过度表达. 槲皮素可逆转肠道微生物群失调及相关内毒素血症介导的TLR-4通路诱导, 随后抑制炎症反应和网状体应激通路的激活, 导致脂质代谢基因表达的阻断的解除. 槲皮素通过其抗炎、抗氧化和益生元综合反应用于治疗ALD[85].
积累的证据表明, 饮食饱和脂肪的有益作用和饮食不饱和脂肪(unsaturated fatty, USF)对酒精性肝损伤的破坏作用已在ALD的实验动物模型中得到证实[71,86]. 此外, 膳食摄入USF与酒精性肝硬化死亡率较高相关[11]. 然而, 不同类型的膳食脂肪增强或减弱ALD的潜在机制尚未完全确定.
在人类研究中得到验证, 累积的实验饮食数据对ALD有重要的影响, 包括预防和治疗ALD. 饮食因素, 如特定的不饱和脂肪, 可能有助于解释为什么只有喝酒多的人会发展为进行性ALD. 限制饮食中潜在的"有害"脂质有助于防止酗酒者的ALD. 对于已开处方或服用营养补充剂的ALD患者, 最佳脂质成分可能包括MCT. 美国肠外和肠内营养学会将MCT油确定为肠外营养脂质乳剂的潜在有益添加剂[87]. "营养"药物, 如三丁酸(丁酸前药, 一种SCFAs)可能对ALD有益. 事实上, 最近的一项临床前实验研究表明, 三丁酸甘油酯可阻止短期乙醇诱导的丙氨酸氨基转移酶和肝脏促炎细胞因子和趋化因子表达增加, 并保护小鼠免受急性乙醇诱导的肠道损伤[88]. 因此, 有多种"脂质干预"可能证明有益于ALD.
戒酒是治疗ALD的基本方法. 然而, 在大多数ALD患者中, 禁欲很难维持. 另一方面, ALD的药物治疗很少. 酒精性肝炎和酒精性肝硬化有明显的症状并接受治疗. 严重急性肝炎患者的死亡率高, 约为50%, 存活者发生肝硬化的概率为70%. 由于营养不良的普遍存在, 因此对AH患者进行营养补充是必要的. 利福昔明是一种改变肠道微生物群的不可吸收抗生素, 在肝性脑病的治疗中是有效的, 并可能在调节ALD中发挥作用[89]. 抑制LPS诱导的TLR4或TNF-α信号被认为是新疗法的目标. 提示阻断血管生成可能是治疗晚期纤维化的一个有前途的选择. 针对肠道微生物及其产物, 针对肝脏炎症和纤维化, 以及免疫调节, 有助于改善肝脏再生. 这些是最有前景的研究领域, 未来的临床试验应重点关注这些领域, 以开发治疗ALD的新疗法[90].
学科分类: 胃肠病学和肝病学
手稿来源地: 山东省
同行评议报告分类
A级 (优秀): A, A
B级 (非常好): 0
C级 (良好): 0
D级 (一般): 0
E级 (差): 0
编辑: 马亚娟 电编:刘继红
| 1. | Cassard AM, Ciocan D. Microbiota, a key player in alcoholic liver disease. Clin Mol Hepatol. 2018;24:100-107. [PubMed] [DOI] |
| 2. | Zhou Z, Zhong W. Targeting the gut barrier for the treatment of alcoholic liver disease. Liver Res. 2017;1:197-207. [PubMed] [DOI] |
| 3. | O'Shea RS, Dasarathy S, McCullough AJ. Practice Guideline Committee of the American Association for the Study of Liver Diseases; Practice Parameters Committee of the American College of Gastroenterology. Alcoholic liver disease. Hepatology. 2010;51:307-328. [PubMed] [DOI] |
| 4. | Gao B, Xu MJ, Bertola A, Wang H, Zhou Z, Liangpunsakul S. Animal Models of Alcoholic Liver Disease: Pathogenesis and Clinical Relevance. Gene Expr. 2017;17:173-186. [PubMed] [DOI] |
| 5. | Dunn W, Zeng Z, O'Neil M, Zhao J, Whitener M, Yu-Jui Wan Y, Mitchell EK, Handler M, Weinman SA. The interaction of rs738409, obesity, and alcohol: a population-based autopsy study. Am J Gastroenterol. 2012;107:1668-1674. [PubMed] [DOI] |
| 6. | Szabo G, Petrasek J. Gut-liver axis and sterile signals in the development of alcoholic liver disease. Alcohol Alcohol. 2017;52:414-424. [PubMed] [DOI] |
| 7. | Setshedi M, Wands JR, Monte SM. Acetaldehyde adducts in alcoholic liver disease. Oxid Med Cell Longev. 2010;3:178-185. [PubMed] [DOI] |
| 9. | Turner JR. Intestinal mucosal barrier function in health and disease. Nat Rev Immunol. 2009;9:799-809. [PubMed] [DOI] |
| 10. | Muniz LR, Knosp C, Yeretssian G. Intestinal antimicrobial peptides during homeostasis, infection, and disease. Front Immunol. 2012;3:310. [PubMed] [DOI] |
| 11. | Pelaseyed T, Bergström JH, Gustafsson JK, Ermund A, Birchenough GM, Schütte A, van der Post S, Svensson F, Rodríguez-Piñeiro AM, Nyström EE, Wising C, Johansson ME, Hansson GC. The mucus and mucins of the goblet cells and enterocytes provide the first defense line of the gastrointestinal tract and interact with the immune system. Immunol Rev. 2014;260:8-20. [PubMed] [DOI] |
| 12. | Van der Sluis M, De Koning BA, De Bruijn AC, Velcich A, Meijerink JP, Van Goudoever JB, Büller HA, Dekker J, Van Seuningen I, Renes IB, Einerhand AW. Muc2-deficient mice spontaneously develop colitis, indicating that MUC2 is critical for colonic protection. Gastroenterology. 2006;131:117-129. [PubMed] [DOI] |
| 13. | Groschwitz KR, Hogan SP. Intestinal barrier function: molecular regulation and disease pathogenesis. J Allergy Clin Immunol. 2009;124:3-20; quiz 21-2. [PubMed] [DOI] |
| 14. | Galipeau HJ, Verdu EF. The complex task of measuring intestinal permeability in basic and clinical science. Neurogastroenterol Motil. 2016;28:957-965. [PubMed] [DOI] |
| 15. | Bischoff SC, Barbara G, Buurman W, Ockhuizen T, Schulzke JD, Serino M, Tilg H, Watson A, Wells JM. Intestinal permeability--a new target for disease prevention and therapy. BMC Gastroenterol. 2014;14:189. [PubMed] [DOI] |
| 16. | Grootjans J, Thuijls G, Verdam F, Derikx JP, Lenaerts K, Buurman WA. Non-invasive assessment of barrier integrity and function of the human gut. World J Gastrointest Surg. 2010;2:61-69. [PubMed] [DOI] |
| 17. | Roh YS, Zhang B, Loomba R, Seki E. TLR2 and TLR9 contribute to alcohol-mediated liver injury through induction of CXCL1 and neutrophil infiltration. Am J Physiol Gastrointest Liver Physiol. 2015;309:G30-G41. [PubMed] [DOI] |
| 18. | Dunn W, Shah VH. Pathogenesis of Alcoholic Liver Disease. Clin Liver Dis. 2016;20:4454-4456. [PubMed] [DOI] |
| 19. | Gao B, Bataller R. Alcoholic liver disease: pathogenesis and new therapeutic targets. Gastroenterology. 2011;141:1572-1585. [PubMed] [DOI] |
| 20. | David BA, Rezende RM, Antunes MM, Santos MM, Freitas Lopes MA, Diniz AB, Sousa Pereira RV, Marchesi SC, Alvarenga DM, Nakagaki BN, Araújo AM, Dos Reis DS, Rocha RM, Marques PE, Lee WY, Deniset J, Liew PX, Rubino S, Cox L, Pinho V, Cunha TM, Fernandes GR, Oliveira AG, Teixeira MM, Kubes P, Menezes GB. Combination of Mass Cytometry and Imaging Analysis Reveals Origin, Location, and Functional Repopulation of Liver Myeloid Cells in Mice. Gastroenterology. 2016;151:1176-1191. [PubMed] [DOI] |
| 21. | Pandey S, Kawai T, Akira S. Microbial sensing by Toll-like receptors and intracellular nucleic acid sensors. Cold Spring Harb Perspect Biol. 2014;7:a016246. [PubMed] [DOI] |
| 22. | Petrasek J, Iracheta-Vellve A, Saha B, Satishchandran A, Kodys K, Fitzgerald KA, Kurt-Jones EA, Szabo G. Metabolic danger signals, uric acid and ATP, mediate inflammatory cross-talk between hepatocytes and immune cells in alcoholic liver disease. J Leukoc Biol. 2015;98:249-256. [PubMed] [DOI] |
| 23. | Petrasek J, Bala S, Csak T, Lippai D, Kodys K, Menashy V, Barrieau M, Min SY, Kurt-Jones EA, Szabo G. IL-1 receptor antagonist ameliorates inflammasome-dependent alcoholic steatohepatitis in mice. J Clin Invest. 2012;122:3476-3489. [PubMed] [DOI] |
| 24. | Stickel F. Alcoholic cirrhosis and hepatocellular carcinoma. Adv Exp Med Biol. 2015;815:113-130. [PubMed] [DOI] |
| 25. | Kurashima Y, Kiyono H. Mucosal Ecological Network of Epithelium and Immune Cells for Gut Homeostasis and Tissue Healing. Annu Rev Immunol. 2017;35:119-147. [PubMed] [DOI] |
| 26. | Rao R. Endotoxemia and gut barrier dysfunction in alcoholic liver disease. Hepatology. 2009;50:638-644. [PubMed] [DOI] |
| 27. | Uesugi T, Froh M, Arteel GE, Bradford BU, Wheeler MD, Gäbele E, Isayama F, Thurman RG. Role of lipopolysaccharide-binding protein in early alcohol-induced liver injury in mice. J Immunol. 2002;168:2963-2969. [PubMed] |
| 28. | Ferrier L, Bérard F, Debrauwer L, Chabo C, Langella P, Buéno L, Fioramonti J. Impairment of the intestinal barrier by ethanol involves enteric microflora and mast cell activation in rodents. Am J Pathol. 2006;168:1148-1154. [PubMed] [DOI] |
| 29. | Tang Y, Forsyth CB, Farhadi A, Rangan J, Jakate S, Shaikh M, Banan A, Fields JZ, Keshavarzian A. Nitric oxide-mediated intestinal injury is required for alcohol-induced gut leakiness and liver damage. Alcohol Clin Exp Res. 2009;33:1220-1230. [PubMed] [DOI] |
| 30. | Tang Y, Banan A, Forsyth CB, Fields JZ, Lau CK, Zhang LJ, Keshavarzian A. Effect of alcohol on miR-212 expression in intestinal epithelial cells and its potential role in alcoholic liver disease. Alcohol Clin Exp Res. 2008;32:355-364. [PubMed] [DOI] |
| 31. | Forsyth CB, Shaikh M, Bishehsari F, Swanson G, Voigt RM, Dodiya H, Wilkinson P, Samelco B, Song S, Keshavarzian A. Alcohol Feeding in Mice Promotes Colonic Hyperpermeability and Changes in Colonic Organoid Stem Cell Fate. Alcohol Clin Exp Res. 2017;41:2100-2113. [PubMed] [DOI] |
| 32. | Chen T, Lin R, Jin S, Chen R, Xue H, Ye H, Huang Z. The Sphingosine-1-Phosphate/Sphingosine-1-Phosphate Receptor 2 Axis in Intestinal Epithelial Cells Regulates Intestinal Barrier Function During Intestinal Epithelial Cells-CD4+T-Cell Interactions. Cell Physiol Biochem. 2018;48:1188-1200. [PubMed] [DOI] |
| 33. | Cho YE, Kim DK, Seo W, Gao B, Yoo SH, Song BJ. Fructose Promotes Leaky Gut, Endotoxemia, and Liver Fibrosis Through Ethanol-Inducible Cytochrome P450-2E1-Mediated Oxidative and Nitrative Stress. Hepatology. 2019;. [PubMed] [DOI] |
| 34. | Tsukita S, Furuse M, Itoh M. Multifunctional strands in tight junctions. Nat Rev Mol Cell Biol. 2001;2:285-293. [PubMed] [DOI] |
| 35. | Elamin E, Jonkers D, Juuti-Uusitalo K, van Ijzendoorn S, Troost F, Duimel H, Broers J, Verheyen F, Dekker J, Masclee A. Effects of ethanol and acetaldehyde on tight junction integrity: in vitro study in a three dimensional intestinal epithelial cell culture model. PLoS One. 2012;7:e35008. [PubMed] [DOI] |
| 36. | Parlesak A, Schäfer C, Schütz T, Bode JC, Bode C. Increased intestinal permeability to macromolecules and endotoxemia in patients with chronic alcohol abuse in different stages of alcohol-induced liver disease. J Hepatol. 2000;32:742-747. [PubMed] |
| 37. | Suzuki T, Seth A, Rao R. Role of phospholipase Cgamma-induced activation of protein kinase Cepsilon (PKCepsilon) and PKCbetaI in epidermal growth factor-mediated protection of tight junctions from acetaldehyde in Caco-2 cell monolayers. J Biol Chem. 2008;283:3574-3583. [PubMed] [DOI] |
| 38. | Seth A, Sheth P, Elias BC, Rao R. Protein phosphatases 2A and 1 interact with occludin and negatively regulate the assembly of tight junctions in the CACO-2 cell monolayer. J Biol Chem. 2007;282:11487-11498. [PubMed] [DOI] |
| 39. | Sheth P, Seth A, Atkinson KJ, Gheyi T, Kale G, Giorgianni F, Desiderio DM, Li C, Naren A, Rao R. Acetaldehyde dissociates the PTP1B-E-cadherin-beta-catenin complex in Caco-2 cell monolayers by a phosphorylation-dependent mechanism. Biochem J. 2007;402:291-300. [PubMed] [DOI] |
| 40. | Nanji AA, Su GL, Laposata M, French SW. Pathogenesis of alcoholic liver disease--recent advances. Alcohol Clin Exp Res. 2002;26:731-736. [PubMed] |
| 41. | Thakur V, Pritchard MT, McMullen MR, Wang Q, Nagy LE. Chronic ethanol feeding increases activation of NADPH oxidase by lipopolysaccharide in rat Kupffer cells: role of increased reactive oxygen in LPS-stimulated ERK1/2 activation and TNF-alpha production. J Leukoc Biol. 2006;79:1348-1356. [PubMed] [DOI] |
| 42. | Franca A, Carlos Melo Lima Filho A, Guerra MT, Weerachayaphorn J, Loiola Dos Santos M, Njei B, Robert M, Xavier Lima C, Vieira Teixeira Vidigal P, Banales JM, Ananthanarayanam M, Leite MF, Nathanson MH. Effects of Endotoxin on Type 3 Inositol 1,4,5-Trisphosphate Receptor in Human Cholangiocytes. Hepatology. 2019;69:817-830. [PubMed] [DOI] |
| 43. | Fujimoto M, Uemura M, Nakatani Y, Tsujita S, Hoppo K, Tamagawa T, Kitano H, Kikukawa M, Ann T, Ishii Y, Kojima H, Sakurai S, Tanaka R, Namisaki T, Noguchi R, Higashino T, Kikuchi E, Nishimura K, Takaya A, Fukui H. Plasma endotoxin and serum cytokine levels in patients with alcoholic hepatitis: relation to severity of liver disturbance. Alcohol Clin Exp Res. 2000;24:48S-54S. [PubMed] |
| 44. | von Montfort C, Beier JI, Guo L, Kaiser JP, Arteel GE. Contribution of the sympathetic hormone epinephrine to the sensitizing effect of ethanol on LPS-induced liver damage in mice. Am J Physiol Gastrointest Liver Physiol. 2008;294:G1227-G1234. [PubMed] [DOI] |
| 45. | McClain CJ, Song Z, Barve SS, Hill DB, Deaciuc I. Recent advances in alcoholic liver disease. IV. Dysregulated cytokine metabolism in alcoholic liver disease. Am J Physiol Gastrointest Liver Physiol. 2004;287:G497-G502. [PubMed] [DOI] |
| 46. | Keshavarzian A, Choudhary S, Holmes EW, Yong S, Banan A, Jakate S, Fields JZ. Preventing gut leakiness by oats supplementation ameliorates alcohol-induced liver damage in rats. J Pharmacol Exp Ther. 2001;299:442-448. [PubMed] |
| 47. | Shao T, Zhao C, Li F, Gu Z, Liu L, Zhang L, Wang Y, He L, Liu Y, Liu Q, Chen Y, Donde H, Wang R, Jala VR, Barve S, Chen SY, Zhang X, Chen Y, McClain CJ, Feng W. Intestinal HIF-1α deletion exacerbates alcoholic liver disease by inducing intestinal dysbiosis and barrier dysfunction. J Hepatol. 2018;69:886-895. [PubMed] [DOI] |
| 48. | Shukla PK, Meena AS, Manda B, Gomes-Solecki M, Dietrich P, Dragatsis I, Rao R. Lactobacillus plantarum prevents and mitigates alcohol-induced disruption of colonic epithelial tight junctions, endotoxemia, and liver damage by an EGF receptor-dependent mechanism. FASEB J. 2018;fj201800351R. [PubMed] [DOI] |
| 49. | Engen PA, Green SJ, Voigt RM, Forsyth CB, Keshavarzian A. The Gastrointestinal Microbiome: Alcohol Effects on the Composition of Intestinal Microbiota. Alcohol Res. 2015;37:223-236. [PubMed] |
| 50. | Llopis M, Cassard AM, Wrzosek L, Boschat L, Bruneau A, Ferrere G, Puchois V, Martin JC, Lepage P, Le Roy T, Lefèvre L, Langelier B, Cailleux F, González-Castro AM, Rabot S, Gaudin F, Agostini H, Prévot S, Berrebi D, Ciocan D, Jousse C, Naveau S, Gérard P, Perlemuter G. Intestinal microbiota contributes to individual susceptibility to alcoholic liver disease. Gut. 2016;65:830-839. [PubMed] [DOI] |
| 51. | Yang AM, Inamine T, Hochrath K, Chen P, Wang L, Llorente C, Bluemel S, Hartmann P, Xu J, Koyama Y, Kisseleva T, Torralba MG, Moncera K, Beeri K, Chen CS, Freese K, Hellerbrand C, Lee SM, Hoffman HM, Mehal WZ, Garcia-Tsao G, Mutlu EA, Keshavarzian A, Brown GD, Ho SB, Bataller R, Stärkel P, Fouts DE, Schnabl B. Intestinal fungi contribute to development of alcoholic liver disease. J Clin Invest. 2017;127:2829-2841. [PubMed] [DOI] |
| 52. | Ferrere G, Wrzosek L, Cailleux F, Turpin W, Puchois V, Spatz M, Ciocan D, Rainteau D, Humbert L, Hugot C, Gaudin F, Noordine ML, Robert V, Berrebi D, Thomas M, Naveau S, Perlemuter G, Cassard AM. Fecal microbiota manipulation prevents dysbiosis and alcohol-induced liver injury in mice. J Hepatol. 2017;66:806-815. [PubMed] [DOI] |
| 53. | Szabo G, Petrasek J. Inflammasome activation and function in liver disease. Nat Rev Gastroenterol Hepatol. 2015;12:387-400. [PubMed] [DOI] |
| 54. | Mutlu EA, Gillevet PM, Rangwala H, Sikaroodi M, Naqvi A, Engen PA, Kwasny M, Lau CK, Keshavarzian A. Colonic microbiome is altered in alcoholism. Am J Physiol Gastrointest Liver Physiol. 2012;302:G966-G978. [PubMed] [DOI] |
| 55. | Vlachogiannakos J, Viazis N, Vasianopoulou P, Vafiadis I, Karamanolis DG, Ladas SD. Long-term administration of rifaximin improves the prognosis of patients with decompensated alcoholic cirrhosis. J Gastroenterol Hepatol. 2013;28:450-455. [PubMed] [DOI] |
| 56. | Kalambokis GN, Mouzaki A, Rodi M, Tsianos EV. Rifaximin improves thrombocytopenia in patients with alcoholic cirrhosis in association with reduction of endotoxaemia. Liver Int. 2012;32:467-475. [PubMed] [DOI] |
| 57. | Kalambokis GN, Mouzaki A, Rodi M, Pappas K, Fotopoulos A, Xourgia X, Tsianos EV. Rifaximin improves systemic hemodynamics and renal function in patients with alcohol-related cirrhosis and ascites. Clin Gastroenterol Hepatol. 2012;10:815-818. [PubMed] [DOI] |
| 58. | Bass NM, Mullen KD, Sanyal A, Poordad F, Neff G, Leevy CB, Sigal S, Sheikh MY, Beavers K, Frederick T, Teperman L, Hillebrand D, Huang S, Merchant K, Shaw A, Bortey E, Forbes WP. Rifaximin treatment in hepatic encephalopathy. N Engl J Med. 2010;362:1071-1081. [PubMed] [DOI] |
| 59. | Madsen BS, Trebicka J, Thiele M, Israelsen M, Arumugan M, Havelund T, Krag A. Antifibrotic and molecular aspects of rifaximin in alcoholic liver disease: study protocol for a randomized controlled trial. Trials. 2018;19:143. [PubMed] [DOI] |
| 60. | Markwick LJ, Riva A, Ryan JM, Cooksley H, Palma E, Tranah TH, Manakkat Vijay GK, Vergis N, Thursz M, Evans A, Wright G, Tarff S, O'Grady J, Williams R, Shawcross DL, Chokshi S. Blockade of PD1 and TIM3 restores innate and adaptive immunity in patients with acute alcoholic hepatitis. Gastroenterology. 2015;148:590-602.e10. [PubMed] [DOI] |
| 61. | Leung C, Rivera L, Furness JB, Angus PW. The role of the gut microbiota in NAFLD. Nat Rev Gastroenterol Hepatol. 2016;13:412-425. [PubMed] [DOI] |
| 62. | Han SH, Suk KT, Kim DJ, Kim MY, Baik SK, Kim YD, Cheon GJ, Choi DH, Ham YL, Shin DH, Kim EJ. Effects of probiotics (cultured Lactobacillus subtilis/Streptococcus faecium) in the treatment of alcoholic hepatitis: randomized-controlled multicenter study. Eur J Gastroenterol Hepatol. 2015;27:1300-1306. [PubMed] [DOI] |
| 63. | Chen RC, Xu LM, Du SJ, Huang SS, Wu H, Dong JJ, Huang JR, Wang XD, Feng WK, Chen YP. Lactobacillus rhamnosus GG supernatant promotes intestinal barrier function, balances Treg and TH17 cells and ameliorates hepatic injury in a mouse model of chronic-binge alcohol feeding. Toxicol Lett. 2016;241:103-110. [PubMed] [DOI] |
| 64. | Hong M, Han DH, Hong J, Kim DJ, Suk KT. Are Probiotics Effective in Targeting Alcoholic Liver Diseases? Probiotics Antimicrob Proteins. 2019;11:335-347. [PubMed] [DOI] |
| 65. | Li F, Duan K, Wang C, McClain C, Feng W. Probiotics and Alcoholic Liver Disease: Treatment and Potential Mechanisms. Gastroenterol Res Pract. 2016;2016:5491465. [PubMed] [DOI] |
| 66. | Borody TJ, Campbell J. Fecal microbiota transplantation: techniques, applications, and issues. Gastroenterol Clin North Am. 2012;41:781-803. [PubMed] [DOI] |
| 67. | Sun Q, Li Q, Zhong W, Zhang J, Sun X, Tan X, Yin X, Sun X, Zhang X, Zhou Z. Dysregulation of hepatic zinc transporters in a mouse model of alcoholic liver disease. Am J Physiol Gastrointest Liver Physiol. 2014;307:G313-G322. [PubMed] [DOI] |
| 68. | Zhong W, Zhao Y, Sun X, Song Z, McClain CJ, Zhou Z. Dietary zinc deficiency exaggerates ethanol-induced liver injury in mice: involvement of intrahepatic and extrahepatic factors. PLoS One. 2013;8:e76522. [PubMed] [DOI] |
| 69. | Kirpich IA, Feng W, Wang Y, Liu Y, Beier JI, Arteel GE, Falkner KC, Barve SS, McClain CJ. Ethanol and dietary unsaturated fat (corn oil/linoleic acid enriched) cause intestinal inflammation and impaired intestinal barrier defense in mice chronically fed alcohol. Alcohol. 2013;47:257-264. [PubMed] [DOI] |
| 70. | Kirpich IA, Petrosino J, Ajami N, Feng W, Wang Y, Liu Y, Beier JI, Barve SS, Yin X, Wei X, Zhang X, McClain CJ. Saturated and Unsaturated Dietary Fats Differentially Modulate Ethanol-Induced Changes in Gut Microbiome and Metabolome in a Mouse Model of Alcoholic Liver Disease. Am J Pathol. 2016;186:765-776. [PubMed] [DOI] |
| 71. | Chen P, Torralba M, Tan J, Embree M, Zengler K, Stärkel P, van Pijkeren JP, DePew J, Loomba R, Ho SB, Bajaj JS, Mutlu EA, Keshavarzian A, Tsukamoto H, Nelson KE, Fouts DE, Schnabl B. Supplementation of saturated long-chain fatty acids maintains intestinal eubiosis and reduces ethanol-induced liver injury in mice. Gastroenterology. 2015;148:203-214.e16. [PubMed] [DOI] |
| 72. | Benoit B, Bruno J, Kayal F, Estienne M, Debard C, Ducroc R, Plaisancié P. Saturated and Unsaturated Fatty Acids Differently Modulate Colonic Goblet Cells In Vitro and in Rat Pups. J Nutr. 2015;145:1754-1762. [PubMed] [DOI] |
| 73. | Lafdil F, Miller AM, Ki SH, Gao B. Th17 cells and their associated cytokines in liver diseases. Cell Mol Immunol. 2010;7:250-254. [PubMed] [DOI] |
| 74. | Ki SH, Park O, Zheng M, Morales-Ibanez O, Kolls JK, Bataller R, Gao B. Interleukin-22 treatment ameliorates alcoholic liver injury in a murine model of chronic-binge ethanol feeding: role of signal transducer and activator of transcription 3. Hepatology. 2010;52:1291-1300. [PubMed] [DOI] |
| 75. | Ratziu V, Sheikh MY, Sanyal AJ, Lim JK, Conjeevaram H, Chalasani N, Abdelmalek M, Bakken A, Renou C, Palmer M, Levine RA, Bhandari BR, Cornpropst M, Liang W, King B, Mondou E, Rousseau FS, McHutchison J, Chojkier M. A phase 2, randomized, double-blind, placebo-controlled study of GS-9450 in subjects with nonalcoholic steatohepatitis. Hepatology. 2012;55:419-428. [PubMed] [DOI] |
| 76. | Szabo G, Mandrekar P, Petrasek J, Catalano D. The unfolding web of innate immune dysregulation in alcoholic liver injury. Alcohol Clin Exp Res. 2011;35:782-786. [PubMed] [DOI] |
| 77. | Lazaro R, Wu R, Lee S, Zhu NL, Chen CL, French SW, Xu J, Machida K, Tsukamoto H. Osteopontin deficiency does not prevent but promotes alcoholic neutrophilic hepatitis in mice. Hepatology. 2015;61:129-140. [PubMed] [DOI] |
| 78. | Liu H, Liu M, Fu X, Zhang Z, Zhu L, Zheng X, Liu J. Astaxanthin Prevents Alcoholic Fatty Liver Disease by Modulating Mouse Gut Microbiota. Nutrients. 2018;10. [PubMed] [DOI] |
| 79. | Kim B, Farruggia C, Ku CS, Pham TX, Yang Y, Bae M, Wegner CJ, Farrell NJ, Harness E, Park YK, Koo SI, Lee JY. Astaxanthin inhibits inflammation and fibrosis in the liver and adipose tissue of mouse models of diet-induced obesity and nonalcoholic steatohepatitis. J Nutr Biochem. 2017;43:27-35. [PubMed] [DOI] |
| 80. | Shen M, Chen K, Lu J, Cheng P, Xu L, Dai W, Wang F, He L, Zhang Y, Chengfen W, Li J, Yang J, Zhu R, Zhang H, Zheng Y, Zhou Y, Guo C. Protective effect of astaxanthin on liver fibrosis through modulation of TGF-β1 expression and autophagy. Mediators Inflamm. 2014;2014:954502. [PubMed] [DOI] |
| 81. | Wang Y, Guan M, Zhao X, Li X. Effects of garlic polysaccharide on alcoholic liver fibrosis and intestinal microflora in mice. Pharm Biol. 2018;56:325-332. [PubMed] [DOI] |
| 82. | Chen JR, Chen YL, Peng HC, Lu YA, Chuang HL, Chang HY, Wang HY, Su YJ, Yang SC. Fish Oil Reduces Hepatic Injury by Maintaining Normal Intestinal Permeability and Microbiota in Chronic Ethanol-Fed Rats. Gastroenterol Res Pract. 2016;2016:4694726. [PubMed] [DOI] |
| 83. | Zhang X, Wang H, Yin P, Fan H, Sun L, Liu Y. Flaxseed oil ameliorates alcoholic liver disease via anti-inflammation and modulating gut microbiota in mice. Lipids Health Dis. 2017;16:44. [PubMed] [DOI] |
| 84. | Cho YE, Song BJ. Pomegranate prevents binge alcohol-induced gut leakiness and hepatic inflammation by suppressing oxidative and nitrative stress. Redox Biol. 2018;18:266-278. [PubMed] [DOI] |
| 85. | Porras D, Nistal E, Martínez-Flórez S, Pisonero-Vaquero S, Olcoz JL, Jover R, González-Gallego J, García-Mediavilla MV, Sánchez-Campos S. Protective effect of quercetin on high-fat diet-induced non-alcoholic fatty liver disease in mice is mediated by modulating intestinal microbiota imbalance and related gut-liver axis activation. Free Radic Biol Med. 2017;102:188-202. [PubMed] [DOI] |
| 86. | Zhong W, Li Q, Xie G, Sun X, Tan X, Sun X, Jia W, Zhou Z. Dietary fat sources differentially modulate intestinal barrier and hepatic inflammation in alcohol-induced liver injury in rats. Am J Physiol Gastrointest Liver Physiol. 2013;305:G919-G932. [PubMed] [DOI] |
| 87. | Vanek VW, Seidner DL, Allen P, Bistrian B, Collier S, Gura K, Miles JM, Valentine CJ, Kochevar M; Novel Nutrient Task Force, Intravenous Fat Emulsions Workgroup; American Society for Parenteral and Enteral Nutrition (A. S.P.E.N.) Board of Directors. A.S.P.E.N. position paper: Clinical role for alternative intravenous fat emulsions. Nutr Clin Pract. 2012;27:150-192. [PubMed] [DOI] |
| 88. | Cresci GA, Bush K, Nagy LE. Tributyrin supplementation protects mice from acute ethanol-induced gut injury. Alcohol Clin Exp Res. 2014;38:1489-1501. [PubMed] [DOI] |
| 89. | Wu GD, Chen J, Hoffmann C, Bittinger K, Chen YY, Keilbaugh SA, Bewtra M, Knights D, Walters WA, Knight R, Sinha R, Gilroy E, Gupta K, Baldassano R, Nessel L, Li H, Bushman FD, Lewis JD. Linking long-term dietary patterns with gut microbial enterotypes. Science. 2011;334:105-108. [PubMed] [DOI] |
| 90. | Kirpich IA, Miller ME, Cave MC, Joshi-Barve S, McClain CJ. Alcoholic Liver Disease: Update on the Role of Dietary Fat. Biomolecules. 2016;6:1. [PubMed] [DOI] |