修回日期: 2019-08-27
接受日期: 2019-09-08
在线出版日期: 2019-09-28
MicroRNA是一种内源性单链非编码小分子RNA, 通过与靶mRNA的特异性结合, 以降解mRNA或阻碍其翻译从而在转录后水平调节靶mRNA的表达. MicroRNA-146a参与机体的多种生物学过程, 具有多种生物学功能. 本文将从其控制炎症反应, 调节免疫, 介导髓样细胞增殖以及肿瘤发生发展等几个方面进行综述.
核心提要: MicroRNA-146a可通过与靶基因mRNA的3'-非翻译区结合, 介导转录抑制和mRNA降解, 在多个信号通路中发挥作用, 与免疫炎症反应、髓性增生、肿瘤、造血等生物过程有着密切联系.
引文著录: 吴慧, 范恒, 刘星星. MicroRNA-146a生物学作用的研究进展. 世界华人消化杂志 2019; 27(18): 1155-1160
Revised: August 27, 2019
Accepted: September 8, 2019
Published online: September 28, 2019
MicroRNAs are endogenous single-stranded non-coding small RNAs that specifically bind to target mRNAs to degrade mRNAs or hinder their translation to regulate the expression of target mRNAs at the post-transcriptional level. MicroRNA-146a is involved in a bulk of biological processes and has a variety of biological functions. This article will review several aspects of the role of microRNA-146a, including controlling inflammation, regulating immunity, mediating myeloid cell proliferation, and involvement in tumor occurrence and development.
- Citation: Wu H, Fan H, Liu XX. Biological role of microRNA-146a. Shijie Huaren Xiaohua Zazhi 2019; 27(18): 1155-1160
- URL: https://www.wjgnet.com/1009-3079/full/v27/i18/1155.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v27.i18.1155
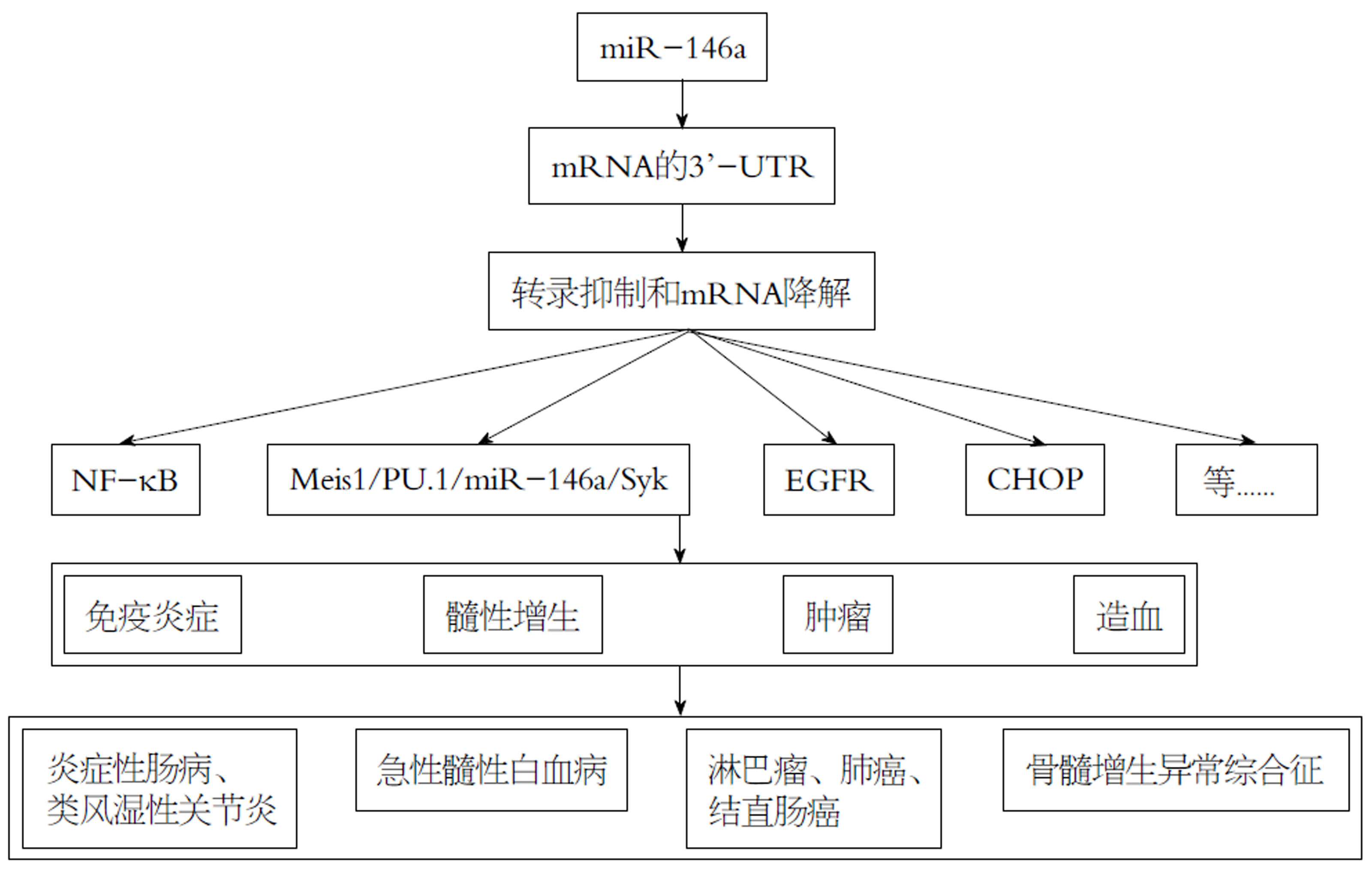
机体的各项生命活动之所以能够正常有序的进行及终止, 这得益于体内各种分子参与其中, 发挥有效的生物学作用. 除蛋白质外, microRNA(miRNA)在生物体维持自身稳态中起着不可或缺的作用, 并逐渐成为研究的热点. 其中, MicroRNA-146a(miR-146a)因为其能够负向调节核因子κB(nuclear factor κB, NF-κB)信号通路, 在控制炎症反应及免疫调节中扮演着重要角色, 而得到众多学者的关注. 通过进一步研究发现, miR-146a同样可以通过不同的分子机制影响骨髓造血稳态的维持及肿瘤形成. 本文将通过参阅文献拟就miR-146a的控制炎症, 调节免疫, 介导髓样细胞增殖及肿瘤的发生发展等几个突出的生物学作用作一综述(图1).
miRNAs是一类在进化上保守的内源性非编码小分子RNA, 其大小约19-23核苷酸. 截至目前, 在人体的基因组中已经发现了超过2000种miRNAs[1]. miRNAs可参与一系列生物过程, 包括细胞分化[2]、发育[3]、增殖[4]、造血[5]、凋亡[6]、应激反应[7]以及免疫功能[8]的调节. miRNAs的经典合成途径包括两步[9,10]: 在动物, 首先, miRNA基因的长初级转录物(pri-miRNAs, pri-miR)在胞核中被Drosha加工形成发夹状前体(pre-miRNAs, pre-miR), 然后, Dicer进一步切割被转运至胞质中的pre-miR, 最终形成其成熟形式. 成熟的miRNA参与形成RNA诱导沉默复合体(RNA-induced silencing complex, RISC)[11,12], 通过与靶基因mRNA的3'-非翻译区(untranslated region, UTR)结合, 介导转录抑制和mRNA降解[13]. 目前检测miRNA的方法主要有Northern印迹分析, 微点阵分析和实时定量PCR.
miR-146a属于miR-146家族(包括miR-146a和miR-146b). miR-146a和miR-146b分别位于人染色体组的5号和10号染色体上, 二者成熟序列的区别仅表现为在3'端相差2个核苷酸. miR-146a广泛表达于免疫系统, 并且, 通常在前体细胞其表达量低, 而随着细胞成熟及活化后其表达上调[14].
miR-146a前体形成是一个NF-κB转录活性依赖过程[15], 而 miR-146a又被证明能反过来影响NF-κB通路, 从而形成一个环形调节通路. 启动子分析显示miR-146a的启动子区含有两个NF-κB共有序列, 这两个序列是脂多糖(lipopolysaccharides, LPS), 白细胞介素-1β(interleukin-1β, IL-1β), 肿瘤坏死因子(tumor necrosis factor, TNF)等炎症刺激诱导下miR-146a基因转录活化中必不可少的. 病毒感染刺激引起的miR-146a诱导表达同样依赖于NF-κB信号通路[16].
研究显示, 类风湿性关节炎[17], 银屑病[18], 干燥综合征[19], 以及系统性红斑狼疮[20]等多种自身免疫性疾病中miR-146a的表达存在异常. Boldin等[21]证实miR-146a主要表达在免疫组织, 在免疫细胞成熟和/或活化时其表达上调. miR-146a基因敲除小鼠会表现出一些免疫相关的表型, 且该改变与miR-146a的表达位置密切相关. miR-146a基因缺陷的巨噬细胞对细菌LPS刺激有更强的反应性; 在miR-146a基因敲除小鼠表现为内毒素刺激会诱导出较野生型小鼠更为严重的炎症反应. 并且, 过表达miR-146a可逆转这些敲除所引起的异常反应. 随着年龄的增长, miR-146a缺陷小鼠会自发出现自身免疫系统紊乱, 具体表现为脾大、淋巴结肿大及早死[21,22]. 严重的组织炎症, 细胞因子产量基础水平升高和自身抗体滴度增高也都反映了小鼠由于基因敲除引起的自身免疫性疾病. 巨噬细胞对病原体的高反应性, 外周效应T细胞对自身组织成分的反应性[21], 以及Tregs细胞功能不良[23], 等细胞异常导致上述miR-146a缺陷遗传背景下自身免疫性疾病的发生.
无论体内还是体外条件下, miR-146a异常表达或者通过miR-146a模拟物过表达均可降低促炎细胞因子的表达水平, 减轻细菌或病毒刺激引起的炎症反应[24,25]. 已有的研究表明, miR-146a在内毒素耐受这一过程中起到了重要作用[26,27]. 1947年已有实验室证明暴露于亚致死剂量LPS会造成细胞暂时性低反应性, 即细胞所产生的炎症介质较未处理细胞更低. 这种对LPS低反应性状态使细胞在紧接着的二次致死剂量的LPS作用下受到一定保护作用. 其原因在于, 一方面miR-146a可促进RelB与促炎因子如TNF启动子的结合以阻碍其表达; 另一方面miR-146a可使RISC募集至TNF的RNA转录物从而促进TNF在转录水平的抑制. 实验证明miR-146a可通过抑制TLR4下游通路中的IRAK1和TRAF6活性来减轻免疫炎症反应所引起的肝移植损伤[28]. 最新研究报道, miR-146a通过负向调节TLR4/NF-kB信号通路来抑制类风湿性关节炎成纤维细胞样滑膜细胞增殖及炎症反应[29].
在不少研究中观察到, miR-146a缺失会导致进行性髓样增生, 在脾脏以CD11b+GR1+幼稚细胞增生为主, 在骨髓则主要是CD11b+前体细胞, 通过特异性敲除NF-κB的p50亚基可有效抑制上述病理进程, 从侧面证实这种髓样增生与NF-κB通路有着密切关系[21,30]. 进一步的研究则证明, NF-κB信号通路上游的miR-146a-Traf6轴参与了髓细胞的异常增殖改变[22]. Li等[31]通过体内体外实验发现, miR-146a在巨噬细胞集落刺激因子(macrophage colony-stimulating factor, G-CSF)影响下表达上调, 进而抑制其下游分子CXCR4和Smad4, 抑制白血病细胞转移, 促进白血病细胞进入细胞周期, 改善老年急性髓性白血病患者的预后. 另一方面, Mohr等[32]利用多基因改造及多组学技术明确了miR-146a参与Hoxa9和Meis1基因融合背景下, Meis1/PU.1/miR-146a/Syk通路介导的以过度增殖、分化停滞及凋亡异常为特征的急性髓性白血病(acute myeloid leukemia, AML)的发病, 使以Syk为靶点的成药性研究及AML治疗突破成为可能.
在多种恶性肿瘤中可观察到miR-146a表达异常, 进一步探索发现, miR-146a可能参与抑制肿瘤转移[33-35]. 经分析, 胃癌[36], 宫颈癌[37], 及甲状腺癌[38]均存在miR-146a表达下调. Contreras等[39]人通过转基因技术及高通量测序等方法发现原癌基因c-Myc过表达同时伴随miR-146a缺陷将导致侵袭性更强的肿瘤形成, 其深层原因在于由于miR-146a被敲除及c-Myc过表达对miR-146a产生的抑制作用而引起miR-146a表达下调, 继而造成miR-146a下游的基因异常表达. 靶基因预测算法和荧光素酶报告实验证明miR-146a可通过抑制垂体瘤转化基因1的表达和活性, 进而抑制膀胱癌的迁移, 侵袭, 转移和生长[40]. 此外, 一项meta分析显示, 高表达miR-146a-5p的实体瘤肿瘤患者往往能有更好的预后, 尤其是生殖和消化系统肿瘤[41].
2.3.1 淋巴瘤: NKT细胞淋巴瘤(natural killer/T-cell lymphoma, NKTCL)是一种罕见而侵袭性强的非霍奇金淋巴瘤(non-Hodgkin lymphoma, NHL), 属于的B细胞淋巴瘤一种. NF-κB构成性活化是许多造血系统肿瘤及实体瘤的一个标志性改变[42,43]. Alizadeh等[44]亦证实B细胞淋巴瘤与NF-κB构成性活化密切相关. miR-146a作为NF-κB信号通路的负向调节分子, 该小RNA的表达缺失可能是B细胞恶性肿瘤的病理机制之一. NKTCL组织和SNK6、YT肿瘤细胞系中miR-146a异常低表达, miR-146a启动子表现出过度的甲基化, 应用去甲基化制剂可上调miR-146a表达; 过表达miR-146a通过抑制肿瘤坏死因子受体相关因子6(TNF receptor-associated factor 6, TRAF6), 下调NF-κB活性, 也可抑制细胞增殖, 诱导凋亡并增强肿瘤细胞化疗敏感性[45]. 这提示, miR-146a在此型淋巴瘤的发病中有着不可忽视的意义. 临床数据表明, miR-146a低表达是预后不良的独立危险因素[46]. 另一种NHL即弥散性大B细胞淋巴瘤(diffuse large B-cell lymphoma, DLBCL)中, miR-146a在外泌体中的表达水平要明显高于血浆, 这为外泌体来源的miR-146a作为DLBCL治疗反应性和复发风险的生物学指标提供了可靠依据[47].
2.3.2 肺癌: miR-146a表达异常在非小细胞肺癌(nonsmall cell lung cancer, NSCLC)中也同样存在. 体外实验显示, miR-146a抑制表皮生长因子受体(epidermal growth factor receptor, EGFR)和NF-κB信号通路, 抑制肿瘤细胞生长, 诱导凋亡, 降低其迁移能力[48]. 临床肺肿瘤组织样本检测发现, miR-146a低表达与晚期TNM分期和NSCLC远处转移相关. 而肿瘤组织高表达miR-146a的患者表现出无进展带瘤存活时间更长. miR-146a除了通过调节上述两条通路参与NSCLC发病, 其下游分子肿瘤胶原酶刺激因子(tumor collagenase stimulatory factor, TCSF)亦可通过影响细胞活性、增殖及凋亡介导NSCLC的病理进程[49]. 另一项研究则证实, 肺癌中miR-146a异常表达对细胞的生长不会产生影响, 但可通过下调DNA损伤诱导转录因子3(DNA damage inducible transcript 3, DDIT3/CHOP)影响自噬及凋亡相关基因, 最终导致肺肿瘤细胞的耐药性增加, 易复发, 提示着较差的预后[50]. 虽然不同研究结果略显矛盾, 但这也反映miR-146a参与多种生物过程, 在肺癌中发挥着复杂的作用.
2.3.3 结直肠癌: Lu等[51]发现miR-146a-5p在结直肠癌(colorectal cancer, CRC)中异常高表达, 并促进CRC细胞的转移. 具体机制涉及高表达的miR-146a-5p下调羧肽酶(carboxypeptidase M, CPM), 进而上调Src和FAK表达, 从而促进肿瘤细胞的侵袭和转移. 在基因表达芯片和miRNA分析等技术的辅助下, Bleau等[52]则证明了miR-146a可阻碍下游原癌基因c-met翻译, 抑制CRC肝转移, 抑制肿瘤发生. 一项大样本病例对照研究显示, miR-146a+60位点处存在的C-G基因多态现象(rs2910164)可能会降低中国人群中不吸烟者及不饮酒者罹患CRC的风险[53]. 对miR-146a表达量的影响可能是miR-146a基因多态性与CRC关系的主要影响因素.由此可见, miR-146a基因型及表达量对CRC的发生发展及预后有着深远影响.
2.3.4 miR-146a与造血: 报道显示miR-146a在造血干细胞稳态维持及骨髓生成方面发挥着重要作用[54]. 随着衰老进程, miR-146a基因敲除小鼠逐渐发展为以全血细胞减少及骨髓纤维化为主要表现的骨髓造血功能衰竭[30]. 而骨髓增生异常综合征(myelodysplastic syndrome, MDS)及急性髓性白血病患者显示也存在miR-146a低表达[55]. Varney等[56]同时还发现miR-146a被认为是人类染色体5q上可能的单倍体不足基因, 介导MDS的常见亚型即5q-综合征. MDS及再生障碍性贫血中进展性的全血细胞减少被认为是正常的造血干细胞微环境遭到破坏[57]. 转导淋巴细胞活化分子系统发现miR-146a基因敲除小鼠骨髓中的长期造血干细胞显著减少, 并进一步证实miR-146a介导的骨髓T细胞来源的IFN-γ在模型鼠造血微环境破坏中起到了至关重要的作用[22].
miR-146a调控下游基因表达的多样性和复杂性, 反映了其可参与机体多个生物过程, 发挥着重要的生物学作用.而miR-146a在不同疾病模型中表达水平各异, 所介导的信号通路和所造成的最终结局也不尽相同. 是疾病或病理过程中确实发生的基因、蛋白等水平差异表达, 而得到相异的结论, 还是在现有的实验条件及实验水平下, 实验设计缺陷等其他干扰因素造成, 目前尚未有一致的定论.因此, 有必要不断完善研究, 以进一步明确miR-146a生物学作用, 尤其是在各种疾病及病理过程的作用.随着对其在生物体内功能的进一步探索, 将会为免疫炎症肿瘤等方面疾病的诊断、治疗及预后判断提供新思路.
学科分类: 胃肠病学和肝病学
手稿来源地: 湖北省
同行评议报告分类
A级 (优秀): 0
B级 (非常好): B
C级 (良好): C
D级 (一般): D
E级 (差): 0
编辑: 王禹乔 电编:刘继红
| 1. | Kozomara A, Griffiths-Jones S. miRBase: annotating high confidence microRNAs using deep sequencing data. Nucleic Acids Res. 2014;42:D68-D73. [PubMed] [DOI] |
| 2. | Liang B, Chen Y, Yuan W, Qin F, Zhang Q, Deng N, Liu X, Ma X, Zhang X, Zhang B, Deng Q, Huang M, Tang H, Liu L, Chen W, Xiao Y. Down-regulation of miRNA-451a and miRNA-486-5p involved in benzene-induced inhibition on erythroid cell differentiation in vitro and in vivo. Arch Toxicol. 2018;92:259-272. [PubMed] [DOI] |
| 3. | Kumar Kingsley SM, Vishnu Bhat B. Role of MicroRNAs in the development and function of innate immune cells. Int Rev Immunol. 2017;36:154-175. [PubMed] [DOI] |
| 4. | Yao C, Sun M, Yuan Q, Niu M, Chen Z, Hou J, Wang H, Wen L, Liu Y, Li Z, He Z. MiRNA-133b promotes the proliferation of human Sertoli cells through targeting GLI3. Oncotarget. 2016;7:2201-2219. [PubMed] [DOI] |
| 5. | Jia W, Liang D, Li N, Liu M, Dong Z, Li J, Dong X, Yue Y, Hu P, Yao J, Zhao Q. Zebrafish microRNA miR-210-5p inhibits primitive myelopoiesis by silencing foxj1b and slc3a2a mRNAs downstream of gata4/5/6 transcription factor genes. J Biol Chem. 2019;294:2732-2743. [PubMed] [DOI] |
| 6. | Ihle MA, Trautmann M, Kuenstlinger H, Huss S, Heydt C, Fassunke J, Wardelmann E, Bauer S, Schildhaus HU, Buettner R, Merkelbach-Bruse S. miRNA-221 and miRNA-222 induce apoptosis via the KIT/AKT signalling pathway in gastrointestinal stromal tumours. Mol Oncol. 2015;9:1421-1433. [PubMed] [DOI] |
| 7. | Megha S, Basu U, Kav NNV. Regulation of low temperature stress in plants by microRNAs. Plant Cell Environ. 2018;41:1-15. [PubMed] [DOI] |
| 8. | Murer A, Rühl J, Zbinden A, Capaul R, Hammerschmidt W, Chijioke O, Münz C. MicroRNAs of Epstein-Barr Virus Attenuate T-Cell-Mediated Immune Control In Vivo. MBio. 2019;10. [PubMed] [DOI] |
| 9. | Krol J, Loedige I, Filipowicz W. The widespread regulation of microRNA biogenesis, function and decay. Nat Rev Genet. 2010;11:597-610. [PubMed] [DOI] |
| 10. | Kim VN, Han J, Siomi MC. Biogenesis of small RNAs in animals. Nat Rev Mol Cell Biol. 2009;10:126-139. [PubMed] [DOI] |
| 11. | Kawamata T, Tomari Y. Making RISC. Trends Biochem Sci. 2010;35:368-376. [PubMed] [DOI] |
| 12. | Ameres SL, Zamore PD. Diversifying microRNA sequence and function. Nat Rev Mol Cell Biol. 2013;14:475-488. [PubMed] [DOI] |
| 13. | Iwakawa HO, Tomari Y. The Functions of MicroRNAs: mRNA Decay and Translational Repression. Trends Cell Biol. 2015;25:651-665. [PubMed] [DOI] |
| 14. | Starczynowski DT, Kuchenbauer F, Wegrzyn J, Rouhi A, Petriv O, Hansen CL, Humphries RK, Karsan A. MicroRNA-146a disrupts hematopoietic differentiation and survival. Exp Hematol. 2011;39:167-178.e4. [PubMed] [DOI] |
| 15. | Taganov KD, Boldin MP, Chang KJ, Baltimore D. NF-kappaB-dependent induction of microRNA miR-146, an inhibitor targeted to signaling proteins of innate immune responses. Proc Natl Acad Sci U S A. 2006;103:12481-12486. [PubMed] [DOI] |
| 16. | Heinz S, Glass CK. Roles of lineage-determining transcription factors in establishing open chromatin: lessons from high-throughput studies. Curr Top Microbiol Immunol. 2012;356:1-15. [PubMed] [DOI] |
| 17. | Singh A, Patro PS, Aggarwal A. MicroRNA-132, miR-146a, and miR-155 as potential biomarkers of methotrexate response in patients with rheumatoid arthritis. Clin Rheumatol. 2019;38:877-884. [PubMed] [DOI] |
| 18. | Mensà E, Recchioni R, Marcheselli F, Giuliodori K, Consales V, Molinelli E, Prattichizzo F, Rippo MR, Campanati A, Procopio AD, Olivieri F, Offidani AM. MiR-146a-5p correlates with clinical efficacy in patients with psoriasis treated with the tumour necrosis factor-alpha inhibitor adalimumab. Br J Dermatol. 2018;179:787-789. [PubMed] [DOI] |
| 19. | Wang-Renault SF, Boudaoud S, Nocturne G, Roche E, Sigrist N, Daviaud C, Bugge Tinggaard A, Renault V, Deleuze JF, Mariette X, Tost J. Deregulation of microRNA expression in purified T and B lymphocytes from patients with primary Sjögren's syndrome. Ann Rheum Dis. 2018;77:133-140. [PubMed] [DOI] |
| 20. | Shumnalieva R, Kachakova D, Shoumnalieva-Ivanova V, Miteva P, Kaneva R, Monov S. Whole peripheral blood miR-146a and miR-155 expression levels in Systemic lupus erythematosus patients. Acta Reumatol Port. 2018;43:217-225. [PubMed] |
| 21. | Boldin MP, Taganov KD, Rao DS, Yang L, Zhao JL, Kalwani M, Garcia-Flores Y, Luong M, Devrekanli A, Xu J, Sun G, Tay J, Linsley PS, Baltimore D. miR-146a is a significant brake on autoimmunity, myeloproliferation, and cancer in mice. J Exp Med. 2011;208:1189-1201. [PubMed] [DOI] |
| 22. | Magilnick N, Reyes EY, Wang WL, Vonderfecht SL, Gohda J, Inoue JI, Boldin MP. miR-146a-Traf6 regulatory axis controls autoimmunity and myelopoiesis, but is dispensable for hematopoietic stem cell homeostasis and tumor suppression. Proc Natl Acad Sci U S A. 2017;114:E7140-E7149. [PubMed] [DOI] |
| 23. | Lu LF, Boldin MP, Chaudhry A, Lin LL, Taganov KD, Hanada T, Yoshimura A, Baltimore D, Rudensky AY. Function of miR-146a in controlling Treg cell-mediated regulation of Th1 responses. Cell. 2010;142:914-929. [PubMed] [DOI] |
| 24. | Hou J, Wang P, Lin L, Liu X, Ma F, An H, Wang Z, Cao X. MicroRNA-146a feedback inhibits RIG-I-dependent Type I IFN production in macrophages by targeting TRAF6, IRAK1, and IRAK2. J Immunol. 2009;183:2150-2158. [PubMed] [DOI] |
| 25. | Bai X, Zhang J, Cao M, Han S, Liu Y, Wang K, Han F, Li X, Jia Y, Wang X, Shi J, Hu D. MicroRNA-146a protects against LPS-induced organ damage by inhibiting Notch1 in macrophage. Int Immunopharmacol. 2018;63:220-226. [PubMed] [DOI] |
| 26. | Dai Y, Jia P, Fang Y, Liu H, Jiao X, He JC, Ding X. miR-146a is essential for lipopolysaccharide (LPS)-induced cross-tolerance against kidney ischemia/reperfusion injury in mice. Sci Rep. 2016;6:27091. [PubMed] [DOI] |
| 27. | El Gazzar M, Church A, Liu T, McCall CE. MicroRNA-146a regulates both transcription silencing and translation disruption of TNF-α during TLR4-induced gene reprogramming. J Leukoc Biol. 2011;90:509-519. [PubMed] [DOI] |
| 28. | Jiang W, Ni Q, Tan L, Kong L, Lu Y, Xu X, Kong L. The microRNA-146a/b attenuates acute small-for-size liver graft injury in rats. Liver Int. 2015;35:914-924. [PubMed] [DOI] |
| 29. | Liu W, Wu YH, Zhang L, Xue B, Wang Y, Liu B, Liu XY, Zuo F, Yang XY, Chen FY, Duan R, Cai Y, Zhang B, Ji Y. MicroRNA-146a suppresses rheumatoid arthritis fibroblast-like synoviocytes proliferation and inflammatory responses by inhibiting the TLR4/NF-kB signaling. Oncotarget. 2018;9:23944-23959. [PubMed] [DOI] |
| 30. | Zhao JL, Rao DS, Boldin MP, Taganov KD, O'Connell RM, Baltimore D. NF-kappaB dysregulation in microRNA-146a-deficient mice drives the development of myeloid malignancies. Proc Natl Acad Sci U S A. 2011;108:9184-9189. [PubMed] [DOI] |
| 31. | Li X, Xu L, Sheng X, Cai J, Liu J, Yin T, Xiao F, Chen F, Zhong H. Upregulated microRNA-146a expression induced by granulocyte colony-stimulating factor enhanced low-dosage chemotherapy response in aged acute myeloid leukemia patients. Exp Hematol. 2018;68:66-79.e3. [PubMed] [DOI] |
| 32. | Mohr S, Doebele C, Comoglio F, Berg T, Beck J, Bohnenberger H, Alexe G, Corso J, Ströbel P, Wachter A, Beissbarth T, Schnütgen F, Cremer A, Haetscher N, Göllner S, Rouhi A, Palmqvist L, Rieger MA, Schroeder T, Bönig H, Müller-Tidow C, Kuchenbauer F, Schütz E, Green AR, Urlaub H, Stegmaier K, Humphries RK, Serve H, Oellerich T. Hoxa9 and Meis1 Cooperatively Induce Addiction to Syk Signaling by Suppressing miR-146a in Acute Myeloid Leukemia. Cancer Cell. 2017;31:549-562.e11. [PubMed] [DOI] |
| 33. | Labbaye C, Testa U. The emerging role of MIR-146A in the control of hematopoiesis, immune function and cancer. J Hematol Oncol. 2012;5:13. [PubMed] [DOI] |
| 34. | Rusca N, Monticelli S. MiR-146a in Immunity and Disease. Mol Biol Int. 2011;2011:437301. [PubMed] [DOI] |
| 35. | Yao Q, Cao Z, Tu C, Zhao Y, Liu H, Zhang S. MicroRNA-146a acts as a metastasis suppressor in gastric cancer by targeting WASF2. Cancer Lett. 2013;335:219-224. [PubMed] [DOI] |
| 36. | Hou Z, Xie L, Yu L, Qian X, Liu B. MicroRNA-146a is down-regulated in gastric cancer and regulates cell proliferation and apoptosis. Med Oncol. 2012;29:886-892. [PubMed] [DOI] |
| 37. | Yue C, Wang M, Ding B, Wang W, Fu S, Zhou D, Zhang Z, Han S. Polymorphism of the pre-miR-146a is associated with risk of cervical cancer in a Chinese population. Gynecol Oncol. 2011;122:33-37. [PubMed] [DOI] |
| 38. | Jazdzewski K, Murray EL, Franssila K, Jarzab B, Schoenberg DR, de la Chapelle A. Common SNP in pre-miR-146a decreases mature miR expression and predisposes to papillary thyroid carcinoma. Proc Natl Acad Sci U S A. 2008;105:7269-7274. [PubMed] [DOI] |
| 39. | Contreras JR, Palanichamy JK, Tran TM, Fernando TR, Rodriguez-Malave NI, Goswami N, Arboleda VA, Casero D, Rao DS. MicroRNA-146a modulates B-cell oncogenesis by regulating Egr1. Oncotarget. 2015;6:11023-11037. [PubMed] [DOI] |
| 40. | Xiang W, Wu X, Huang C, Wang M, Zhao X, Luo G, Li Y, Jiang G, Xiao X, Zeng F. PTTG1 regulated by miR-146a-3p promotes bladder cancer migration, invasion, metastasis and growth. Oncotarget. 2017;8:664-678. [PubMed] [DOI] |
| 41. | Li MW, Gao L, Dang YW, Li P, Li ZY, Chen G, Luo DZ. Protective potential of miR-146a-5p and its underlying molecular mechanism in diverse cancers: a comprehensive meta-analysis and bioinformatics analysis. Cancer Cell Int. 2019;19:167. [PubMed] [DOI] |
| 42. | Bosman MC, Schuringa JJ, Vellenga E. Constitutive NF-κB activation in AML: Causes and treatment strategies. Crit Rev Oncol Hematol. 2016;98:35-44. [PubMed] [DOI] |
| 43. | Pham LV, Tamayo AT, Yoshimura LC, Lin-Lee YC, Ford RJ. Constitutive NF-kappaB and NFAT activation in aggressive B-cell lymphomas synergistically activates the CD154 gene and maintains lymphoma cell survival. Blood. 2005;106:3940-3947. [PubMed] [DOI] |
| 44. | Alizadeh AA, Eisen MB, Davis RE, Ma C, Lossos IS, Rosenwald A, Boldrick JC, Sabet H, Tran T, Yu X, Powell JI, Yang L, Marti GE, Moore T, Hudson J, Lu L, Lewis DB, Tibshirani R, Sherlock G, Chan WC, Greiner TC, Weisenburger DD, Armitage JO, Warnke R, Levy R, Wilson W, Grever MR, Byrd JC, Botstein D, Brown PO, Staudt LM. Distinct types of diffuse large B-cell lymphoma identified by gene expression profiling. Nature. 2000;403:503-511. [PubMed] [DOI] |
| 45. | Paik JH, Jang JY, Jeon YK, Kim WY, Kim TM, Heo DS, Kim CW. MicroRNA-146a downregulates NFκB activity via targeting TRAF6 and functions as a tumor suppressor having strong prognostic implications in NK/T cell lymphoma. Clin Cancer Res. 2011;17:4761-4771. [PubMed] [DOI] |
| 46. | Mei M, Zhang M. Non-coding RNAs in Natural Killer/T-Cell Lymphoma. Front Oncol. 2019;9:515. [PubMed] [DOI] |
| 47. | Zare N, Eskandari N, Mehrzad V, Javanmard SH. The expression level of hsa-miR-146a-5p in plasma-derived exosomes of patients with diffuse large B-cell lymphoma. J Res Med Sci. 2019;24:10. [PubMed] [DOI] |
| 48. | Chen G, Umelo IA, Lv S, Teugels E, Fostier K, Kronenberger P, Dewaele A, Sadones J, Geers C, De Grève J. miR-146a inhibits cell growth, cell migration and induces apoptosis in non-small cell lung cancer cells. PLoS One. 2013;8:e60317. [PubMed] [DOI] |
| 49. | Huang WT, He RQ, Li XJ, Ma J, Peng ZG, Zhong JC, Hu XH, Chen G. miR146a5p targets TCSF and influences cell growth and apoptosis to repress NSCLC progression. Oncol Rep. 2019;41:2226-2240. [PubMed] [DOI] |
| 50. | Tan W, Liao Y, Qiu Y, Liu H, Tan D, Wu T, Tang M, Zhang S, Wang H. miRNA 146a promotes chemotherapy resistance in lung cancer cells by targeting DNA damage inducible transcript 3 (CHOP). Cancer Lett. 2018;428:55-68. [PubMed] [DOI] |
| 51. | Lu D, Yao Q, Zhan C, Le-Meng Z, Liu H, Cai Y, Tu C, Li X, Zou Y, Zhang S. MicroRNA-146a promote cell migration and invasion in human colorectal cancer via carboxypeptidase M/src-FAK pathway. Oncotarget. 2017;8:22674-22684. [PubMed] [DOI] |
| 52. | Bleau AM, Redrado M, Nistal-Villan E, Villalba M, Exposito F, Redin E, de Aberasturi AL, Larzabal L, Freire J, Gomez-Roman J, Calvo A. miR-146a targets c-met and abolishes colorectal cancer liver metastasis. Cancer Lett. 2018;414:257-267. [PubMed] [DOI] |
| 53. | Ma L, Zhu L, Gu D, Chu H, Tong N, Chen J, Zhang Z, Wang M. A genetic variant in miR-146a modifies colorectal cancer susceptibility in a Chinese population. Arch Toxicol. 2013;87:825-833. [PubMed] [DOI] |
| 54. | Zhao JL, Starczynowski DT. Role of microRNA-146a in normal and malignant hematopoietic stem cell function. Front Genet. 2014;5:219. [PubMed] [DOI] |
| 55. | Wang Y, Li Z, He C, Wang D, Yuan X, Chen J, Jin J. MicroRNAs expression signatures are associated with lineage and survival in acute leukemias. Blood Cells Mol Dis. 2010;44:191-197. [PubMed] [DOI] |
| 56. | Varney ME, Niederkorn M, Konno H, Matsumura T, Gohda J, Yoshida N, Akiyama T, Christie S, Fang J, Miller D, Jerez A, Karsan A, Maciejewski JP, Meetei RA, Inoue J, Starczynowski DT. Loss of Tifab, a del(5q) MDS gene, alters hematopoiesis through derepression of Toll-like receptor-TRAF6 signaling. J Exp Med. 2015;212:1967-1985. [PubMed] [DOI] |