修回日期: 2019-09-06
接受日期: 2019-09-14
在线出版日期: 2019-09-28
内脏高敏感的发生与肠系膜淋巴结树突状细胞(mesenteric lymph node dendritic cells, MLNDC)的异常活化相关; 蛋白质二硫键异构酶A3(protein disulfide isomerase A3, PDIA3)可以调节信号转导与转录激活因子3(signal transduction and activator of transcription 3, STAT3)通路的活性. 我们假设, 在MLNDC中, PDIA3可以抑制STAT3通路, 激活MLNDC, 并最终引起内脏高敏感.
初步探讨PDIA3/STAT3在内脏高敏感小鼠肠道树突状细胞异常免疫活化中的可能作用
40只C57BL/6小鼠随机分成对照组(20只)和模型组(20只), 采用束缚应激建立小鼠肠易激综合征内脏高敏感模型, 用腹部撤回反射评估小鼠肠道敏感性, 磁珠分选技术分离两组小鼠MLNDC, 流式检测分选纯度以及比较两组MLNDC表面主要组织相容性复合体Ⅱ(major histocompatibility complex II, MHC-II)类分子的表达情况, 蛋白印记技术和免疫荧光技术比较两组MLNDC中PDIA3和磷酸化-信号转导与转录激活因子3(phosphorylated signal transduction and activator of transcription 3, P-STAT3)的表达及分布情况, 混合淋巴细胞反应(mixed lymphocyte reaction, MLR)比较两组DC对初始T淋巴细胞的激活能力.
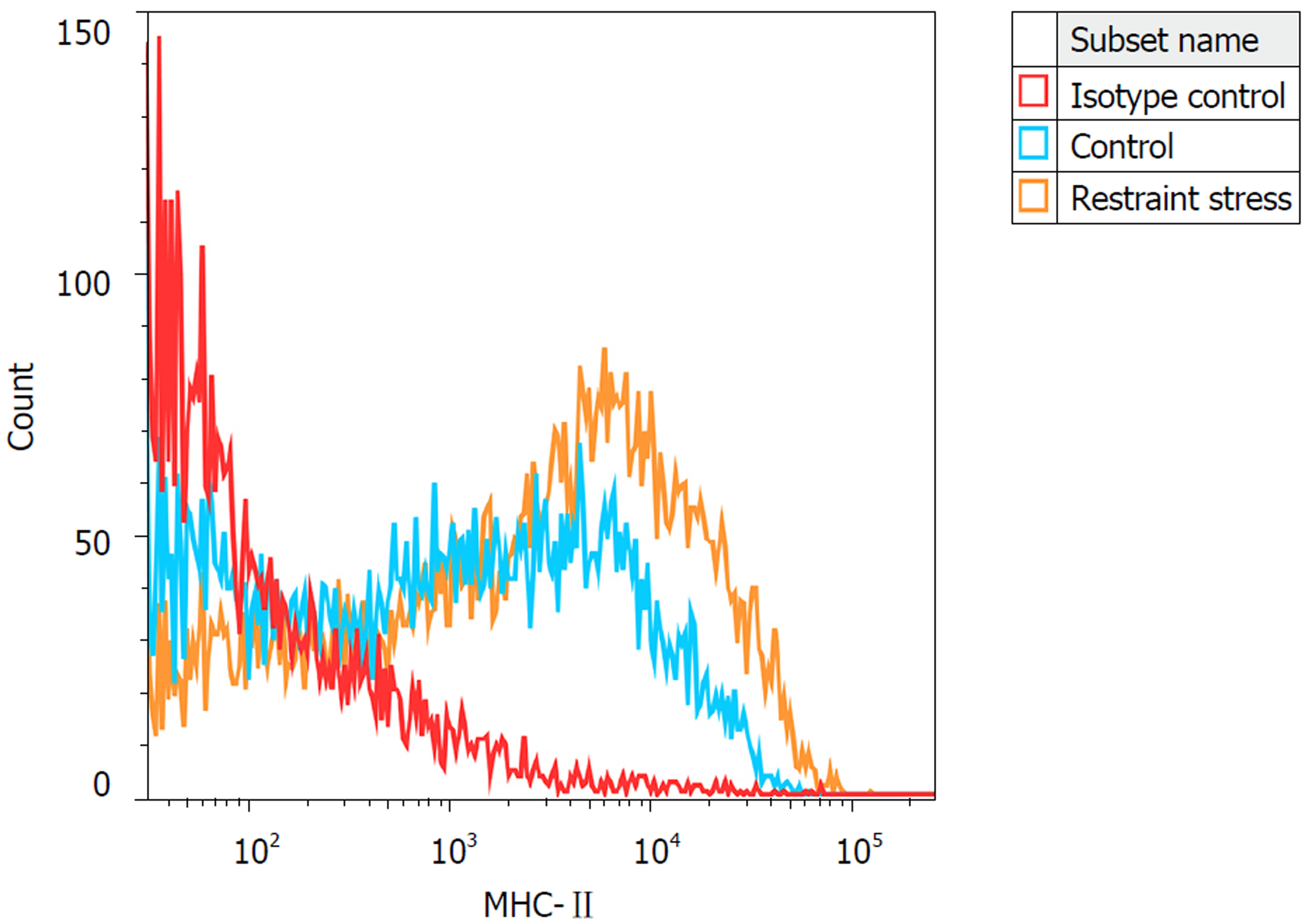
模型组小鼠结肠扩张容量阈值明显低于对照组[(0.53 mL±0.07 mL)vs(0.85 mL±0.12 mL), t = -10.845, P = 0.000]; 流式检测磁珠分选所得的小鼠树突状细胞特异性抗原CD11c阳性MLNDC为86.61%±7.02%; 模型组MLNDC表面MHC-Ⅱ类分子表达显著高于对照组[(73.08%±2.64%)vs(53.20%±4.50%), t = - 7.617, P = 0.000]; 与对照组相比, 模型组小鼠MLNDC表达PDIA3明显升高[(0.77±0.04)vs(0.42±0.03), t = 11.086, P = 0.000], 同时P-STAT3的表达明显下降[(0.73±0.03)vs(1.24±0.18), t = -4.737, P = 0.038)], MLR中刺激初始T淋巴细胞增殖的能力明显增强[(34.24%±2.95%)vs(17.22%±3.47%), t = 6.472, P = 0.003].
内脏高敏感小鼠MLNDC的异常免疫活化或许和PDIA3/STAT3有关.
核心提要: 本研究通过对比模型组和对照组实验动物肠系膜淋巴结树突状细胞(mesenteric lymph node dendritic cells, MLNDC)的活性差异、蛋白质二硫键异构酶A3(protein disulfide isomerase A3, PDIA3)和磷酸化-信号转导与转录激活因子3(signal transduction and activator of transcription 3, STAT3)的表达差异, 提示内脏高敏感的发生或许和PDIA3对STAT3通路的抑制所引起的MLNDC的异常免疫活化有关.
引文著录: 马陈皋, 毛立祺, 应笑, 王爽爽, 李蒙, 张璐, 王曦, 吕宾. 内脏高敏感小鼠肠道树突状细胞异常活化与PDIA3/STAT3的相关性研究. 世界华人消化杂志 2019; 27(18): 1125-1132
Revised: September 6, 2019
Accepted: September 14, 2019
Published online: September 28, 2019
The occurrence of visceral hypersensitivity is associated with the abnormal activation of mesenteric lymph node dendritic cells (MLNDCs); protein disulfide isomerase A3 (PDIA3) regulates the activity of the signal transduction and activator of transcription 3 (STAT3) pathway. We hypothesized that in MNLDCs, PDIA3 can inhibit the STAT3 pathway, activate MNLDCs, and ultimately cause visceral hypersensitivity.
To explore the possible role of PDIA3/STAT3 in the abnormal immune activation of intestinal dendritic cells in visceral hypersensitivity mice
Forty C57BL/6 mice were randomly divided into a control group (20 mice) and a model group (20 mice). A visceral hypersensitivity model of irritable bowel syndrome was established by restraint stress, and the abdominal withdrawal reflex was used to evaluate the visceral sensitivity of mice. Magnetic label-based technique was used to separate MLNDCs. The purity of MLNDCs and the expression of major histocompatibility complex Ⅱ (MHC-Ⅱ) molecules on the surface of MLMDCs were analyzed by flow cytometry. Western blot and immunofluorescence technique were used to compare the expression level of PDIA3 and phosphorylated STAT3 (p-STAT3) between the two groups of MNLDCs. Mixed lymphocyte reaction was used to compare the ability of dendritic cells (DCs) to activate the initial T lymphocytes.
The colonic expansion volume threshold of the model group was significantly lower than that of the control group [(0.53 mL ± 0.07 mL) vs (0.85 mL ± 0.12 mL), t = -10.845, P = 0.000]. The percentage of DC-specific antigen CD11c-positive MNLDCs was 86.61% ± 7.02%, and the expression of MHC-II molecules on the surface of MNLDCs in the model group was significantly higher than that in the control group [(73.08% ± 2.64%) vs (53.20% ± 4.50%), t = - 7.617, P = 0.000]. Compared with the control group, the expression of PDIA3 in the model group was significantly increased [(0.77 ± 0.04) vs (0.42 ± 0.03), t = 11.086, P = 0.000], while p-STAT3 decreased significantly [(0.73 ± 0.03) vs (1.24 ± 0.18), t = -4.737, P = 0.038)]. And the ability of DCs to stimulate the proliferation of initial T lymphocytes was significantly enhanced in the model group [(34.24% ± 2.95%) vs (17.22% ± 3.47%), t = 6.472, P = 0.003].
Abnormal immune activation of MLNDCs in visceral hypersensitive mice may be associated with PDIA3/STAT3.
- Citation: Ma CG, Mao LQ, Ying X, Wang SS, Li M, Zhang L, Wang X, Lv B. Correlation between abnormal activation of intestinal dendritic cells and PDIA3/STAT3 in visceral hypersensitivity mice. Shijie Huaren Xiaohua Zazhi 2019; 27(18): 1125-1132
- URL: https://www.wjgnet.com/1009-3079/full/v27/i18/1125.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v27.i18.1125
肠易激综合征(irritable bowel syndrome, IBS)是世界范围内的多发病[1], 但是其发病机制目前尚不明确. 近年来, 肠道免疫异常在IBS发生过程中的作用受到了越来越多的关注. 我们的前期研究显示, IBS大鼠肠道树突状细胞(dendritic cells, DC)数量增加[2], 细胞表面主要组织相容性复合体Ⅱ(major histocompatibility complex Ⅱ, MHC-Ⅱ)类分子表达增加, 激活T淋巴细胞的能力显著增强[3], 说明其可能通过自身的活化, 参与肠道免疫异常的发生, 并最终引起IBS内脏高敏感.
信号转导与转录激活因子3(signal transduction and activator of transcription 3, STAT3)通路在不同的细胞中发挥着多种不同的调节功能. 在DC中, STAT3通路的激活会对DC的活化产生明确的抑制作用[4]. 蛋白质二硫键异构酶A3(protein disulfide isomerase A3, PDIA3)主要位于内质网中, 以分子伴侣形式参与新生蛋白质的加工处理及质量监控. 多项研究表明PDIA3可以参与STAT3通路的激活调控[5-9].
本课题组前期研究发现, PDIA3在应激IBS大鼠以及IBS患者肠黏膜病理标本中的表达明显高于对照组[10]. 结合PDIA3对STAT3通路的调节功能及STAT3通路在DC活化中发挥的关键性作用, 我们假设: IBS模型动物肠道DC的异常免疫活化或许和STAT3通路的抑制以及PDIA3的高表达有关.
实验动物: C57BL/6小鼠、Balb/c小鼠购自浙江中医药大学动物实验研究中心.
主要试剂: RPMI1640、胎牛血清购自Sigma公司; 2-巯基乙醇(2-ME)、磷酸盐缓冲液(phosphate belanced solution, PBS)购自杭州吉诺生物医药技术有限公司; 组织细胞裂解液、ECL试剂盒购自北京普利莱基因技术有限公司; BCA蛋白定量试剂盒、羧基荧光素二醋酸盐琥珀酰亚胺酯(carboxyfluorescein succinimidyl amino ester, CFSE)购自美国赛默飞世尔科技公司; 抗PDIA3抗体、抗甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase, GAPDH)抗体购自美国CST公司; 流式抗体: FITC标记的CD11c抗体、APC标记的MHC-Ⅱ抗体购自美国ebioscience公司; 小鼠初始CD4阳性T淋巴细胞分选试剂盒、小鼠CD11c阳性树突状细胞分选试剂盒购自美天旎生物技术有限公司; 免疫染色固定液、免疫染色强力通透液、免疫染色封闭液、抗荧光淬灭封片剂购自上海碧云天生物技术有限公司. 实验取得动物伦理委员会批准(ZSLL-2018-037).
1.2.1 内脏高敏感小鼠建模: 参考Williams等[11]和Zheng等[12]的方法, 对小鼠造成人为的束缚应激, 使其内脏敏感性增加, 具体如下: 模型组小鼠20只, 雄性, 6-8 wk, 体重21 g±2 g, 造模过程采用束缚器限制小鼠上半身、前肩及前肢的自由活动, 主要限制其前肢对头面部的清理动作, 对其造成慢性应激. 每日08:00-10:00造模, 持续1 h, 连续14 d. 造模结束3 d后小鼠禁食不禁水12 h, 随后对小鼠实行结直肠扩张(colorectal distension, CRD)试验, 然后用国际通用的腹部收缩反射评分[13]评价CRD后小鼠的内脏敏感性, 具体如下: 将石蜡润滑后的CRD装置插入小鼠肛门, 用胶布固定于鼠尾部, 让小鼠适应该装置15 min. 然后对装置中的气囊注水, 使小鼠结肠被动扩张, 观察记录小鼠腹肌收缩、背部拱起时所注入的水量, 为小鼠的扩张容量阈值, 同一小鼠重复3次, 间隔4 min, 取平均值.
1.2.2 小鼠MLNDC的提取: 根据Van den Broeck等[14]对于小鼠肠系膜淋巴结分布的描述摘取小鼠腹腔肠系膜淋巴结, 具体如下: 将小鼠颈椎脱臼处死, 于75%酒精浸泡10 min, 然后无菌环境下剖开小鼠腹腔, 找到小鼠盲肠, 在升结肠与横结肠交界处的肠系膜根部可以找到空肠淋巴结以及结肠淋巴结共2-4颗. 用无菌玻璃板对所获得的淋巴结进行碾磨, 收集获得的淋巴细胞悬液, 过400目滤网除去纤维组织以及细胞团块. 按美天旎CD11c阳性树突状细胞分选试剂盒里的说明手册进行树突状细胞的分离, 具体如下: 将所获得的淋巴细胞悬液300 r/min离心10 min, 每1×108个细胞用400 μL磁珠分选缓冲液重悬, 加入100 μL CD11c磁珠, 4 ℃孵育10 min; 加入10 mL预冷的磁珠分选缓冲液, 300 r/min离心10 min去除未结合的磁珠, 1 mL磁珠分选缓冲液重悬, 上磁珠架, 收集CD11c阳性MLNDC备用.
1.2.3 流式细胞术检测细胞表型: 取少量上述MLNDC单细胞悬液于1.5 mL EP管, 300 r/min离心10 min, 去上清, 100 μL流式上样缓冲液重悬细胞, 加入对应的流式抗体, 室温孵育15 min, 加入1 mL PBS, 300 r/min离心10 min, 去上清, 500 μL流式上样缓冲液重悬, 上机检测.
1.2.4 蛋白印记实验(western blot, WB): 按照Burnette等[15]提供的实验步骤进行WB. 具体如下: (1)细胞总蛋白的提取: 300 r/min, 4 ℃离心10 min收集上述MLNDC单细胞悬液, 预冷PBS洗2次. 加入5倍于细胞沉淀体积的组织细胞裂解液, 冰上裂解15 min, 每隔5 min振荡1 min. 12000 g, 4 ℃离心10 min, 转移富含蛋白的上清到新EP管. 加入1/2体积的上样缓冲液, 加入1/30体积的二硫苏糖醇, 混匀, 水浴锅99 ℃加热5 min, 冰上冷却, 获得蛋白样品, -80 ℃冰箱保存. (2)SDS-聚丙烯酰胺凝胶电泳: 安装好电泳装置, 将蛋白样品按预先计算所得的上样量加到凝胶凹槽中, 接通电源, 电泳时, 浓缩胶电压70 V, 分离胶电压120 V. 酚红到达分离胶的底部后停止电泳. (3)转膜: 取出电泳后的凝胶, 切去多余部分, 取预先转移缓冲液湿润3张转印滤纸, 将上述凝胶置于其上, 再将PVDF膜置于凝胶上, 最后将另外3张转印滤纸盖于PVDF膜上, 用夹子夹好后, 置入电转移系统, 接通电源, 300 mA恒定电流转移2 h, 期间保持低温. (4)免疫检测: 用5%的脱脂牛奶常温封闭转膜结束后的PVDF膜2 h, 根据抗体说明书上描述分子量切下对应条带, 置于1:4000稀释后的抗PDIA3抗体、抗磷酸化-信号转导与转录激活因子3(phosphorylated signal transduction and activator of transcription 3, P-STAT3)抗体以及抗GAPDH抗体缓冲液中孵育, 4 ℃摇床过夜. TBST洗3次, 5 min/次. 1:4000稀释后的抗兔二抗或抗鼠二抗室温孵育1 h, TBST洗3次. 将ECL发光液均匀覆盖PVDF膜, 上机曝光、显影. 条带结果用Image Lab软件进行分析. PDIA3蛋白表达量用其与GAPDH蛋白对应条带的积分光密度值(integral optical density, IOD)的比值来表示、P-STAT3蛋白表达量用其与非磷酸化的STAT3蛋白对应条带的IOD的比值来表示.
1.2.5 免疫荧光技术: 用免疫荧光技术对PDIA3与P-STAT3进行亚细胞定位, 具体如下: 调整上述获得的MLNDC细胞悬液浓度至1×106个/mL, 取100 μL于1.5 mL EP管中, PBS洗2次, 重悬后加入到甩片机中, 3000 r/min, 10 min制成细胞甩片. 免疫染色固定液室温固定10 min, PBS洗3次, 5 min/次, 免疫染色强力通透液室温通透10 min, 免疫染色封闭液室温封闭1 h, 1:200兔来源抗PDIA3抗体、1:200鼠来源抗P-STAT3抗体4 ℃孵育过夜, PBS洗脱3次, FITC标记的山羊抗鼠抗体以及CY3标记的山羊抗兔抗体室温孵育1 h, PBS洗3次, 含4', 6-二脒基-2-苯基吲哚(4', 6-diamidino-2-phenylindole, DAPI)抗荧光淬灭封片剂封片, 共聚焦显微镜观察、拍照. 荧光图片采用Image J进行分析, 结果以绿色或红色荧光的平均光密度(mean optical density, MOD)来表示.
1.2.6 磁珠分选初始T淋巴细胞: 按照磁珠分选试剂盒说明书进行操作, 具体如下: 提取Balb/c小鼠脾脏细胞, 计数, 每107个细胞进行如下处理: 加入40 μL预冷磁珠分选缓冲液, 10 μL抗体cocktail, 冰上孵育5 min, 加入额外的20 μL磁珠分选缓冲液, 20 μL磁珠, 冰上孵育10 min, 加入200 μL磁珠分选缓冲液, 300 r/min, 4 ℃离心10 min去除未结合细胞的抗体和磁珠. 磁珠分选缓冲液重悬, 上分选架.
1.2.7 混合淋巴细胞反应: (1)对上述初始T淋巴细胞进行细胞内染色标记: 取分选所得初始T淋巴细胞, 用PBS调整细胞浓度为5×106个/mL, 加入CFSE, 工作浓度为1.5 μmol/L, 37 ℃培养箱孵育15 min, 每5 min振荡1次. 加入预冷的完全培养基终止反应, 300 r/min离心10 min, 去除上清多余染料; (2)调整染色后的初始T淋巴细胞浓度为106个/mL, 取100 μL加入弧形底96孔板; (3)将上述获得的模型组及对照组MLNDC密度均调整为2×106个/mL, 以DC: T比例为1:1加入对应量的MLNDC细胞悬液, 最后加入完全培养液调整每孔终体积至200 μL. 2 d后流式检测初始T淋巴细胞增殖情况.
统计学处理 数据采用SPSS 20.0软件进行统计学分析. 正态分布的计量资料以mean±SD表示, 两组独立样本比较采用t检验, P<0.05被认为差异有统计学意义.
对照组小鼠一般情况良好. 模型组小鼠逐渐出现焦虑、烦躁, 出现重复刻板行为, 体重减轻, 大便偏稀, 肛门口大便污染. 造模结束3 d后, 对小鼠进行模型验证, 以模型组、对照组小鼠的扩张容量阈值作为评价指标. 结果模型组小鼠的内脏敏感性显著高于对照组[(0.53 mL±0.07 mL)vs(0.85 mL±0.12 mL), t = -10.845, P = 0.000].
收集磁珠分离得到的MLNDC, 流式鉴定CD11c阳性MLNDC细胞比例为86.61%±7.02%, 台盼蓝染色后相差显微镜下观察计数显示所获得的DC活性大于95%.
如图1, 模型组小鼠MLNDC细胞表面MHC-Ⅱ类分子表达高于对照组[(73.08%±2.64%)vs(53.20%±4.50%), t = -7.617, P = 0.000].
模型组MLNDC中PDIA3表达量明显高于对照组[(0.77±0.04)vs(0.42±0.03), t = 11.086, P = 0.000]; P-STAT3表达量显著降低[(0.73±0.03)vs(1.24±0.18), t = -4.737, P = 0.038)](图2).
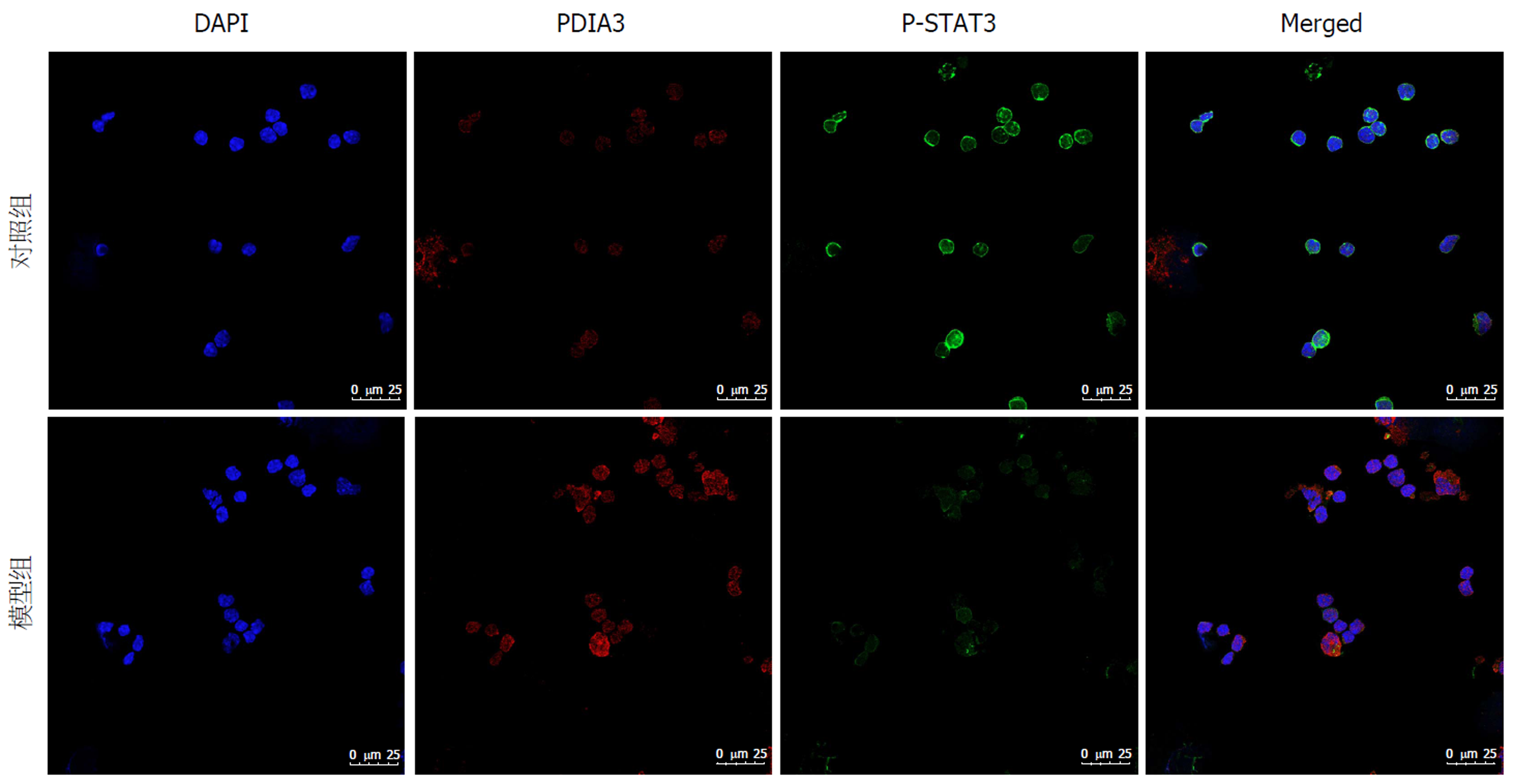
小鼠MLNDC中PDIA3和P-STAT3多分布于细胞膜上(图3); 相比较于对照组, 模型组P-STAT3对应的绿色荧光的MOD降低[(0.0358±0.0036)vs(0.0745±0.0119), t = -17.782, P = 0.000], 与此同时, 与PDIA3对应的红色荧光的MOD升高[(0.0639±0.0142)vs(0.0567±0.0003), t = 8.758, P = 0.013].
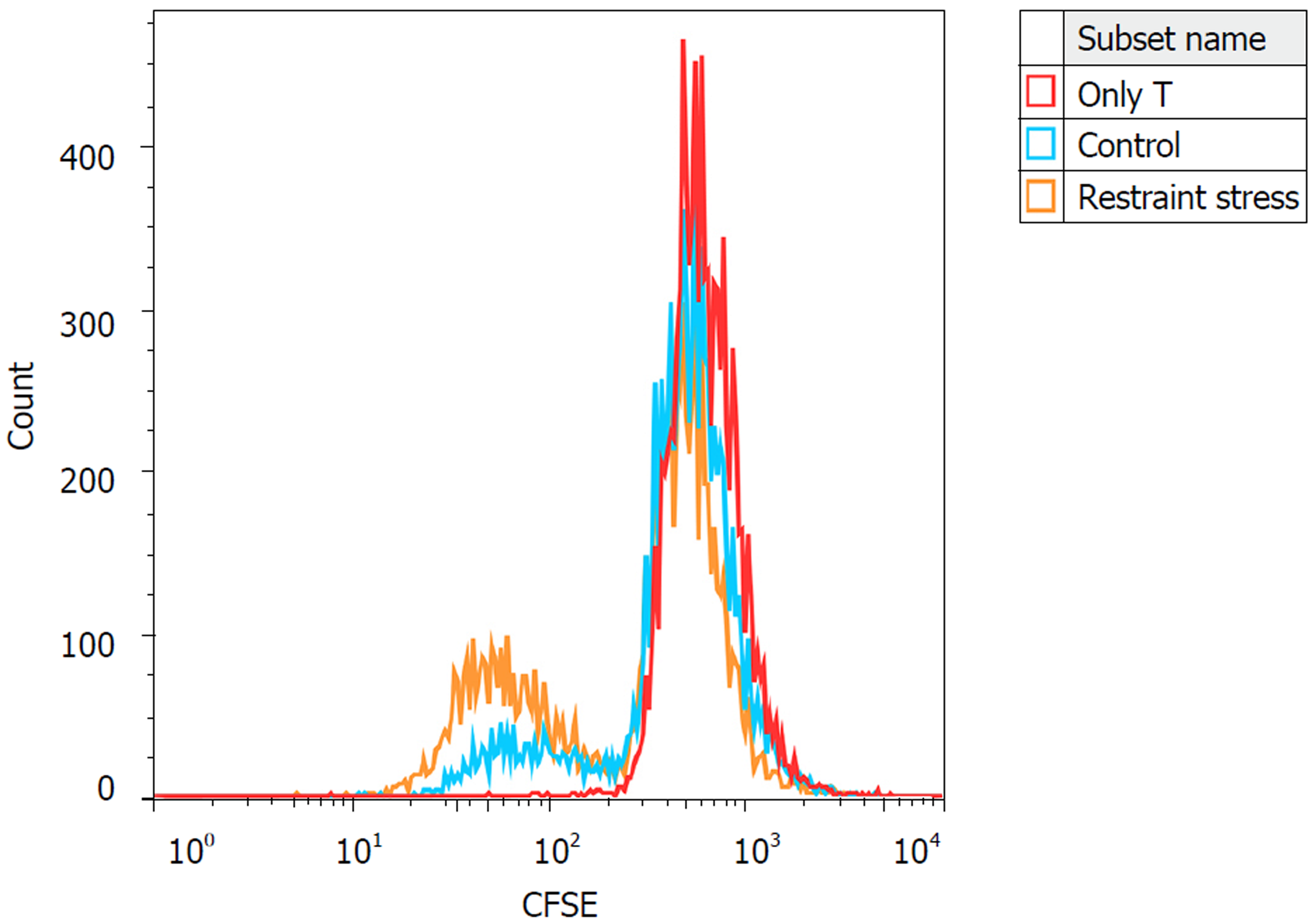
如图4, 未加入BMDC的反应孔(BMDC: T = 0:1)初始T淋巴细胞几乎不出现增殖; 加入模型组MLNDC的MLR体系中, 初始T细胞的增殖细胞百分比高于对照组(control), 差异有统计学意义([(34.24%±2.95%)vs(17.22%±3.47%), t = 6.472, P = 0.003].
IBS的发病率逐年增高, 近来, 免疫失衡在IBS的发病过程中的作用引起了越来越多的关注, DC作为机体免疫系统的核心, 广泛分布于胃肠道中, 在免疫失衡引起的IBS内脏高敏感中发挥重要作用.
本课题组前期研究发现, IBS模型组MLNDC中MHC-Ⅱ类分子表达增加, 同时激活T淋巴细胞的能力增强[3]. 在此基础之上, 本研究进一步探索IBS模型组MLNDC异常活化的可能机制.
STAT3是信号转导与转录激活因子家族中重要的成员. STAT3通路是一条由细胞因子激活、众多相关蛋白调节的信号转导通路, 广泛参与细胞的增殖、分化、凋亡等多种重要的生物学功能. 通路被激活后, STAT3蛋白发生酪氨酸磷酸化, 随后发生二聚化, 二聚体P-STAT3进入细胞核, 结合对应的DNA结合序列, 发挥转录调控的作用. 大量研究表明, STAT3通路的激活, 对DC的活化有明确的抑制作用[4]. 我们的研究发现, 模型组MLNDC细胞表面MHC-Ⅱ分子表达增加; 在MLR体系中, 激活初始T细胞的能力增强; 同时其内部P-STAT3的表达减弱. 这提示MLNDC中STAT3通路的抑制, 或许是引起DC免疫异常, 并最终导致IBS内脏高敏感发生的一个可能因素.
PDIA3也被称为Erp57或GRP58, 是蛋白质二硫键异构酶家族的一员, 主要功能是通过催化内质网中蛋白质二硫键的形成, 促进合成后蛋白质的正确折叠. 同时作为STAT3的伴侣蛋白, PDIA3也可以调节STAT3通路的活化[5-9].
本课题组前期研究发现IBS模型动物以及IBS患者肠系膜病理标本PDIA3表达增加[10], 并且明确了PDIA3在DC介导的免疫异常所引起的IBS内脏高敏感中的作用[16]. 在此基础之上, 本研究试图探索PDIA3此种作用的发挥与STAT3通路之间的相关性. 我们发现, 模型组MLNDC中P-STAT3表达减弱的同时伴随着PDIA3的表达增高; 在激光共聚焦显微镜下, PDIA3、P-STAT3多分布于细胞膜上, 在空间上存在共定位的可能性, 且模型组PDIA3对应的红色荧光的MOD上升, 而P-STAT3对应的绿色荧光MOD明显减少. 这一结果和Sehgal等[7]的研究结果相似, Sehgal等[7]认为, PDIA3和P-STAT3会共同存在于细胞膜的脂筏结构中, PDIA3的存在会抑制P-STAT3与DNA的结合. 这提示PDIA3作为IBS模型组与对照组的差异蛋白, 或许可以通过抑制STAT3通路, 引起DC免疫异常, 最终导致IBS内脏高敏感的发生.
关于PDIA3对于STAT3通路活化的调节, 现有研究结果尚不一致. Coe等[6]的研究发现, 在小鼠的胚胎成纤维干细胞中, PDIA3和STAT3蛋白主要在内质网中发挥相互作用, PDIA3基因的敲除会引起P-STAT3表达增加, 并且重新过表达的PDIA3必须带有内质网定位序列才能逆转这种情况, 提示内置网中的PDIA3才是引起STAT3通路抑制的关键分子. 另一方面, Kondo等[9]和Chichiarelli等[5]在M14黑色素瘤细胞以及HepG2肝癌细胞中发现两者的共定位发生于核内, PDIA3的敲低表达显著抑制STAT3通路的活化, 并且抑制了随后的STAT3通路依赖性的C反应蛋白的表达. 在我们的研究中, 小鼠MLNDC中PDIA3和P-STAT3大量共存于细胞膜上, 且PDIA3的表达增加伴随着P-STAT3的表达下降以及DC活性的异常增加.
本研究尚存在一定的局限性. 由于本研究为模型组与对照组的横断面比较研究, 所以并不能充分说明PDIA3高表达与STAT3通路的抑制之间的因果关系. 随后的研究可以从改变MLNDC中PDIA3的表达量, 然后观察STAT3通路的活化情况来入手.
综上, 本实验通过建立内脏高敏感小鼠模型, 对比模型组和对照组小鼠MLNDC的活性以及其PDIA3、P-STAT3蛋白的表达差异, 提示了IBS内脏高敏感小鼠MLNDC的异常免疫活化或许和PDIA3/STAT3有关, 为IBS内脏高敏感的发病机制提供了新的研究思路, 为进一步的治疗提供了一个潜在的靶点.
蛋白质二硫键异构酶A3(protein disulfide isomerase A3, PDIA3)/信号转导与转录激活因子3(signal transduction and activator of transcription 3, STAT3)通路在肠系膜淋巴结树突状细胞(mesenteric lymph node dendritic cells, MLNDC)介导的肠易激综合征(irritable bowel syndrome, IBS)内脏高敏感发生发展中的作用还是一个未知数.
探究PDIA3/STAT3通路在IBS内脏高敏感发生发展中的作用.
比较模型组和对照组小鼠MLNDC的免疫活性及其PDIA3、P-STAT3的表达和分布情况.
束缚应激建立IBS内脏高敏感小鼠模型, 磁珠分选获取MLNDC, 用MLR和细胞表面组织相容性复合体Ⅱ(major histocompatibility complex Ⅱ, MHC-Ⅱ)的含量反映树突状细胞(dendritic cells, DC)的免疫活性, WB比较组间PDIA3以及P-STAT3的表达差异, 免疫荧光比较两者分布差异.
IBS模型组小鼠MLNDC免疫活性增强, PDIA3表达增加, 但是P-STAT3表达下降.
PDIA3/STAT3通路或许在MLNDC介导的IBS内脏高敏感的发生发展中起到一定作用.
PDIA3/STAT3通路和IBS内脏高敏感发生发展的相关性的确立, 可以为后续IBS内脏高敏感发生机制的研究提供思路, 为临床IBS内脏高敏感症状的治疗提供新的靶点.
学科分类: 胃肠病学和肝病学
手稿来源地: 浙江省
同行评议报告分类
A级 (优秀): A
B级 (非常好): B
C级 (良好): C
D级 (一般): 0
E级 (差): 0
编辑: 王禹乔 电编:刘继红
| 1. | Cashman MD, Martin DK, Dhillon S, Puli SR. Irritable Bowel Syndrome: A Clinical Review. Curr Rheumatol Rev. 2016;12:13-26. [PubMed] |
| 3. | 李 蒙, 胡 玥, 王 霄腾, 吕 宾, 张 梦, 陈 超英. ERK1/2通路对内脏高敏感大鼠肠道树突细胞表面MHC-Ⅱ分子表达的影响. 中华医学杂志. 2015;95:3930-3934. [DOI] |
| 4. | Barton BE. STAT3: a potential therapeutic target in dendritic cells for the induction of transplant tolerance. Expert Opin Ther Targets. 2006;10:459-470. [PubMed] [DOI] |
| 5. | Chichiarelli S, Gaucci E, Ferraro A, Grillo C, Altieri F, Cocchiola R, Arcangeli V, Turano C, Eufemi M. Role of ERp57 in the signaling and transcriptional activity of STAT3 in a melanoma cell line. Arch Biochem Biophys. 2010;494:178-183. [PubMed] [DOI] |
| 6. | Coe H, Jung J, Groenendyk J, Prins D, Michalak M. ERp57 modulates STAT3 signaling from the lumen of the endoplasmic reticulum. J Biol Chem. 2010;285:6725-6738. [PubMed] [DOI] |
| 7. | Sehgal PB. Plasma membrane rafts and chaperones in cytokine/STAT signaling. Acta Biochim Pol. 2003;50:583-594. [PubMed] |
| 8. | Guo GG, Patel K, Kumar V, Shah M, Fried VA, Etlinger JD, Sehgal PB. Association of the chaperone glucose-regulated protein 58 (GRP58/ER-60/ERp57) with Stat3 in cytosol and plasma membrane complexes. J Interferon Cytokine Res. 2002;22:555-563. [PubMed] [DOI] |
| 9. | Kondo R, Ishino K, Wada R, Takata H, Peng WX, Kudo M, Kure S, Kaneya Y, Taniai N, Yoshida H, Naito Z. Downregulation of protein disulfideisomerase A3 expression inhibits cell proliferation and induces apoptosis through STAT3 signaling in hepatocellular carcinoma. Int J Oncol. 2019;54:1409-1421. [PubMed] [DOI] |
| 10. | Ding Y, Lu B, Chen D, Meng L, Shen Y, Chen S. Proteomic analysis of colonic mucosa in a rat model of irritable bowel syndrome. Proteomics. 2010;10:2620-2630. [PubMed] [DOI] |
| 11. | Williams CL, Villar RG, Peterson JM, Burks TF. Stress-induced changes in intestinal transit in the rat: a model for irritable bowel syndrome. Gastroenterology. 1988;94:611-621. [PubMed] [DOI] |
| 12. | Zheng PY, Feng BS, Oluwole C, Struiksma S, Chen X, Li P, Tang SG, Yang PC. Psychological stress induces eosinophils to produce corticotrophin releasing hormone in the intestine. Gut. 2009;58:1473-1479. [PubMed] [DOI] |
| 14. | Van den Broeck W, Derore A, Simoens P. Anatomy and nomenclature of murine lymph nodes: Descriptive study and nomenclatory standardization in BALB/cAnNCrl mice. J Immunol Methods. 2006;312:12-19. [PubMed] [DOI] |
| 15. | Burnette WN. "Western blotting": electrophoretic transfer of proteins from sodium dodecyl sulfate--polyacrylamide gels to unmodified nitrocellulose and radiographic detection with antibody and radioiodinated protein A. Anal Biochem. 1981;112:195-203. [PubMed] [DOI] |