修回日期: 2019-08-08
接受日期: 2019-09-03
在线出版日期: 2019-09-08
炎症性肠病(inflammatory bowel disease, IBD)是一种病因未明的慢性肠道炎症性疾病, 症状易反复发作, 迁延不愈, 治疗手段及疗效有限. 近期有较多研究表明核苷酸结合寡聚化结构域样受体含pyrin结构域蛋白6(NLR family, pyrin domain containing6, Nlrp6)在IBD及相关肿瘤方面具有调节肠道免疫及微生物菌群的重要作用, Nlrp6促进白细胞介素(interleukin, IL)-18及抗菌肽的分泌, IL-18可抑制IL-22BP的产生, 增强IL-22作用, 并通过MyD88通路来促进上皮细胞增殖; Nlrp6还可通过Toll-like receptors调节杯状细胞分泌Mucoprotein2, 清除肠道细菌, 调节肠道免疫功能及维持肠道菌群稳态. 由于IBD有一定癌变倾向, 研究人员发现Nlrp6可作用于NOTCH及Wnt靶点, 激活趋化因子配体5及IL-6信号通路, 调节上皮细胞增殖, 影响IBD相关性结直肠癌. 本文就Nlrp6在IBD中的作用机制作一综述.
核心提要: 核苷酸结合寡聚化结构域样受体含pyrin结构域蛋白6(NLR family, pyrin domain containing6, Nlrp6)促进IL-18及抗菌肽的分泌, IL-18可抑制IL-22BP的产生, 增强IL-22作用, 并通过MyD88通路来促进上皮细胞增殖; Nlrp6还可通过Toll-like receptors调节杯状细胞分泌Mucoprotein2, 清除肠道细菌, 调节肠道免疫功能及维持肠道菌群稳态.
引文著录: 朱凤, 刘星星, 范恒. 核苷酸结合寡聚化结构域样受体含pyrin结构域蛋白6在炎症性肠病中作用机制研究进展. 世界华人消化杂志 2019; 27(17): 1076-1082
Revised: August 8, 2019
Accepted: September 3, 2019
Published online: September 8, 2019
Inflammatory bowel disease (IBD) is a chronic intestinal inflammatory disease of unknown etiology. The symptoms of IBD are prone to recurrent episodes, and there is currently limited treatment and efficacy. Recently, there have been many studies showing that the nucleotide-binding oligomerization domain-like receptor containing the pyrin domain containing protein (NLR family, pyrin domain containing 6, NLRP6) regulates intestinal immunity and microorganisms in inflammatory bowel disease and related tumors. NLRP6 promotes the secretion of interleukin (IL)-18 and antimicrobial peptides, and IL-18 can inhibit the production of IL-22BP, enhance the role of IL-22, and promote the proliferation of epithelial cells through the MyD88 pathway. NLRP6 also regulates the secretion of mucoprotein 2 by goblet cells via Toll-like receptors, clears intestinal bacteria, regulates intestinal immune function, and maintains intestinal flora. Because IBD is associated with a tendency of malignant transformation, and researchers have found that NLRP6 can act on NOTCH and Wnt, activate chemokine ligand 5 and IL-6 signaling, regulate epithelial cell proliferation, and affect the development of IBD-related colorectal cancer. This article reviews the role of NLRP6 in IBD.
- Citation: Zhu F, Liu XX, Fan H. Role of NLRP6 in inflammatory bowel disease. Shijie Huaren Xiaohua Zazhi 2019; 27(17): 1076-1082
- URL: https://www.wjgnet.com/1009-3079/full/v27/i17/1076.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v27.i17.1076
炎症性肠病(inflammatory bowel disease, IBD)为累及回肠、结肠、直肠的一种特发性肠道炎症性疾病, 主要包括溃疡性结肠炎(ulcerative colitis, UC)和克罗恩病(crohn's disease, CD). 其临床表现以腹痛、腹泻及黏液脓血便为主, 症状易反复发作, 难以治愈, 且有一定的癌变倾向[1]. 该病多发于青少年, 在欧美国家发病率较高. 近年我国发病率有增加趋势, 可能与我国人民生活方式改变有关[2]. 目前普遍认为IBD的发病机制是由环境因素和肠道菌群共同作用, 激活遗传易感个体肠道黏膜的免疫应答, 引发一系列的炎症反应, 使肠黏膜中的抗炎和促炎介质失衡, 导致肠黏膜的病理改变. IBD目前的药物治疗主要包括氨基水杨酸制剂、糖皮质激素、免疫调节剂等, 配合调整患者生活方式, 但治疗效果不理想, 且存在一定的副作用. 因此, 深入研究IBD的发病机制对于创新治疗方法及治疗药物具有重要的临床意义.
固有免疫应答是机体抵抗病原体的第一道防线, 亦是获得性免疫应答的基础. 核苷酸结合寡聚化结构域样受体(nucleotide-binding and oligomerization domain-like receptors, NLRs)家族是近年来研究比较多的一个参与免疫应答的庞大的炎症蛋白家族, 在细胞凋亡、炎症、肿瘤等方面发挥着重要作用. 核苷酸结合寡聚化结构域样受体含pyrin结构域蛋白6(NLR family, pyrin domain containing6, Nlrp6)是NLRs家族中一个比较特殊的成员, 目前对其有一定的研究, 但其功能和作用机理尚未完全明确. 本文就Nlrp6在IBD中的作用机制研究进展作一综述.
NLRs家族是一类存在于细胞质内的模式识别受体, 可以识别结合某些病原体或其产物所共有的高度保守的病原相关分子模式, 通过激活NF-κB、IFNr和其它炎性信号来促进免疫反应, 参与机体免疫应答[3]. 目前发现NLRs家族蛋白在人类有23种, 在小鼠有34种[4,5]. NLRs家族主要由氨基端(N端)结构域、NOD结构域、羧基端(C端)富含亮氨酸的重复序列三部分组成. N端为效应结构域, 介导蛋白质相互作用, 参与免疫应答[6]. 不同类型NLRs分子因为其N端结构域不同, 有其特定下游信号转导通路. 根据N端结构域不同, 目前NLRs家族分子分成四类[7]: (1)Ⅱ类反式激活因子, 调节主要组织相容性复合体MHCⅡ类分子的表达; (2)NOD1和NOD2, 主要功能是识别细菌肽聚糖亚单位, 并激活NF-κB信号通路发生免疫应答[8]; (3)白细胞介素-1β转化酶蛋白激酶激活因子; (4)NLR家族含pyrin结构域蛋白(NLR family, pyrin domain containing, NLRP). NLRs家族主要参与调节肠道的免疫信号通路和微生物菌群, 影响肠道的炎症的发生[9,10].
Nlrp6是第一个被发现的抑制天然免疫反应相关信号通路的NLRs蛋白家族成员, 其编码基因位于人11号染色体. 在肠道组织中, Nlrp6高表达于肠上皮细胞和肌成纤维细胞等非造血细胞[11]. Nlrp6可与含半胱氨酸的天冬氨酸蛋白水解酶(cysteinyl aspartate specific proteinase-1, Caspase-1)和含CARD结构域的凋亡相关颗粒样蛋白(apoptosis associated speck-like protein containing CARD, ASC)通过N端PYD结构域的蛋白-蛋白连接作用组成细胞内多聚蛋白复合物(即Nlrp6炎症小体), 最终产生白细胞介素(interleukin, IL)-1β、IL-18等细胞因子, 参与炎症反应和免疫应答[12,13].
在Nlrp6缺失型小鼠中观察到Nlrp6的功能是抑制NF-κB和MAPK的活化, 从而发挥促进凋亡、抑制炎症及肠道组织增殖的作用[14,15]. Nlrp6缺失型小鼠体内的巨噬细胞在细菌感染时对NF-κB的激活增加, 并伴有NF-κB和MAPK依赖性细胞因子、趋化因子分泌增加, 免疫细胞数目明显增加, 通过激活Toll样受体(multiple toll-like receptors, TLR), 增强NF-κB和MAPK信号转导的活化, 说明Nlrp6可能在识别病原体后抑制TLR通路, 防止炎症扩大[16]. NF-κB相关细胞因子如肿瘤坏死因子α(tumor necrosis factor-α, TNF-α)和IL-6在Nlrp6缺失型小鼠体内显著升高[11], TNF-α和IL-6可以激活肠上皮细胞STAT3途径促进肿瘤的发生[17,18]. ASC与其他Nlrp蛋白共表达并不能激活Caspase-1前体, 表明Nlrp6能够有效地激活Caspase-1前体, 促使细胞发生凋亡, 阻止细胞的无限增殖, 抑制肿瘤发生[19].
近年来, Ranson等[20]观察到Nlrp6在人类CD中上调, 但在人类UC中没有显著程度上调. 相反, Alipour等[21]发现IBD亚群中Nlrp6表达有降低的趋势, 但这没有达到统计学意义. 进一步研究表明, 在CD和UC患者的上皮层中Nlrp6的表达降低. 动物模型进一步证实了Nlrp6表达与肠屏障完整性之间的关联. 在小鼠的WAS(避水应激)诱导的小肠炎症(肠炎)中报道了Nlrp6水平降低[22]. 然而, 在结肠炎小鼠模型中Nlrp6的表达尚不完全清楚. 由此可见, Nlrp6在调节肠道免疫功能和维持肠道菌群稳态中的作用日益受到重视, 研究Nlrp6炎性小体及其配体有助于深入探讨UC的发病机制.
Nlrp6炎性小体导致蛋白水解切割和激活caspase-1, 之后释放促炎细胞因子IL-18[23]. 为了评估Nlrp6对结肠炎的影响, 进行了几种使用Nlrp6-/-小鼠的研究[24,25]. 在该实验中, Nlrp6-/-小鼠显示出对DSS诱发的结肠炎增强的易感性. 研究人员还观察到IL-18的水平降低了. 此外, 使用16SrRNA分析肠道菌群组成揭示了Nlrp6-/-小鼠肠道中更多的致癌微生物群. 我们了解到, 炎症小体的激活导致多重下游效应, 包括通过蛋白水解切割产生活化形式的前IL-18. Levy等[26]发现敲除IL-18导致结肠炎严重程度和肠道细菌群落的显著恶化, 类似于Nlrp6-/-小鼠. 这些结果表明, Nlrp6对肠道细菌群落的影响可能部分取决于IL-18, 且IL-18在DSS诱导的结肠炎中具有保护作用. Kempster等[27]认为病态的IL-18过度激活存在差异. 然而, IL-18的不同表达也可能导致关于IL-18在NEC中的作用的"冲突".观察发生在回肠中的环状物, 而不是它在DSS诱导的结肠炎中的作用(大多数严重的远端结肠). 为此, Nlrp6在小鼠结肠上皮细胞中的缺乏改变了粪便微生物, 其特征是细菌门拟杆菌和TM7[11]. Seregin等[28]证明使用不依赖于上皮损伤和修复的IBD替代模型, Nlrp6通过限制IL-10-/-小鼠致结肠炎病菌 A.muciniphila的定植来预防结肠炎的发展. 在肠道中, AMP是参与该组织的先天免疫系统的关键组成部分. Nlrp6可以调节"健康"宿主-微生物界面的机制, 从IgA和粘液分泌到AMP产生[29,30].
由此可见在IBD中, Nlrp6炎性小体信号通路主要是通过产生细胞因子IL-18来介导免疫功能和维持肠道菌群稳态. 深入研究Nlrp6/IL-18通路的作用机制, 有利于揭示肠道免疫紊乱和菌群失调在UC发病中的作用.
在UC患者和DSS诱导的结肠炎小鼠中, 可以观察到结肠上皮细胞中杯状细胞通常被耗尽, 粘液合成和分泌减少[31,32]. 在肠道病原体清除实验中, 固有层物质会被微生物和病原体穿透[33]. Wlodarska等[9]观察到与野生型小鼠相比, Nlrp6缺陷小鼠的C.rodentium负荷和病理变化增加. ASC-/-和caspase-1/11-/-小鼠也表现出无法清除C.rodentium. 这些结果表明Nlrp6炎性体激活是宿主防御A/E病原体感染的关键. Muc2粘蛋白是由杯状细胞产生的大型糖蛋白, 形成先天宿主防御的第一线[34]. Muc2-/-小鼠会发生自发性结肠炎并且不能阻止从黏膜表面附着和去除粘附的病原体[35]. Nlrp6在整个肠黏膜中高表达, 特别是在杯状细胞中. 该发现表明Nlrp6调节粘液分泌, 进一步的研究表明, Nlrp6-/-小鼠的肠上皮细胞表现出显着的杯状细胞增生. 然而, 杯状细胞粘液颗粒分泌受到抑制, 缺乏厚的连续覆盖的内部黏膜层[9].
有报道指出, Nlrp6仅调节粘液颗粒和肠上皮的融合以及粘液的分泌, 但不影响粘液的表达. 自噬对于Paneth细胞、破骨细胞和肥大细胞的功能至关重要[36-38]. 同样, 在Nlrp6-/-小鼠的上皮中缺乏可见的自噬体形成, 表明自噬过程是由Nlrp6介导的粘液颗粒分泌所必需的过程. 此外, caspase-1/11-/-和ASC-/-小鼠的杯状细胞显示明显缺乏粘液分泌.
通常, 肠道内部粘液层将结肠细胞与微生物群分离, 这样就可以阻止细菌接触隐窝, 破坏其结构及功能[39]. Birchenough等[40]报道细菌的流入增加了隐窝附近TLR配体的浓度并激活了前杯状细胞(sentinel goblet cells, senGCs), 这是在Nlrp6炎性体激活之前, 由内吞作用下游的TLR-MyD88信号通路传导引起的. 这导致Ca2+信号传导驱动化合物Muc2分泌、GJ依赖性细胞信号传导的产生、功能性GC的Muc2分泌和活化的senGC的排出. 这种方式清除了隐窝中的细菌, 从而保护下部隐窝和肠干细胞免受细菌侵入. Nlrp6控制senGC排出, 并促进活化的senGC诱发细胞间信号传导, 最终诱导相邻功能性GC中的Muc2分泌.
由此可见, Nlrp6对于肠道上皮细胞的杯状细胞表达Muc2粘液蛋白具有重要作用, 而Muc2可以调节肠道免疫及微生物, 保护肠道黏膜, 故Nlrp6-Muc2轴对治疗IBD可以提供新的治疗思路.
众所周知, IL-22可以促进上皮细胞增殖[41]. 作为可溶性IL-22受体, IL-22BP特异性结合IL-22并阻止IL-22与IL-22的结合膜结合IL-22R1可抑制上皮细胞增殖[42]. Castleman等[43]表明人肠道微生物群(包括共生细菌)间接调节结肠ILC3功能以诱导IL-22, IL-22通过其对上皮屏障的功能性作用促进肠内稳态. 当肠道上皮屏障完整性受损时, 例如人类免疫缺陷病毒感染和IBD, 来自肠腔的微生物易位到固有层中, 诱导多种潜在的致病性免疫应答. Huber等[44]发现Nlrp6炎性小体导致IL-18依赖性降低, IL-22BP的下调, 从而增加上皮细胞增殖. 此外, IL-18还通过MyD88信号通路促进上皮细胞增值. 通过用AOM或DSS治疗诱导的结肠炎相关癌症小鼠模型, Nlrp6-/-小鼠比野生型小鼠发展出更多更大的肿瘤[45]. 在该研究中, 作者首次阐述了Nlrp6在肿瘤发展中的保护作用. 进一步的研究表明, Nlrp6下调上皮细胞增殖的相关因子, 包括Wnt和肿瘤中的Notch靶基因[46]. 正如上述研究报道的那样, Nlrp6可调节肠道菌群的组成. 在Nlrp6-/-小鼠中携带的致结肠炎肠道微生物群落和微生物群诱导的趋化因子(C-C基序)配体5(CCL5)一起通过IL-6途径局部激活促进上皮细胞增殖[47].
结直肠癌(CRC)是消化系统最常见的癌症之一, 但很多有关CRC发展的潜在分子机制仍然未知[48]. 一个主要的风险因素CRC的发展是IBD的延长. 进一步证明NF-κB激酶依赖性途径的经典抑制剂对于肿瘤的生长和进展至关重要, 突出了CRC发病过程中炎症的重要性[49,50]. 肠道微生物群落使一个复杂的生态系统, 最近显示出对动物模型和人类的健康和疾病有很大的影响[51-54]. 肠道微生物群被认为影响IBD的发病机制, 因为抗生素和益生菌的治疗可以改善某些IBD亚组患者的疾病症状[55]. 此外, 最近证实IBD患者的肠道微生物群的一些成员丰度降低, 包括厚壁菌门和拟杆菌[56,57]. 牛链球菌/溶血弧菌, 产肠毒素细菌脆弱体和大肠杆菌NC101已被认为是CRC的危险因素[58,59]. 此外, 一些小鼠模型中的自发性肠炎在无菌环境中无法发展[60]. Hu等[46]证明了Nlrp6-/-和ASC-/-小鼠含有一种在WT小鼠中可传染的肠道菌群微生物群落, 它可以导致结肠炎恶化. 在这里, 使用(AOM)-DSS诱导的结肠炎相关CRC模型(CAC), 证明了WT小鼠与Nlrp6-/-和ASC-/-共养发展为炎症诱导的CRC作用的戏剧性增强趋势, 其通过诱导IL-18改变其介导的微生物群落和由此诱导的CCL5依赖性结肠炎症和IL-6途径的激活. 由于IBD的持续炎症刺激容易导致癌变, 形成CRC, 因此, 预防和及时治疗IBD可以有效控制CRC的发生. 由此可知, Nlrp6通过IL-18影响肠道微生物菌群, 进一步通过CCL-5及IL-6的激活影响IBD相关性CRC的发生发展. 因此, 此实验研究对于我们治疗IBD相关性CRC具有临床指导意义.
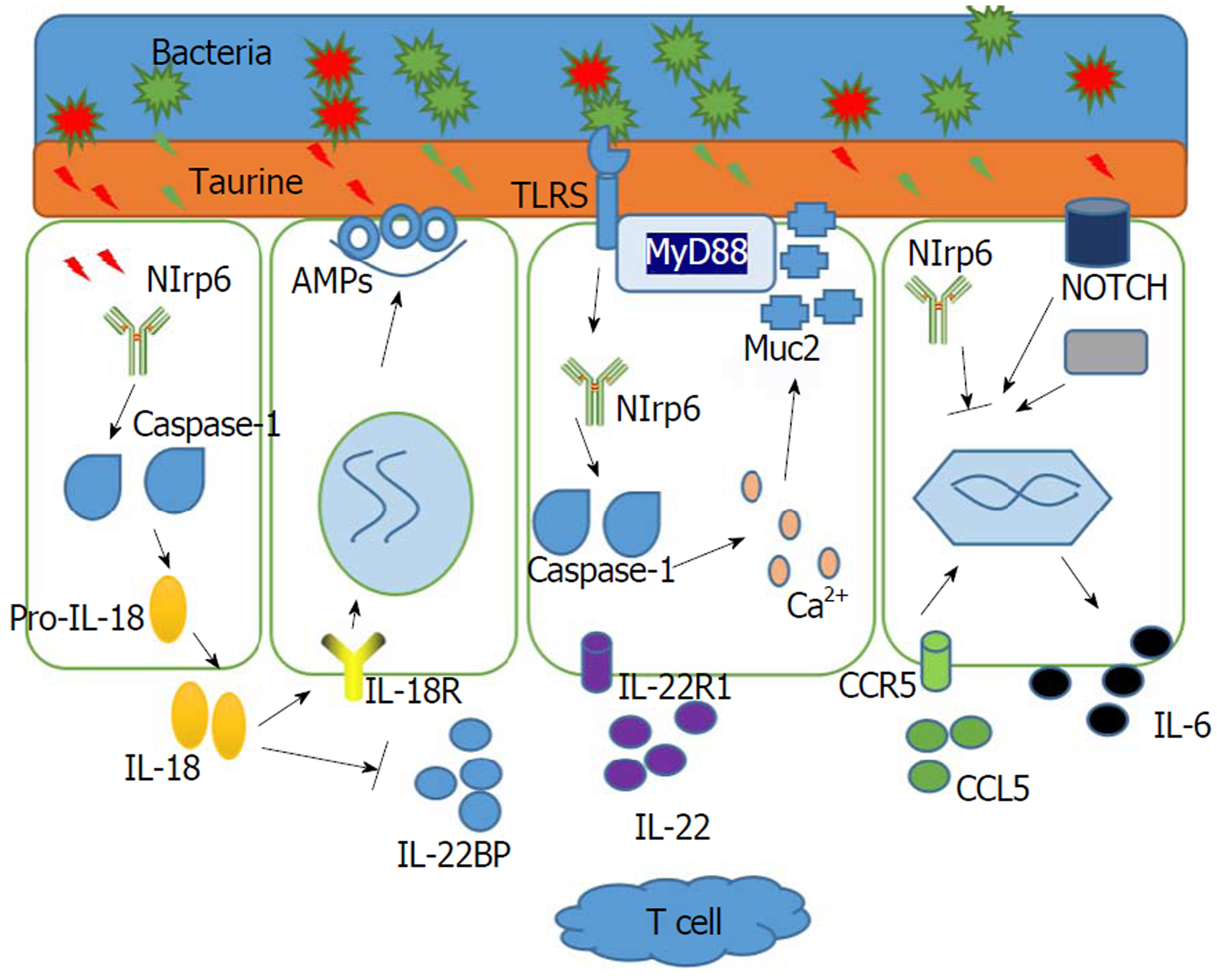
Nlrp6通过作用于caspase-1产生IL-18, 从而促进AMPs的分泌, 清除肠道细菌, 调节肠道免疫功能及维持肠道菌群稳态; IL-18还可抑制IL-22BP的产生, 增强IL-22作用, 并通过MyD88通路来促进上皮细胞增殖; Nlrp6通过TLR调节杯状细胞分泌Muc2粘蛋白, Muc2也可调节肠道免疫及微生物, 保护肠黏膜(图1). Nlrp6可通过各种途径影响肠道免疫及菌群稳态, 而这正是IBD的主要致病原因. 因此, 深入研究Nlrp6作用机制, 有助于揭示IBD发病机制. 由于IBD有一定癌变倾向, Hu[46]发现Nlrp6可作用于NOTCH及Wnt靶点, 激活CCL5及IL-6信号通路, 调节上皮细胞增殖, 影响IBD相关性CRC. Nlrp6在肿瘤的形成中也具有保护作用. Nlrp6的表达已被人提出作为结肠腺癌检测的诊断标记物[61]. 由上可知, 目前的研究证据显示Nlrp6参与维持上皮屏障的完整性、促进肠上皮伤口愈合、抑制肠上皮过度增殖和细胞凋亡, 并在炎症、肿瘤等多种疾病发生发展中具有抑制作用. 因此, Nlrp6及其相应细胞因子的表达水平可以作为IBD及相关肿瘤的一个很有价值的生物标记物和治疗的靶点.
学科分类: 胃肠病学和肝病学
手稿来源地: 湖北省
同行评议报告分类
A级 (优秀): 0
B级 (非常好): B, B
C级 (良好): C, C, C
D级 (一般): 0
E级 (差): E
编辑: 王禹乔 电编:刘继红
| 1. | Márquez L, Shen C, Cleynen I, De Hertogh G, Van Steen K, Machiels K, Perrier C, Ballet V, Organe S, Ferrante M, Henckaerts L, Galicia G, Rutgeerts P, Ceuppens JL, Vermeire S. Effects of haptoglobin polymorphisms and deficiency on susceptibility to inflammatory bowel disease and on severity of murine colitis. Gut. 2012;61:528-534. [PubMed] [DOI] |
| 2. | Cui G, Yuan A. A Systematic Review of Epidemiology and Risk Factors Associated With Chinese Inflammatory Bowel Disease. Front Med (Lausanne). 2018;5:183. [PubMed] [DOI] |
| 3. | Kanneganti TD, Lamkanfi M, Núñez G. Intracellular NOD-like receptors in host defense and disease. Immunity. 2007;27:549-559. [PubMed] [DOI] |
| 4. | Kanneganti TD. Central roles of NLRs and inflammasomes in viral infection. Nat Rev Immunol. 2010;10:688-698. [PubMed] [DOI] |
| 5. | Rathinam VA, Vanaja SK, Fitzgerald KA. Regulation of inflammasome signaling. Nat Immunol. 2012;13:333-342. [PubMed] [DOI] |
| 7. | Ting JP, Lovering RC, Alnemri ES, Bertin J, Boss JM, Davis BK, Flavell RA, Girardin SE, Godzik A, Harton JA, Hoffman HM, Hugot JP, Inohara N, Mackenzie A, Maltais LJ, Nunez G, Ogura Y, Otten LA, Philpott D, Reed JC, Reith W, Schreiber S, Steimle V, Ward PA. The NLR gene family: a standard nomenclature. Immunity. 2008;28:285-287. [PubMed] [DOI] |
| 8. | Kobayashi K, Inohara N, Hernandez LD, Galán JE, Núñez G, Janeway CA, Medzhitov R, Flavell RA. RICK/Rip2/CARDIAK mediates signalling for receptors of the innate and adaptive immune systems. Nature. 2002;416:194-199. [PubMed] [DOI] |
| 9. | Wlodarska M, Thaiss CA, Nowarski R, Henao-Mejia J, Zhang JP, Brown EM, Frankel G, Levy M, Katz MN, Philbrick WM, Elinav E, Finlay BB, Flavell RA. NLRP6 inflammasome orchestrates the colonic host-microbial interface by regulating goblet cell mucus secretion. Cell. 2014;156:1045-1059. [PubMed] [DOI] |
| 10. | Chen GY. Role of Nlrp6 and Nlrp12 in the maintenance of intestinal homeostasis. Eur J Immunol. 2014;44:321-327. [PubMed] [DOI] |
| 11. | Elinav E, Strowig T, Kau AL, Henao-Mejia J, Thaiss CA, Booth CJ, Peaper DR, Bertin J, Eisenbarth SC, Gordon JI, Flavell RA. NLRP6 inflammasome regulates colonic microbial ecology and risk for colitis. Cell. 2011;145:745-757. [PubMed] [DOI] |
| 12. | Lamkanfi M, Dixit VM. Mechanisms and functions of inflammasomes. Cell. 2014;157:1013-1022. [PubMed] [DOI] |
| 13. | Chen GY, Liu M, Wang F, Bertin J, Núñez G. A functional role for Nlrp6 in intestinal inflammation and tumorigenesis. J Immunol. 2011;186:7187-7194. [PubMed] [DOI] |
| 14. | Meixenberger K, Pache F, Eitel J, Schmeck B, Hippenstiel S, Slevogt H, N'Guessan P, Witzenrath M, Netea MG, Chakraborty T, Suttorp N, Opitz B. Listeria monocytogenes-infected human peripheral blood mononuclear cells produce IL-1beta, depending on listeriolysin O and NLRP3. J Immunol. 2010;184:922-930. [PubMed] [DOI] |
| 15. | Normand S, Delanoye-Crespin A, Bressenot A, Huot L, Grandjean T, Peyrin-Biroulet L, Lemoine Y, Hot D, Chamaillard M. Nod-like receptor pyrin domain-containing protein 6 (NLRP6) controls epithelial self-renewal and colorectal carcinogenesis upon injury. Proc Natl Acad Sci U S A. 2011;108:9601-9606. [PubMed] [DOI] |
| 16. | Anand PK, Malireddi RK, Lukens JR, Vogel P, Bertin J, Lamkanfi M, Kanneganti TD. NLRP6 negatively regulates innate immunity and host defence against bacterial pathogens. Nature. 2012;488:389-393. [PubMed] [DOI] |
| 17. | Grivennikov SI, Karin M. Dangerous liaisons: STAT3 and NF-kappaB collaboration and crosstalk in cancer. Cytokine Growth Factor Rev. 2010;21:11-19. [PubMed] [DOI] |
| 18. | Grivennikov S, Karin E, Terzic J, Mucida D, Yu GY, Vallabhapurapu S, Scheller J, Rose-John S, Cheroutre H, Eckmann L, Karin M. IL-6 and Stat3 are required for survival of intestinal epithelial cells and development of colitis-associated cancer. Cancer Cell. 2009;15:103-113. [PubMed] [DOI] |
| 19. | Grenier JM, Wang L, Manji GA, Huang WJ, Al-Garawi A, Kelly R, Carlson A, Merriam S, Lora JM, Briskin M, DiStefano PS, Bertin J. Functional screening of five PYPAF family members identifies PYPAF5 as a novel regulator of NF-kappaB and caspase-1. FEBS Lett. 2002;530:73-78. [PubMed] [DOI] |
| 20. | Ranson N, Veldhuis M, Mitchell B, Fanning S, Cook AL, Kunde D, Eri R. Nod-Like Receptor Pyrin-Containing Protein 6 (NLRP6) Is Up-regulated in Ileal Crohn's Disease and Differentially Expressed in Goblet Cells. Cell Mol Gastroenterol Hepatol. 2018;6:110-112.e8. [PubMed] [DOI] |
| 21. | Alipour M, Zaidi D, Valcheva R, Jovel J, Martínez I, Sergi C, Walter J, Mason AL, Wong GK, Dieleman LA, Carroll MW, Huynh HQ, Wine E. Mucosal Barrier Depletion and Loss of Bacterial Diversity are Primary Abnormalities in Paediatric Ulcerative Colitis. J Crohns Colitis. 2016;10:462-471. [PubMed] [DOI] |
| 22. | Sun Y, Zhang M, Chen CC, Gillilland M, Sun X, El-Zaatari M, Huffnagle GB, Young VB, Zhang J, Hong SC, Chang YM, Gumucio DL, Owyang C, Kao JY. Stress-induced corticotropin-releasing hormone-mediated NLRP6 inflammasome inhibition and transmissible enteritis in mice. Gastroenterology. 2013;144:1478-1487, 1487.e1-1487.e8. [PubMed] [DOI] |
| 23. | Sellin ME, Maslowski KM, Maloy KJ, Hardt WD. Inflammasomes of the intestinal epithelium. Trends Immunol. 2015;36:442-450. [PubMed] [DOI] |
| 24. | Anand PK, Kanneganti TD. NLRP6 in infection and inflammation. Microbes Infect. 2013;15:661-668. [PubMed] [DOI] |
| 25. | Vladimer GI, Marty-Roix R, Ghosh S, Weng D, Lien E. Inflammasomes and host defenses against bacterial infections. Curr Opin Microbiol. 2013;16:23-31. [PubMed] [DOI] |
| 26. | Levy M, Thaiss CA, Zeevi D, Dohnalová L, Zilberman-Schapira G, Mahdi JA, David E, Savidor A, Korem T, Herzig Y, Pevsner-Fischer M, Shapiro H, Christ A, Harmelin A, Halpern Z, Latz E, Flavell RA, Amit I, Segal E, Elinav E. Microbiota-Modulated Metabolites Shape the Intestinal Microenvironment by Regulating NLRP6 Inflammasome Signaling. . Cell. 2015; 163:1428-1443. [PubMed] [DOI] |
| 27. | Kempster SL, Belteki G, Forhead AJ, Fowden AL, Catalano RD, Lam BY, McFarlane I, Charnock-Jones DS, Smith GC. Developmental control of the Nlrp6 inflammasome and a substrate, IL-18, in mammalian intestine. Am J Physiol Gastrointest Liver Physiol. 2011;300:G253-G263. [PubMed] [DOI] |
| 28. | Seregin SS, Golovchenko N, Schaf B, Chen J, Pudlo NA, Mitchell J, Baxter NT, Zhao L, Schloss PD, Martens EC, Eaton KA, Chen GY. NLRP6 Protects Il10-/- Mice from Colitis by Limiting Colonization of Akkermansia muciniphila. Cell Rep. 2017;19:2174. [PubMed] [DOI] |
| 29. | Williams H, Campbell L, Crompton RA, Singh G, McHugh BJ, Davidson DJ, McBain AJ, Cruickshank SM, Hardman MJ. Microbial Host Interactions and Impaired Wound Healing in Mice and Humans: Defining a Role for BD14 and NOD2. J Invest Dermatol. 2018;138:2264-2274. [PubMed] [DOI] |
| 30. | Hooper LV, Littman DR, Macpherson AJ. Interactions between the microbiota and the immune system. Science. 2012;336:1268-1273. [PubMed] [DOI] |
| 31. | Swidsinski A, Loening-Baucke V, Theissig F, Engelhardt H, Bengmark S, Koch S, Lochs H, Dörffel Y. Comparative study of the intestinal mucus barrier in normal and inflamed colon. Gut. 2007;56:343-350. [PubMed] [DOI] |
| 32. | Gersemann M, Becker S, Kübler I, Koslowski M, Wang G, Herrlinger KR, Griger J, Fritz P, Fellermann K, Schwab M, Wehkamp J, Stange EF. Differences in goblet cell differentiation between Crohn's disease and ulcerative colitis. Differentiation. 2009;77:84-94. [PubMed] [DOI] |
| 33. | Schneider H, Pelaseyed T, Svensson F, Johansson MEV. Study of mucin turnover in the small intestine by in vivo labeling. Sci Rep. 2018;8:5760. [PubMed] [DOI] |
| 34. | Tawiah A, Cornick S, Moreau F, Gorman H, Kumar M, Tiwari S, Chadee K. High MUC2 Mucin Expression and Misfolding Induce Cellular Stress, Reactive Oxygen Production, and Apoptosis in Goblet Cells. Am J Pathol. 2018;188:1354-1373. [PubMed] [DOI] |
| 35. | Wenzel UA, Magnusson MK, Rydström A, Jonstrand C, Hengst J, Johansson ME, Velcich A, Öhman L, Strid H, Sjövall H, Hansson GC, Wick MJ. Spontaneous colitis in Muc2-deficient mice reflects clinical and cellular features of active ulcerative colitis. PLoS One. 2014;9:e100217. [PubMed] [DOI] |
| 36. | DeSelm CJ, Miller BC, Zou W, Beatty WL, van Meel E, Takahata Y, Klumperman J, Tooze SA, Teitelbaum SL, Virgin HW. Autophagy proteins regulate the secretory component of osteoclastic bone resorption. Dev Cell. 2011;21:966-974. [PubMed] [DOI] |
| 37. | Cadwell K, Liu JY, Brown SL, Miyoshi H, Loh J, Lennerz JK, Kishi C, Kc W, Carrero JA, Hunt S, Stone CD, Brunt EM, Xavier RJ, Sleckman BP, Li E, Mizushima N, Stappenbeck TS, Virgin HW 4th. A key role for autophagy and the autophagy gene Atg16l1 in mouse and human intestinal Paneth cells. Nature. 2008;456:259-263. [PubMed] [DOI] |
| 38. | Ushio H, Ueno T, Kojima Y, Komatsu M, Tanaka S, Yamamoto A, Ichimura Y, Ezaki J, Nishida K, Komazawa-Sakon S, Niyonsaba F, Ishii T, Yanagawa T, Kominami E, Ogawa H, Okumura K, Nakano H. Crucial role for autophagy in degranulation of mast cells. J Allergy Clin Immunol. 2011;127:1267-76.e6. [PubMed] [DOI] |
| 39. | Johansson ME, Phillipson M, Petersson J, Velcich A, Holm L, Hansson GC. The inner of the two Muc2 mucin-dependent mucus layers in colon is devoid of bacteria. Proc Natl Acad Sci U S A. 2008;105:15064-15069. [PubMed] [DOI] |
| 40. | Birchenough GM, Nyström EE, Johansson ME, Hansson GC. A sentinel goblet cell guards the colonic crypt by triggering Nlrp6-dependent Muc2 secretion. Science. 2016;352:1535-1542. [PubMed] [DOI] |
| 41. | Witte E, Witte K, Warszawska K, Sabat R, Wolk K. Interleukin-22: a cytokine produced by T, NK and NKT cell subsets, with importance in the innate immune defense and tissue protection. Cytokine Growth Factor Rev. 2010;21:365-379. [PubMed] [DOI] |
| 42. | Wei CC, Ho TW, Liang WG, Chen GY, Chang MS. Cloning and characterization of mouse IL-22 binding protein. Genes Immun. 2003;4:204-211. [PubMed] [DOI] |
| 43. | Castleman MJ, Dillon SM, Purba CM, Cogswell AC, Kibbie JJ, McCarter MD, Santiago ML, Barker E, Wilson CC. Commensal and Pathogenic Bacteria Indirectly Induce IL-22 but Not IFNγ Production From Human Colonic ILC3s via Multiple Mechanisms. Front Immunol. 2019;10:649. [PubMed] [DOI] |
| 44. | Huber S, Gagliani N, Zenewicz LA, Huber FJ, Bosurgi L, Hu B, Hedl M, Zhang W, O'Connor W, Murphy AJ, Valenzuela DM, Yancopoulos GD, Booth CJ, Cho JH, Ouyang W, Abraham C, Flavell RA. IL-22BP is regulated by the inflammasome and modulates tumorigenesis in the intestine. . Nature. 2012; 491:259-263. [PubMed] [DOI] |
| 45. | Karki R, Man SM, Kanneganti TD. Inflammasomes and Cancer. Cancer Immunol Res. 2017;5:94-99. [PubMed] [DOI] |
| 46. | Hu B, Elinav E, Huber S, Strowig T, Hao L, Hafemann A, Jin C, Wunderlich C, Wunderlich T, Eisenbarth SC, Flavell RA. Microbiota-induced activation of epithelial IL-6 signaling links inflammasome-driven inflammation with transmissible cancer. Proc Natl Acad Sci U S A. 2013;110:9862-9867. [PubMed] [DOI] |
| 47. | Weir HK, Thun MJ, Hankey BF, Ries LA, Howe HL, Wingo PA, Jemal A, Ward E, Anderson RN, Edwards BK. Annual report to the nation on the status of cancer, 1975-2000, featuring the uses of surveillance data for cancer prevention and control. J Natl Cancer Inst. 2003;95:1276-1299. [PubMed] [DOI] |
| 48. | Popivanova BK, Kitamura K, Wu Y, Kondo T, Kagaya T, Kaneko S, Oshima M, Fujii C, Mukaida N. Blocking TNF-alpha in mice reduces colorectal carcinogenesis associated with chronic colitis. J Clin Invest. 2008;118:560-570. [PubMed] [DOI] |
| 49. | Grivennikov SI, Greten FR, Karin M. Immunity, inflammation, and cancer. Cell. 2010;140:883-899. [PubMed] [DOI] |
| 50. | Henao-Mejia J, Elinav E, Jin C, Hao L, Mehal WZ, Strowig T, Thaiss CA, Kau AL, Eisenbarth SC, Jurczak MJ, Camporez JP, Shulman GI, Gordon JI, Hoffman HM, Flavell RA. Inflammasome-mediated dysbiosis regulates progression of NAFLD and obesity. Nature. 2012;482:179-185. [PubMed] [DOI] |
| 51. | Guarner F, Malagelada JR. Gut flora in health and disease. Lancet. 2003;361:512-519. [PubMed] [DOI] |
| 52. | Wen L, Ley RE, Volchkov PY, Stranges PB, Avanesyan L, Stonebraker AC, Hu C, Wong FS, Szot GL, Bluestone JA, Gordon JI, Chervonsky AV. Innate immunity and intestinal microbiota in the development of Type 1 diabetes. Nature. 2008;455:1109-1113. [PubMed] [DOI] |
| 53. | Wang Z, Klipfell E, Bennett BJ, Koeth R, Levison BS, Dugar B, Feldstein AE, Britt EB, Fu X, Chung YM, Wu Y, Schauer P, Smith JD, Allayee H, Tang WH, DiDonato JA, Lusis AJ, Hazen SL. Gut flora metabolism of phosphatidylcholine promotes cardiovascular disease. Nature. 2011;472:57-63. [PubMed] [DOI] |
| 54. | Gionchetti P, Rizzello F, Helwig U, Venturi A, Lammers KM, Brigidi P, Vitali B, Poggioli G, Miglioli M, Campieri M. Prophylaxis of pouchitis onset with probiotic therapy: a double-blind, placebo-controlled trial. Gastroenterology. 2003;124:1202-1209. [PubMed] [DOI] |
| 55. | Frank DN, St Amand AL, Feldman RA, Boedeker EC, Harpaz N, Pace NR. Molecular-phylogenetic characterization of microbial community imbalances in human inflammatory bowel diseases. Proc Natl Acad Sci U S A. 2007;104:13780-13785. [PubMed] [DOI] |
| 56. | Davis CD, Milner JA. Gastrointestinal microflora, food components and colon cancer prevention. J Nutr Biochem. 2009;20:743-752. [PubMed] [DOI] |
| 57. | Goodwin AC, Destefano Shields CE, Wu S, Huso DL, Wu X, Murray-Stewart TR, Hacker-Prietz A, Rabizadeh S, Woster PM, Sears CL, Casero RA. Polyamine catabolism contributes to enterotoxigenic Bacteroides fragilis-induced colon tumorigenesis. Proc Natl Acad Sci U S A. 2011;108:15354-15359. [PubMed] [DOI] |
| 58. | Abdulamir AS, Hafidh RR, Abu Bakar F. The association of Streptococcus bovis/gallolyticus with colorectal tumors: the nature and the underlying mechanisms of its etiological role. J Exp Clin Cancer Res. 2011;30:11. [PubMed] [DOI] |
| 59. | Arthur JC, Perez-Chanona E, Mühlbauer M, Tomkovich S, Uronis JM, Fan TJ, Campbell BJ, Abujamel T, Dogan B, Rogers AB, Rhodes JM, Stintzi A, Simpson KW, Hansen JJ, Keku TO, Fodor AA, Jobin C. Intestinal inflammation targets cancer-inducing activity of the microbiota. Science. 2012;338:120-123. [PubMed] [DOI] |
| 60. | Elson CO, Cong Y, McCracken VJ, Dimmitt RA, Lorenz RG, Weaver CT. Experimental models of inflammatory bowel disease reveal innate, adaptive, and regulatory mechanisms of host dialogue with the microbiota. Immunol Rev. 2005;206:260-276. [PubMed] [DOI] |
| 61. | Ahmed FE, Vos P. Molecular markers for human colon cancer in stool and blood identified by RT-PCR. Anticancer Res. 2004;24:4127-4134. [PubMed] |