修回日期: 2019-07-26
接受日期: 2019-08-19
在线出版日期: 2019-08-28
胰腺腺泡细胞增殖及凋亡与急性胰腺炎(acute pancreatitis, AP)发生密切相关, miRNA可通过调控靶基因表达从而参与细胞增殖及凋亡过程, 因而寻找与胰腺腺泡细胞增殖及凋亡相关的miRNA分子标志物对临床诊断及治疗AP具有重要意义.
探讨微小RNA-7a-5p(miR-7a-5p)对AP腺泡细胞增殖、凋亡的影响及机制.
构建雨蛙肽诱导的AP模型并收集胰腺炎腺泡细胞AR42J(雨蛙肽组), 采用qRT-PCR与Western blot分别检测未经雨蛙肽诱导的AR42J细胞(对照组)及雨蛙肽组AR42J细胞中miR-7a-5p相对表达量及活化信号转导和转录激活因子的蛋白抑制因子-1(protein inhibitor of activated signal transducer and activator of transcription 1, PIAS1)表达. 分别将anti-miR-7a-5p、pcDNA-PIAS1转染至雨蛙肽组AR42J细胞, 采用MTT法检测AR42J细胞增殖能力, 流式细胞术检测AR42J细胞凋亡. 荧光素酶报告系统检测miR-7a-5p对PIAS1基因的靶向调控作用, 并采用Western blot检测miR-7a-5p对PIAS1蛋白表达的调控作用. 采用RNA干扰技术沉默PIAS1表达(si-PIAS1组), 分别将si-PIAS1及其阴性对照转染至anti-miR-7a-5p组AR42J细胞, 观察AR42J细胞增殖及凋亡能力.
与对照组相比, 雨蛙肽组AR42J细胞中miR-7a-5p表达水平显著升高(P<0.05), PIAS1蛋白表达显著降低(P<0.05); 抑制miR-7a-5p表达可促进胰腺炎腺泡细胞AR42J增殖并抑制其凋亡; miR-7a-5p可负向调控靶基因PIAS1表达; PIAS1过表达可促进AR42J细胞增殖并抑制其凋亡; 与anti-miR-7a-5p+si-NC组相比, anti-miR-7a-5p+si-PIAS1组AR42J细胞活性显著降低(P<0.05), 细胞凋亡率显著升高(P<0.05).
miR-7a-5p可通过抑制PIAS1表达进而促进AP腺泡细胞凋亡并降低细胞增殖能力.
核心提要: 本研究采用雨蛙肽处理AR42J细胞构建急性胰腺炎(acute pancreatitis, AP)细胞模型,分析miR-7a-5p对胰腺炎细胞增殖及凋亡的影响,初步验证其作用靶基因,为揭示AP发病机制及治疗方法奠定理论基础.
引文著录: 楼一波, 王晓华, 傅志成. miR-7a-5p对急性胰腺炎腺泡细胞增殖、凋亡的影响及机制. 世界华人消化杂志 2019; 27(16): 991-998
Revised: July 26, 2019
Accepted: August 19, 2019
Published online: August 28, 2019
Pancreatic acinar cell proliferation and apoptosis are closely related to the development of acute pancreatitis (AP). MicroRMAs (miRNAs) participate in cell proliferation and apoptosis by regulating target gene expression, and identification of miRNA molecules related to pancreatic acinar cell proliferation and apoptosis is important for clinical diagnosis and treatment of AP.
To investigate the effect of miRNA-7a-5p on the proliferation and apoptosis of acinar cells in AP and the underlying mechanism.
A caerulin-induced AP model was constructed using pancreatitis acinar AR42J cells. qRT-PCR and Western blot were used to detect the expression of miR-7a-5p and protein inhibitor of activated signal transducer and activator of transcription 1 (PIAS1) in control AR42J cells and cerulein induced AR42J cells. After anti-miR-7a-5p and pcDNA-PIAS1 were transfected into AR42J cells, the proliferation of AR42J cells was detected by MTT assay, and the apoptosis of AR42J cells was detected by flow cytometry. The luciferase reporter system was used to detect the targeted regulation of PIAS1 gene by miR-7a-5p, and Western blot was used to detect the regulation of PIAS1 protein expression by miR-7a-5p. To silence PIAS1 expression by RNA interference, si-PIAS1 and its negative control plasmid were transfected into anti-miR-7a-5p treated AR42J cells, and the proliferation and apoptosis of AR42J cells were detected.
Compared with control AR42J cells, the expression level of miR-7a-5p was significantly increased in cerulein induced AR42J cells (P < 0.05), and the expression of PIAS1 protein was significantly decreased (P < 0.05). Inhibition of miR-7a-5p expression promoted proliferation and inhibited apoptosis of AR42J cells. MiR-7a-5p could negatively regulate the expression of its target gene PIAS1. Overexpression of PIAS1 promoted proliferation and inhibited apoptosis of AR42J cells. Compared with the anti-miR-7a-5p + si-NC group, the activity of AR42J cells in the anti-miR-7a-5p + si-PIAS1 group was significantly decreased (P < 0.05), and the apoptosis rate was significantly increased (P < 0.05).
MiR-7a-5p can promote the apoptosis of acinar cells and reduce the proliferation of cells in AP by inhibiting the expression of PIAS1.
- Citation: Lou YB, Wang XH, Fu ZC. Effects of miR-7a-5p expression on proliferation and apoptosis of acinar cells in acute pancreatitis. Shijie Huaren Xiaohua Zazhi 2019; 27(16): 991-998
- URL: https://www.wjgnet.com/1009-3079/full/v27/i16/991.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v27.i16.991
急性胰腺炎(acute pancreatitis, AP)是临床常见疾病,胰腺腺泡细胞增殖及凋亡与AP发生及发展密切相关[1-3]. 因而寻找与胰腺腺泡细胞增殖及凋亡相关的分子标志物对临床诊断及治疗AP具有重要意义. 微小RNA-7a-5p(microRNA-7a-5p, miR-7a-5p)表达异常与缺血性脑损伤密切相关, miR-7在重症急性胰腺炎(severe acute pancreatitis, SAP)和轻症急性胰腺炎(mild acute pancreatitis, MAP)患者血清中呈高表达[4,5]. 活化信号转导和转录激活因子的蛋白抑制因子-1(protein inhibitor of activated signal transducer and activator of transcription 1, PIAS1)在AP腺泡细胞中呈低表达[6]. 雨蛙肽可刺激胆囊收缩及胰酶分泌并可促使胰腺腺泡细胞凋亡导致组织损伤[7]. 但关于miR-7a-5p在AP中的表达及其对AP腺泡细胞增殖、凋亡的影响尚未见报道. 因此, 本研究采用雨蛙肽处理AR42J细胞构建AP细胞模型, 分析沉默miR-7a-5p表达及PIAS1过表达对雨蛙肽刺激胰腺腺泡细胞增殖及凋亡的影响, 为临床治疗AP及基础研究提供理论依据.
大鼠胰腺AR42J腺泡细胞购自中国科学院上海细胞库. 雨蛙肽购自美国Sigma公司; 胎牛血清(fetal bovine serum, FBS)、RPMI1640培养基、磷酸盐缓冲液(phosphate buffer saline, PBS)及青链霉素均购自美国 Gibco公司; Annexin V-FITC凋亡检测试剂盒、Trizol试剂及Lipofectamine2000转染试剂均购自美国Invitrogen 公司; PVDF膜购自美国Millipore公司; 兔抗鼠GAPDH抗体、PIAS1抗体及辣根过氧化物酶(horseradish peroxidase, HRP)标记的IgG二抗均购自武汉博士德生物工程有限公司; BCA蛋白定量检测试剂盒、反转录试剂盒均购自美国Thermo Fisher公司; miR-7a-5p mimic、anti-miR-7a-5p及其各自阴性对照质粒均购自上海吉玛基因公司; qRT-PCR试剂盒购自日本TaKaRa公司; 蛋白裂解液购自上海生工生物工程有限公司; 荧光素酶活性检测试剂盒及荧光素酶报告载体均购自北京原平皓生物技术有限公司; pcDNA载体购自美国Addgene公司.
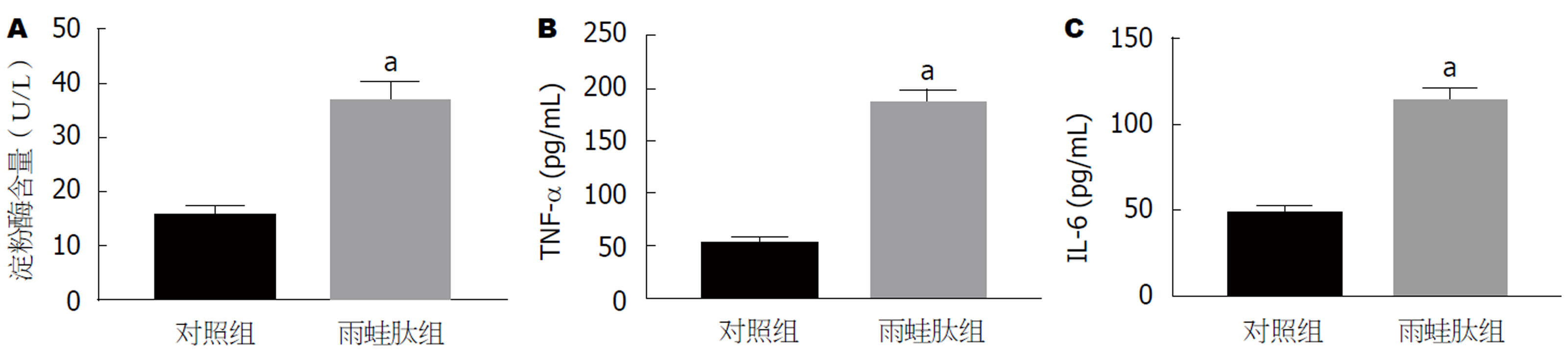
1.2.1 胰腺炎细胞模型的构建: 大鼠胰腺腺泡细胞AR42J培养于RPMI1640培养基, 培养基含有10% FBS、青霉素(100 U/mL)、链霉素(100 g/L), 常规培养细胞, 48 h更换培养液. 收集AR42J细胞, 接种至6孔细胞培养板, 密度为1×106个/孔, 当细胞贴壁生长后加入浓度为100 nmol/L的雨蛙肽刺激细胞, 6 h后收集细胞上清液, 经酶联免疫吸附法检测淀粉酶、白细胞介素-6(Interleukin-6, IL-6)及肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)等炎性因子表达水平, 结果显示雨蛙肽处理后炎性因子表达水平显著高于对照细胞组, 提示建模成功[8]. 收集胰腺炎腺泡细胞AR42J用于后续研究.
1.2.2 细胞转染及分组: 未经雨蛙肽处理的AR42J细胞为对照组, 经雨蛙肽处理的AR42J细胞为雨蛙肽组. 收集雨蛙肽组对数生长期AR42J细胞接种于6孔板, 密度为3×105个/孔, 待细胞融合至50%左右时(2 d), 以anti-miR-NC和anti-miR-7a-5p分别与Lipofectamine2000转染试剂混合加入不含FBS的RPMI 1640培养液, 即分别为雨蛙肽组+anti-miR-NC组、雨蛙肽组+anti-miR-7a-5p组. 分别将pcDNA、pcDNA-PIAS1转染至AR42J细胞, 即分别为雨蛙肽+pcDNA组、雨蛙肽+pcDNA-PIAS1组. 转染6 h后更换为完全培养基, 继续培养48 h, 收集细胞.
1.2.3 qRT-PCR检测miR-7a-5p表达: 用1.5 mL试管收集各组AR42J细胞, 利用离心机离心细胞, 弃上清, PBS洗涤, 分别加入Trizol试剂1 mL提取总RNA, 测定RNA浓度与纯度, 参照反转录试剂盒合成cDNA, 以cDNA为模板进行qRT-PCR反应. PCR扩增条件为95 ℃ 5 min循环1次, 95 ℃变性15 s, 60 ℃退火60 s, 72 ℃延伸30 s, 共循环40次. miR-7a-5p以U6为内参基因, 采用2-ΔΔCt法分析数据. 每组实验设置3次生物学重复.
1.2.4 Western blot检测PIAS1蛋白表达: 收集各组AR42J细胞, 加入蛋白裂解液提取总蛋白, 测定蛋白浓度及纯度, 将SDS-PAGE电泳结束后将蛋白凝胶转移至PVDF膜, 2 h后将其置于5%脱脂牛奶封闭液, 室温放置2 h, 加入1000倍稀释的PIAS1一抗, 4 ℃孵育过夜, 次日采用Tis-HCI缓冲液(TBST)洗膜, 清洗3次, 每次15 min, 放入稀释2000倍二抗中, 室温反应2 h, TBST清洗, 加入ECL显色, 置于Bio-Rad凝胶电泳成像仪中分析蛋白条带, 利用Quantity One软件分析蛋白相对表达量, 每组实验设置3次生物学重复.
1.2.5 MTT检测细胞增殖: 取各组对数生长期AR42J细胞, 培养液重悬细胞(1.5×105 /mL), 以每孔接种细胞体积20 μL接种至96孔细胞培养板培养24 h, 每孔加入40 μL MTT溶液, 继续培养4 h, 每孔加入200 μL DMSO, 分别继续培养24 h、48 h、72 h, 置于酶标仪检测各孔在波长为490 nm时细胞光密度值(optical density, OD), OD值大小表示细胞增殖能力, 实验设置3次重复, 求取平均值.
1.2.6 流式细胞术检测细胞凋亡: 分别取各组AR42J细胞, 制备重悬细胞, 接种于6孔细胞培养板(5×105个/孔), 分别加入5 μL Annexin V-FITC, 室温避光孵育, 15 min后加入5 μL PI染色液, 利用流式细胞仪检测细胞凋亡率.
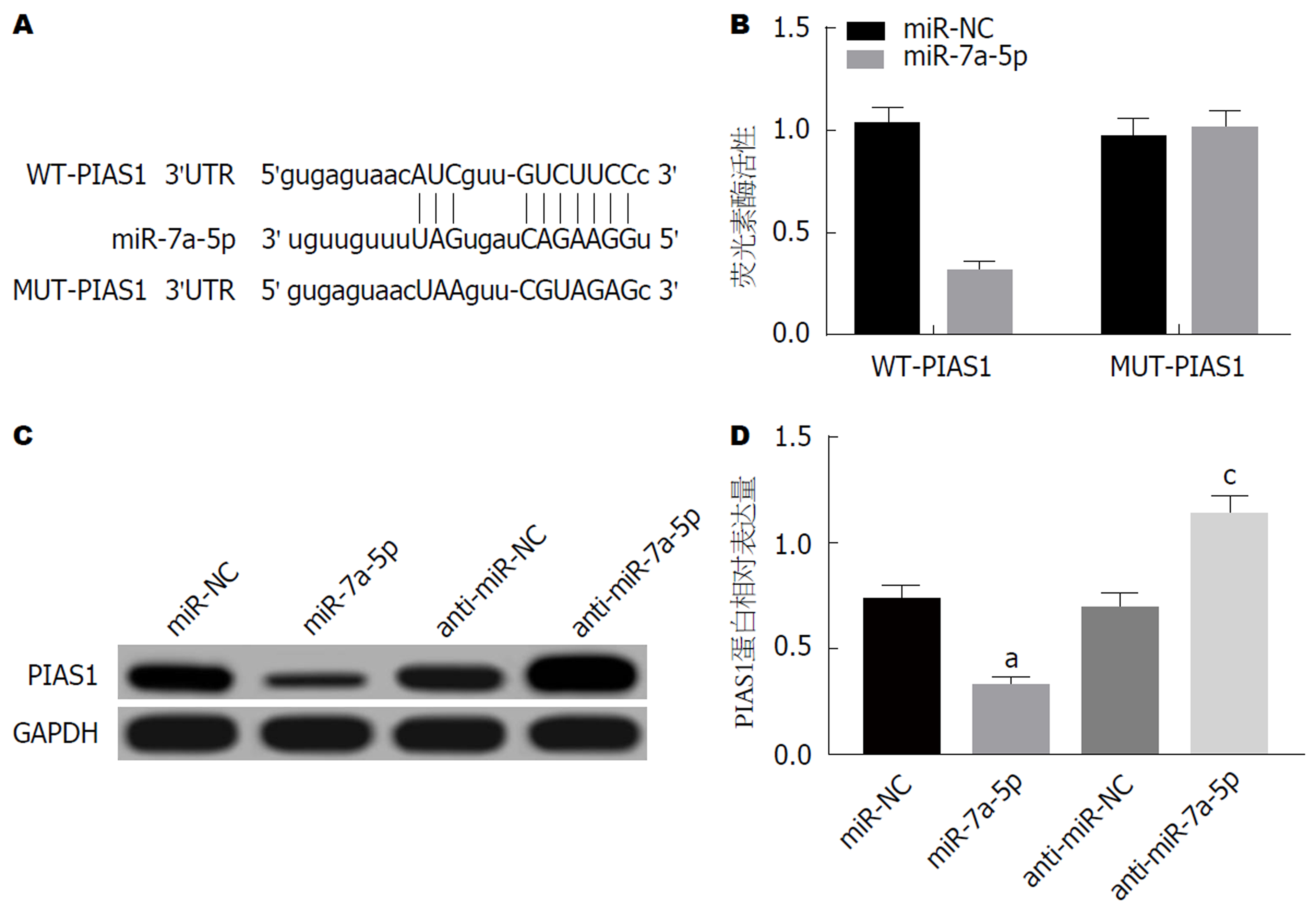
1.2.7 荧光素酶检测: 通过TargetScan、miRanda等生物信息学软件预测PIAS1可能是miR-7a-5p的靶基因, 取对数生长期AR42J细胞, 接种于96孔板(1.5×104个/孔), WT-PIAS1分别与miR-NC、miR-7a-5p mimics共转染; MUT-PIAS1分别与miR-NC、miR-7a-5p mimics共转染至AR42J细胞, 继续培养24 h后收集细胞, 检测AR42J细胞相对荧光素酶活性, 严格按照双荧光素酶活性检测试剂盒说明书操作.
统计学处理 采用统计学软件SPSS 21.0分析数据, 应用GraphPad Prism7软件作图, 计量资料以mean±SD表示, 两组间比较采用独立样本t检验, 多组间比较采用单因素方差分析; 计数资料采用χ2检验, 各组数据均以P<0.05为差异具有统计学意义.
与对照组相比, 雨蛙肽组AR42J细胞上清液中淀粉酶含量、TNF-α含量、IL-6含量均显著升高(图1), 提示造模成功.
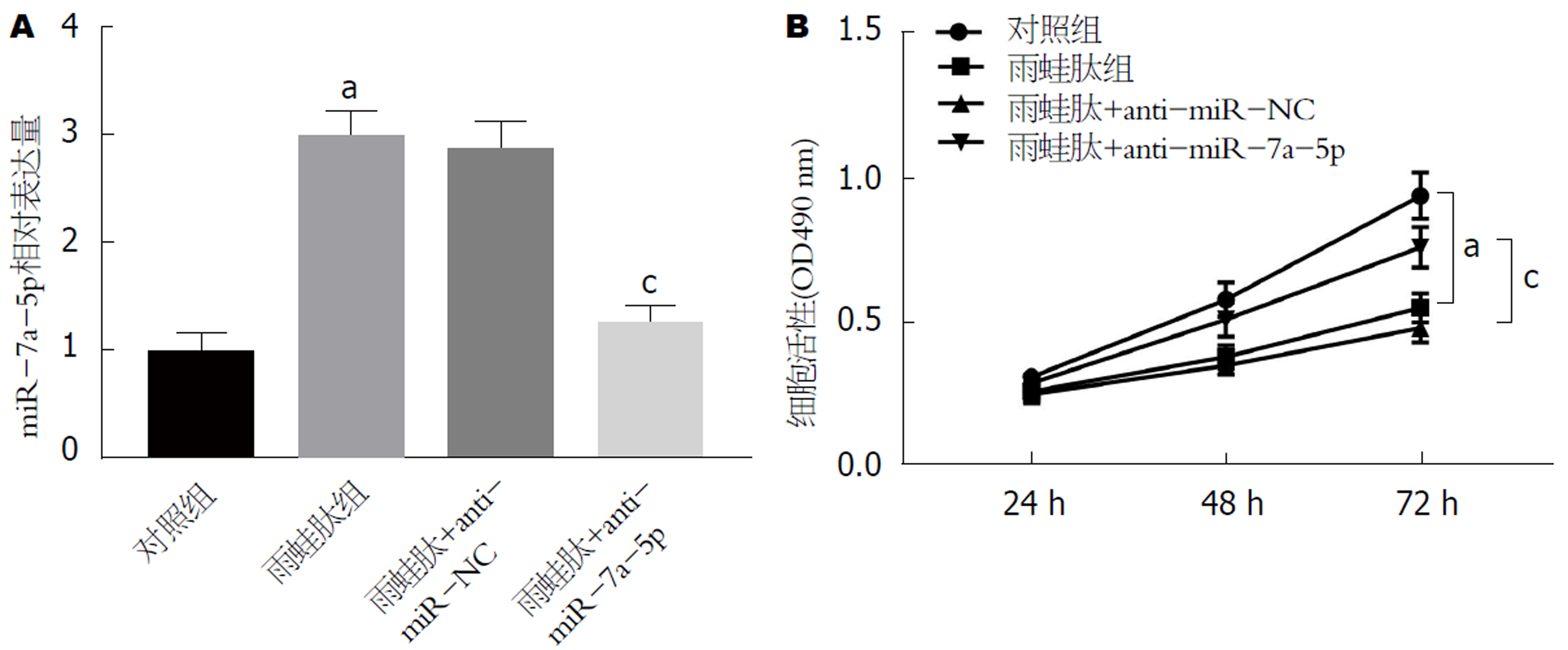
对照组AR42J细胞中miR-7a-5p表达水平较低, 雨蛙肽组AR42J细胞中miR-7a-5p表达水平显著升高(P<0.05)(图1A). Western blot检测结果显示雨蛙肽组AR42J细胞中PIAS1蛋白表达显著低于对照组(P<0.05)(图1B、1C).
雨蛙肽+anti-miR-7a-5p组AR42J细胞中miR-7a-5p表达水平显著降低(P<0.05),提示转染成功(图2A). 与对照组相比, 雨蛙肽组AR42J细胞活性显著降低(P<0.05); 与雨蛙肽+anti-miR-NC组相比, 雨蛙肽+anti-miR-7a-5p组AR42J细胞活性显著升高(P<0.05)(图2B). 表明抑制miR-7a-5p表达可促进胰腺炎腺泡细胞AR42J增殖.
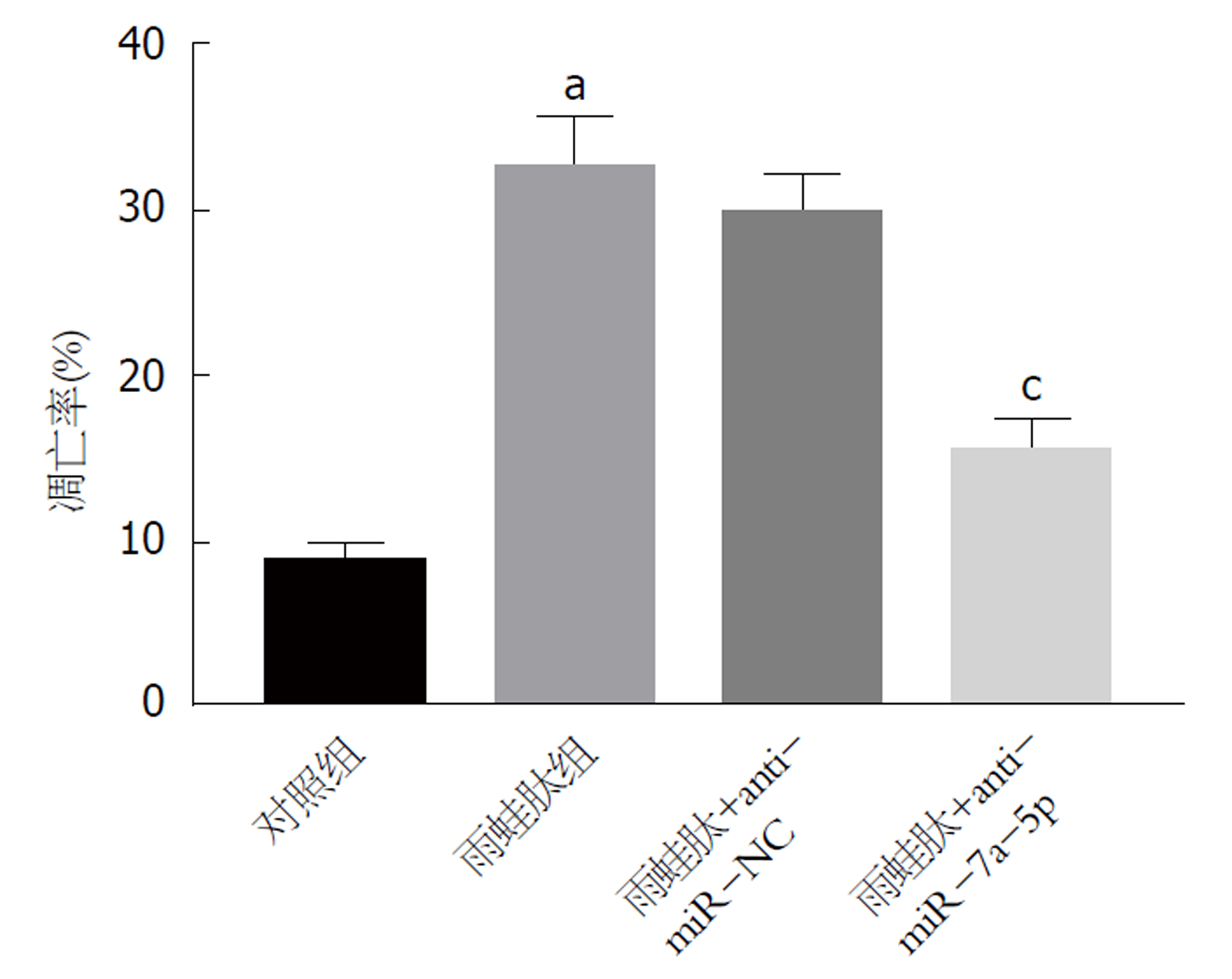
与对照组相比, 雨蛙肽组AR42J细胞凋亡率显著升高(P<0.05), 雨蛙肽+anti-miR-7a-5p组AR42J细胞凋亡率显著低于雨蛙肽+anti-miR-NC组(P<0.05)(图3). 结果表明抑制miR-7a-5p表达可抑制胰腺炎腺泡细胞AR42J凋亡.
共转染miR-7a-5p mimic与WT-PIAS1质粒后, 荧光强度相较于转染miR-7a-5p对照质粒与WT-PIAS1质粒明显降低(P<0.05); 共转染miR-7a-5p mimic与MUT-PIAS1质粒后, 荧光强度相较于转染miR-7a-5p对照质粒与MUT-PIAS1质粒差异无统计学意义(P>0.05). miR-7a-5p组胰腺炎腺泡细胞AR42J中PIAS1蛋白表达水平较miR-NC组明显降低(P<0.05); anti-miR-7a-5p组AR42J细胞中PIAS1蛋白表达水平较miR-NC组明显升高(P<0.05)(图4). 结果表明PIAS1是miR-7a-5p的靶基因, miR-7a-5p可负向调控PIAS1表达.
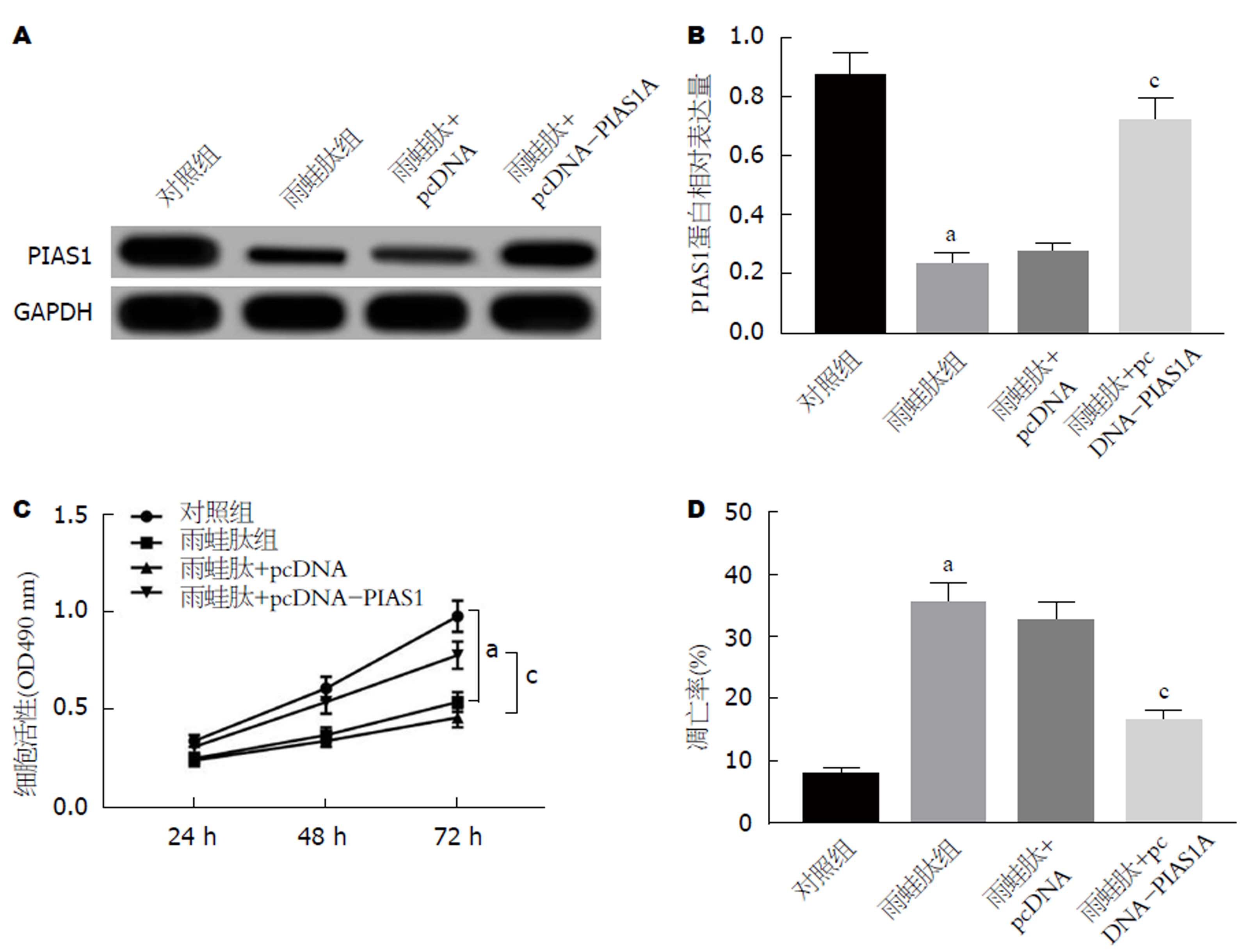
雨蛙肽+pcDNA-PIAS1组AR42J细胞中PIAS1蛋白表达水平显著升高(P<0.05)(图5A、5B). 雨蛙肽+pcDNA-PIAS1组AR42J细胞活性显著高于雨蛙肽+pcDNA组(P<0.05), AR42J细胞凋亡率显著降低(P<0.05)(图5C、5D).
anti-miR-7a-5p+si-PIAS1组AR42J细胞活性低于anti-miR-7a-5p+si-NC组(P<0.05), 细胞凋亡率明显升高(P<0.05)(图6). 结果表明抑制PIAS1表达可逆转抑制miR-7a-5p表达对雨蛙肽诱导的胰腺炎腺泡细胞AR42J增殖和凋亡的作用.
胰腺腺泡细胞死亡方式为坏死时可造成重症胰腺炎, 若胰腺腺泡细胞死亡方式为凋亡时可造成轻度胰腺炎[9,10]. AR42J细胞属于大鼠胰腺腺泡细胞瘤细胞, 具有利于培养、转染效率高及刺激反应敏感性较大等优点[11]. 故此本研究选用AR42J细胞为研究对象. 既往研究发现miRNA对AP早期诊断及评估病情进展均具有应用价值[12]. 本研究旨在揭示AP发生及发展过程中的作用机制, 为临床治疗胰腺炎提供新方向.
本研究结果显示雨蛙肽组AR42J细胞中miR-7a-5p表达水平显著升高, 研究表明AP患者血清中miR-7表达水平明显升高并可用于早期诊断AP及评估疾病进展[13,14]. Ballegaard等[15]研究报道指出miR-7可作为全身性炎症的标志物. 本研究结果与上述文献报道结果相似, 研究报道指出胰腺腺泡细胞增殖并抑制其凋亡可降低体内炎症反应, miR-7可减轻脑出血大鼠脑炎症[16,17]. Cao等[18]研究发现长非编码RNA SNHG1通过调节miR-7/NLRP3途径促进帕金森病神经炎症. 提示miR-7a-5p表达水平异常升高可能引发AP. 本研究发现雨蛙肽组AR42J细胞活力显著低于对照组, 细胞凋亡率升高, 抑制miR-7a-5p表达可促进AR42J细胞增殖并抑制细胞凋亡. 分析原因可能为抑制miR-7a-5p表达可通过减少AR42J细胞凋亡进而缓解AP炎症反应. 提示miR-7a-5p表达水平升高可能通过促进AR42J细胞凋亡进而加重AP炎症反应. 本研究进一步探究miR-7a-5p在AP发生过程中的作用机制, 靶基因预测显示PIAS1可能为miR-7a-5p的靶基因, 双荧光素酶报告实验证明miR-7a-5p可靶向结合PIAS1, 并可负向调控PIAS1表达, 研究表明PIAS1在AP大鼠中呈低表达并与疾病严重程度呈负相关, 进一步分析发现PIAS1可通过调控STAT1等多种信号通路进而发挥抑制炎症作用[19,20]. 与上述研究报道结果相似, 本研究结果显示雨蛙肽组AR42J细胞中PIAS1表达降低, 说明PIAS1在雨蛙肽诱导的AP模型AR42J细胞中呈低表达. 探究AP发病机制发现炎症介质大量释放是引起全身炎症综合反应特征及患者死亡的主要原因[21,22]. Chen等[23]研究显示PIAS1可直接调控MAPK信号转导途径进而参与疾病发生及发展过程. 本研究结果发现PIAS1过表达可促进胰腺炎腺泡细胞AR42J增殖并抑制其凋亡, 分析原因可能为PIAS1水平升高增强其对MAPK信号转导途径的抑制作用而抑制炎症介质释放进而降低炎症反应, 但关于其是否通过MAPK信号转导途径发挥作用需深入探究.
综上所述, miR-7a-5p在AR42J细胞中呈高表达并可促进细胞凋亡、抑制细胞增殖, 本研究发现并证实miR-7a-5p可通过负向调控靶基因PIAS1表达进而促进AP发生及发展, 但关于其具体作用机制仍需进一步探索, 可为miR-7a-5p在AP发病机制中的研究及AP治疗提供理论基础.
急性胰腺炎(acute pancreatitis, AP)发病率逐年升高,严重影响患者生活质量, 目前关于AP发病机制尚未完全阐明, miRNA作为内源性非编码小RNA分子广泛分布于多种组织或器官中, 其异常表达可参与多种疾病发生及发展过程, 本研究试图寻找miRNA与AP发生及发展的相关性, 揭示其潜在作用机制, 为临床研发治疗药物或制定治疗方案提供依据.
本研究主题为揭示miR-7a-5p与AP发生及发展的相关性及其潜在作用机制, 拟解决的问题是为揭示AP致病机制提供新方向, 为进一步揭示AP致病机制提供理论依据.
本研究主要目标是揭示miR-7a-5p与活化信号转导和转录激活因子的蛋白抑制因子-1(protein inhibitor of activated signal transducer and activator of transcription 1, PIAS1)在AP致病机制的靶向关系, 可为下一步体内动物实验研究奠定基础, 对临床提高AP治疗效果提供参考.
本研究选用雨蛙肽素构建AP模型, 检测胰腺炎细胞中miR-7a-5p与PIAS1表达水平, 检测抑制miR-7a-5p表达及PIAS1过表达对细胞增殖、凋亡的影响, 双荧光素酶报告基因检测miR-7a-5p与PIAS1的靶向作用. 在胰腺炎细胞中首次验证miR-7a-5p与PIAS1的靶向关系.
本研究证实胰腺炎细胞中miR-7a-5p表达升高, PIAS1表达降低, 抑制miR-7a-5p表达或PIAS1过表达可抑制细胞凋亡, 双荧光素酶报告基因证实miR-7a-5p可负向调控靶基因PIAS1的表达活性, 抑制PIAS1表达可逆转抑制miR-7a-5p表达对细胞增殖及凋亡的作用.
本研究首次发现miR-7a-5p与PIAS1的靶向调控关系; 首次提出miR-7a-5p可负向调控PIAS1表达而参与胰腺细胞增殖及凋亡过程; 为miRNA与AP致病机制的细胞学基础提供新理论; 针对miR-7a-5p与AP的相关性可进一步进行体内实验, 还需研究其与相关信号通路的作用关系, 构建整体调控网络; 证实AP中miR-7a-5p可靶向负性调控PIAS1的表达, 为未来研究提供理论依据.
经验教训: 选用适宜浓度的雨蛙肽构建AP模型, 收集细胞及处理细胞时需谨慎小心, 避免失误, 减少失误; 未来方向: 体内实验研究, 寻找miR-7a-5p上游调控基因LncRNA或circRNA; 最佳方法: 细胞实验, 体内实验, 测序分析.
学科分类: 胃肠病学和肝病学
手稿来源地: 浙江省
同行评议报告分类
A级 (优秀): 0
B级 (非常好): 0
C级 (良好): C, C, C
D级 (一般): 0
E级 (差): 0
编辑: 马亚娟 电编:刘继红
| 2. | Lin Z, Guo J, Xue P, Huang L, Deng L, Yang X, Xia Q. Chaiqinchengqi decoction regulates necrosis-apoptosis via regulating the release of mitochondrial cytochrome c and caspase-3 in rats with acute necrotizing pancreatitis. J Tradit Chin Med. 2014;34:178-183. [PubMed] |
| 3. | Zhang XX, Deng LH, Chen WW, Shi N, Jin T, Lin ZQ, Ma Y, Jiang K, Yang XN, Xia Q. Circulating microRNA 216 as a Marker for the Early Identification of Severe Acute Pancreatitis. Am J Med Sci. 2017;353:178-186. [PubMed] [DOI] |
| 4. | Kim T, Mehta SL, Morris-Blanco KC, Chokkalla AK, Chelluboina B, Lopez M, Sullivan R, Kim HT, Cook TD, Kim JY, Kim H, Kim C, Vemuganti R. The microRNA miR-7a-5p ameliorates ischemic brain damage by repressing α-synuclein. Sci Signal. 2018;11:eaat4285. [PubMed] [DOI] |
| 5. | Lu P, Wang F, Wu J, Wang C, Yan J, Li ZL, Song JX, Wang JJ. Elevated Serum miR-7, miR-9, miR-122, and miR-141 Are Noninvasive Biomarkers of Acute Pancreatitis. Dis Markers. 2017;2017:7293459. [PubMed] [DOI] |
| 6. | 陈 平, 董 文杰, 孙 蕴伟, 姚 玮艳, 章 永平, 乔 敏敏, 袁 耀宗. PIAS1基因沉默对胰腺腺泡细胞炎症反应的影响. 中华胰腺病杂志. 2010;10:404-407. [DOI] |
| 10. | 朱 勇, 崔 建娇, 张 明智, 王 萍. 甘氨酸对重症急性胰腺炎肺组织中髓样细胞触发受体-1mRNA及高迁移率族蛋白-1表达的影响及临床意义. 中国老年学杂志. 2016;36:1055-1056. [DOI] |
| 13. | Lee HB, Park HK, Choi HJ, Lee S, Lee SJ, Lee JY, Cho EH, Han HJ, Seok JH, Son WC. Evaluation of Circulating MicroRNA Biomarkers in the Acute Pancreatic Injury Dog Model. Int J Mol Sci. 2018;19:E3048. [PubMed] [DOI] |
| 14. | Liu P, Xia L, Zhang WL, Ke HJ, Su T, Deng LB, Chen YX, Lv NH. Identification of serum microRNAs as diagnostic and prognostic biomarkers for acute pancreatitis. Pancreatology. 2014;14:159-166. [PubMed] [DOI] |
| 15. | Ballegaard V, Ralfkiaer U, Pedersen KK, Hove M, Koplev S, Brændstrup P, Ryder LP, Madsen HO, Gerstoft J, Grønbæk K, Nielsen SD. MicroRNA-210, MicroRNA-331, and MicroRNA-7 Are Differentially Regulated in Treated HIV-1-Infected Individuals and Are Associated With Markers of Systemic Inflammation. J Acquir Immune Defic Syndr. 2017;74:e104-e113. [PubMed] [DOI] |
| 16. | 付 强, 秦 涛, 刘 传江, 陈 琳, 楚 皓源, 胡 明星, 王 玉柱, 张 宏伟. 微小RNA-135a通过抑制其靶基因Sp3的表达促进大鼠胰腺腺泡细胞凋亡. 中华实验外科杂志. 2016;33:666-669. [DOI] |
| 17. | Zhang XD, Fan QY, Qiu Z, Chen S. MiR-7 alleviates secondary inflammatory response of microglia caused by cerebral hemorrhage through inhibiting TLR4 expression. Eur Rev Med Pharmacol Sci. 2018;22:5597-5604. [PubMed] [DOI] |
| 18. | Cao B, Wang T, Qu Q, Kang T, Yang Q. Long Noncoding RNA SNHG1 Promotes Neuroinflammation in Parkinson's Disease via Regulating miR-7/NLRP3 Pathway. Neuroscience. 2018;388:118-127. [PubMed] [DOI] |
| 19. | 陈 平, 赵 德寿, 孙 蕴伟, 姚 玮艳, 章 永平, 袁 耀宗. 信号转导和转录激活子1的活化抑制蛋白对急性胰腺炎的预后判断. 中华胰腺病杂志. 2012;12:250-253. [DOI] |
| 20. | Alagu J, Itahana Y, Sim F, Chao SH, Bi X, Itahana K. Tumor Suppressor p14ARF Enhances IFN-γ-Activated Immune Response by Inhibiting PIAS1 via SUMOylation. J Immunol. 2018;201:451-464. [PubMed] [DOI] |
| 21. | Habtezion A. Inflammation in acute and chronic pancreatitis. Curr Opin Gastroenterol. 2015;31:395-399. [PubMed] [DOI] |
| 22. | Cao MH, Xu J, Cai HD, Lv ZW, Feng YJ, Li K, Chen CQ, Li YY. p38 MAPK inhibition alleviates experimental acute pancreatitis in mice. Hepatobiliary Pancreat Dis Int. 2015;14:101-106. [PubMed] |