修回日期: 2019-07-11
接受日期: 2019-08-02
在线出版日期: 2019-08-28
肠神经胶质是肠神经系统的重要组成部分, 其在胃肠道的黏膜中共同组成完整的神经调节体系. 肠神经胶质细胞(enteric glial cells, EGCs)分布于肠壁的全层, 并通过多条信号转导途径参与到了神经递质和神经调质对肠道功能的调节中. 肠神经系统与肠道中的固有神经胶质细胞相互作用, 参与上皮功能的调节. 上皮细胞具有吸收和分泌的重要功能, 同时参与到了肠道的屏障中. 研究表明肠神经胶质不仅参与调控胃肠道的运动和上皮屏障功能, 还参与形成肠神经元、肠内分泌细胞、免疫细胞和上皮细胞之间的细胞分子桥. 本文主要对EGCs在肠道屏障和防御功能中的作用进展加以综述.
核心提要: 胶质细胞广泛分布于整个消化道. 具有神经营养支持和神经免疫的属性.在消化系统疾病以及非消化系统疾病中发挥不可或缺的作用. 特别是近年来发现胶质细胞在免疫调控中的作用, 成为目前消化领域备受关注的治疗靶点.
引文著录: 狄治杉, 杨泽俊, 朱敏佳, 王菲菲, 李利生, 徐敬东. 肠神经胶质细胞对肠上皮屏障的调节与功能紊乱疾病. 世界华人消化杂志 2019; 27(16): 1013-1021
Revised: July 11, 2019
Accepted: August 2, 2019
Published online: August 28, 2019
The enteric glia is an important component of the enteric nervous system and forms a broad network in the mucosa of the gastrointestinal tract. Enteric glial cells (EGC) are located in all layers of the intestinal wall and respond to neurotransmitters and neuromodulators through signal transduction pathways. The enteric nervous system interacts with resident glial cells in the gut, and there is increasing evidence that EGC are involved in the regulation of epithelial function. Epithelial cells have important absorption and secretion functions and are also involved in the formation of intestinal epithelial barrier. Studies have found that the enteric glia is not only involved in the regulation of gastrointestinal motility and epithelial barrier function, but also in the formation of cellular molecular bridges between intestinal neurons, enteroendocrine cells, immune cells, and epithelial cells. This article reviews the recent progress in the understanding of the role of EGC in the intestinal barrier and defense functions.
- Citation: Di ZS, Yang ZJ, Zhu MJ, Wang FF, Li LS, Xu JD. Regulation of intestinal epithelial barrier by and dysfunction of intestinal glial cells. Shijie Huaren Xiaohua Zazhi 2019; 27(16): 1013-1021
- URL: https://www.wjgnet.com/1009-3079/full/v27/i16/1013.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v27.i16.1013
肠神经胶质细胞(enteric glial cells, EGCs)作为肠神经系统的重要组成成分, 可将肠神经系统的各种组分粘合在一起, 在人体扮演了重要的粘合剂角色. 除此之外, EGC还具有调节肠道稳态、参与神经保护等作用, 是肠道生理功能和炎症反应的复杂相互关系中的积极参与者. EGC可以调节肠上皮屏障(intestinal epithelial barrier, IEB)的完整性, 在此过程中可作为抗原呈递细胞影响肠上皮细胞的增殖与分化. 因此, EGC在维持IEB的完整性、保持肠道微生物生态平衡和调节肠道稳态中发挥了不可替代的作用. 最近, 大量的研究表明EGCs的改变可能在肠道疾病的引发中有重要的作用. 因此, 本综述的重点将放在基础, 转化和/或临床研究支持的新兴概念上, 探讨EGCs在通讯、肠道微环境中其他细胞的相互调节以及感染和炎症中的作用. 另外在临床上, EGCs正在成为神经胃肠病学的新领域和潜在的治疗靶点.
"神经胶质"源于希腊语, 意思为肠道神经系统的粘合剂. 多年来, EGCs被认为主要提供结构支持. 然而, 作为中枢神经系统(central nervous system, CNS)中的星形胶质细胞的EGC可以在肠神经系统和胃肠功能的稳态调节中的作用不可小觑.
EGCs最早是从肠壁中发现, 但是由于研究手段的限制, 直到1971年真正开启了神经胶质的研究时代[1]. 直到20世纪70年代电子显微镜的发现, 科学家才观察到了EGCs与中枢系统的星形胶质细胞在形态学中的相似性. 在1971年将肠壁内的神经胶质细胞, 描述这种多分支, 单细胞周围没有基底膜而在整个神经节周围观察到基底膜的细胞, 确定为一种单独的细胞类型. 此后越来越多的证据表明, 肠神经系统的EGCs与CNS中的星形胶质细胞相对应. 从分子学角度看, 成熟的EGCs能表达与星形胶质细胞相似的分子标记物如: 胶质纤维酸性蛋白(glial fibrillary acidic protein, GFAP)、波形蛋白(vimentin)[1,2]、连接蛋白-43(connexin, Cx)[3]和S100β[1].
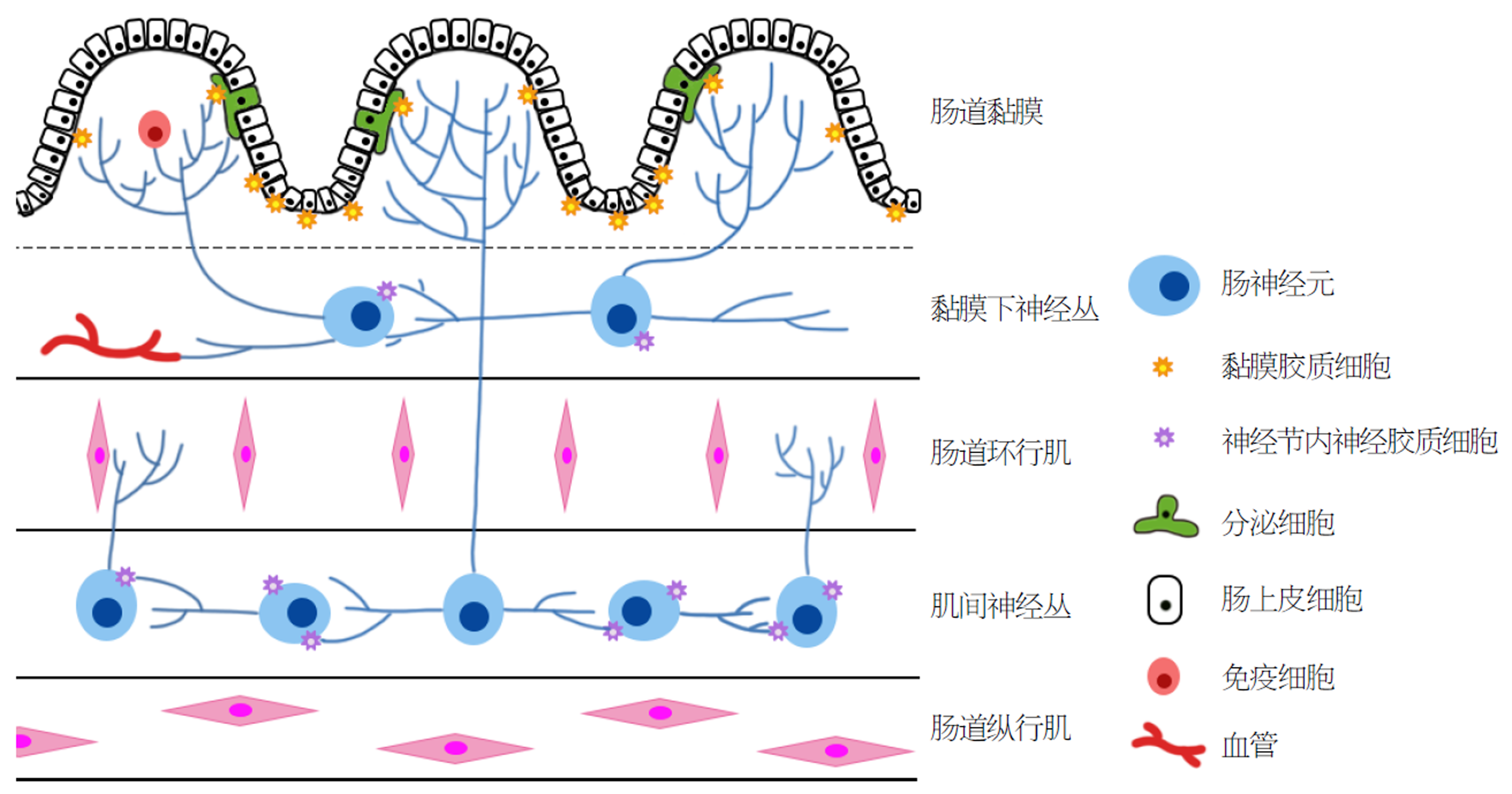
目前发现有两种主要的EGCs群, 一种位于神经节内, 称为神经节内神经胶质细胞. 其功能有: 释放生物活性分子、为神经元提供神经递质前体、螯合和降解胞外神经活性分子和接收神经递质等功能; 另一种分布于在黏膜上皮细胞下方, 与黏膜紧密连接, 广泛分布, 称为黏膜胶质细胞. 其影响着上皮细胞的分化、支持粘附、迁移、增殖等功能[4](图1). Van等[5]人通过将EGC和肠上皮细胞(intestinal epithelial cell, IEC)共培养24 h后, 发现与单独培养的IEC相比, 在用EGC培养的IEC中, IEC的116个基因表达发生变化, 其中70个发生上调, 46个发生下调. 通过使用ingenuity pathway analysis对其中116个鉴定的基因进行功能分析, 发现EGC诱导了有利于细胞-细胞、细胞-基质粘附以及细胞分化的基因表达. 并且此实验用基因芯片证明EGC诱导了IEC的细胞粘附、分化和运动加强, 这有利于促进细胞修复和减少细胞增殖的效果.
IEB由排列在胃肠道上的单层柱状上皮细胞组成. 它的机械屏障作用的功能完整性受到多种因素调节, 其中受微生物调节的报道比较多, 而EGCs在其中的作用报道比较少. 有研究表明在小鼠模型中, 敲除神经胶质可以诱导炎症和肠紊乱, 这可能与IEB有关. 由此可见正常EGC功能可能是缓解炎症的有效策略.
IEB由单层IEC组成, 受上皮细胞与肠神经和免疫系统之间的多向相互作用调节. 当这些调节出现紊乱时, 肠道微生物群可跨越上皮屏障发生易位, 肠道微生物群与宿主之间的平衡被破坏, 肠道发生紊乱, 导致疾病的发生. 电镜观察显示EGCs、肠神经元轴突和IEC之间有直接的联系, 这成为相互作用和调节的结构基础[6,7].
从微观角度上来讲, IEB主要由相邻IEC的三种连接复合物组成--紧密连接、黏着连接和桥粒[8]. 黏着连接是由跨膜蛋白E-钙粘着蛋白和细胞内成分通过E-钙粘着蛋白、细胞内成分和肌动蛋白细胞骨架(actin cytoskeleton, AC)之间的相互联系, 保持细胞形状, 维持组织整体性. 除此之外, 黏着连接的另一作用是参与组装紧密连接, 密封细胞间隙[9]. 而桥粒是跨膜蛋白桥粒芯蛋白和桥粒胶蛋白的连接复合物, 增强了组织抵抗外界压力与张力的机械强度. 黏着连接和桥粒是IEC之间的粘着剂, 为IEB提供了机械加固作用, 保持细胞间的近距离, 并且是细胞间通信的位点[8].
然而, 三种连接复合物中, 肠神经胶质影响最大的是紧密连接. 其主要作用是封闭细胞间隙, 调控细胞旁离子和溶质分子的通过. 在紧密连接的组成成分中, 最重要的跨膜蛋白属于闭合蛋白家族(closed protein family, CPF), CPF是一种组织特异性蛋白, 其决定紧密连接渗透性特性. Claudin家族成员具有相同的结构, 均由4个跨膜结构域组成, 细胞外形成2个环状结构, 氨基和羧基末端位于细胞质内, 羧基末端在信号传导上发挥重大作用, 其上存在特异性PDZ(PSD-95/DLG/ZO1)结合区, 可以和胞浆内的其他紧密连接蛋白直接相连[10], 例如ZO-1、ZO-2和ZO-3、PDZ结构蛋白-1和PALS-1关联的紧密连接蛋白. 这段序列与细胞质支架蛋白ZO-1、ZO-2相互作用, 可以使闭合蛋白与肌动蛋白间接作用, 在维持紧密连接之间的稳定性和选择性通透方面起到非常重要的作用[11].
IEB完整性对机体健康十分重要, 多种因素参与其完整性的调节. 旁细胞通透性由紧密连接和黏着连接有关F-AC的从属关系调节. 过程涉及重要的酶, 如: 肌球蛋白调节轻链激酶(myosin-regulated light chain kinase, MLCK)[12,13]、PhoA、Rac1[1]、CDC42[14,15]、蛋白激酶C[16]. MLCK可以催化肌球蛋白20KD轻链(MLC)的磷酸化并诱导紧密连接蛋白分布. 并且 MLCK的上调可能导致屏障功能障碍和IBD发病机制[17]. 相反, 使用药理学抑制剂和显性失活突变体抑制Rac1、CDC42, 发现抑制细胞增殖、IEC的恢复[18]. 除此之外, 旁细胞渗透性还由关键的紧密连接相关蛋白的转译变化调节, 如ZO-1[19-21]、闭合蛋白(occludin)或密封蛋白(claudins)[22]的磷酸化作用. 旁细胞通透性还由闭合蛋白或密封蛋白的内吞穿梭作用来调节[23]. 以上众所周知, 但是随着研究的继续深入, 发现还有其他通路参与其中. 有研究表明, 促炎细胞因子: 肿瘤坏死因子-α, 白细胞介素-1β和干扰素-γ可以通过对紧密连接的破坏引起肠道紧密连接通透性的增加, 并通过允许抗原渗透入体内以促进炎症过程[24-26]. Ye等[27]人证明了肿瘤坏死因子-α(tumor necrosis factor, TNF)诱导的增加肠上皮紧密连接通透性由NF-增加肠上皮紧密连接通结合和MLCK启动子的活化介导. 而IL-10则通过调节IEB的渗透性, 促进肠道屏障功能[28].
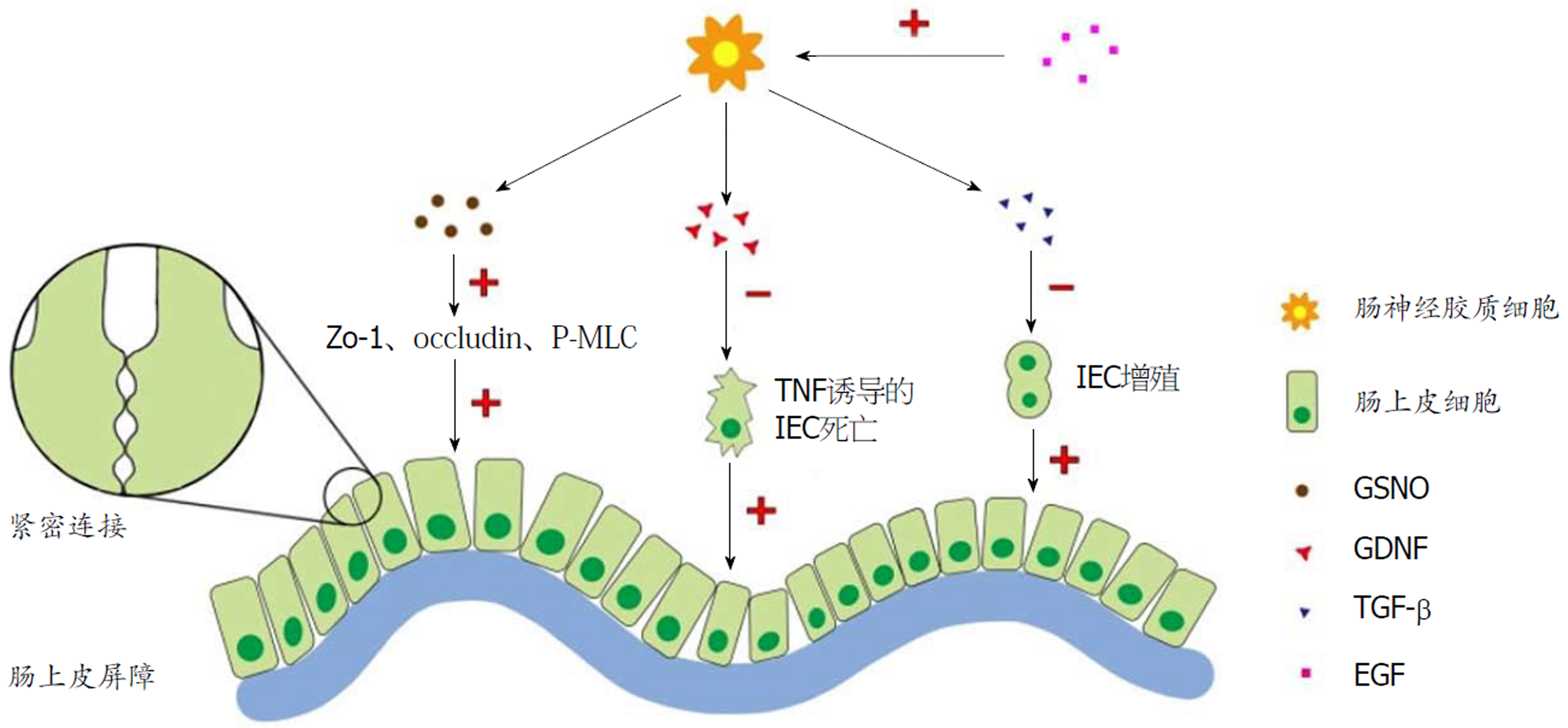
肠神经和神经胶质细胞与IEC密切关联, 并在维护上皮完整性和肠道内环境稳定功能中起关键作用. 最近的研究表明, 肠神经系统的作用特别是肠神经胶质与上皮下固有层中成纤维细胞(subepithelial myofibroblasts, ISEMF)[29], 通过调控s-亚硝基谷胱甘肽(nitrosoglutathione, GSNO)、转化生长因子β(transforming growth factor, TGF-β)等细胞因子的产生来调节IEB的功能[30-34]. GSNO是通过影响紧密连接蛋白的表达而影响IEB的功能, 而TGF则通过调节IEC的增殖而影响IEB的功能(图2).
肠神经胶质衍生的GSNO在体内外可担任黏膜屏障功能有效诱导物的角色. Savidge等[30]人发现, 在GFAP-HSVtk转基因小鼠中减少肠神经胶质可以导致组织炎症, 注射了GCV(ganciclovir, GCV)的GFAP-HSVtk转基因小鼠注射GSNO, 发现可有效降低EGC减少导致的肠道通透性的增高. 这说明GSNO在体内对黏膜屏障功能具有保护功能. 同样的Cheadle等[35]使用HT29与EGC共培养或与GSNO共培养后再加入肿瘤坏死因子-α, 白细胞介素-1β和干扰素-γ后, 发现EGC不但阻止与其共培养的上皮细胞通透性增加, 而且增加紧密连接蛋白ZO-1、occludin和磷酸化MLC(P-MLC)的表达, 降低了黏膜的通透性. 此外GSNO也有类似的作用. 以上结果提示EGCs衍生的GSNO可防止损伤后上皮屏障失效并改善紧密连接蛋白表达, 该作用与不仅与F-Actin的表达有关, 还部分地受到紧密连接相关蛋白和闭合蛋白与Actin-细胞骨架关联的影响[30]. 有趣的是, Savidge等[30]人发现, GSNO的功能与其浓度的大小有关系. 在低浓度下, GSNO促进紧密连接相关蛋白与细胞骨架结合, 而在较高浓度和潜在药理剂量下, GSNO直接破坏F-Actin的合成, 导致IEB渗透压升高. 这种现象可能与NO信号有关. 值得关注的是, 有研究表明, NO信号对上皮的屏障功能具有双向调节作用[36-38]. 这种双重作用可能与GSNO的剂量有关. 因此, 该结果提示临床医务工作者在临床上可使用低浓度的GSNO来恢复肠炎患者的IEB功能.
除了GSNO, 由EGCs合成并分泌的神经营养因子(glial cell derived neurotrophic factor, GDNF)使机体存在自我挽救机制. Fettucciari等[39]人用毒素B(toxin B, TcdB)处理大鼠的EGC, 发现在TcdB的细胞毒性作用下存活的EGC没有完全恢复, 并且不仅表现出持久的Rac1葡糖基化, 细胞周期停滞和低凋亡, 同时也增加GDNF的产生, 表明GDNF可通过降低TNF诱导的IEC死亡来维持肠炎期间的黏膜稳态.
EGCs衍生的转化生长因子β(transforming growth factor, TGFβ)可以抑制IEC增殖, 从而降低IEB通透性[6]. 小鼠通过转基因使EGC减少的同时, IEC增殖的研究表明隐窝细胞增增殖明显, 此外结肠腺癌中黏膜胶质网络间的联系显著降低. 与单独培养的Caco-2相比, 混合EGC的体外共培养模型的Caco-2细胞密度显著降低. 然而EGC可以诱导Caco-2细胞表面积显著增加. 外源性添加TGF-β1部分地复制了EGC介导的对细胞密度和表面积的影响. 当中和TGF-细抗体之后, EGC对Caco-2细胞增殖效应明显降低[6]. 这表明EGC分泌的TGF-I在抑制IEC增殖中起到关键作用. EGC的此功能的发现提示其在治疗肠道癌症治疗中的发挥的重要潜能.
除TGF-肠之外, 由EGCs释放的GSNO可抑制IEC增殖并降低IEB通透性[6,30], GSNO有维持黏膜屏障功能, 并在体内肠道胶质细胞受损时保护肠道免受炎症损伤, 同时降低CD炎症反应[30]. 弗氏志贺氏菌(Shigella freundi)是一种导致IEC的破坏和主要的肠道炎症反应的一种侵袭性病原体. 从人结肠黏膜与Shigella freundi共培养的试验中发现, GSNO可降低Shigella freundi诱导的IEB损伤[40]. 这项研究为治疗、预防与IEB功能障碍相关的胃肠道疾病, 特别在感染期疾病提供理论依据.
基于EGCs和其衍生物在IEB损坏时起到的保护作用. 有研究表明激活EGC可增强肠道屏障功能, 而刺激迷走神经可通过胆碱能信号传导增加表皮生长因子(epidermal growth factor, EGF)活性. 当Caco-2单独培育或与EGC共培养, 然后在使用或不使用烟碱胆碱能激动剂尼古丁的情况下用Cytomix刺激细胞24 h, 并通过免疫印迹评估磷酸化的NF-κF抑制剂(P-I-Iα)和磷酸化的NF-κF(P-NF-κ-)的变化. 通过GFAP表达的增加证明, 用尼古丁刺激导致EGC 活化. Cytomix刺激增加了单独或与EGCs一起培养的Caco-2 细胞的通透性. 尼古丁可使Caco-2/EGC共培养物降低渗透性. 尼古丁不能单独阻止Caco-2细胞的屏障通透性. 刺激的Caco-2细胞与尼古丁激活的EGC的共培养阻止了Cytomix诱导的P-I-Iα和P-NF-κ-表达的增加. 由此可见药理学烟碱胆碱能激动剂在肠损伤的体外模型中增加EGC 活化并改善IEB功能. 而过程有NF-κF途径的激活来调节屏障功能[41]. 当然, 一些药物会对肠神经胶质产生影响, 从而影响到肠道的正常机能, 例如阿片类药物吗啡会参与到GDNF的机制, 损害IEB的功能[42]. 这个研究提示在临床上激活EGCs的疗法有望成为改善损伤后肠屏障功能的新的治疗途径[41](图2).
除此之外, 肠道胶质细胞与IEC和肠内分泌细胞等非神经细胞相互作用在维持肠道环境的稳态中是十分重要的. 胶质细胞通过影响肠细胞的发育和成熟调节IEB的完整性[43]. 但是, 目前关于黏膜胶质细胞-肠内分泌相互作用知之甚少, 然而, 两种细胞之间的特殊结构特征提示胶质细胞可能对胃肠激素释放调节的候选细胞之一[44].
在正常条件下, IEB具有高度选择性, 可以阻止促炎分子从外部环境进入黏膜下层和血液循环. 然而, 当IEB受损内毒素或一些病原微生物通过黏膜屏障, 进入机体可引发一系列的炎性疾病. 另外, 除IBD、IBS的发生发展与肠屏障功能障碍相关性已有大量的报道, 然而近年来结肠癌、帕金森综合征与之相关性引起了高度关注.
研究表明, 长期的慢性炎症是导致癌症发病的一个重要基础. IBD、UC是结肠癌的主要风险之一, 这种疾病的发生与肠上皮受损密切相关[45]. EGC释放的TGF-β可以抑制IEC的增殖, 降低肠道癌症的发生几率, 维护IEB[46]. 与此同时有研究表明微血管和EGC之间的相关活动. 已经证明GDNF是炎症条件下肠神经元和微血管之间自分泌抗细胞凋亡环的效应物[47]. 当在暴露于致癌物的大鼠中用化学方法去肌间神经丛的神经支配, 使神经元数量减少63%, 阻止了结肠肿瘤的发展[48]. 而EGCs不仅可以引起肠神经元的生成, 还可以控制IEC的增殖. 在肠炎过程中, 胶质细胞出现变化, 而肠神经元在这种情况下数量增加, 可增加肠道癌症的发生几率[49]. 以上结果提示肠神经胶质对结肠癌的发生发展有显著影响. 由此可见激活EGC可能成为结肠癌治的新疗策略.
在过去的二十年里, 帕金森病(parkinson's disease, PD)和肠道失调存在联系这一现象已经变得越来越明显. 在某些时候, 几乎每个帕金森患者都会出现肠胃的不适, 这也是该疾病中最使人虚弱的非运动特征. 临床的数据和病理学研究也证明了肠神经系统中路易病理学(路易小体和神经突)的存在. PD的病因现在尚不清楚, 但已有证据表明慢性神经炎症可以导致神经变性[50-56]. 然而神经炎症的来源尚不清楚. 但最近通过对PD患者的研究表明, PD患者肠道对乳果糖/甘露醇比值的增高, 以及倡导紧密连接蛋白ZO-1和occludin降低, 表明肠道的通透性明显降低[57]. 同时ELISA检测发现PD患者胃肠道中神经胶质标志物GFAP和Sox-10的表达增加[58]. GFAP和Sox-10的水平与若干促炎性细胞因子的数量密切相关, 而这些促炎性细胞因子是被EGCs活化后释放. 这些观察结果支持PD期间患者胃肠道中发生胶质反应的观点. 同时发现, 神经胶质标志物的水平与疾病的持续时间呈负相关, 这表明肠道胶质细胞反应在疾病发作时高, 随后随着时间降低[58]. 当疾病发作时, 活化细胞释放其细胞因子, EGCs反应可能很高. 随后肠胶质细胞反应在保持疾病活动(如脑中小胶质细胞激活)的同时减少.
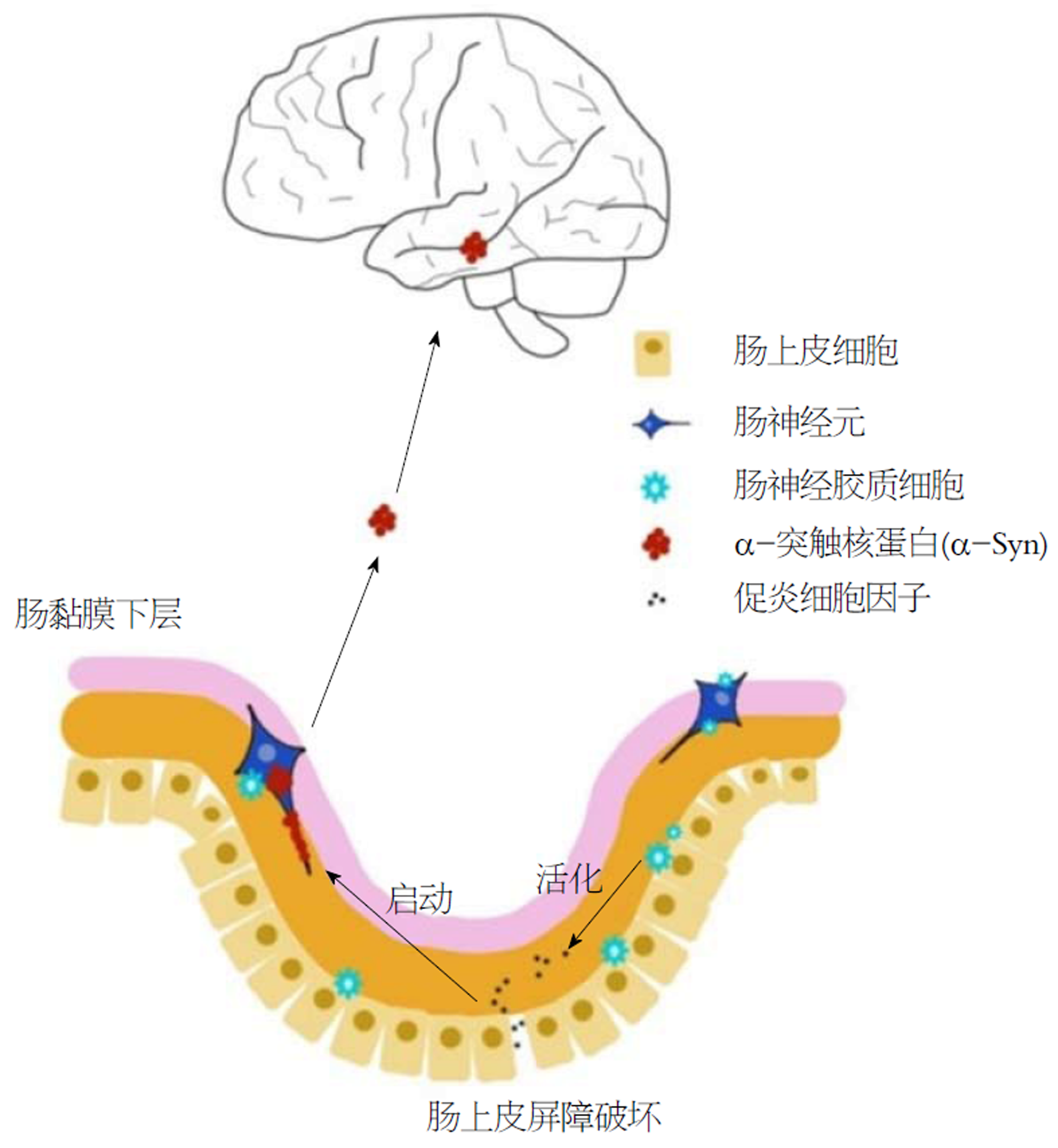
在PD中, EGCs失调的作用可能是什么呢?首先尸检结果表明, PD中肠道化学表型中没有明显的神经元丢失与改变, 这提示肠神经系统的神经病理学不太可能称为PD相关胃肠功能障碍的致病因素[59,60]. 因此人们假设, 是PD中EGCs的生化变化导致了胶质的机能失衡. 这反过来会导致突触功能障碍, 并且肠道蠕动也会改变. 这种假设已经被用于慢性便秘中[61]. 其次, PD中EGCs功能障碍支持了Braak的假设. Braak提出PD可能由某种的神经营养因子触发, 该神经营养因子破坏IEB以启动黏膜下神经丛末端轴突中的α突触核蛋白(alpha synuclein, α-Syn)聚集. 同时由于肠道过度渗透和微生物生态失调, 促炎性肠环境会引发或加剧PD发病机制(图3). 更有趣的是肠细胞外α-Syn可能的作用, 它能促进局部神经胶质细胞反应. 肠胶质细胞会反过来诱导局部促炎细胞因子的分泌和炎症, 从而促进PD的进一步加重[62-65].
总之, 肠神经胶质不仅仅是一个简单的"粘合剂". 肠神经胶质可以通过其分泌的细胞因子和紧密连接相关蛋白调节IEB的功能. 肠神经胶质产生s-GSNO、 GDNF、TGF-F增强IEB的功能. 而且EGCs还可以与非神经细胞相互作用, 维持肠道环境的稳态. 胶质细胞调节肠细胞的发育和成熟, 以维持IEB的完整性. 在临床肠神经胶质对于IEB的保护作用已成为治疗结肠癌和帕金森综合征等疾病的新靶点.
学科分类: 胃肠病学和肝病学
手稿来源地: 北京市
同行评议报告分类
A级 (优秀): 0
B级 (非常好): B
C级 (良好): C, C
D级 (一般): 0
E级 (差): 0
编辑: 崔丽君 电编:刘继红
| 1. | Neunlist M, Van Landeghem L, Mahé MM, Derkinderen P, des Varannes SB, Rolli-Derkinderen M. The digestive neuronal-glial-epithelial unit: a new actor in gut health and disease. Nat Rev Gastroenterol Hepatol. 2013;10:90-100. [PubMed] [DOI] |
| 2. | Jessen KR, Mirsky R. Astrocyte-like glia in the peripheral nervous system: an immunohistochemical study of enteric glia. J Neurosci. 1983;3:2206-2218. [PubMed] |
| 3. | McClain J, Grubišić V, Fried D, Gomez-Suarez RA, Leinninger GM, Sévigny J, Parpura V, Gulbransen BD. Ca2+ responses in enteric glia are mediated by connexin-43 hemichannels and modulate colonic transit in mice. Gastroenterology. 2014;146:497-507.e1. [PubMed] [DOI] |
| 4. | Gulbransen BD, Sharkey KA. Novel functional roles for enteric glia in the gastrointestinal tract. Nat Rev Gastroenterol Hepatol. 2012;9:625-632. [PubMed] [DOI] |
| 5. | Van Landeghem L, Mahé MM, Teusan R, Léger J, Guisle I, Houlgatte R, Neunlist M. Regulation of intestinal epithelial cells transcriptome by enteric glial cells: impact on intestinal epithelial barrier functions. BMC Genomics. 2009;10:507. [PubMed] [DOI] |
| 6. | Neunlist M, Aubert P, Bonnaud S, Van Landeghem L, Coron E, Wedel T, Naveilhan P, Ruhl A, Lardeux B, Savidge T, Paris F, Galmiche JP. Enteric glia inhibit intestinal epithelial cell proliferation partly through a TGF-beta1-dependent pathway. Am J Physiol Gastrointest Liver Physiol. 2007;292:G231-G241. [PubMed] [DOI] |
| 7. | Van Landeghem L, Chevalier J, Mahé MM, Wedel T, Urvil P, Derkinderen P, Savidge T, Neunlist M. Enteric glia promote intestinal mucosal healing via activation of focal adhesion kinase and release of proEGF. Am J Physiol Gastrointest Liver Physiol. 2011;300:G976-G987. [PubMed] [DOI] |
| 8. | Turner JR. Intestinal mucosal barrier function in health and disease. Nat Rev Immunol. 2009;9:799-809. [PubMed] [DOI] |
| 9. | Capaldo CT, Macara IG. Depletion of E-cadherin disrupts establishment but not maintenance of cell junctions in Madin-Darby canine kidney epithelial cells. Mol Biol Cell. 2007;18:189-200. [PubMed] [DOI] |
| 10. | Bazzoni G. Pathobiology of junctional adhesion molecules. Antioxid Redox Signal. 2011;15:1221-1234. [PubMed] [DOI] |
| 11. | Gonzalez JE, DiGeronimo RJ, Arthur DE, King JM. Remodeling of the tight junction during recovery from exposure to hydrogen peroxide in kidney epithelial cells. Free Radic Biol Med. 2009;47:1561-1569. [PubMed] [DOI] |
| 12. | Shen L, Black ED, Witkowski ED, Lencer WI, Guerriero V, Schneeberger EE, Turner JR. Myosin light chain phosphorylation regulates barrier function by remodeling tight junction structure. J Cell Sci. 2006;119:2095-2106. [PubMed] [DOI] |
| 13. | Su L, Shen L, Clayburgh DR, Nalle SC, Sullivan EA, Meddings JB, Abraham C, Turner JR. Targeted epithelial tight junction dysfunction causes immune activation and contributes to development of experimental colitis. Gastroenterology. 2009;136:551-563. [PubMed] [DOI] |
| 14. | Bruewer M, Hopkins AM, Hobert ME, Nusrat A, Madara JL. RhoA, Rac1, and Cdc42 exert distinct effects on epithelial barrier via selective structural and biochemical modulation of junctional proteins and F-actin. Am J Physiol Cell Physiol. 2004;287:C327-C335. [PubMed] [DOI] |
| 15. | Rojas R, Ruiz WG, Leung SM, Jou TS, Apodaca G. Cdc42-dependent modulation of tight junctions and membrane protein traffic in polarized Madin-Darby canine kidney cells. Mol Biol Cell. 2001;12:2257-2274. [PubMed] [DOI] |
| 16. | Ivanov AI, Samarin SN, Bachar M, Parkos CA, Nusrat A. Protein kinase C activation disrupts epithelial apical junctions via ROCK-II dependent stimulation of actomyosin contractility. BMC Cell Biol. 2009;10:36. [PubMed] [DOI] |
| 17. | Blair SA, Kane SV, Clayburgh DR, Turner JR. Epithelial myosin light chain kinase expression and activity are upregulated in inflammatory bowel disease. Lab Invest. 2006;86:191-201. [PubMed] [DOI] |
| 18. | Babbin BA, Jesaitis AJ, Ivanov AI, Kelly D, Laukoetter M, Nava P, Parkos CA, Nusrat A. Formyl peptide receptor-1 activation enhances intestinal epithelial cell restitution through phosphatidylinositol 3-kinase-dependent activation of Rac1 and Cdc42. J Immunol. 2007;179:8112-8121. [PubMed] |
| 19. | Chen Yh, Lu Q, Schneeberger EE, Goodenough DA. Restoration of tight junction structure and barrier function by down-regulation of the mitogen-activated protein kinase pathway in ras-transformed Madin-Darby canine kidney cells. Mol Biol Cell. 2000;11:849-862. [PubMed] [DOI] |
| 20. | Ciccocioppo R, Finamore A, Ara C, Di Sabatino A, Mengheri E, Corazza GR. Altered expression, localization, and phosphorylation of epithelial junctional proteins in celiac disease. Am J Clin Pathol. 2006;125:502-511. [PubMed] [DOI] |
| 21. | Resta-Lenert S, Smitham J, Barrett KE. Epithelial dysfunction associated with the development of colitis in conventionally housed mdr1a-/- mice. Am J Physiol Gastrointest Liver Physiol. 2005;289:G153-G162. [PubMed] [DOI] |
| 22. | Findley MK, Koval M. Regulation and roles for claudin-family tight junction proteins. IUBMB Life. 2009;61:431-437. [PubMed] [DOI] |
| 23. | Ivanov AI, Nusrat A, Parkos CA. Endocytosis of epithelial apical junctional proteins by a clathrin-mediated pathway into a unique storage compartment. Mol Biol Cell. 2004;15:176-188. [PubMed] [DOI] |
| 24. | Al-Sadi R, Ye D, Dokladny K, Ma TY. Mechanism of IL-1beta-induced increase in intestinal epithelial tight junction permeability. J Immunol. 2008;180:5653-5661. [PubMed] |
| 25. | Ma TY, Iwamoto GK, Hoa NT, Akotia V, Pedram A, Boivin MA, Said HM. TNF-alpha-induced increase in intestinal epithelial tight junction permeability requires NF-kappa B activation. Am J Physiol Gastrointest Liver Physiol. 2004;286:G367-G376. [PubMed] [DOI] |
| 26. | Nusrat A, Turner JR, Madara JL. Molecular physiology and pathophysiology of tight junctions. IV. Regulation of tight junctions by extracellular stimuli: nutrients, cytokines, and immune cells. Am J Physiol Gastrointest Liver Physiol. 2000;279:G851-G857. [PubMed] [DOI] |
| 27. | Ye D, Ma I, Ma TY. Molecular mechanism of tumor necrosis factor-alpha modulation of intestinal epithelial tight junction barrier. Am J Physiol Gastrointest Liver Physiol. 2006;290:G496-G504. [PubMed] [DOI] |
| 28. | Mazzon E, Puzzolo D, Caputi AP, Cuzzocrea S. Role of IL-10 in hepatocyte tight junction alteration in mouse model of experimental colitis. Mol Med. 2002;8:353-366. [PubMed] |
| 29. | Lei NY, Jabaji Z, Wang J, Joshi VS, Brinkley GJ, Khalil H, Wang F, Jaroszewicz A, Pellegrini M, Li L, Lewis M, Stelzner M, Dunn JC, Martín MG. Intestinal subepithelial myofibroblasts support the growth of intestinal epithelial stem cells. PLoS One. 2014;9:e84651. [PubMed] [DOI] |
| 30. | Savidge TC, Newman P, Pothoulakis C, Ruhl A, Neunlist M, Bourreille A, Hurst R, Sofroniew MV. Enteric glia regulate intestinal barrier function and inflammation via release of S-nitrosoglutathione. Gastroenterology. 2007;132:1344-1358. [PubMed] [DOI] |
| 31. | Rühl A, Franzke S, Collins SM, Stremmel W. Interleukin-6 expression and regulation in rat enteric glial cells. Am J Physiol Gastrointest Liver Physiol. 2001;280:G1163-G1171. [PubMed] [DOI] |
| 32. | Neunlist M, Toumi F, Oreschkova T, Denis M, Leborgne J, Laboisse CL, Galmiche JP, Jarry A. Human ENS regulates the intestinal epithelial barrier permeability and a tight junction-associated protein ZO-1 via VIPergic pathways. Am J Physiol Gastrointest Liver Physiol. 2003;285:G1028-G1036. [PubMed] [DOI] |
| 33. | Al-Sadi R, Ye D, Boivin M, Guo S, Hashimi M, Ereifej L, Ma TY. Interleukin-6 modulation of intestinal epithelial tight junction permeability is mediated by JNK pathway activation of claudin-2 gene. PLoS One. 2014;9:e85345. [PubMed] [DOI] |
| 34. | von Boyen GB, Steinkamp M, Geerling I, Reinshagen M, Schäfer KH, Adler G, Kirsch J. Proinflammatory cytokines induce neurotrophic factor expression in enteric glia: a key to the regulation of epithelial apoptosis in Crohn's disease. Inflamm Bowel Dis. 2006;12:346-354. [PubMed] [DOI] |
| 35. | Cheadle GA, Costantini TW, Lopez N, Bansal V, Eliceiri BP, Coimbra R. Enteric glia cells attenuate cytomix-induced intestinal epithelial barrier breakdown. PLoS One. 2013;8:e69042. [PubMed] [DOI] |
| 36. | Gookin JL, Duckett LL, Armstrong MU, Stauffer SH, Finnegan CP, Murtaugh MP, Argenzio RA. Nitric oxide synthase stimulates prostaglandin synthesis and barrier function in C. parvum-infected porcine ileum. Am J Physiol Gastrointest Liver Physiol. 2004;287:G571-G581. [PubMed] [DOI] |
| 37. | Han X, Fink MP, Yang R, Delude RL. Increased iNOS activity is essential for intestinal epithelial tight junction dysfunction in endotoxemic mice. Shock. 2004;21:261-270. [PubMed] [DOI] |
| 38. | Lee NP, Mruk DD, Wong CH, Cheng CY. Regulation of Sertoli-germ cell adherens junction dynamics in the testis via the nitric oxide synthase (NOS)/cGMP/protein kinase G (PRKG)/beta-catenin (CATNB) signaling pathway: an in vitro and in vivo study. Biol Reprod. 2005;73:458-471. [PubMed] [DOI] |
| 39. | Fettucciari K, Ponsini P, Gioè D, Macchioni L, Palumbo C, Antonelli E, Coaccioli S, Villanacci V, Corazzi L, Marconi P, Bassotti G. Enteric glial cells are susceptible to Clostridium difficile toxin B. Cell Mol Life Sci. 2017;74:1527-1551. [PubMed] [DOI] |
| 40. | Flamant M, Aubert P, Rolli-Derkinderen M, Bourreille A, Neunlist MR, Mahé MM, Meurette G, Marteyn B, Savidge T, Galmiche JP, Sansonetti PJ, Neunlist M. Enteric glia protect against Shigella flexneri invasion in intestinal epithelial cells: a role for S-nitrosoglutathione. Gut. 2011;60:473-484. [PubMed] [DOI] |
| 41. | Cheadle GA, Costantini TW, Bansal V, Eliceiri BP, Coimbra R. Cholinergic signaling in the gut: a novel mechanism of barrier protection through activation of enteric glia cells. Surg Infect (Larchmt). 2014;15:387-393. [PubMed] [DOI] |
| 42. | Bauman BD, Meng J, Zhang L, Louiselle A, Zheng E, Banerjee S, Roy S, Segura BJ. Enteric glial-mediated enhancement of intestinal barrier integrity is compromised by morphine. J Surg Res. 2017;219:214-221. [PubMed] [DOI] |
| 43. | Meir M, Flemming S, Burkard N, Wagner J, Germer CT, Schlegel N. The glial cell-line derived neurotrophic factor: a novel regulator of intestinal barrier function in health and disease. Am J Physiol Gastrointest Liver Physiol. 2016;310:G1118-G1123. [PubMed] [DOI] |
| 44. | Bohórquez DV, Samsa LA, Roholt A, Medicetty S, Chandra R, Liddle RA. An enteroendocrine cell-enteric glia connection revealed by 3D electron microscopy. PLoS One. 2014;9:e89881. [PubMed] [DOI] |
| 45. | Waldner MJ, Wirtz S, Jefremow A, Warntjen M, Neufert C, Atreya R, Becker C, Weigmann B, Vieth M, Rose-John S, Neurath MF. VEGF receptor signaling links inflammation and tumorigenesis in colitis-associated cancer. J Exp Med. 2010;207:2855-2868. [PubMed] [DOI] |
| 46. | Moradi-Marjaneh R, Khazaei M, Ferns GA, Aghaee-Bakhtiari SH. The Role of TGF-β Signaling Regulatory MicroRNAs in the Pathogenesis of Colorectal Cancer. Curr Pharm Des. 2018;24:4611-4618. [PubMed] [DOI] |
| 47. | Steinkamp M, Schulte N, Spaniol U, Pflüger C, Hartmann C, Kirsch J, von Boyen GB. Brain derived neurotrophic factor inhibits apoptosis in enteric glia during gut inflammation. Med Sci Monit. 2012;18:BR117-BR122. [PubMed] |
| 48. | Garcia SB, Oliveira JS, Pinto LZ, Muccillo G, Zucoloto S. The relationship between megacolon and carcinoma of the colon: an experimental approach. Carcinogenesis. 1996;17:1777-1779. [PubMed] |
| 49. | Margolis KG, Stevanovic K, Karamooz N, Li ZS, Ahuja A, D'Autréaux F, Saurman V, Chalazonitis A, Gershon MD. Enteric neuronal density contributes to the severity of intestinal inflammation. Gastroenterology. 2011;141:588-598, 598.e1-598.e2. [PubMed] [DOI] |
| 50. | Bartels AL, Leenders KL. Neuroinflammation in the pathophysiology of Parkinson's disease: evidence from animal models to human in vivo studies with [11C]-PK11195 PET. Mov Disord. 2007;22:1852-1856. [PubMed] [DOI] |
| 51. | Block ML, Hong JS. Microglia and inflammation-mediated neurodegeneration: multiple triggers with a common mechanism. Prog Neurobiol. 2005;76:77-98. [PubMed] [DOI] |
| 52. | Hirsch EC, Hunot S. Neuroinflammation in Parkinson's disease: a target for neuroprotection? Lancet Neurol. 2009;8:382-397. [PubMed] [DOI] |
| 53. | McGeer PL, McGeer EG. Inflammation and neurodegeneration in Parkinson's disease. Parkinsonism Relat Disord. 2004;10 Suppl 1:S3-S7. [PubMed] [DOI] |
| 54. | Norden DM, Muccigrosso MM, Godbout JP. Microglial priming and enhanced reactivity to secondary insult in aging, and traumatic CNS injury, and neurodegenerative disease. Neuropharmacology. 2015;96:29-41. [PubMed] [DOI] |
| 55. | Sekiyama K, Sugama S, Fujita M, Sekigawa A, Takamatsu Y, Waragai M, Takenouchi T, Hashimoto M. Neuroinflammation in Parkinson's Disease and Related Disorders: A Lesson from Genetically Manipulated Mouse Models of ¦Á-Synucleinopathies. Parkinsons Dis. 2012;2012:271732. [PubMed] [DOI] |
| 56. | Xanthos DN, Sandkühler J. Neurogenic neuroinflammation: inflammatory CNS reactions in response to neuronal activity. Nat Rev Neurosci. 2014;15:43-53. [PubMed] [DOI] |
| 57. | Clairembault T, Leclair-Visonneau L, Coron E, Bourreille A, Le Dily S, Vavasseur F, Heymann MF, Neunlist M, Derkinderen P. Structural alterations of the intestinal epithelial barrier in Parkinson's disease. Acta Neuropathol Commun. 2015;3:12. [PubMed] [DOI] |
| 58. | Devos D, Lebouvier T, Lardeux B, Biraud M, Rouaud T, Pouclet H, Coron E, Bruley des Varannes S, Naveilhan P, Nguyen JM, Neunlist M, Derkinderen P. Colonic inflammation in Parkinson's disease. Neurobiol Dis. 2013;50:42-48. [PubMed] [DOI] |
| 59. | Annerino DM, Arshad S, Taylor GM, Adler CH, Beach TG, Greene JG. Parkinson's disease is not associated with gastrointestinal myenteric ganglion neuron loss. Acta Neuropathol. 2012;124:665-680. [PubMed] [DOI] |
| 60. | Lebouvier T, Neunlist M, Bruley des Varannes S, Coron E, Drouard A, N'Guyen JM, Chaumette T, Tasselli M, Paillusson S, Flamand M, Galmiche JP, Damier P, Derkinderen P. Colonic biopsies to assess the neuropathology of Parkinson's disease and its relationship with symptoms. PLoS One. 2010;5:e12728. [PubMed] [DOI] |
| 61. | Bassotti G, Villanacci V, Maurer CA, Fisogni S, Di Fabio F, Cadei M, Morelli A, Panagiotis T, Cathomas G, Salerni B. The role of glial cells and apoptosis of enteric neurones in the neuropathology of intractable slow transit constipation. Gut. 2006;55:41-46. [PubMed] [DOI] |
| 62. | Lema Tomé CM, Tyson T, Rey NL, Grathwohl S, Britschgi M, Brundin P. Inflammation and α-synuclein's prion-like behavior in Parkinson's disease--is there a link. Mol Neurobiol. 2013;47:561-574. [PubMed] [DOI] |
| 63. | Neunlist M, Rolli-Derkinderen M, Latorre R, Van Landeghem L, Coron E, Derkinderen P, De Giorgio R. Enteric glial cells: recent developments and future directions. Gastroenterology. 2014;147:1230-1237. [PubMed] [DOI] |
| 64. | Grubišić V, Verkhratsky A, Zorec R, Parpura V. Enteric glia regulate gut motility in health and disease. Brain Res Bull. 2018;136:109-117. [PubMed] [DOI] |
| 65. | Chow AK, Gulbransen BD. Potential roles of enteric glia in bridging neuroimmune communication in the gut. Am J Physiol Gastrointest Liver Physiol. 2017;312:G145-G152. [PubMed] [DOI] |