修回日期: 2019-07-03
接受日期: 2019-08-02
在线出版日期: 2019-08-28
脑肠轴是消化道和中枢神经系统的生物化学信号, 控制着肠和脑之间的双向信息交流系统,由免疫、迷走神经和神经内分泌途径构成. 脑肠肽(brain-gut peptide, BGP)是脑肠轴中调节胃肠功能、参与调节胃肠生理活动一种小分子多肽, 在脑肠互动中调控胃肠道疾病发挥重要作用. 而胃肠肽类激素作为BGP的分子基础, 不仅作用于胃肠道功能运动, 还通过炎症反应、免疫反应等影响全身的代谢、心血管功能甚至人类行为. 本文对胃肠肽类激素与脑肠轴之间的相互作用机制作一综述, 期望能对相关疾病治疗提供线索及思路.
核心提要: 本文梳理了近年来关于胃肠肽类激素与中枢神经系统和肠道神经系统双向交互影响(脑肠轴)之间相关关系的研究. 并从疾病发生发展角度进一步分析了胃肠肽类激素在其中的作用及可能的治疗效果.
引文著录: 刘娅薇, 惠华英, 谭周进. 脑肠轴传输中的胃肠肽类激素. 世界华人消化杂志 2019; 27(16): 1007-1012
Revised: July 3, 2019
Accepted: August 2, 2019
Published online: August 28, 2019
The brain-intestinal axis is the interaction between biochemical signals of the digestive tract and the central nervous system, controls the two-way information exchange between the intestine and brain, and is composed of immune, vagus nerve, and neuroendocrine pathways. Brain-gut peptide (BGP) is a small molecule polypeptide that regulates gastrointestinal function and participates in regulating gastrointestinal physiological activities in the brain-intestinal axis, and is involved in the pathogenesis of gastrointestinal diseases by regulating brain-intestinal interaction. As a molecular basis of BGP, gastrointestinal peptide hormones not only affect the functional movement of the gastrointestinal tract, but also regulate the metabolism, cardiovascular function, and even human behavior of the whole body through inflammatory reactions and immune responses. This article reviews the interaction between gastrointestinal peptide hormones and the brain-intestinal axis, with an aim to provide clues and ideas for the treatment of related diseases.
- Citation: Liu YW, Hui HY, Tan ZJ. Gastrointestinal peptide hormones associated with brain-intestinal axis. Shijie Huaren Xiaohua Zazhi 2019; 27(16): 1007-1012
- URL: https://www.wjgnet.com/1009-3079/full/v27/i16/1007.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v27.i16.1007
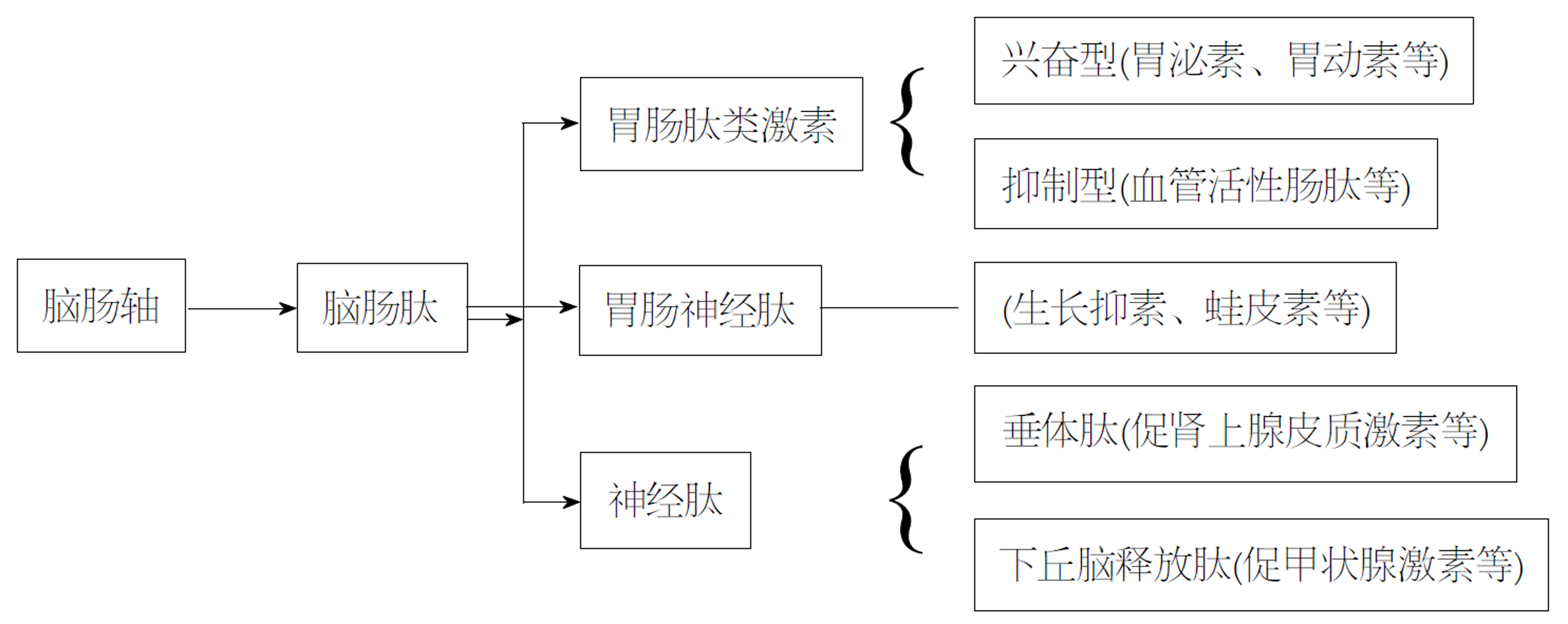
从广义上说, 脑肠轴是连接感情中枢与神经内分泌、肠神经系统和免疫系统的双向交通枢纽. 脑肠肽(brain-gut peptide, BGP)在胃肠和神经系统中双重分布, 由多种具有神经递质和激素双重功能的小分子多肽影响脑肠轴各个环节的交互作用. 目前已发现的BGP有60多种[1], BGP在脑肠轴中介导细胞间信息传递, 发挥激素和局部递质效应, 起到搭建连接桥梁和调控功能的作用, 亦可直接作用于胃肠道感觉神经末梢或平滑肌细胞的相应受体而调节胃肠道功能[2]. BGP主要分为胃肠肽类激素、胃肠神经肽、神经肽3类[1]. 其中胃肠肽类激素可分为兴奋型和抑制型两类, 这些递质相互作用、相互影响, 共同发挥调节作用. 近年来, 胃肠肽类激素的基础研究向临床应用的转化取得了前所未有的进展, 在对胃肠肽类激素与疾病发病及预后的基础研究中, 或许调节胃肠肽类激素能成为新型的辅助治疗方法. 本文综述了近年来胃肠肽类激素的检测方法、分布位置、合成途径以及对脑肠轴的作用过程和保护机制. 本文从胃肠肽类激素的检测方法、分布位置、合成途径及作用机制来阐明其水平变化对脑肠轴的影响(图1).
胃动素(motilin, MTL)是由近端小肠Mo细胞分泌的胃肠道肽激素, 主要分布在十二指肠和上端空肠, 同时也存在于大脑、外周神经和肠壁内神经等神经系统中[3]. 研究表明[4]脑梗死急性期中脑组织水肿及颅内压增高, 引起丘脑下部自主神经功能紊乱, 十二指肠酸化均可刺激MTL分泌. MTL的动态变化说明了胃肠损伤与脑梗死神经中枢的变化有密切相关性. 研究指出MTL水平降低下降会导致胃收缩减弱或消化间期肌电活动III相收缩缺乏, MTL通过影响消化间期复合肌电活动III相, 升高胃肠道平滑肌细胞内Ca2+浓度, 加强胃平滑肌收缩, 促进小肠蠕动, 缩短内容物在小肠的传送时间, 调节胃肠道运动及水电解质转运[5]. MTL受体能够诱导血管平滑肌收缩, 在胃黏膜上的平滑肌细胞和神经细胞内存在直接发生的相互作用[6]. 该物质可以用放射免疫分析法[1]检测.
胃泌素(gastrin, GAS)是由十二指肠、胃窦及空肠黏膜中的1/3的G细胞分泌的胃肠道多肽激素, 同时也存在于中枢神经系统的下丘脑和延髓迷走神经背核[7]. GAS是目前唯一均能在中枢神经系统、肠神经系统和外周神经3个水平上兴奋胃肠道运动的BGP. GAS是公认与胃溃疡发病有密切关系的指标. GAS可直接刺激壁细胞或通过产生组胺作用于壁细胞增加胃酸的分泌, 促进胃肠黏膜细胞生长并能营养胃黏膜和壁细胞, 促进胃肠运动与收缩, 增加应激性溃疡的发生发展[8]. 近年研究表明[9]脑梗塞后的脑组织破坏及颅内压增高, 使迷走神经高度兴奋, 过度释放乙酰胆碱及GAS释放肽, 从而引起GAS分泌增加. 此外GAS参与胃黏膜炎症反应, 刺激正常黏膜组织的生长修复, 促进细胞因子和炎症介质的表达、释放[10]; GAS亦可与胃窦平滑肌细胞的受体相结合, 使胃窦和幽门括约肌进行舒缩活动. 该物质可以用放射免疫法[10]检测.
P物质(substance P, SP)是最早发现的神经肽, 以十二指肠和结肠含量丰富. 在消化系统中SP主要以D细胞旁分泌的形式产生, 是维持胃肠激素环境稳定的重要BGP[11]. SP可直接作用于平滑肌纤维, 激活胃肠道胆碱能神经元、增强乙酰胆碱效应, 促进食管下括约肌及胃肠平滑肌收缩. 最近研究表明SP可以通过激活肌内神经节非胆碱能传递而增强其收缩效能[12]. SP可以通过下调炎症因子来减轻肠损伤、恢复隐窝结构, 保持肠屏障完整[13]. 研究发现[14]在肠道低度炎性状态下, 肥大细胞(mast cell, MC)易被活化, 产生类胰蛋白酶等物质刺激兴奋性递质SP等相关神经肽的释放, 导致内脏高敏感性症状出现. SP作为内脏感觉神经递质可启动活化和致敏机制的级联效应, 并向中枢神经系统传递伤害性疼痛信息. 该物质可用免疫组织化学方法[14]检测.
5-羟色胺(5-hydroxytryptamine, 5-HT)是一种参与中枢神经系统和胃肠道活动的神经递质[15]. 肠嗜铬细胞(enterochromaffin cells, EC)摄取色氨酸后, 先在羟化酶的催化下生成5-羟色氨酸, 然后通过5-羟色氨酸脱羧酶作用形成5-HT储存于囊泡内[16]. 在双向的脑-肠相互作用中, 5-HT为其重要的神经递质和信号分子. 5-HT对肠道功能的具体调节作用方式有以下3种: (1) 5-HT通过5-HT2B受体直接作用于肠道黏膜上皮细胞或平滑肌细胞调节结肠的分泌及运动[17]; (2) 5-HT1、5-HT7受体可通过作用于中间神经元及内源性传入神经元, 参与并调节肠道的分泌、蠕动反射[18]; (3) 通过作用于外源性传入神经元上的5-HT3、5-HT4受体, 增加细胞内Ca2+的浓度, 调节中枢神经和外周神经元的兴奋性, 导致内脏高敏感性和腹部不适等胃肠道功能异常, 从而将不适感觉信号传入中枢神经系统[16]. 该物质可以用免疫组化法检测[19](表1).
| 名称 | 分布位置 | 功能作用 | 检测方法 | |
| 兴奋型胃肠肽类激素 | MTL | 十二指肠和上端空肠, 大脑、外周神经和肠壁内神经等神经系统 | 促进和影响胃肠运动及胃肠道对水、电解质的运输 | 放射免疫法 |
| GAS | 十二指肠、胃窦及空肠黏膜中的1/3的G细胞 | 刺激胃窦与肠运动, 延缓胃排空 | 放射免疫法 | |
| SP | 十二指肠和结肠, 以D细胞旁分泌的形式产生 | 传递痛觉信息, 向脑内痛觉中枢传递痛觉信息 | 免疫组化法 | |
| 5-HT | 约90%合成和分布于肠嗜铬细胞 | 参与神经系统和胃肠道活动 | 免疫组化法 | |
| 抑制型胃肠肽类激素制型胃肠肽类激素 | CCK | 小肠黏膜i细胞分泌产生 | 刺激胃酸分泌, 抑制吸收 | ELISA法 |
| VIP | 神经系统, 以黏膜下层为最多 | 舒张肠道平滑肌 | 免疫组化法 | |
| NPY | 胃、食管下和肛门内外括约肌及支配小肠肠系膜的神经纤维中 | 抑制胃的收缩和排空, 舒张肠道平滑肌, 抑制结肠动力 | 放射免疫法 | |
| SS | 胃窦和十二指肠及小肠和结肠 | 保护胃黏膜, 减少毛细血管通透性, 降低肠黏膜水肿 | 放射免疫法 | |
| CGRP | 广泛分布于中枢及外周神经系统, 主要分布于内脏感觉神经中 | 降低内脏的敏感性, 抑制胃酸分泌及胃肠运动 | 放射免疫法 |
胆囊收缩素(cholecystokin, CCK)是一种由小肠黏膜i细胞分泌产生的激素, 通过多种分泌作用于消化系统、中枢及外周神经系统的BGP, CCK是通过对肽CCK基因的翻译后修饰产生的, 由三肽酶II在内的酶灭活[20]. CCK在胃肠道中主要通过作用于幽门及胃平滑肌上CCK-A受体, 使胃排空延缓、抑制食欲及摄食减少出现肠胃运动障; 在中枢调节方面, 通过迷走反射以及中枢边缘系统舒张近端胃、提高幽门括约肌张力[21]. 介导CCK抑制摄食活动的主要途径是迷走传入神经途径[22], CCK可通过组织液的扩散作用进入机体微循环; 另一部分则与迷走神经传入末梢的CCK1R受体结合后, 影响了后脑中神经元产生饱感信号[23]. 该物质可以用ELISA分析[24]检测.
血管活性肠肽(vasoactive intestinal peptide, VIP)是一个由28个氨基酸残基构成的多肽, 由中枢神经系统和胰岛D1细胞分泌, 副交感神经节后纤维和免疫细胞所释放, 广泛分布于中枢及外周神经系统, 以黏膜下层为最多[25]. 研究发现VIP神经元可以直接激活上皮隐窝细胞调节肠道离子和液体, 维持上皮屏障稳态[26]. Conlin等[27]研究发现VIP可以改善由柠檬酸杆菌引起的结肠炎所导致的肠屏障损伤, 并诱导细胞旁通透性增加, 进一步维持肠屏障完整性. VIP有引起消化道环形肌松弛的独特能力, 能促进NO合成从而引起环形肌舒张, 而NO则能使易于VIP释放, 与一氧化氮合酶共存于肌间神经丛及黏膜下神经丛[28]. 另外有研究[29]表明VIP对肠神经丛具有抗应激和稳定作用, VIP含量降低易发生肠道蠕动性收缩, 同时减小对肠道动力抑制作用, 使肠神经应激性增强. 该物质可用免疫组织化学方法[30]检测.
酪神经肽(neuropeptide Y, NPY)是一种含有36个氨基酸残基的BGP. 消化系统中NPY主要分布于胃、食管下和肛门内外括约肌及支配小肠肠系膜的神经纤维中[31]. 下丘脑中的NPY来源于弓状核中含有NPY的纤维束, 可参与调节下丘脑激素的释放, 下丘脑室旁核释放促肾上腺皮质激素, 使得这两个祌经肽系统之间可实现交流[32]. 研究[33]认为NPY通过G蛋白相关膜受体与配体结合发挥作用, NPY与Y1或Y5受体结合后产生的信号抑制交感神经兴奋, 此外NPY与肠黏膜下神经节中的周围性胆碱乙酰转移酶相结合发挥作用能抑制胃的收缩和排空, 舒张小肠及结肠平滑肌, 抑制结肠的动力[34]. 该物质可以用放射免疫法[10]检测.
生长抑素(somatostatin, SS)是一个由14个氨基酸残基构成的短肽, 在胃肠道主要分布在胃窦和十二指肠及小肠和结肠. SS在消化系统主要由D细胞分泌[11]. SS与体内多种神经递质共存: SS通过调节G细胞GAS的分泌, 抑制CCK、MOT等胃肠激素的分泌和释放, 对胃肠道进行直接和间接调节作用[35]. 研究发现SS在通过诱导或抑制炎症因子调节肠上皮细胞的黏膜炎症反应. 亦有研究证明[36]SS通过抑制猕猴回肠上皮细胞分泌IFN-γ间接阻止肥大细胞脱颗粒, 减少毛细血管通透性, 降低肠黏膜水肿, 维持结肠上皮细胞完整性改善肠缺血再灌注引起的全身炎症反应. 同时SS能够全面增强谷胱甘肽过氧化物酶系统的功能, 以维持黏膜内非蛋白结合巯基含量, 从而加强胃黏膜对氧自由基及其引起的脂质过氧化产物的清除能力, 以实现其胃黏膜保护作用. 该物质可以用放射免疫法测定[37]检测.
降钙素基因相关肽(calcitonin gene related peptide, CGRP)是由37个氨基酸组成的促炎症性感觉性神经肽, 广泛分布于中枢及外周神经系统, 其中主要分布于内脏感觉神经. 肠道中的CGRP主要有2种来源途径[38]: 一种为黏膜下血管壁的脊髓传入神经, 另一种为肠壁其他各层的壁内神经. CGRP发挥生物学效应的机制是通过与其相互关联的受体相互作用而产生的, CGRP受体主要存在血管内膜和中膜中由降钙素受体样受体、受体活性修饰蛋白质和受体组分蛋白质三部分组成[39], CGRP与其相关的受体结合后, 腺苷酸环化酶被激活, 升高细胞内环磷酸腺苷水平, 进而促使细胞膜上的腺嘌呤核苷三磷酸敏感的钾离子通道被激活, 促使细胞膜发生超极化反应, 从而使电压依赖性钙离子通道关闭, 使细胞内Ca2+浓度降低, 从而发挥其效应[40]; 其次在痛觉的产生与传递过程中, CGRP作为神经调节介质在内脏疼痛调节中起重要作用, 可以通过调节脊髓初级传入神经元NKR1表达, 降低血浆CGRP的水平, 减弱背角神经元兴奋性, 提高内脏的痛阈[41], 降低内脏的敏感性, 也可以抑制胃酸分泌及胃肠运动[42]; 最后CGRP在扩张血管、抑制细胞过度增殖等方面的作用是通过刺激内皮细胞增加一氧化氮等舒血管因子的释放来实现的[43]. 该物质可以用放射免疫法测定检测[37].
综上所述, 近年来研究发现通过脑-肠轴进行沟通并调节肠道功能及大脑的发育和改变宿主的行为, 也重新阐释了众多疾病尤其是代谢性疾病和精神异常性疾病的发生机制, 也为其治疗及研究提供了新的方向. BGP分子胃肠肽类激素在参与脑肠轴功能中发挥着重要的生理功能, 通过自身调节与多种受体作用, 参与了胃肠道功能的调控和中枢系统的传导. 但关于BGP在脑肠轴中发挥作用的具体调节机制尚需要进一步深入研究及完善, 这将为临床预防、治疗及新药物的研发提供理论依据.
学科分类: 胃肠病学和肝病学
手稿来源地: 湖南省
同行评议报告分类
A级 (优秀): 0
B级 (非常好): B
C级 (良好): C
D级 (一般): D
E级 (差): 0
编辑: 崔丽君 电编:刘继红
| 3. | Sanger GJ, Wang Y, Hobson A, Broad J. Motilin: towards a new understanding of the gastrointestinal neuropharmacology and therapeutic use of motilin receptor agonists. Br J Pharmacol. 2013;170:1323-1332. [PubMed] [DOI] |
| 5. | Asano H, Tomita T, Nakamura K, Yamasaki T, Okugawa T, Kondo T, Kono T, Tozawa K, Ohda Y, Oshima T, Fukui H, Fukushima K, Hirota S, Watari J, Miwa H. Prevalence of Gastric Motility Disorders in Patients with Functional Dyspepsia. J Neurogastroenterol Motil. 2017;23:392-399. [PubMed] [DOI] |
| 8. | Lee KJ, Cha DY, Cheon SJ, Yeo M, Cho SW. Plasma ghrelin levels and their relationship with gastric emptying in patients with dysmotility-like functional dyspepsia. Digestion. 2009;80:58-63. [PubMed] [DOI] |
| 12. | Welgan P, Meshkinpour H, Hoehler F. The effect of stress on colon motor and electrical activity in irritable bowel syndrome. Psychosom Med. 1985;47:139-149. [PubMed] [DOI] |
| 13. | Hong HS, Hwang DY, Park JH, Kim S, Seo EJ, Son Y. Substance-P alleviates dextran sulfate sodium-induced intestinal damage by suppressing inflammation through enrichment of M2 macrophages and regulatory T cells. Cytokine. 2017;90:21-30. [PubMed] [DOI] |
| 14. | 裴 丽霞, 张 伟, 宋 亚芳, 耿 昊, 陈 璐, 吴 晓亮, 周 俊灵, 孙 建华. 电针"天枢"穴对感染后肠易激综合征内脏高敏感模型大鼠结肠肥大细胞活化和P物质的影响. 针刺研究. 2018;43:419-423. [DOI] |
| 16. | Yu FY, Huang SG, Zhang HY, Ye H, Chi HG, Zou Y, Lv RX, Zheng XB. Comparison of 5-hydroxytryptophan signaling pathway characteristics in diarrhea-predominant irritable bowel syndrome and ulcerative colitis. World J Gastroenterol. 2016;22:3451-3459. [PubMed] [DOI] |
| 17. | Okamoto T, Barton MJ, Hennig GW, Birch GC, Grainger N, Corrigan RD, Koh SD, Sanders KM, Smith TK. Extensive projections of myenteric serotonergic neurons suggest they comprise the central processing unit in the colon. Neurogastroenterol Motil. 2014;26:556-570. [PubMed] [DOI] |
| 21. | Rehfeld JF. Cholecystokinin-From Local Gut Hormone to Ubiquitous Messenger. Front Endocrinol (Lausanne). 2017;8:47. [PubMed] [DOI] |
| 22. | Mirza KB, Alenda A, Eftekhar A, Grossman N, Nikolic K, Bloom SR, Toumazou C. Influence of Cholecystokinin-8 on Compound Nerve Action Potentials from Ventral Gastric Vagus in Rats. Int J Neural Syst. 2018;28:1850006. [PubMed] [DOI] |
| 25. | Bell LA, Bell KA, McQuiston AR. Activation of muscarinic receptors by ACh release in hippocampal CA1 depolarizes VIP but has varying effects on parvalbumin-expressing basket cells. J Physiol. 2015;593:197-215. [PubMed] [DOI] |
| 26. | Bednarska O, Walter SA, Casado-Bedmar M, Ström M, Salvo-Romero E, Vicario M, Mayer EA, Keita ÅV. Vasoactive Intestinal Polypeptide and Mast Cells Regulate Increased Passage of Colonic Bacteria in Patients With Irritable Bowel Syndrome. Gastroenterology. 2017;153:948-960.e3. [PubMed] [DOI] |
| 27. | Conlin VS, Wu X, Nguyen C, Dai C, Vallance BA, Buchan AM, Boyer L, Jacobson K. Vasoactive intestinal peptide ameliorates intestinal barrier disruption associated with Citrobacter rodentium-induced colitis. Am J Physiol Gastrointest Liver Physiol. 2009;297:G735-G750. [PubMed] [DOI] |
| 28. | Vicario M, Alonso C, Guilarte M, Serra J, Martínez C, Gonz¨¢lez-Castro AM, Lobo B, Antolán M, Andreu AL, García-Arumí E, Casellas M, Saperas E, Malagelada JR, Azpiroz F, Santos J. Chronic psychosocial stress induces reversible mitochondrial damage and corticotropin-releasing factor receptor type-1 upregulation in the rat intestine and IBS-like gut dysfunction. Psychoneuroendocrinology. 2012;37:65-77. [PubMed] [DOI] |
| 29. | Askar B, Ibrahim H, Barrow P, Foster N. Vasoactive intestinal peptide (VIP) differentially affects inflammatory immune responses in human monocytes infected with viable Salmonella or stimulated with LPS. Peptides. 2015;71:188-195. [PubMed] [DOI] |
| 30. | 李 林, 茹 立强. 大鼠肠道内ACh能、SP、VIP-肽能和NO能神经的分布模式及相互关系. 华中科技大学学报(医学版). 2009;38:575-580. [DOI] |
| 32. | Aveleira CA, Botelho M, Cavadas C. NPY/neuropeptide Y enhances autophagy in the hypothalamus: a mechanism to delay aging? Autophagy. 2015;11:1431-1433. [PubMed] [DOI] |
| 33. | Holzer P, Reichmann F, Farzi A. Neuropeptide Y, peptide YY and pancreatic polypeptide in the gut-brain axis. Neuropeptides. 2012;46:261-274. [PubMed] [DOI] |
| 34. | Wu HG, Jiang B, Zhou EH, Shi Z, Shi DR, Cui YH, Kou ST, Liu HR. Regulatory mechanism of electroacupuncture in irritable bowel syndrome: preventing MC activation and decreasing SP VIP secretion. Dig Dis Sci. 2008;53:1644-1651. [PubMed] [DOI] |
| 37. | 于 林, 吴 升伟, 禤 正正, 伍 远菲, 徐 琰, 丁 国安, 吴 宝烽, 郭 建雄. 加味逍遥散对胃肠功能失调的抑郁大鼠脑肠肽SS、GAS表达的影响. 时珍国医国药. 2017;28:1290-1292. |
| 40. | Zeng SY, Yang L, Hong CL, Lu HQ, Yan QJ, Chen Y, Qin XP. Evidence That ADAM17 Mediates the Protective Action of CGRP against Angiotensin II-Induced Inflammation in Vascular Smooth Muscle Cells. Mediators Inflamm. 2018;2018:2109352. [PubMed] [DOI] |
| 41. | Schou WS, Ashina S, Amin FM, Goadsby PJ, Ashina M. Calcitonin gene-related peptide and pain: a systematic review. J Headache Pain. 2017;18:34. [PubMed] [DOI] |
| 43. | Yamawaki K, Zamami Y, Kawasaki H, Takatori S. Effects of endogenous nitric oxide on adrenergic nerve-mediated vasoconstriction and calcitonin gene-related peptide-containing nerve-mediated vasodilation in pithed rats. Eur J Pharmacol. 2017;802:69-75. [PubMed] [DOI] |