修回日期: 2019-07-01
接受日期: 2019-07-22
在线出版日期: 2019-07-28
对于结肠癌伴肺部转移的患者, 常用传统的放疗方式, 其主要作用于肿瘤细胞内部的双链DNA, 然而国外多项研究发现, 提高放疗剂量并不能改善患者预后, 且由于其对于正常组织的副作用大, 故常用的放疗剂量通常在60-70 Gy之间, 然而此剂量对于肺部肿瘤的局部控制不佳. 现科学技术的飞速发展, 立体定向放射治疗(stereotactic body radiotherapy, SBRT)技术大量应用于非小细胞肺癌的患者, SBRT同样应用于结肠癌伴肺部转移的患者, 然而有研究发现由于结肠癌组织中乏氧细胞较其他组织多, 且乏氧细胞对放射线相对不敏感, 故对于SBRT对于结肠癌伴肺转移的患者较其他部位肿瘤伴肺转移的患者疗效较差, 然而此结论存在争议, 且对于最佳的放疗剂量暂无明确的结论, 有研究发现, 提高放疗剂量可改善结肠癌伴肺部转移患者的预后, 然而此结论也存在争议, 本研究在国内外多项研究的基础上, 对于SBRT治疗结肠癌伴肺转移与非结肠癌伴肺部转移的疗效以及不同放疗剂量对于结肠癌伴肺部转移的疗效比较进行Meta分析, 进而提供循证医学相关的依据.
比较体部SBRT结肠癌伴肺转移与非结肠癌伴肺部转移的疗效以及不同放疗剂量对于结肠癌伴肺部转移的疗效比较.
检索体部立体定向放射治疗结肠癌伴肺转移的对照试验, 年限为2008-01/2018-12, 以Cochrane系统评价手册内的质量评价标准进行筛选和评价, 用Revman 5.3软件进行系统Meta分析.
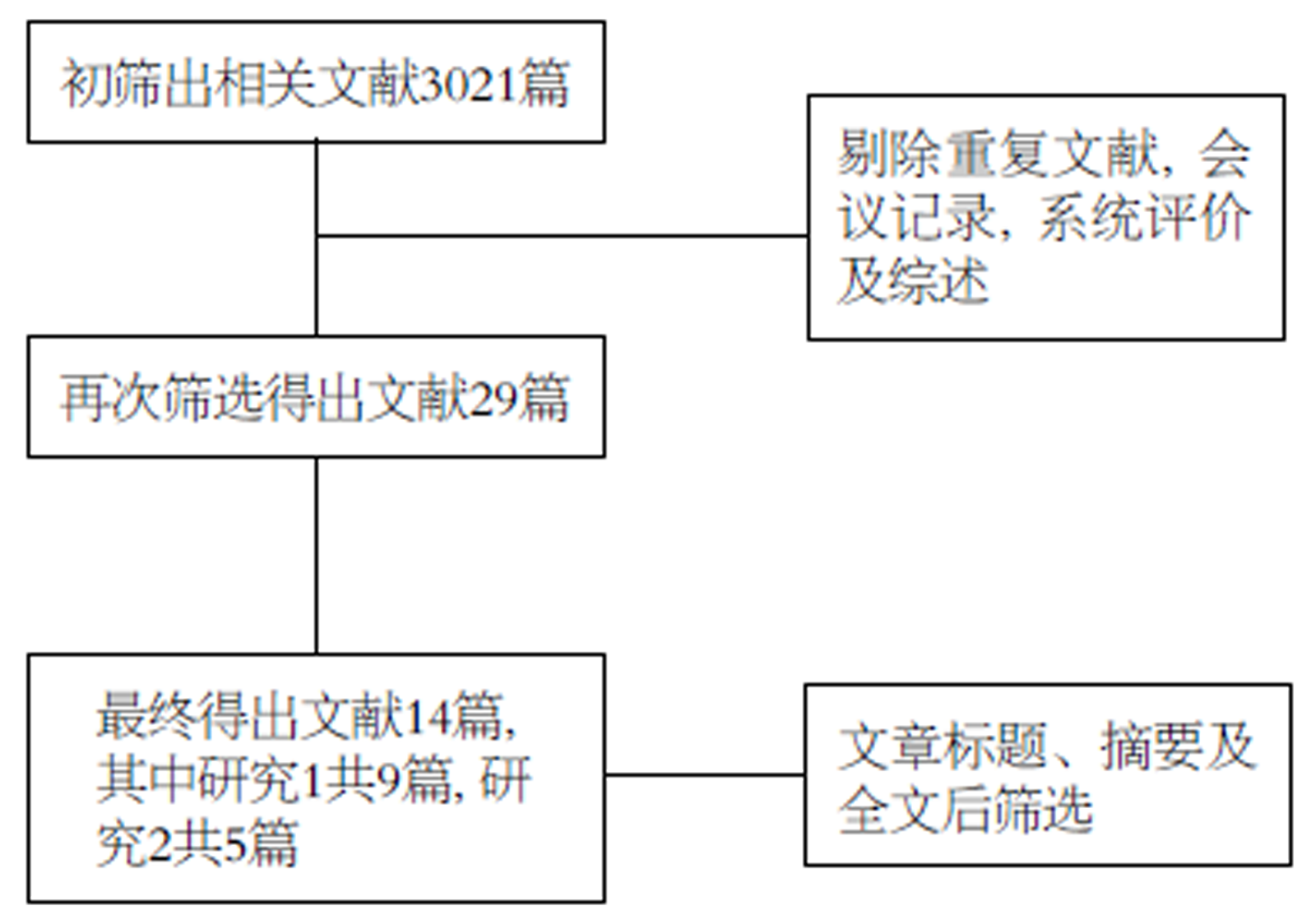
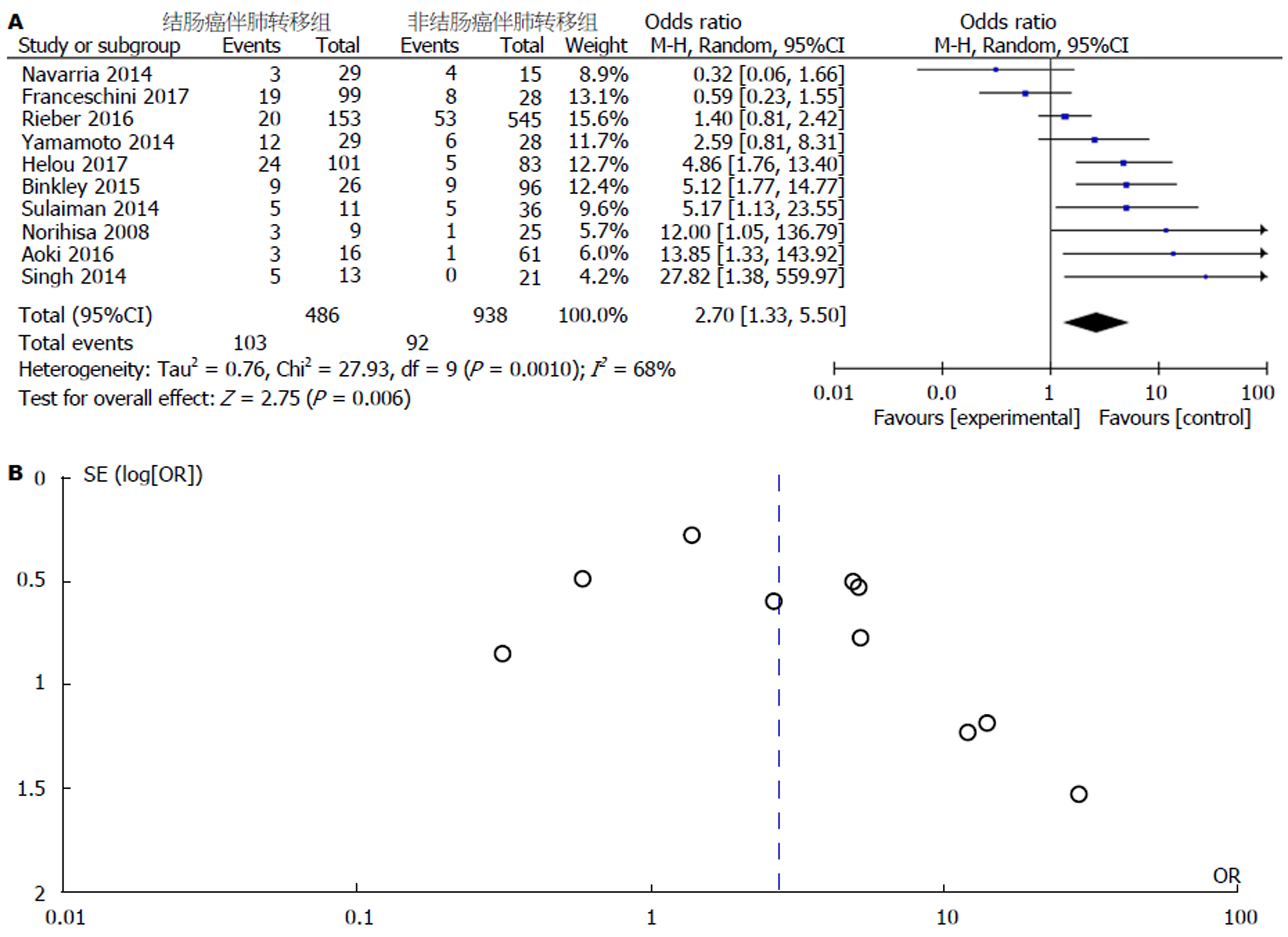
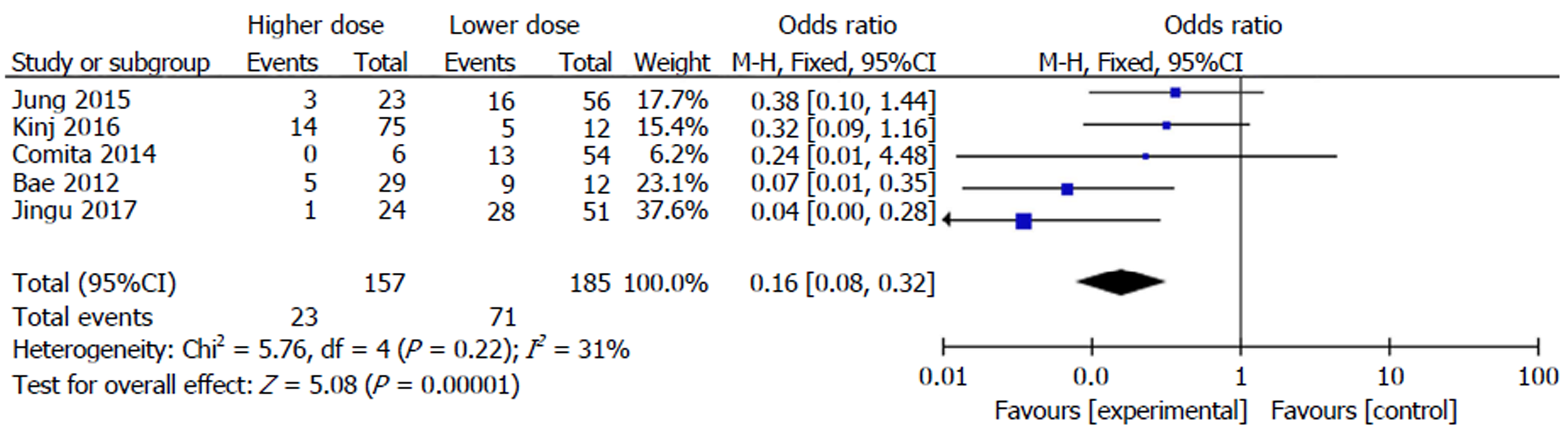
共纳入14篇文献, 研究1共9篇文献, 结肠癌伴肺部转移组共486例, 非结肠癌伴肺转移组共938例研究对象, 研究2共5篇文献, 高剂量组共157例研究对象, 低剂量组共185例研究对象, Meta分析结果表明: SBRT对于结肠癌伴肺转移的患者疗效低于非结肠癌伴肺转移的患者, 且对于结肠癌伴肺转移的患者而言, 高剂量的SBRT疗效要高于低剂量的SBRT, 二者差异有统计学意义(P<0.05).
SBRT对于结肠癌伴肺转移的患者疗效较非结肠癌来源的肺转移患者要差, 对于结肠癌伴肺部转移的患者而言, 可以通过提高SBRT放疗剂量来改善预后.
核心提要: 目前国内外较多研究发现, 立体定向放射治疗(stereotactic body radiotherapy, SBRT)对于结肠癌伴肺部转移的患者具有较好的疗效, 然而, 对于SBRT对于结肠癌伴肺部转移患者的疗效较非结肠癌伴肺部转移患者的疗效, 各研究结论不一, 且对于最佳的放疗剂量暂无明确的结论, 有研究发现, 提高放疗剂量可改善结肠癌伴肺部转移患者的预后, 然而此结论也存在争议, 本研究在国内外多项研究的基础上, 对于SBRT治疗结肠癌伴肺转移与非结肠癌伴肺部转移的疗效以及不同放疗剂量对于结肠癌伴肺部转移的疗效比较进行Meta分析, 进而提供循证医学相关的依据.
引文著录: 刘海源, 雷鑫明. 体部立体定向放射治疗结肠癌伴肺转移的临床特点Meta分析. 世界华人消化杂志 2019; 27(14): 889-897
Revised: July 1, 2019
Accepted: July 22, 2019
Published online: July 28, 2019
For patients with colon cancer with lung metastasis, conventional radiotherapy is commonly used, which mainly acts on the double-stranded DNA inside the tumor cells. However, many foreign studies have found that increasing the dose of radiotherapy cannot improve the prognosis of patients, and because of its side effects on normal tissues, the commonly used dose of radiotherapy is usually between 60 and 70 Gy. However, the local control of lung tumors using this dose is not good. With the rapid development of science and technology, stereotactic body radiotherapy (SBRT) technology has been widely used in patients with non-small cell lung cancer, and SBRT is also used in patients with colon cancer and lung metastasis. However, some studies have found that because there are more hypoxic cells in colon cancer tissues than in other tissues, and hypoxic cells are relatively insensitive to radiation, the efficacy of SBRT in patients with lung metastasis from colon cancer is worse than that in patients with lung metastasis from other sites. However, this conclusion is controversial. There is no definite conclusion about the optimal dose of radiotherapy. Some studies have found that increasing the dose of radiotherapy can improve the prognosis of patients with colon cancer and lung metastasis. However, this conclusion is controversial. On the basis of many studies both in China and other countries, this study made a meta-analysis on the efficacy of SBRT in the treatment of colon cancer with lung metastasis and non-colon cancer with lung metastasis, as well as a comparison of the efficacy of different radiation doses in the treatment of colon cancer with lung metastasis, in order to provide evidence-based medicine-related evidence.
To compare the efficacy of stereotactic radiotherapy for colon cancer with lung metastasis and non-colon cancer with lung metastasis (Study 1), and to compare the efficacy of different doses of radiotherapy for colon cancer with lung metastasis (Study 2).
Methods
The controlled trials including cases with pulmonary oligometastases from colon cancer published from January 2008 to December 2018 were searched according to the method of the Cochrane Collaboration, and meta-analysis was carried out by using RevMan5.3 software.
Results
Fourteen studies were included, of which nine were included in Study 1, involving 486 patients with colon cancer and 938 with non-colon cancer, and five were included in Study 2, involving 157 patients treated with high doses and 185 treated with low doses. Meta-analysis indicated that the clinical efficacy of stereotactic radiotherapy for pulmonary oligometastases from colorectal was significantly lower than that for pulmonary oligometastases from other cancers, and that the efficacy of high doses was significantly better than that of low doses (P < 0.05).
Conclusion
SBRT has worse efficacy for pulmonary oligometastases from colorectal than for those from other cancer, and better efficacy for pulmonary oligometastases from colon cancer can be achieved by dose escalation.
- Citation: Liu HY, Lei XM. A meta-analysis of stereotactic radiotherapy for pulmonary oligometastases from colorectal cancer. Shijie Huaren Xiaohua Zazhi 2019; 27(14): 889-897
- URL: https://www.wjgnet.com/1009-3079/full/v27/i14/889.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v27.i14.889
结肠癌非常常见, 肺部转移为结肠癌非常常见的转移方式, 结肠癌伴肺部转移在我国非常常见, 且确诊时已处于晚期, 故已失去手术机会[1]. 目前国内外较多研究发现, 立体定向放射治疗(stereotactic body radiotherapy, SBRT)对于结肠癌伴肺部转移的患者较单纯放疗相比具有较好的疗效[2], 然而, 对于SBRT对于结肠癌伴肺部转移患者的疗效较非结肠癌伴肺部转移患者的疗效, 各研究结论不一[3], 且对于最佳的放疗剂量暂无明确的结论, 有研究发现, 提高放疗剂量可改善结肠癌伴肺部转移患者的预后[4], 本研究在国内外多项研究的基础上, 对于SBRT治疗结肠癌伴肺转移与非结肠癌伴肺部转移的疗效以及不同放疗剂量对于结肠癌伴肺部转移的疗效比较进行Meta分析, 进而提供循证医学相关的依据[5].
检索国内外公开数据库, 检索员为2人, 检索的数据库主要包括: 国外数据库Embase、PubMed、The Cochrane Library、中文数据库维普数据库、中国知网数据库、中国生物医学文献数据库、万方数据库, 检索时间范围为2008-01/2018-12. 检索词主要为: "Stereotactic Radiotherapy"、"Colorectal Cancer"、"Pulmonary Oligometastases"和"体部立体定向放射治疗"、"结肠癌"、"肺转移". 检索语种主要为英文和中文并从中多次选择直至选出最佳的文献.
1.2.1 纳入标准: (1)所选择的研究对象必须确诊为除肺癌以外的肿瘤患者, 且必须为初诊; (2)所选择的研究对象必须有肺转移; (3) 所选择对象需排除除体部立体定向放射治疗以外的其它治疗方式.
1.2.2 排除标准: (1)确诊对象包含原发性肺癌的患者; (2)非初诊研究对象; (3)不存在远处转移的研究对象; (4)观察指标过少, 样本量过小, 随访时间过短的研究对象.
1.2 方法 由2名研究者以Cochrane系统评价手册内的质量评价标准进行筛选和评价并相互核对, 若得到的结论不一致, 则进行相互讨论或者征求第三方、文献作者的意见. 评价标准主要包括5个方面: (1)随机分配方法; (2)分配方案隐藏; (3)对研究对象、治疗方案实施者、研究结果测量者采用盲法; (4)实验类型; (5)对于失访患者的描述情况.
统计学处理 对于纳入的研究对象, 用RevMan 5.3进行Meta分析. 对于二分类变量而言, 采用OR值及其95%CI描述, 采用χ2检验检验各研究间异质性, 当I2<50%, P>0.1时, 则提示各研究之间异质性较低或者异质性不存在, 此时Meta分析采用固定效应模型. 然而当I2≥50%, P≤0.1时, 则提示异质性较高, 此时Meta分析采用随机效应模型并且需要排除可能影响异质性的相关因素, 运用漏斗图进行偏倚评价.
按照以上关键词搜索各个数据库, 得出总文献3021篇, 将所有的重复文献, 会议记录, 系统评价及综述剔除后得到文献29篇, 再通过文章标题、摘要及全文后最终得到14篇文献[6-19]. 其中研究1文献共9篇, 结肠癌伴肺部转移组共486例, 非结肠癌伴肺转移组共938例研究对象. 其中1篇为非随机对照实验. 8篇文章质量为B级. 文献基本情况详见表1和表2. 研究2中文献共5篇. 其中高剂量放疗组共157例, 低剂量放疗组共185例研究对象. 其中2篇为非随机对照实验, 3篇文章质量为B级. 文献基本情况详见表3和表4. 具体文献搜索过程见流程图(图1).
| 作者 | 发表时间 | 随机方法 | 实验类型 | 分配隐藏 | 盲法 | 失访 | 质量 |
| Aoki et al[6] | 2016年 | 未描述 | 随机对照实验 | 未描述 | 未描述 | 描述 | B |
| Binkley et al[7] | 2015年 | 未描述 | 随机对照实验 | 未描述 | 未描述 | 描述 | B |
| Helou et al[8] | 2017年 | 未描述 | 随机对照实验 | 未描述 | 未描述 | 描述 | B |
| Navarria et al[9] | 2014年 | 未描述 | 随机对照实验 | 未描述 | 未描述 | 描述 | B |
| Norihisa et al[10] | 2008年 | 非随机 | 非随机对照实验 | 未描述 | 未描述 | 描述 | C |
| Rieber et al[11] | 2016年 | 未描述 | 随机对照实验 | 未描述 | 未描述 | 描述 | B |
| Singh et al[12] | 2014年 | 未描述 | 随机对照实验 | 未描述 | 未描述 | 描述 | B |
| Sulaiman et al[13] | 2014年 | 未描述 | 随机对照实验 | 未描述 | 未描述 | 描述 | B |
| Yamamoto et al[14] | 2014年 | 未描述 | 随机对照实验 | 未描述 | 未描述 | 描述 | B |
| 作者 | 分组情况 | 每组人数(人) | 中位平均生物等效剂量 | 中位随访时间(mo) | 2年后死亡人数(人) | 2年局部控制率(%) |
| Aoki et al[6] | 结肠癌组 | 15 | 100 Gy BED | 37 | 3 | 47.6 |
| 非结肠癌组 | 61 | 132 Gy BED | 47 | 1 | 97.5 | |
| Binkley et al[7] | 结肠癌组 | 30 | 87 Gy BED | 54 | 0 | 57.6 |
| 非结肠癌组 | 26 | 66 Gy BED | 65 | 9 | 90.1 | |
| Helou et al[8] | 结肠癌组 | 101- | 78 Gy BED | 39 | 24 | 76.4 |
| 非结肠癌组 | 83 | 51 Gy BED | 45 | 5 | 91.7 | |
| Navarria et al[9] | 结肠癌组 | 29 | 66 Gy BED | 41 | 3 | 89.7 |
| 非结肠癌组 | 15 | 79 Gy BED | 50 | 4 | 73.3 | |
| Norihisa et al[10] | 结肠癌组 | 9 | 87 Gy BED | 66 | 3 | 66.7 |
| 非结肠癌组 | 25 | 89 Gy BED | 46 | 1 | 96 | |
| Rieber et al[11] | 结肠癌组 | 153 | 100 Gy BED | 37.5 | 20 | 86.9 |
| 非结肠癌组 | 545 | 103 Gy BED | 38.5 | 53 | 90.3 | |
| Singh et al[12] | 结肠癌组 | 13 | 102 Gy BED | 55.4 | 5 | 61.5 |
| 非结肠癌组 | 21 | 141 Gy BED | 36 | 0 | 100 | |
| Sulaiman et al[13] | 结肠癌组 | 11 | 84 Gy BED | 57 | 5 | 54.5 |
| 非结肠癌组 | 36 | 98 Gy BED | 52.1 | 5 | 86.1 | |
| Yamamoto et al[14] | 结肠癌组 | 29 | 77 Gy BED | 45.6 | 12 | 25.5 |
| 非结肠癌组 | 28 | 89 Gy BED | 56 | 6 | 70 |
研究1中体部立体定向体部放射治疗对两组患者的疗效: 对结肠癌伴肺转移组和非结肠癌伴肺转移组组间异质性检测得出P = 0.001, I2 = 68%, 存在异质性, 则用随机效应模型进行Meta分析, 结果显示(OR = 2.7, 95%CI: 1.33-5.50), P = 0.006, 两组差异有统计学意义(P<0.05). 具体详见图2A. 漏斗图提示散点基本对称并且呈倒漏斗状分布, 故漏斗图提示无发表偏倚, 具体详见图2B.
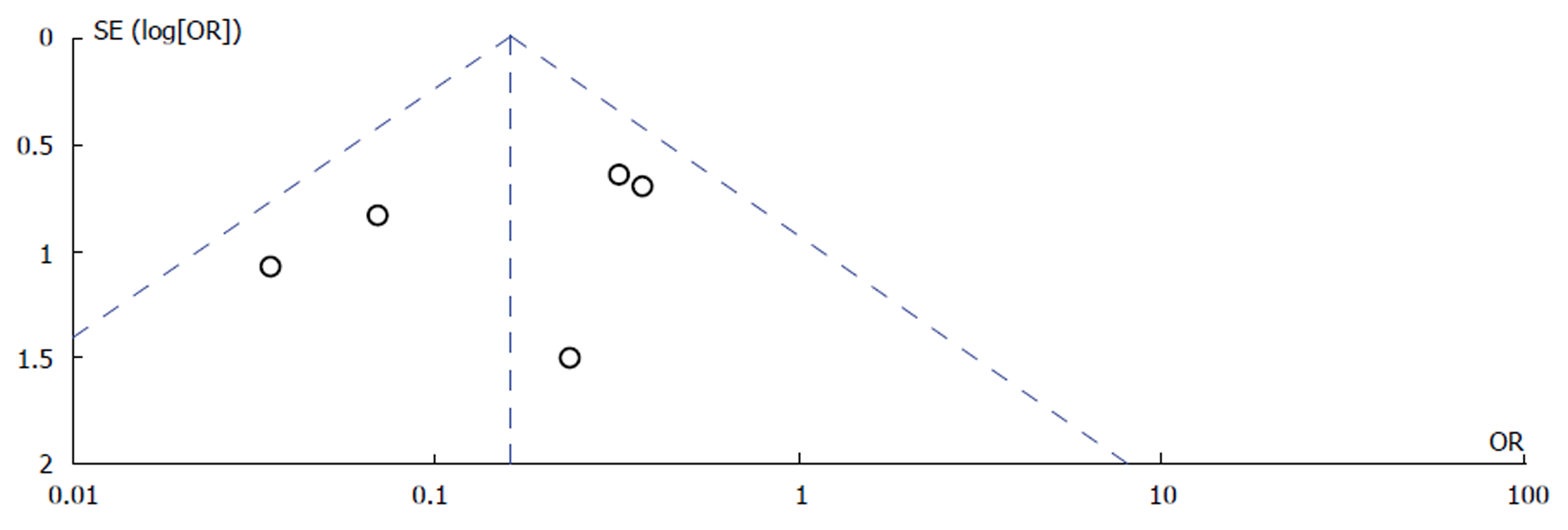
研究2中体部立体定向体部放射治疗不同放疗剂量对于结肠癌伴肺部转移疗效比较: 组间异质性检测得出P = 0.22, I2 = 31%, 不存在异质性, 则用固定效应模型进行Meta分析, 结果显示(OR = 0.16, 95%CI: 0.08-0.32), P<0.0001, 两组差异有统计学意义(P<0.05). 具体详见图3, 漏斗图提示散点基本对称并且呈倒漏斗状分布, 故漏斗图提示无发表偏倚, 具体详见图4.
结肠癌作为最常见的消化道肿瘤之一, 其早期临床表现不明显, 故发现时往往处于中晚期, 这对于结肠癌的治疗带来极大的困难[20], 超过30%的患者在确诊时已存在远处转移, 故已失去手术最佳时机. 以往对于结肠癌伴肺部转移的患者, 常用传统的放疗方式, 其主要作用于肿瘤细胞内部的双链DNA, 然而国外多项研究发现[21-23], 提高放疗剂量并不能改善患者预后, 且由于其对于正常组织的副作用大, 故常用的放疗剂量通常在60-70 Gy之间, 然而此剂量对于肺部肿瘤的局部控制不佳.
现科学技术的飞速发展, SBRT技术大量应用于非小细胞肺癌的患者, SBRT能够精准定位于肿瘤组织, 通过精确计算, 精确治疗, 能够最大限度的提升肿瘤区域内部放疗剂量, 同时能尽量减少对于其余正常组织的影响[24]. SBRT 在临床治疗中具有以下优点: 门诊治疗、无创、分割次数减少、提高单次放疗剂量, 无需镇静和麻醉、不影响日常生活[25]. 现在一度认为对于肺癌的患者可用SBRT代替手术治疗. SBRT同样应用于结肠癌伴肺部转移的患者, 然而有研究发现由于结肠癌组织中乏氧细胞较其他组织多, 且乏氧细胞对放射线相对不敏感, 故对于SBRT对于结肠癌伴肺转移的患者较其他部位肿瘤伴肺转移的患者疗效较差[21], 然而此结论存在争议, 且对于最佳的放疗剂量暂无明确的结论, 有研究发现, 提高放疗剂量可改善结肠癌伴肺部转移患者的预后[4], 然而此结论也存在争议, 对于SBRT治疗结肠癌伴肺转移与非结肠癌伴肺部转移的疗效以及不同放疗剂量对于结肠癌伴肺部转移的疗效比较进行Meta分析, 进而提供循证医学相关的依据.
本研究共纳入14篇文献, 研究1共9篇文献, 结肠癌伴肺部转移组共486例, 非结肠癌伴肺转移组共938例研究对象. Meta分析结果表明; SBRT对于结肠癌伴肺转移的患者疗效低于非结肠癌伴肺转移的患者, 二者差异有统计学意义(P<0.05). 研究2中文献共5篇. 其中高剂量放疗组共157例, 低剂量放疗组共185例研究对象. Meta分析结果表明: 对于结肠癌伴肺转移的患者而言, 高剂量的SBRT疗效要高于低剂量的SBRT, 二者差异有统计学意义(P<0.05).
综上所述, SBRT对于结肠癌伴肺转移的患者疗效较非结肠癌来源的肺转移患者要差, 对于结肠癌伴肺部转移的患者而言, 可以通过提高SBRT放疗剂量来改善预后. 但是此次研究纳入的文献数目仍较少, 并且大部分研究的质量为B级, 且无法对每一篇文献进行进一步的亚组分析, 因此希望将来有更多的双盲、多中心、随机、大样本的对照实验的出现. 进而为临床医师对结肠癌的诊疗提供更好的指导.
对于结肠癌伴肺部转移的患者, 常用传统的放疗方式, 其主要作用于肿瘤细胞内部的双链DNA, 然而国外多项研究发现, 提高放疗剂量并不能改善患者预后, 且由于其对于正常组织的副作用大, 故常用的放疗剂量通常在60-70 Gy之间, 然而此剂量对于肺部肿瘤的局部控制不佳. 现科学技术的飞速发展, 立体定向放射治疗(stereotactic body radiotherapy, SBRT)技术大量应用于非小细胞肺癌的患者, SBRT同样应用于结肠癌伴肺部转移的患者, 然而有研究发现由于结肠癌组织中乏氧细胞较其他组织多, 且乏氧细胞对放射线相对不敏感, 故对于SBRT对于结肠癌伴肺转移的患者较其他部位肿瘤伴肺转移的患者疗效较差, 然而此结论存在争议, 且对于最佳的放疗剂量暂无明确的结论, 有研究发现, 提高放疗剂量可改善结肠癌伴肺部转移患者的预后, 然而此结论也存在争议.
本研究在国内外多项研究的基础上, 对于SBRT治疗结肠癌伴肺转移与非结肠癌伴肺部转移的疗效以及不同放疗剂量对于结肠癌伴肺部转移的疗效比较进行Meta分析, 进而提供循证医学相关的依据, 进而给临床医师提供重要指导.
本研究主要的目标在于通过搜集国内外大量文献, 对于SBRT治疗结肠癌伴肺转移与非结肠癌伴肺部转移的疗效以及不同放疗剂量对于结肠癌伴肺部转移的疗效比较进行Meta分析, 进而提供循证医学相关的依据. 进而对于临床医师在治疗结肠癌肺转移的患者上提供重要的参考.
检索体部立体定向放射治疗结肠癌伴肺转移的对照试验, 年限为2008-01/2018-12, 以Cochrane系统评价手册内的质量评价标准进行筛选和评价, 用Revman 5.3软件进行系统Meta分析. 对于二分类变量而言, 采用OR值及其95%CI描述, 采用χ2检验检验各研究间异质性, 运用漏斗图进行偏倚评价.
Meta分析结果表明, SBRT对于结肠癌伴肺转移的患者疗效低于非结肠癌伴肺转移的患者, 二者差异有统计学意义(P<0.05). 研究2中文献共5篇. 其中高剂量放疗组共157例, 低剂量放疗组共185例研究对象. Meta分析结果表明: 对于结肠癌伴肺转移的患者而言, 高剂量的SBRT疗效要高于低剂量的SBRT, 二者差异有统计学意义(P<0.05). 明确SBRT对于结肠癌伴肺转移的患者疗效较非结肠癌来源的肺转移患者要差, 对于结肠癌伴肺部转移的患者而言, 可以通过提高SBRT放疗剂量来改善预后. 进而对于临床医师在治疗结肠癌肺转移的患者上提供重要的参考. 基本达到实验目标.
SBRT对于结肠癌伴肺转移的患者疗效较非结肠癌来源的肺转移患者要差, 对于结肠癌伴肺部转移的患者而言, 可以通过提高SBRT放疗剂量来改善预后. 对于临床上对于结肠癌肺转移患者的治疗方案选择有着重要意义.
此次研究纳入的文献数目仍较少,并且大部分研究的质量为B级, 且无法对每一篇文献进行进一步的亚组分析, 因此希望将来有更多关于SBRT治疗结肠癌肺转移的双盲、多中心、随机、大样本的对照实验的出现.
学科分类: 胃肠病学和肝病学
手稿来源地: 浙江省
同行评议报告分类
A级 (优秀): 0
B级 (非常好): 0
C级 (良好): C, C
D级 (一般): D
E级 (差): 0
编辑: 马亚娟 电编:刘继红
| 1. | Klement RJ, Abbasi-Senger N, Adebahr S, Alheid H, Allgaeuer M, Becker G, Blanck O, Boda-Heggemann J, Brunner T, Duma M, Eble MJ, Ernst I, Gerum S, Habermehl D, Hass P, Henkenberens C, Hildebrandt G, Imhoff D, Kahl H, Klass ND, Krempien R, Lewitzki V, Lohaus F, Ostheimer C, Papachristofilou A, Petersen C, Rieber J, Schneider T, Schrade E, Semrau R, Wachter S, Wittig A, Guckenberger M, Andratschke N. The impact of local control on overall survival after stereotactic body radiotherapy for liver and lung metastases from colorectal cancer: a combined analysis of 388 patients with 500 metastases. BMC Cancer. 2019;19:173. [PubMed] [DOI] |
| 2. | Jereczek-Fossa BA, Bortolato B, Gerardi MA, Dicuonzo S, Arienti VM, Berlinghieri S, Bracelli S, Buglione M, Caputo M, Catalano G, Cazzaniga LF, De Cicco L, Di Muzio N, Filippone FR, Fodor A, Franceschini D, Frata P, Gottardo S, Ivaldi GB, Laudati A, Magrini SM, Mantero E, Meaglia I, Morlino S, Palazzi M, Piccoli F, Romanelli P, Scorsetti M, Serafini F, Scandolaro L, Valdagni R, Orecchia R, Antognoni P; Lombardy Section of the Italian Society of Oncological Radiotherapy (Associazione Italiana di Radioterapia Oncologica-Lombardia, AIRO-L). Radiotherapy for oligometastatic cancer: a survey among radiation oncologists of Lombardy (AIRO-Lombardy), Italy. Radiol Med. 2019;124:315-322. [PubMed] [DOI] |
| 3. | Ottaiano A, Scotti V, De Divitiis C, Capozzi M, Romano C, Cassata A, Casaretti R, Silvestro L, Nappi A, Vicario V, De Stefano A, Tafuto S, Berretta M, Nasti G, Avallone A. Integration of stereotactic radiotherapy in the treatment of metastatic colorectal cancer patients: a real practice study with long-term outcome and prognostic factors. Oncotarget. 2018;9:35251-35265. [PubMed] [DOI] |
| 4. | Wang X, Zamdborg L, Ye H, Grills IS, Yan D. A matched-pair analysis of stereotactic body radiotherapy (SBRT) for oligometastatic lung tumors from colorectal cancer versus early stage non-small cell lung cancer. BMC Cancer. 2018;18:962. [PubMed] [DOI] |
| 5. | Kobiela J, Spychalski P, Marvaso G, Ciardo D, Dell¡¯Acqua V, Kraja F, Błażynska-Spychalska A, Lachinski AJ, Surgo A, Glynne-Jones R, Jereczek-Fossa BA. Ablative stereotactic radiotherapy for oligometastatic colorectal cancer: Systematic review. Crit Rev Oncol Hematol. 2018;129:91-101. [PubMed] [DOI] |
| 6. | Aoki M, Hatayama Y, Kawaguchi H, Hirose K, Sato M, Akimoto H, Miura H, Ono S, Takai Y. Stereotactic body radiotherapy for lung metastases as oligo-recurrence: a single institutional study. J Radiat Res. 2016;57:55-61. [PubMed] [DOI] |
| 7. | Binkley MS, Trakul N, Jacobs LR, von Eyben R, Le QT, Maxim PG, Loo BW, Shultz DB, Diehn M. Colorectal Histology Is Associated With an Increased Risk of Local Failure in Lung Metastases Treated With Stereotactic Ablative Radiation Therapy. Int J Radiat Oncol Biol Phys. 2015;92:1044-1052. [PubMed] [DOI] |
| 8. | Helou J, Thibault I, Poon I, Chiang A, Jain S, Soliman H, Erler D, Yeung L, Cheung P. Stereotactic Ablative Radiation Therapy for Pulmonary Metastases: Histology, Dose, and Indication Matter. Int J Radiat Oncol Biol Phys. 2017;98:419-427. [PubMed] [DOI] |
| 9. | Navarria P, Ascolese AM, Tomatis S, Cozzi L, De Rose F, Mancosu P, Alongi F, Clerici E, Lobefalo F, Tozzi A, Reggiori G, Fogliata A, Scorsetti M. Stereotactic body radiotherapy (sbrt) in lung oligometastatic patients: role of local treatments. Radiat Oncol. 2014;9:91. [PubMed] [DOI] |
| 10. | Norihisa Y, Nagata Y, Takayama K, Matsuo Y, Sakamoto T, Sakamoto M, Mizowaki T, Yano S, Hiraoka M. Stereotactic body radiotherapy for oligometastatic lung tumors. Int J Radiat Oncol Biol Phys. 2008;72:398-403. [PubMed] [DOI] |
| 11. | Rieber J, Streblow J, Uhlmann L, Flentje M, Duma M, Ernst I, Blanck O, Wittig A, Boda-Heggemann J, Krempien R, Lohaus F, Klass ND, Eble MJ, Imhoff D, Kahl H, Petersen C, Gerum S, Henkenberens C, Adebahr S, Hass P, Schrade E, Wendt TG, Hildebrandt G, Andratschke N, Sterzing F, Guckenberger M. Stereotactic body radiotherapy (SBRT) for medically inoperable lung metastases-A pooled analysis of the German working group "stereotactic radiotherapy". Lung Cancer. 2016;97:51-58. [PubMed] [DOI] |
| 12. | Singh D, Chen Y, Hare MZ, Usuki KY, Zhang H, Lundquist T, Joyce N, Schell MC, Milano MT. Local control rates with five-fraction stereotactic body radiotherapy for oligometastatic cancer to the lung. J Thorac Dis. 2014;6:369-374. [PubMed] [DOI] |
| 13. | Sulaiman NS, Fujii O, Demizu Y, Terashima K, Niwa Y, Akagi T, Daimon T, Murakami M, Sasaki R, Fuwa N. Particle beam radiation therapy using carbon ions and protons for oligometastatic lung tumors. Radiat Oncol. 2014;9:183. [PubMed] [DOI] |
| 14. | Yamamoto T, Jingu K, Shirata Y, Koto M, Matsushita H, Sugawara T, Kubozono M, Umezawa R, Abe K, Kadoya N, Ishikawa Y, Kozumi M, Takahashi N, Takeda K, Takai Y. Outcomes after stereotactic body radiotherapy for lung tumors, with emphasis on comparison of primary lung cancer and metastatic lung tumors. BMC Cancer. 2014;14:464. [PubMed] [DOI] |
| 15. | Jingu K, Matsuo Y, Onishi H, Yamamoto T, Aoki M, Murakami Y, Yamashita H, Kakuhara H, Nemoto K, Sakayauchi T, Okamoto M, Niibe Y, Nagata Y, Ogawa K. Dose Escalation Improves Outcome in Stereotactic Body Radiotherapy for Pulmonary Oligometastases from Colorectal Cancer. Anticancer Res. 2017;37:2709-2713. [PubMed] [DOI] |
| 16. | Bae SH, Kim MS, Cho CK, Kang JK, Kang HJ, Kim YH, Shin US, Moon SM, Lee DH. High dose stereotactic body radiotherapy using three fractions for colorectal oligometastases. J Surg Oncol. 2012;106:138-143. [PubMed] [DOI] |
| 17. | Kinj R, Bondiau PY, François E, G¨¦rard JP, Naghavi AO, Leysalle A, Chamorey E, Evesque L, Padovani B, Ianessi A, Benezery K, Doyen J. Radiosensitivity of Colon and Rectal Lung Oligometastasis Treated With Stereotactic Ablative Radiotherapy. Clin Colorectal Cancer. 2017;16:e211-e220. [PubMed] [DOI] |
| 18. | Comito T, Cozzi L, Clerici E, Campisi MC, Liardo RL, Navarria P, Ascolese A, Tozzi A, Iftode C, De Rose F, Villa E, Personeni N, Rimassa L, Santoro A, Fogliata A, Mancosu P, Tomatis S, Scorsetti M. Stereotactic Ablative Radiotherapy (SABR) in inoperable oligometastatic disease from colorectal cancer: a safe and effective approach. BMC Cancer. 2014;14:619. [PubMed] [DOI] |
| 19. | Jung J, Song SY, Kim JH, Yu CS, Kim JC, Kim TW, Jeong SY, Kim SS, Choi EK. Clinical efficacy of stereotactic ablative radiotherapy for lung metastases arising from colorectal cancer. Radiat Oncol. 2015;10:238. [PubMed] [DOI] |
| 20. | Rades D, Dziggel L, Blanck O, Gebauer N, Bartscht T, Schild SE. A Score to Identify Patients with Brain Metastases from Colorectal Cancer Who May Benefit from Whole-brain Radiotherapy in Addition to Stereotactic Radiosurgery/Radiotherapy. Anticancer Res. 2018;38:3111-3114. [PubMed] [DOI] |
| 21. | Jingu K, Matsushita H, Yamamoto T, Umezawa R, Ishikawa Y, Takahashi N, Katagiri Y, Takeda K, Kadoya N. Stereotactic Radiotherapy for Pulmonary Oligometastases From Colorectal Cancer: A Systematic Review and Meta-Analysis. Technol Cancer Res Treat. 2018;17:1533033818794936. [PubMed] [DOI] |
| 22. | Palmer J, Mesa R. Transplantation in Myelofibrosis Reaches the Molecular Age. Biol Blood Marrow Transplant. 2017;23:1043-1044. [PubMed] |
| 23. | Filippi AR, Guerrera F, Badellino S, Ceccarelli M, Castiglione A, Guarneri A, Spadi R, Racca P, Ciccone G, Ricardi U, Ruffini E. Exploratory Analysis on Overall Survival after Either Surgery or Stereotactic Radiotherapy for Lung Oligometastases from Colorectal Cancer. Clin Oncol (R Coll Radiol). 2016;28:505-512. [PubMed] [DOI] |
| 24. | Joo JH, Park JH, Kim JC, Yu CS, Lim SB, Park IJ, Kim TW, Hong YS, Kim KP, Yoon SM, Park J, Kim JH. Local Control Outcomes Using Stereotactic Body Radiation Therapy for Liver Metastases From Colorectal Cancer. Int J Radiat Oncol Biol Phys. 2017;99:876-883. [PubMed] [DOI] |