修回日期: 2019-04-25
接受日期: 2019-05-15
在线出版日期: 2019-06-08
肠黏膜屏障的损伤、免疫系统紊乱可能是腹型过敏性紫癜(henoch-schonlein purpura, HSP)的重要发病机制之一, 然而免疫因子与肠黏膜屏障损伤的关系尚不清楚.
探讨外周血、肠黏膜白细胞介素-17(interleukin-17, IL-17)及其相关细胞因子的变化在腹型HSP发病机制中的作用, 以及了解肠道菌群失调与腹型HSP发病机制的关系.
选取26例急性期腹型HSP患儿为观察组, 16例健康体检儿童为健康对照组, 收集两组儿童外周血、粪便标本; 选取20例接受胃镜检查的急性期腹型HSP患儿为病例组, 8例胃镜检查无明显黏膜病变的儿童为对照组, 收集两组儿童十二指肠黏膜组织. 采用流式细胞术检测外周血单个核细胞中辅助性T细胞-17(Th17)、细胞毒性T细胞-17(Tc17)细胞比例; ELISA检测血浆IL-17、IL-6、IL-23、γ-干扰素(IFN-γ)细胞因子含量; HE染色观察十二指肠黏膜活检组织病理改变; RT-PCR及免疫组化法检测十二指肠黏膜IL-17、IL-6、IL-23、IFN-γ mRNA及蛋白表达水平; 细菌16S rDNA法检测肠道粪便中双歧杆菌、大肠杆菌的数量.
观察组Th17与Tc17细胞比例均较健康对照组显著增高(P<0.05). 观察组血浆IL-17、IL-6、IL-23水平均较健康对照组显著增高(P<0.05). 病例组十二指肠黏膜组织病理改变主要为非特异性慢性炎症, 部分可见血管炎性病变. 病例组十二指肠黏膜IL-17、IL- 6、IFN-γ mRNA及蛋白表达水平较对照组显著增高(P<0.05). 观察组双歧杆菌数量、双歧杆菌/大肠杆菌比值较健康对照组显著下降(P<0.05).
IL-17及其相关细胞因子参与了腹型HSP患儿全身及肠黏膜局部的炎症反应, 肠道菌群失调可能促进IL-17介导的炎症反应过程. 与腹型HSP的发病及肠黏膜屏障损伤有关.
核心提要: 急性期腹型过敏性紫癜(henoch-schonlein purpura, HSP)患儿Th17、Tc17细胞表达增高, IL-17在全身及肠黏膜局部一致性表达增高, 提示IL-17与腹型HSP的发病及肠黏膜损伤具有相关性; 患儿肠道双歧杆菌数量减少, 双歧杆菌/大肠杆菌比值<1, 提示肠道菌群失调与腹型HSP发病机制有关.
引文著录: 兰连成, 杨梅雄, 唐清, 吕自力, 云翔, 黄丽, 陈秀奇, 单庆文. IL-17及其相关细胞因子在腹型过敏性紫癜患儿外周血和肠黏膜中的变化. 世界华人消化杂志 2019; 27(11): 694-702
Revised: April 25, 2019
Accepted: May 15, 2019
Published online: June 8, 2019
Intestinal mucosal barrier injury and immune system disorder may be important in the pathogenesis of abdominal Henoch-Schonlein purpura (HSP). However, the relationship between immune factors and intestinal mucosal barrier injury remains unclear.
To investigate the role of changes of interleukin-17 (IL-17) and its related cytokines in peripheral blood and intestinal mucosa in the pathogenesis of abdominal HSP, and to analyze the relationship between intestinal dysbacteriosis and the pathogenesis of abdominal HSP.
Twenty-six children with acute abdominal HSP were included into an observation group and 16 healthy children were included into a healthy control group. Peripheral blood and fecal samples were collected from subjects of the two groups. Twenty children with acute abdominal HSP who underwent gastroscopy were selected as a case group, and eight children without obvious mucosal lesions were selected as a control group. The duodenal mucosal tissues of the two groups were collected. Flow cytometry was used to detect the percentages of Th17 cells and Tc17 cells in peripheral blood mononuclear cells (PBMCs). ELISA was used to detect the contents of IL-17, IL-6, IL-23, and IFN-γ in plasma. HE staining was used to observe the pathological changes in the duodenal mucosa. RT-qPCR and immunohistochemistry were used to detect the mRNA and protein expression levels of IL-17, IL-6, IL-23, and IFN-γ in the duodenal mucosa, respectively. Bacterial 16S rDNA was used to detect the number of Bifidobacterium and Escherichia coli in feces.
The percentages of Th17 and Tc17 cells in the observation group were significantly higher than those in the control group (P < 0. 05). Plasma concentrations of IL-17, IL-6, and IL-23 in the observation group were significantly higher than those in the healthy control group (P < 0. 05). The pathological changes in the duodenal mucosa in the case group were non-specific chronic inflammation, with vascular inflammatory lesions observed in some cases. The expression of IL-17, IL-6, and IFN-γ mRNAs and proteins in the duodenal mucosa in the case group were significantly higher than those in the control group (P < 0. 05). The quantity of Bifidobacterium and Bifidobacterium/Escherichia coli ratio in the observation group were significantly lower than those in the healthy control group (P < 0.05).
IL-17 and its related cytokines are involved in systemic and intestinal mucosal inflammation in children with abdominal HSP. Intestinal dysbacteriosis may promote the IL-17-mediated inflammatory reaction, which is related to the pathogenesis of abdominal HSP and intestinal mucosal barrier injury.
- Citation: Lan LC, Yang MX, Tang Q, Lu ZL, Yun X, Huang L, Chen XQ, Shan QW. Changes of IL-17 and related cytokines in peripheral blood and intestinal mucosa of children with abdominal Henoch-Schonlein purpura. Shijie Huaren Xiaohua Zazhi 2019; 27(11): 694-702
- URL: https://www.wjgnet.com/1009-3079/full/v27/i11/694.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v27.i11.694
过敏性紫癜(henoch-schonlein purpura, HSP)是儿童时期最常见的出血性疾病之一, 是由免疫复合介导的累及全身多个器官, 以小血管炎症为主要病变的系统性血管炎; 其临床分型有单纯皮肤型、腹型、肾型、关节型以及混合型HSP. 该病的发生率呈逐年上升趋势, 而以皮肤紫癜伴有腹痛、恶心、呕吐、便血等消化道症状为主要表现的腹型HSP可占本病的50%-75%[1,2], 造成胃肠黏膜不同程度的损害. 近年研究发现细胞免疫失调及细胞因子紊乱、肠道微生物屏障菌群结构改变与腹型HSP的发病及病程有关[3].
IL-17是一种强大的前炎性细胞因子, 在介导炎症反应过程中发挥中枢性调节作用[4]. Th17与Tc17细胞是IL-17的两大主要来源细胞, Th17细胞产生的IL-17与多种细胞因子协同作用参与体内固有免疫、黏膜免疫、血管新生等多种生理病理反应[5]. Tc17细胞主要通过分泌IL-17、IFN-γ、TNF-α等细胞因子增强T细胞、中性粒细胞和巨噬细胞在炎症部位的聚集. 两者的分化及在疾病中的作用受细胞因子微环境的调节. IL-6与转录生长因子-β(tissue growth factor-β, TGF-β)是启动Th17、Tc17细胞的分化的关键, IL-23对已分化的Th17、Tc17细胞起稳定和维持其细胞特性的作用[6]. IFN-γ是Th1细胞的主要效应因子, 研究表明IFN-γ与IL-17之间即相互协调又相互拮抗. 两者之间的平衡紊乱可导致组织免疫病理的发生[5].
目前已有多项研究表明IL-17及Th17细胞在外周血中高表达与HSP的发病机制有关, IL-17可能通过介导炎症反应促进HSP患者靶器官皮肤及肾小球的病理损伤[7,8]. 但关于IL-17与腹型HSP的发病及肠黏膜屏障损伤的研究较少, 本研究通过检测急性期腹型HSP患儿外周血Th17、Tc17细胞比例和外周血及十二指肠黏膜中IL-17及其相关细胞因子的表达以及肠道菌群结构变化, 旨在探讨外周血、肠黏膜IL-17及其相关细胞因子的变化在腹型HSP发病机制中的作用, 以及了解肠道菌群失调与腹型HSP发病机制的关系, 以期为临床免疫治疗腹型HSP提供一定的理论依据.
选取2015-11/2018-02在广西医科大学第一附属医院儿科病区住院的确诊为腹型HSP的急性期患儿26例为观察组, 其中男19例, 女7例; 年龄7.46岁±3.01岁. 另取健康体检儿童16例为健康对照组, 其中男9例, 女7例; 年龄5.6岁±3.0岁. 于清晨空腹时采集肘静脉血3 mL, 并留取粪便标本. 两组儿童在年龄、性别上的差异无统计学意义. 选取20例接受胃镜检查的急性期腹型HSP患儿为病例组, 其中男18例, 女2例; 年龄8.2岁±3.1岁. 8例胃镜检查示无明显黏膜病变的儿童为对照组, 其中男3例, 女5例; 年龄10.62岁±3.72岁. 于胃镜检查时采集十二指肠黏膜活检组织标本. 所有腹型HSP患儿的临床诊断均符合《诸福棠实用儿科学》第八版诊断标准[9]. 排除其他自身免疫性疾病、过敏性疾病或感染、肿瘤性疾病. 该临床研究已经通过医院伦理委员会审核, 受试者及家属对该研究均已知情同意.
1.2.1 流式细胞术: 取所收集外周血, 经Ficoll密度梯度离心法分离获得单个核细胞(peripheral blood mononuclear cells, PBMCs), 加佛波酯离子霉素混合物、布雷非德菌素A/莫能霉素混合物于培养液混合, 于37 ℃的体积分数为5%的CO2培养箱中刺激培5 h, 收集培养后的细胞混合液. 取上述细胞培养后的混合液, 以CD3-PreCP、CD4-FITC、CD8-APC设门, 固定破膜, 17A-PE避光染色30 min, PBS洗涤后重新悬浮细胞上机检测(FACSCanto Ⅱ流式细胞仪).
1.2.2 ELISA: 血浆按照人IL-17、IL-6、IL-23、IFN-γELISA试剂盒说明书进行操作; 使用全自动酶标仪检测OD值, Curve Expert 1.4软件绘制标准曲线, 计算IL-17、IL-6、IL-23、IFN-γ的蛋白浓度.
1.2.3 HE染色: 石蜡切片常规HE染色, 由病理科两位资深老师阅片, 于光学显微镜下观察十二指肠黏膜病理学改变.
1.2.4 RT-qPCR: 按试剂盒说明提取组织RNA, 逆转录合成cDNA. 采用SYBR Green Ⅰ嵌合荧光法, 应用美国ABI 7500荧光定量PCR仪进行扩增检测. 引物序列为: β-actin上游引物序列5'-GGCACCACACCTTCTACAATGAGC-3', β-actin下游引物序列5'-GATAGCACAGCCTGGATAGCAACG-3'; IL-6上游引物序列5'-GGTGTTGCCTGCTGCCTTCC-3', IL-6下游引物序列5'-GTTCTGAAGAGGTGAGTGGCTGTC-3'; IL-17上游引物序列5'-GTGTCACTGCTACTGCTGCTGAG-3', IL-17下游引物序列5'-GT-GAGGTGGATCGGTTGTAGTAATCTG-3'; IL-23上游引物序列5'-AGTGCCAGCAGCTTTCACAGA-3', IL-23下游引物序列5'-AATCAGACCCTGGTGGATCCTT-3'; IFN-γ上游引物序列5'-AGT GATGGCTGAACTGTCGC-3', IFN-γ下游引物序列5'-ACTGGGATGCTCTTCGAC-CT-3'. 结果采用2-△△Ct法计算各目的基因mRNA的相对表达量.
1.2.5 免疫组织化学染色法: 石蜡切片行免疫组织化学染色SP法检测十二指肠黏膜中各细胞因子的表达, 光镜下观察结果, 细胞染色呈棕黄色或棕褐色颗粒为阳性, 不着色为阴性. 应用Image-Pro Plus 6.0病理图像分析仪, 采用光密度值法对其进行计量, 求得平均值.
1.2.6 16S rDNA qPCR: 所收集的粪便标本经室温溶解后于电子分析天平上称取0.2 g湿便, 按试剂盒说明书要求提取DNA. 标准菌株复活、接种培养后用试剂盒提取DNA作为标准品; 双歧杆菌上游引物序列5'-GGCTCGTAGGCGGTTCGTC-3', 下游引物序列5'-GCCTTCGCCATTGGTGTTCTTC-3'; 大肠杆菌上游引物序列5'-CATGCCGCGTGTATGAAGAA-3', 下游引物序列5'-CGGGTAACGTCAATGAGCAAA-3'; 根据两种标准菌株DNA吸光度(A260值), 配制各细菌DNA 106 copies/μL-1010 copies/μL浓度梯度的标准品溶液; PCR仪上设置采用绝对定量标准曲线法进行qPCR扩增. 扩增结束时, 根据7500 PCR仪分析系统软件software v2.0所生成的标准曲线及其相关系数建立标准曲线方程(双歧杆菌: Y = -3.42X+51.236, R2 = 0.999, Eff% = 96.06%; 大肠杆菌: Y = -3.286X+47.258, R2 = 0.994, Eff% = 101.53%). 每份粪便标本所含的两种细菌数量可通过循环数(CT值)与标准曲线比较得到, 结果以每克湿便的细菌基因拷贝数的对数值表示. 并计算双歧杆菌/大肠杆菌(bifidobacterium and bifidobacterium/escherichia coli, B/E)比值以反应儿童肠道功能状态及对健康的影响. 当B/E比值≥1, 表示肠道定植抗力正常; 当B/E比值<1, 表示肠道定植抗力降低, 菌群结构发生紊乱(菌群失调).
统计学处理 采用SPSS 17.0统计软件进行分析, 计量资料结果均采用mean±SD表示, 两组间均数比较若方差齐采用t检验, 若方差不齐采用t'检验, 所有假设检验用双侧检验, P<0.05为差异有统计学意义.
观察组腹型HSP患儿外周血PBMCs中CD3+CD4+IL-17+T细胞(Th17细胞)比例、CD3+CD8+IL-17+T细胞(Tc17细胞)比例均较健康对照组儿童显著升高, 差异有统计学(P<0.05); Th17/Tc17比值较健康对照组儿童差异无统计学意义(P>0.05, 见表1).
| 分组 | n | Th17(%) | Tc17(%) | Th17/Tc17 |
| 健康对照组 | 16 | 0.29 ± 0.24 | 0.03 ± 0.04 | 17.60 ± 15.74 |
| 观察组 | 26 | 1.82 ± 0.96 | 0.41 ± 0.34 | 8.43 ± 8.13 |
| t值 | 7.82 | 5.64 | 1.95 | |
| P值 | 0.000 | 0.000 | 0.070 |
观察组腹型HSP患儿血清IL-17、IL-23、IL-6较健康对照组儿童显著升高, 差异有统计学意义(P<0.05); IFN-γ较健康对照组儿童稍高, 但差异无统计学意义(P>0.05, 表2).
| 分组 | n | IL-6 (pg/mL) | IL-17 (pg/mL) | IL-23 (pg/mL) | IFN-γ (pg/mL) |
| 健康对照组 | 16 | 1.91 ± 1.39 | 1.69 ± 1.59 | 13.82 ± 8.03 | 2.19 ± 1.40 |
| 观察组 | 26 | 4.36 ± 4.36 | 4.46 ± 4.40 | 27.23 ± 18.32 | 3.36 ± 2.63 |
| t值 | 2.15 | 2.27 | 2.98 | 3.90 | |
| P值 | 0.047 | 0.034 | 0.006 | 0.109 |
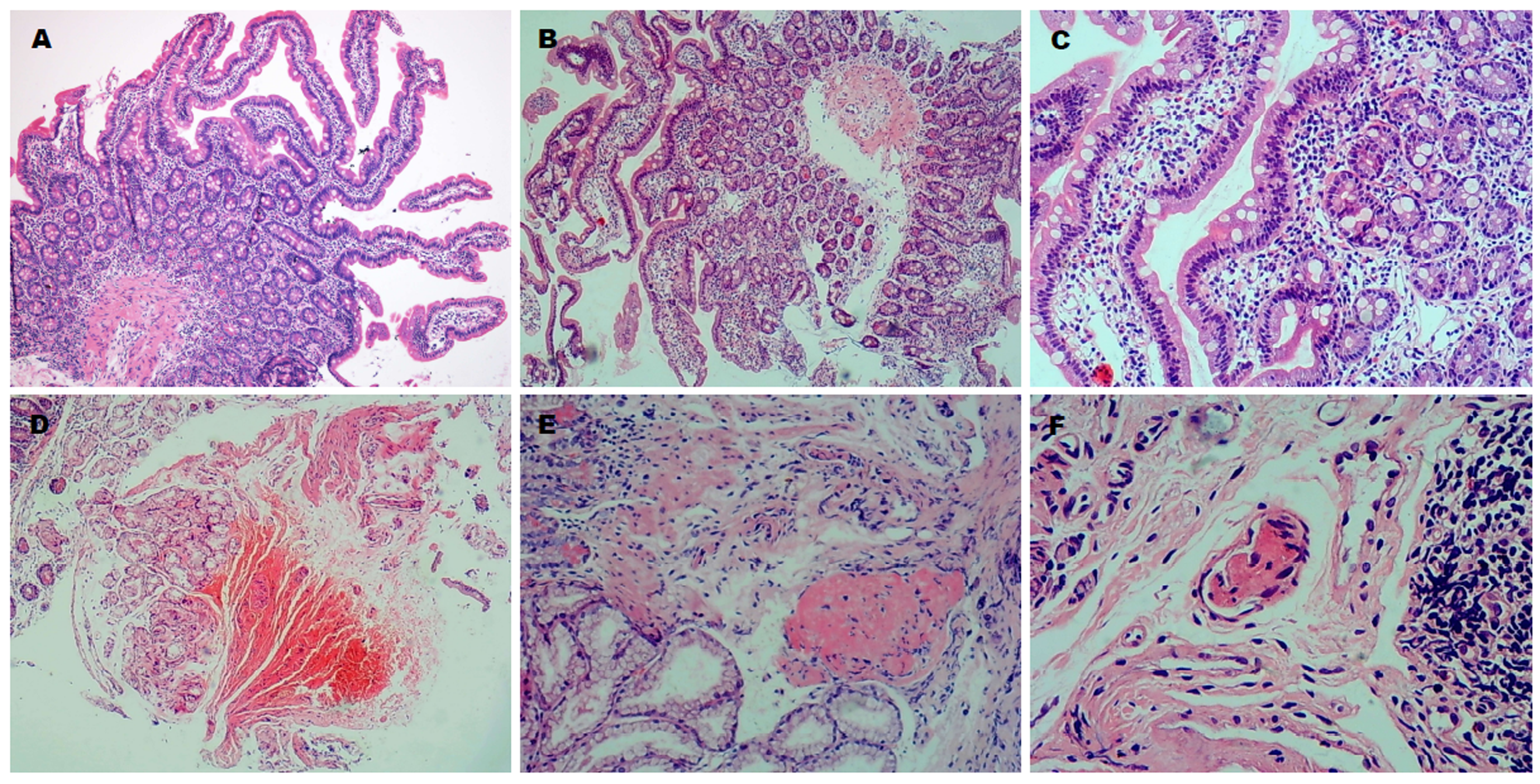
经HE常规染色后显微镜下观察, 结果示病例组腹型HSP患儿十二指肠黏膜主要表现为非异性慢性炎症, 20例患儿中有1例表现为轻度炎症, 19例表现为中度炎症; 伴或不伴糜烂或溃疡等. 黏膜内及黏膜下层可见炎细胞浸润、出血、间质水肿、血栓形成、组织坏死等. 其中有1例病例可见明显的黏膜下层血管壁破坏及纤维素样坏死,血管周围中性粒细胞、嗜酸性细胞浸润的血管炎性病变(图1).
病例组腹型HSP患儿较对照组儿童十二指肠黏膜IL-17、IL-6、IFN-γ mRNA表达水平显著增高, 差异有统计学意义(P<0.05), IL-23较对照儿童组稍高, 但差异无统计学意义(P>0.05, 表3).
| 分组 | n | IL-6 | IL-17 | IL-23 | IFN-γ |
| 对照组 | 8 | 0.27 ± 0.33 | 0.26 ± 0.32 | 0.31 ± 0.34 | 0.15 ± 0.34 |
| 病例组 | 20 | 4.41 ± 3.48 | 12.22 ± 9.27 | 0.64 ± 0.77 | 2.18 ± 2.38 |
| t值 | 3.74 | 3.64 | 1.12 | 2.66 | |
| P值 | 0.004 | 0.008 | 0.282 | 0.025 |
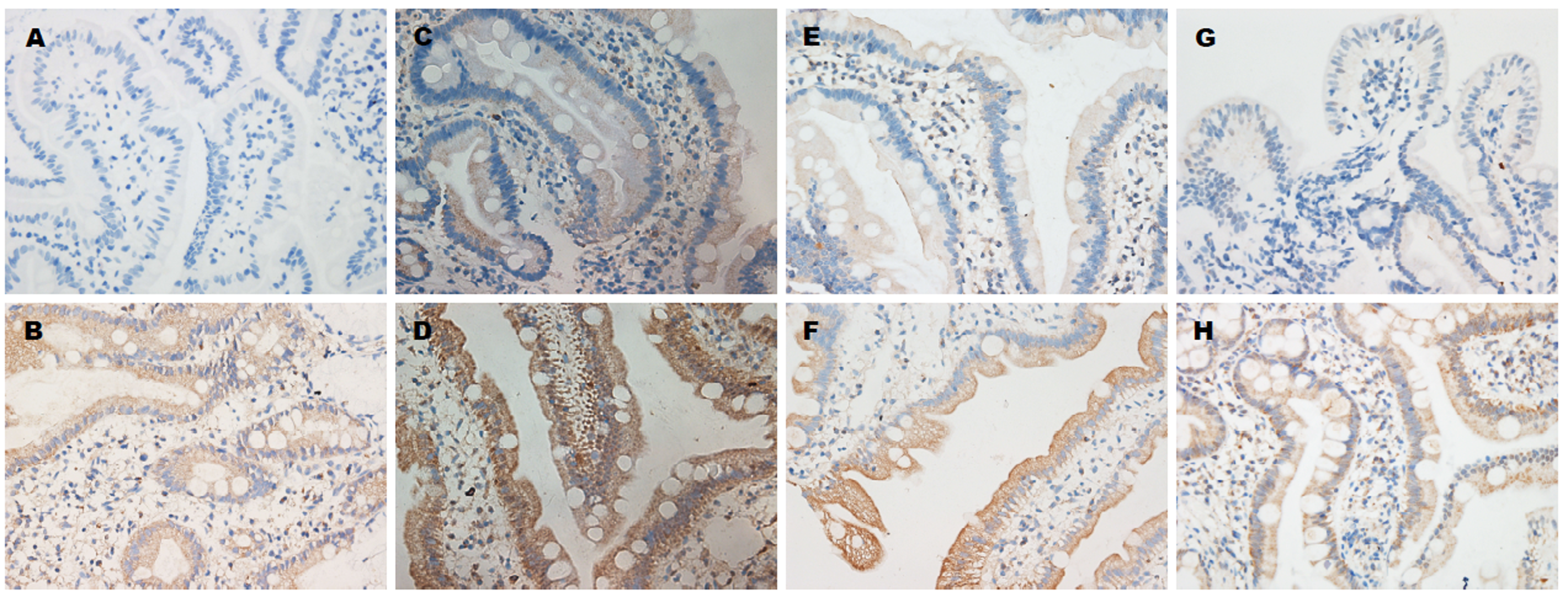
2.5 十二指肠黏膜组织IL-6、IL-17、IL-23、IFN-γ蛋白表达 免疫组织化学染色结果示IL-6、IL-17、IL-23、IFN-γ蛋白阳性表达主要分布于黏膜上皮细胞胞质. 其中, IL-6、IFN-γ在对照组中基本不表达, 在病例组阳性表达; IL-17、IL-23在对照组及病例组中均为阳性表达, 见(图2). 光密度分析结果示病例组腹型HSP患儿较对照组儿童十二指肠黏膜IL-17、IL-6、IFN-γ平均光密度值显著增高, 差异有统计学意义(P<0.05), IL-23平均光密度值较对照儿童组稍高, 但差异无统计学意义(P>0.05, 表4).
| 分组 | n | IL-6 | IL-17 | IL-23 | IFN-γ |
| 对照组 | 8 | 0.07 ± 0.00 | 0.24 ± 0.04 | 0.13 ± 0.03 | 0.11 ± 0.01 |
| 病例组 | 20 | 0.16 ± 0.04 | 0.33 ± 0.06 | 0.15 ± 0.05 | 0.13 ± 0.03 |
| t值 | 8.29 | 3.14 | 1.02 | 3.23 | |
| P值 | 0.000 | 0.002 | 0.317 | 0.004 |
Th17、Tc17细胞是体内重要的免疫调节细胞, 在致病原的刺激下其细胞活化增强并产生大量的IL-17介导炎症免疫应答. 研究已证实Th17、Tc17细胞比例增加与银屑病、免疫性血小板减少性紫癜、哮喘、变态反应性接触性皮炎、流感、黑色素瘤等疾病的发病有关[10]. 国内外研究表明HSP患者外周血存在Th17细胞及IL-17高表达[3,11,12], 但其作用机制尚未明确. 且关于Tc17细胞的表达变化与HSP发病的关系的研究未见报道. 本研究结果显示腹型HSP患儿外周血中Th17、Tc17细胞比例均显著增高, Th17/Tc17细胞比值无显著改变; 提示腹型HSP患儿存在Tc17和Th17细胞分化异常, 但两者各自分化的程度可能并无相关性. 而血浆中IL-17、IL-6、IL-23水平显著增高, IFN-γ水平无显著改变. 提示了该细胞因子微环境促进Th17、Tc17细胞分化增加, 并引起全身性(系统性)的IL-17表达增高, 可能与腹型HSP发病密切相关.
腹型HSP患儿消化道症状表现明显, 与胃肠黏膜屏障受损有关. 本研究发现腹型HSP患儿的十二指肠黏膜组织病理改变为非特异性的炎症改变, 少部分病例可观察到血管壁纤维素样坏死及炎症细胞渗出的血管炎症改变, 与Louie等[13]研究结果一致, 提示腹型HSP患儿肠黏膜损伤的病理生理基础为炎症反应状态. Zhu等[14]研究发现IBD患儿血清和肠黏膜中IL-17和IL-23水平均增高, 并且与疾病的严重程度呈正相关. 近年研究发现机体组织病理损伤与炎症状态下IL-23的表达水平增加导致致病性Th17细胞(IL-17+IFN-Y+Th17细胞)分化增加有关. 该细胞产生的IL-17和IFN-γ协同介导的炎症反应在实验性自身免疫性脑脊髓炎(experimental allergic encephalitis, EAE)及炎症性肠病(inflammatory bowel disease, IBD)等自身免疫性及炎症性疾病中发挥重要作用[15]. Li等[16]研究发现IBD患者肠黏膜组织细胞中致病性Th17细胞占Th17细胞一定的比例, 在活动性炎症病变部位发生累积. 目前关于IL-17和IFN-γ在HSP发病机制中作用关系尚不明确. 国内外研究报道HSP患儿外周血Th17细胞及IL-17表达增加而Th1和IFN-γ表达下降[3,11], 因此, 一般认为Th17细胞及IL-17与HSP的发病有关, 而Th1和IFN-γ与HSP的发病可能无明显相关性. 然而, Gülhan等[17]通过免疫组化法检测则发现HSP患者肾组织中IFN-γ和IL-17的表达显著增高, 并推测IFN-γ和IL-17可能通过促进炎症反应在HSP肾炎中起一定作用. 本研究通过RT-qPCR及免疫组化法检测发现病例组腹型HSP患儿十二指肠黏膜IL-17、IL-6、IFN-γ mRNA及蛋白表达水平均显著增高, IL-23mRNA及蛋白表达水平表达略高, 因此推测十二指肠黏膜中产生IL-17的Th17细胞分化增强, 可能与部分Th17细胞转变成致病性Th17细胞有关, 导致IL-17与IFN-γ表达增高, 两者协同作用可能介导腹型HSP肠黏膜炎症反应, 促进肠黏膜损伤过程.
本研究通过探讨各细胞因子在外周血及十二指肠黏膜中表达的变化趋势, 结果发现腹型HSP患儿IL-17、IL-6表达水平在局部及全身的表达呈一致性增高, 证实了IL-17在腹型HSP的全身性免疫及局部黏膜免疫均发挥重要作用. 然而, IFN-γ、IL-23表达水平在局部及全身性的表达均存在一定的差异. 本研究病例组及对照组儿童十二指肠黏膜组织均表达IL-23, 病例组十二指肠黏膜IL-23mRNA及蛋白表达水平较对照组略增高, 但血浆中的IL-23蛋白表达水平较对照组显著增高, 考虑可能与本研究中十二指肠黏膜样本量较小有关, 有待扩大样本进一步证实. 另外, 本研究观察组血浆IFN-γ蛋白的表达较健康对照组并无明显变化, 与国内外研究结果一致[11,18], 然而病例组IFN-γ mRNA及蛋白表达水平在十二指肠黏膜组织中表达显著增高, 我们推测腹型HSP患儿肠黏膜局部可能存在同时分泌IL-17、IFN-γ的致病性Th17细胞, 该细胞多在肠道炎症部位累积, 但其确切原因及机制有待进一步探讨.
近年来, 研究发现IL-17与肠道共生微生物在维持胃肠黏膜屏障的稳态发挥重要作用[19,20]. 肠道共生菌尤其是分段丝状细菌(segmented filamentous bacteria, SFB)可以产生细胞外三磷酸腺苷(adenosine triphosphate, ATP)及血清淀粉样蛋白A(serum amyloid protein A, SAA)等分子, 通过各类Toll样受体(toll like receptor, TLR)等相关信号通路调节肠黏膜固有层Th17细胞的发育. Th17细胞产生的IL-17则通过刺激上皮细胞分泌抗菌肽以增强上皮细胞屏障功能, 从而阻止致病菌的繁殖. 双歧杆菌可上调肠道Treg细胞的分化以恢复肠黏膜免疫耐受功能, 抑制Th17细胞的过度活化, 从而减轻IL-17介导的炎症反应[21]. 反之, 肠道菌群失调时, 肠黏膜屏障受损, 一些致病菌侵袭力增强, 诱导Th17细胞过度活化、增殖并产生大量的效应因子IL-17, IL-17通过募集炎症细胞及炎症因子等介导炎症反应以清除病原菌, 但强烈及持续的炎症反应则造成肠黏膜局部病理损伤[22]. 本研究发现腹型HSP患儿肠道有益菌双歧杆菌数量明显下降, 潜在致病菌大肠杆菌数量无明显变化, B/E比值下降且B/E比值<1, 证实了肠道存在菌群失调. 由此推测腹型HSP患儿肠道菌群失调, 致病菌侵袭力增强可能刺激Th17细胞分泌IL-17增加, 从而扩大了IL-17介导的肠黏膜免疫及炎症反应过程, 进而加重了肠黏膜屏障损伤.
总之, 本研究发现腹型HSP患儿外周血及肠黏膜均存在IL-17的高表达, IL-17及其相关细胞因子参与了腹型HSP患儿全身及肠黏膜局部的炎症反应, 肠道菌群失调可能促进IL-17介导的炎症反应过程. 与腹型HSP的发病及黏膜屏障损伤机制密切相关, 但其具体的作用途径与机制尚有待深入研究探讨. 此外, 因本研究为小样本研究, 所获结论有待将来扩大样本进一步研究证实.
肠黏膜屏障的损伤、免疫系统紊乱、肠道菌群失调可能是腹型过敏性紫癜(henoch-schonlein purpura, HSP)的重要发病机制之一, 然而对于免疫因子与肠黏膜屏障损伤的关系尚不清楚.
本研究主要探讨急性期腹型HSP患儿外周血及十二指肠黏膜中IL-17及其相关细胞因子的表达变化及其与肠道黏膜防御屏障(简称黏膜屏障)的关系, 拟明确全身及局部黏膜IL-17等免疫细胞因子在腹型HSP发病机制中的作用, 同时了解肠道菌群失调与腹型HSP的关系. 所获的结果将有可能为临床探索新的腹型HSP治疗策略提供一定的理论依据.
本研究旨在明确全身及局部黏膜IL-17等免疫细胞因子在腹型HSP发病机制中的作用, 同时了解肠道菌群失调与腹型HSP的关系. 本研究表明IL-17及其相关细胞因子可能介导全身性及肠黏膜局部的炎症反应, 肠道菌群失调则可能加重了IL-17的炎症反应, 与腹型HSP的发病及黏膜屏障损伤机制具有相关性. 进一步扩大样本及研究肠黏膜机械屏障的损伤情况, 分析肠道免疫屏障、生物屏障、机械屏障三者之间的相关性, 将有可能为本研究结论提供更有力的依据, 甚至为临床特异性免疫治疗及益生菌治疗腹型HSP提供更多依据.
本研究(1)采用了流式细胞术: 流式细胞术可以检测某种细胞的不同细胞亚群的百分比(比例). (2)ELISA检测: 操作简便、灵敏度高、特异性高, 可定量检测蛋白含量. (3)(RT-PCR): 特异性检测不同基因的表达情况, 可计算基因的相对表达量. (4)免疫组化法: 可对待测指标在组织中的表达进行定位检测, 通过软件可进行定量分析. (5)组织HE染色: 是观察组织病理学改变的常用方法. (6)细菌16S rDNA法: 特异度高, 可以定量检测待测细菌的含量.
本研究已达到预期的实验目标. 本研究结果主要发现了腹型HSP患儿表达Th17、Tc17细胞明显增高; 腹型HSP患儿外周血IL-17、IL-6、IL-23水平增高, IFN-γ水平无明显改变; 腹型HSP患儿十二指肠黏膜组织病变主要为非特异性慢性炎症, 部分可见血管炎性病变; 腹型HSP患儿十二指肠黏膜IL-17、IL-6、IFN-γ mRNA及蛋白表达水平均明显增高, IL-23mRNA及蛋白表达水平增高不明显; 腹型HSP患儿双歧杆菌数量、双歧杆菌/大肠杆菌(B/E)比值下降(P<0.05). 大肠杆菌数量无明显改变. 本研究结果提示了IL-17及其相关细胞因子通过介导全身性及肠黏膜局部的炎症反应, 肠道菌群失调则可能扩大了IL-17介导的炎症反应过程, 与腹型HSP的发病及黏膜屏障损伤机制密切相关. 可能为临床特异性免疫治疗和(或)及益生菌治疗腹型HSP提供一定的理论依据.
本研究发现Tc17细胞在腹型HSP患儿外周血中高表达; IL-17在腹型HSP患儿黏膜组织中高表达, 与外周血高表达趋势一致; IFN-γ在腹型HSP患儿黏膜组织中高表达. 可能与炎症部位的致病性Th17细胞(IFN-γ+IL-17+T细胞)产生IFN-γ有关.
在获取足够大的研究样本例数的基础上. 对不同指标间可能存在的作用关系进行更深的探索. 本研究未来研究的方向是: (1)完成肠黏膜机械屏障相关指标的研究. 进一步探讨肠道机械屏障、免疫屏障、生物屏障三者之间的关系. (2)研究IL-17及其相关细胞的表达水平与肠黏膜炎症程度是否存在相关性.
学科分类: 胃肠病学和肝病学
手稿来源地: 广西壮族自治区
同行评议报告分类
A级 (优秀): 0
B级 (非常好): B
C级 (良好): C, C
D级 (一般): D
E级 (差): 0
编辑: 崔丽君 电编:刘继红
| 1. | Lee YH, Kim YB, Koo JW, Chung JY. Henoch-Schonlein Purpura in Children Hospitalized at a Tertiary Hospital during 2004-2015 in Korea: Epidemiology and Clinical Management. Pediatr Gastroenterol Hepatol Nutr. 2016;19:175-185. [PubMed] [DOI] |
| 2. | Hetland LE, Susrud KS, Lindahl KH, Bygum A. Henoch-Schonlein Purpura: A Literature Review. Acta Derm Venereol. 2017;97:1160-1166. [PubMed] [DOI] |
| 5. | Veldhoen M. Interleukin 17 is a chief orchestrator of immunity. Nat Immunol. 2017;18:612-621. [PubMed] [DOI] |
| 6. | Srenathan U, Steel K, Taams LS. IL-17+ CD8+ T cells: Differentiation, phenotype and role in inflammatory disease. Immunol Lett. 2016;178:20-26. [PubMed] [DOI] |
| 7. | Xu H, Pan Y, Li W, Fu H, Zhang J, Shen H, Han X. Association between IL17A and IL17F polymorphisms and risk of Henoch-Schonlein purpura in Chinese children. Rheumatol Int. 2016;36:829-835. [PubMed] [DOI] |
| 10. | Li YY, Li CR, Wang GB, Yang J, Zu Y. Investigation of the change in CD4 T cell subset in children with Henoch-Schonlein purpura. Rheumatol Int. 2012;32:3785-3792. [PubMed] [DOI] |
| 11. | Wang Q, Shi YY, Cao M, Dong W, Zhang JB. Role of Imbalance between Th17 Cells and Treg Cells in the Pathogenesis of Children with Henoch-Schonlein Purpura. Zhongguo Shi Yan Xue Ye Xue Za Zhi. 2015;23:1391-1396. [PubMed] [DOI] |
| 12. | Louie CY, Gomez AJ, Sibley RK, Bass D, Longacre TA. Histologic Features of Gastrointestinal Tract Biopsies in IgA Vasculitis (Henoch-Schonlein Purpura). Am J Surg Pathol. 2018;42:529-533. [PubMed] [DOI] |
| 13. | Zhu XM, Shi YZ, Cheng M, Wang DF, Fan JF. Serum IL-6, IL-23 profile and Treg/Th17 peripheral cell populations in pediatric patients with inflammatory bowel disease. Pharmazie. 2017;72:283-287. [PubMed] [DOI] |
| 14. | Globig AM, Hennecke N, Martin B, Seidl M, Ruf G, Hasselblatt P, Thimme R, Bengsch B. Comprehensive intestinal T helper cell profiling reveals specific accumulation of IFN-γ+IL-17+coproducing CD4+ T cells in active inflammatory bowel disease. Inflamm Bowel Dis. 2014;20:2321-2329. [PubMed] [DOI] |
| 15. | Li J, Doty AL, Tang Y, Berrie D, Iqbal A, Tan SA, Clare-Salzler MJ, Wallet SM, Glover SC. Enrichment of IL-17A IFN-γ and IL-22 IFN-γ T cell subsets is associated with reduction of NKp44 ILC3s in the terminal ileum of Crohn¡¯s disease patients. Clin Exp Immunol. 2017;190:143-153. [PubMed] [DOI] |
| 16. | Gulhan B, Orhan D, Kale G, Besbas N, Qzen S. Studying cytokines of T helper cells in the kidney disease of IgA vasculitis (Henoch-Schonlein purpura). Pediatr Nephrol. 2015;30:1269-1277. [PubMed] [DOI] |
| 17. | 王 烨, 梁 庆红, 张 莹, 张 琳. CD4+T淋巴细胞亚群在儿童过敏性紫癜病理机制中的调控作用. 中华实用儿科临床杂志. 2015;21:1614-1618. [DOI] |
| 18. | Ahluwalia B, Magnusson MK, Ohman L. Mucosal immune system of the gastrointestinal tract: maintaining balance between the good and the bad. Scand J Gastroenterol. 2017;52:1185-1193. [PubMed] [DOI] |
| 19. | Kayama H, Takeda K. Functions of innate immune cells and commensal bacteria in gut homeostasis. J Biochem. 2016;159:141-149. [PubMed] [DOI] |
| 20. | Zhang D, Wei C, Yao J, Cai X, Wang L. Interleukin-10 gene-carrying bifidobacteria ameliorate murine ulcerative colitis by regulating regulatory T cell/T helper 17 cell pathway. Exp Biol Med (Maywood). 2015;240:1622-1629. [PubMed] [DOI] |
| 21. | Atarashi K, Tanoue T, Umesaki Y, Honda K. Regulation of Th17 cell differentiation by intestinal commensal bacteria. Benef Microbes. 2010;1:327-334. [PubMed] [DOI] |