修回日期: 2018-01-14
接受日期: 2018-01-22
在线出版日期: 2018-02-28
原发性肝癌(hepatocellular carcinoma, HCC)是常见恶性肿瘤之一, 中医药在治疗HCC领域具有独特的疗效. 中药黄芩具有解热保肝之功效, 其主要有效活性成分黄芩苷治疗HCC的作用近年来被大量报道. 其抑制HCC生长的机制涉及诱导癌细胞凋亡和分化、抑制蛋白合成、抑制癌细胞迁徙、干扰细胞间通讯和逆转肿瘤耐药等. 此外, 黄芩苷与传统化疗药物或其他抗癌中药用于治疗HCC也有较好的协同作用. 基于黄芩苷的体内吸收特征和分子结构, 研究者亦开发出黄芩苷固体脂质纳米粒和黄芩苷金属离子复合物, 为黄芩苷的靶向治疗和提高抗癌效果提供了新视角. 本文综述了近年来黄芩苷治疗HCC的国内外文献报道, 以期为临床和科研工作者提供有价值参考.
核心提要: 原发性肝癌(hepatocellular carcinoma, HCC)为常见恶性肿瘤, 中医药在治疗HCC领域具有独特的疗效. 中药黄芩主要成分黄芩苷治疗HCC的作用近年来被大量报道. 本文重点综述黄芩苷从诱导癌细胞凋亡和分化、抑制蛋白合成、抑制癌细胞迁徙、干扰细胞间通讯、逆转肿瘤耐药、协同增效和靶向新剂型开发等方面治疗HCC作用的进展.
引文著录: 向东, 杨金玉, 张程亮, 刘东. 黄芩苷治疗原发性肝癌的研究进展. 世界华人消化杂志 2018; 26(6): 378-383
Revised: January 14, 2018
Accepted: January 22, 2018
Published online: February 28, 2018
Hepatocellular carcinoma (HCC) is one of the most common malignant tumors. Traditional Chinese medicine (TCM) has shown special therapeutic effects for HCC. Scutellaria baicalensis Georgi has antipyretic and hepatoprotective effects, and baicalin, the main active compound of Scutellaria baicalensis Georgi, has been widely reported for the treatment of HCC in recent years. The mechanisms of baicalin for inhibition of liver cancer growth involve inducing cancer cell apoptosis and differentiation, inhibiting protein synthesis and cancer cell migration, interfering with intercellular communication, reversing tumor drug resistance and so on. In addition, baicalin combined with traditional chemotherapeutic drugs or other anti-cancer TCMs has been demonstrated to exert good synergistic activity for HCC treatment. Based on the in vivo absorption characteristics and molecular structure of baicalin, researchers have developed solid lipid nanoparticles and metal-ion complexes of baicalin, which provides new insights into the use of baicalin in targeted therapy and improves anti-cancer effects. In this paper, we will review the recent advances in research of baicalin in the treatment of baicalin.
- Citation: Xiang D, Yang JY, Zhang CL, Liu D. Research progress on baicalin in treatment of hepatocellular carcinoma. Shijie Huaren Xiaohua Zazhi 2018; 26(6): 378-383
- URL: https://www.wjgnet.com/1009-3079/full/v26/i6/378.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v26.i6.378
原发性肝癌(hepatocellular carcinoma, HCC)是世界上导致死亡的常见疾病之一, 在常见恶性肿瘤中位居前列[1]. 由于其发病率较高, 预后不良, 极大地威胁着人类的生命健康, 因此在HCC的药物治疗研究一直是医学领域的难点和热点[2,3]. 中医理论认为, 肿瘤的形成实为热毒内蕴, 如热灼血凝、凝结成块、热灼伤津, 久积成块等[4-6]. 近代以来基于清热解毒的治法一直是中医药抗肿瘤的研究切入点[7-9]. 黄芩是唇形科黄芩属(Scutellaria Linn)植物黄芩(Scutellaria baicalensis Georgi)的干燥根, 具有解热、保肝的作用, 在肝脏疾病、细菌病毒感染和炎症等治疗领域应用广泛[10]. 黄芩的主要成分是黄酮、萜类、甾醇、有机酸和微量元素, 其中黄酮被认为是黄芩的主要药效活性成分, 包括黄芩苷、汉黄芩素和黄芩素[11]. 近年来, 黄芩苷在HCC的治疗研究中亦有大量文献报道. 本文综述了黄芩苷治疗HCC及其机制的研究进展, 以期为该药的进一步研究和应用提供参考.
黄芩苷治疗HCC的报道可以追溯到20世纪90年代初, 日本学者陆续从小柴胡汤抑制HCC细胞增殖的实验中发现黄芩苷的抑癌作用[12]. 后来国内外学者发现黄芩中所含的黄酮能够有效抑制HCC细胞生长, 其中黄芩苷、黄芩素和汉黄芩素等均显著有效. 我国的郭昱等[13]过一系列体外研究, 评价了黄芩苷对人源HCC细胞BEL-7402的活性影响和作用机制. 其研究结果发现, 黄芩苷在体外对于HCC细胞的抑制作用表现出较好的量效关系, 并随着作用时间延长, 抑制作用也愈加明显. 黄芩苷在体外对于HCC细胞的抑制作用表现为剂量依赖性, 其对HepG2和SMMC-7221细胞的IC50均不超过40 μmol/L[14].
黄芩苷在体内可以被代谢成为黄芩素, 有关黄芩苷和黄芩素在对抗HCC的作用方面孰优孰劣尚存在争议: Khanal等[15]研究发现黄芩苷对于HepG2细胞的抑制作用更强, 然而Chiu等[16]通过比较了两种单体在抑制HA22T/VGH和SK-Hep1细胞活性和侵袭能力的作用后, 发现黄芩苷的效果并不优于黄芩素. 从药物在体内的动力学角度看, 黄芩苷在胃肠吸收后, 经肠道菌群和肝脏转化为黄芩素, 入血后又重新转化为黄芩苷[17]. 因为肿瘤治疗的效果最终还需整体实验来证明, 两者在体内最终应主要以黄芩苷的形式发挥作用, 所以目前治疗HCC的报道主要还是以黄芩苷为主.
不仅黄芩苷单体, 以黄芩苷为主要成分的方剂如黄连解毒汤在HCC的治疗作用中也有报道[18]. 其中黄芩苷是多组分中抑制癌症的重要成分之一.
黄芩苷不仅可以抑制信号转导子和转录激活子3(signal transducer and activator of transcription 3, STAT3)向活化形式磷酸化P-STAT3转化, 而且下调STAT3 mRNA的表达, 降低STAT3蛋白的表达[19]. 董明等[20]在裸鼠人HCC细胞株SMMC-7721移植瘤动物模型中观察了黄芩苷的抑瘤能力, 研究显示黄芩苷可显著抑制肿瘤生长, 与其下调Cyclin D1表达抑制瘤体增殖和上调Caspase-3表达促进凋亡的作用相关. 但是在保护免疫器官等方面, 黄芩苷并没有表现出相应的作用. Yu等[14]同样发现, 黄芩苷诱导HCC细胞凋亡的机制涉及上调Bax, 下调Bcl-2并增加Caspase-9、Caspase-3和聚腺苷二磷酸-核糖聚合酶的裂解作用等. 其中, 对于Caspase-9和Caspase-3的裂解增强作用在黄芩苷抑制荷瘤小鼠的实验中也得以证实.
线粒体被认为是诱导细胞凋亡的主要执行者[21]. 在细胞凋亡的前期, 线粒体的结构和功能就已出现特征性改变, 同时线粒体中亦大量表达与凋亡相关的蛋白和酶类[22]. 研究发现, 黄芩苷可剂量依赖性地诱导人HCC细胞BEL-7402的凋亡, 在这一过程中细胞的线粒体结构发生了明显的改变, 例如肿胀、空泡等[23]. 同时黄芩苷可以增加细胞内Ca2+含量, 可进一步激活线粒体膜通透性转运孔, 从而使得线粒体膜电位降低. 在黄芩苷的作用下, 癌细胞内细胞色素(cytochome C, Cyt)释放增加, 而这一效应可能与其抑制HCC细胞Bcl-2蛋白表达, 促进caspase-3活性增加有直接关联性. 综上所述发现, 线粒体损伤是黄芩苷诱导HCC细胞凋亡的重要途径.
内质网应激是黄芩苷诱导HCC细胞凋亡的另一种作用机制. Yu等[24]评价了诱导凋亡的转膜蛋白肌醇依赖酶1、活化转录因子6(activating transcription factor 6, ATF6)和蛋白激酶R样内质网激酶等对黄芩苷促进凋亡的影响, 通过小分子干扰RNA降低3种基因蛋白表达, 发现ATF6的沉默显著影响了黄芩苷诱导凋亡的作用. 随后, 通过比较S1P和S2P两种裂解ATF6的蛋白激酶在黄芩苷诱导凋亡中的作用, 结果发现S2P会显著影响黄芩苷的促凋亡活性. 因此, S2P被认为是黄芩苷介导HCC细胞凋亡的关键分子靶点.
黄芩苷对HCC细胞的诱导分化作用也已经被证实. 在黄芩苷的作用下, 癌细胞的细胞质面积显著提高, 核面积减少(即核质比降低), 肝细胞的γ谷氨酰转肽酶(γ-glutamyltranspeptidase, γ-GT)活力也逐步降低, 细胞甲胎蛋白(alpha fetoprotein, AFP)的表达和分泌在黄芩苷的作用下均被下调. 通过细胞周期测定, 发现随着黄芩苷体外处理HepG2和SMMC-7221细胞的时间延长, S期细胞增多, G1期细胞减少[14]. 由于S期细胞是DNA合成和有丝分裂的准备期, 因此黄芩苷将HCC细胞阻滞在G1期从而达到了对HCC细胞诱导分化的作用. 同时癌细胞的细胞周期蛋白A(Cyclin A)、细胞周期蛋白依赖性激酶2(cyclin-dependent kinase 2, CDK2)和Cyclin D1等有丝分裂的促进因子被黄芩苷下调, 这是其阻止细胞从S期进入有丝分裂期的内在机制[14].
癌症细胞的增长与蛋白合成增加密切相关[25,26]. 许多研究报道了真核细胞延伸因子-2(eukaryotic elongation factor 2, eEF2)在调控肿瘤进展中的重要作用[27-29], 过表达eEF2能够促进G2/M期细胞比例并促进肿瘤细胞增殖. 含有黄芩苷的黄连解毒汤能够有效抑制eEF2激酶的Th56磷酸化, 从而干扰转录过程并阻断细胞蛋白的合成[18]. 同时也发现黄芩苷可以特异性地作用于eEF2, 灭活eEF2, 其作用机制可能是通过黄芩苷激活单磷酸腺苷活化蛋白激酶(AMP-activated protein kinase, AMPK), 抑制mTOR通路, 进而激活eEF2的负调控子eEF2激酶(eEF2 kinase, eEF2K)来实现.
肿瘤转移是肿瘤患者死亡的主要原因之一[30,31]. 研究者通过Boyden小室模型和细胞迁徙实验测定了不同浓度黄芩苷处理后HCC细胞的侵袭力、黏附力以及细胞运动能力, 结果发现黄芩苷处理后的细胞较少表现出纤维母细胞样形态, 伪足数目也较少, 细胞的侵袭力、黏附力和迁徙能力均显著低于对照组. 黄芩苷直接抑制细胞迁徙运动的作用可能与以下机制有关: 一方面与下调基质金属蛋白酶2和促进金属蛋白酶组织抑制因子2的表达有关; 另一方面与抑制黏附分子上皮钙黏附素的表达, 促进整合素β1表达有关[13].
黄芩苷可以在转录水平上上调HCC细胞SMMC-7721的连接蛋白26(connexin 26, Cx26)的mRNA水平, 但在蛋白水平上可以同时增强Cx26和Cx43的表达, 从而导致HCC细胞的细胞间隙连接通讯恢复和增加, 最终抑制HCC细胞生长[32,33].
除上述作用之外, 对于5-氟尿嘧啶(5-fluorouracil, 5-Fu)耐药的HCC细胞, 黄芩苷也可以有效逆转耐药现象, 逆转倍数最高可达到46.7, 并与5-Fu表现出较好的协同作用, 其内在机制为黄芩苷可下调多药耐药蛋白1(multidrug resistance protein 1, MDR1)和P-糖蛋白(P-glycoprotein, P-gp)的表达[13,34]. 不仅如此, 黄芩苷对耐阿霉素的人HCC细胞株BEL-7402/ADM也具有较好的逆转耐药能力, 其机制除上述下调MDR1和P-gp外, 还与诱导谷胱甘肽S-转移酶(glutathione S-transferase, GST)表达和细胞凋亡有关[35].
尽管化疗药物在肿瘤治疗中的作用已经十分明确, 但是在临床应用过程中依然受限于严重的不良反应[36]. 黄芩苷和顺铂在单独应用时具有抗人HCC细胞HepG2的作用, 当两者联合应用时, 在体外表现出协同抗增殖和诱导凋亡的作用, 机制可能与下调Bcl-2, 上调Bax、Caspase-3和c-myc蛋白的表达有关[37,38]. 淫羊藿苷与黄芩苷联合ADM能够有效降低HepG2细胞中增殖诱导配体和血管内皮生长因子的表达, 从而达到了抑制血管内皮细胞ECV304生长的作用[39]. 从上述研究看来, 黄芩苷的应用可以有效降低化疗药物的剂量, 因此化疗不良反应也随之减小, 这一策略有望提高治疗依从性和有效率.
张健等[40]使用二乙基亚硝胺诱发HCC前病变小鼠模型, 考察了黄芩苷的保护作用, 结果发现黄芩苷可以有效减少二乙基亚硝胺引起的肝脏纤维化、降低血清肝功能酶学指标, 因此其对于肝细胞的保护作用可能是黄芩苷抑制肝脏癌前病变的重要机制.
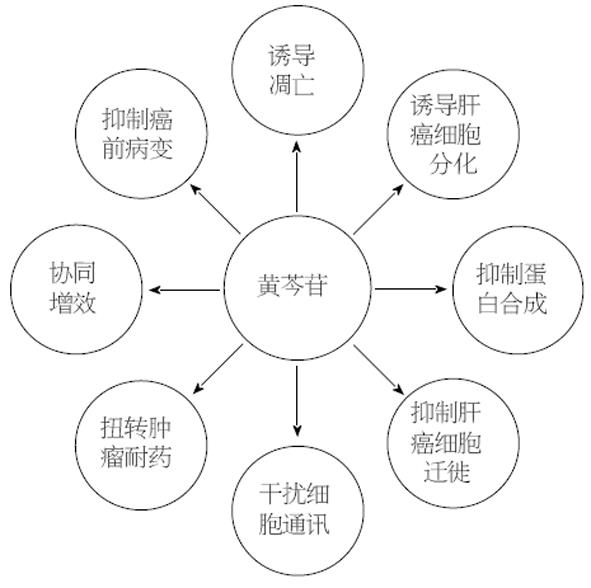
虽然在上述研究中已经证实黄芩苷治疗HCC的多种机制(图1). 然而, 黄芩苷并非对所有类型的HCC具有较好的抑制作用. 赖炫城等[41]比较了大黄素、黄芩苷和木犀草素对于大鼠HCC细胞株CBRH7919的体外抑制作用. 结果显示, 黄芩苷作用48 h的IC50为160 μmol/L, 这一数值远高于另外两种测试成分, 可见黄芩苷对CBRH7919细胞的生长抑制作用欠佳. 不过此研究采用的是大鼠肝细胞系, 考虑到种属差异性因素, 还需进一步深入研究.
黄芩苷在治疗HCC方面也有一定的局限性, 该药水溶液不稳定, 亲水性和亲油性较差[42], 在肠道吸收不充分[43], 因此口服的生物利用度偏低, 在体内的生物半衰期短[44]. 为提高药物作用的靶向性和稳定性, 洪怡等[45]采用薄膜分散法制备的黄芩苷脂质体对HepG-2细胞表现出更好的诱导凋亡作用. 此外, 研究者通过制备黄芩苷固体脂质纳米粒(baicalin solid lipid nanoparticles, BSLNs), 考察了其在动物体内的药动学和体外杀灭HCC细胞的作用. 结果发现BSLNs在大鼠体内具有较好的缓释作用, 该技术有效提高了黄芩苷的生物利用度, 并对HepG-2细胞的生长抑制作用强于黄芩苷[46]. 这些研究能够保证黄芩苷药效作用的充分发挥, 为该药的体内和临床应用提供了实验基础.
另外, 由于黄芩苷含有富含电子的羰基和羧基, 能够与金属离子Í、钴或镍等形成复合物. 研究者发现黄芩苷的金属离子复合物在抗菌和抗肿瘤方面比黄芩苷具有更好的效果, 其中黄芩苷-Í离子复合物在抗HCC细胞的作用中表现最佳[47]. 进一步考察发现黄芩苷-Í离子复合物是一种潜在的PI3K抑制剂, 可下调PI3K/Akt/mTOR信号通路, 可将细胞周期阻滞在G2/M期, 加之上述的诱导凋亡作用, 从而表现出显著抑制HepG2细胞生长的效果[48].
目前黄芩苷对于HCC的治疗研究主要集中于体外尤其是细胞实验. 尽管已经有大量前期的基础研究, 黄芩苷用于HCC患者的治疗研究非常少见. 在临床上, 黄芩苷与其他药物或治疗手段的联合应用有少量报道. 陕西中医药大学附属医院肝胆外科在原发性HCC患者肝动脉化疗栓塞术(transcatheter arte-rial chemoembolization, TACE)后, 给予患者口服黄芩苷胶囊治疗, 30 d为1个疗程, 连续服用3个疗程. 结果发现黄芩苷组在临床症状、体征、肝功能、肿瘤体大小、生存期和不良反应等方面均好于对照组. 因此认为黄芩苷联合TACE治疗HCC, 可以提高临床疗效, 安全性较好[49].
有关黄芩苷抗肿瘤方面的报道日新月异, 均在不同角度显示出其在临床应用的巨大潜力. 尽管黄芩苷在不同肿瘤类型中的治疗研究已有综述报道, 但是针对黄芩苷治疗肝脏的最新且全面的回顾尚缺乏[50]. 因此本文系统收集了黄芩苷在HCC治疗领域的国内外报道, 从不同的抗癌机制分析了目前对于其作用机制的新发现, 以期对研究者们提供详尽的参考. 但是当前的研究大多仍是处于体外或者动物的研究水平, 黄芩苷在临床治疗HCC的报道极为少见, 因此进一步推进该药在患者体内的应用或者联合治疗是未来的发展方向.
学科分类: 胃肠病学和肝病学
手稿来源地: 湖北省
同行评议报告分类
A级 (优秀): 0
B级 (非常好): B, B
C级 (良好): C
D级 (一般): 0
E级 (差): 0
编辑: 闫晋利 电编:闫晋利
| 1. | Wu W, Liu S, Liang Y, Zhou Z, Liu X. MiR-7 inhibits progression of hepatocarcinoma by targeting KLF-4 and promises a novel diagnostic biomarker. Cancer Cell Int. 2017;17:31. [PubMed] [DOI] |
| 2. | Maluccio M, Covey A. Recent progress in understanding, diagnosing, and treating hepatocellular carcinoma. CA Cancer J Clin. 2012;62:394-399. [PubMed] [DOI] |
| 3. | Wilson CL, Mann DA, Borthwick LA. Epigenetic reprogramming in liver fibrosis and cancer. Adv Drug Deliv Rev. 2017;121:124-132. [PubMed] [DOI] |
| 13. | 郭 昱. 黄芩甙对肝癌细胞体外作用及机制的实验研究. 石家庄: 河北医科大学 2006; . |
| 14. | Yu Y, Pei M, Li L. Baicalin induces apoptosis in hepatic cancer cells in vitro and suppresses tumor growth in vivo. Int J Clin Exp Med. 2015;8:8958-8967. [PubMed] |
| 15. | Khanal T, Kim HG, Choi JH, Park BH, Do MT, Kang MJ, Yeo HK, Kim DH, Kang W, Jeong TC. Protective role of intestinal bacterial metabolism against baicalin-induced toxicity in HepG2 cell cultures. J Toxicol Sci. 2012;37:363-371. [PubMed] [DOI] |
| 16. | Chiu YW, Lin TH, Huang WS, Teng CY, Liou YS, Kuo WH, Lin WL, Huang HI, Tung JN, Huang CY. Baicalein inhibits the migration and invasive properties of human hepatoma cells. Toxicol Appl Pharmacol. 2011;255:316-326. [PubMed] [DOI] |
| 17. | Yu J, Guo X, Zhang Q, Peng Y, Zheng J. Metabolite profile analysis and pharmacokinetic study of emodin, baicalin and geniposide in rats. Xenobiotica. 2017; Oct 6. [Epub ahead of print]. [PubMed] [DOI] |
| 18. | Wang N, Feng Y, Tan HY, Cheung F, Hong M, Lao L, Nagamatsu T. Inhibition of eukaryotic elongation factor-2 confers to tumor suppression by a herbal formulation Huanglian-Jiedu decoction in human hepatocellular carcinoma. J Ethnopharmacol. 2015;164:309-318. [PubMed] [DOI] |
| 21. | Tian S, Zhu F, Hu R, Tian S, Chen X, Lou D, Cao B, Chen Q, Li B, Li F. The anti-apoptotic effect of fluid mechanics preconditioning by cells membrane and mitochondria in rats brain microvascular endothelial cells. Neurosci Lett. 2018;662:6-11. [PubMed] [DOI] |
| 22. | Shoshan-Barmatz V, Krelin Y, Chen Q. VDAC1 as a Player in Mitochondria-Mediated Apoptosis and Target for Modulating Apoptosis. Curr Med Chem. 2017;24:4435-4446. [PubMed] |
| 24. | Yu Z, Luo X, Wang C, Ye J, Liu S, Xie L, Wang F, Bao J. Baicalin promoted site-2 protease and not site-1 protease in endoplasmic reticulum stress-induced apoptosis of human hepatocellular carcinoma cells. FEBS Open Bio. 2016;6:1093-1101. [PubMed] [DOI] |
| 25. | Stockwell BR, Friedmann Angeli JP, Bayir H, Bush AI, Conrad M, Dixon SJ, Fulda S, Gascón S, Hatzios SK, Kagan VE. Ferroptosis: A Regulated Cell Death Nexus Linking Metabolism, Redox Biology, and Disease. Cell. 2017;171:273-285. [PubMed] [DOI] |
| 26. | Yoshida S, Pacitto R, Inoki K, Swanson J. Macropinocytosis, mTORC1 and cellular growth control. Cell Mol Life Sci. 2017; Nov 8. [Epub ahead of print]. [PubMed] [DOI] |
| 27. | Xie CM, Liu XY, Sham KW, Lai JM, Cheng CH. Silencing of EEF2K (eukaryotic elongation factor-2 kinase) reveals AMPK-ULK1-dependent autophagy in colon cancer cells. Autophagy. 2014;10:1495-1508. [PubMed] [DOI] |
| 28. | Delaidelli A, Negri GL, Jan A, Jansonius B, El-Naggar A, Lim JKM, Khan D, Zarni Oo H, Carnie CJ, Remke M. MYCN amplified neuroblastoma requires the mRNA translation regulator eEF2 kinase to adapt to nutrient deprivation. Cell Death Differ. 2017;24:1564-1576. [PubMed] [DOI] |
| 29. | Sun W, Wei X, Niu A, Ma X, Li JJ, Gao D. Enhanced anti-colon cancer immune responses with modified eEF2-derived peptides. Cancer Lett. 2015;369:112-123. [PubMed] [DOI] |
| 30. | Loberg RD, Bradley DA, Tomlins SA, Chinnaiyan AM, Pienta KJ. The lethal phenotype of cancer: the molecular basis of death due to malignancy. CA Cancer J Clin. 2007;57:225-241. [PubMed] [DOI] |
| 31. | Li Z, Kang Y. Emerging therapeutic targets in metastatic progression: A focus on breast cancer. Pharmacol Ther. 2016;161:79-96. [PubMed] [DOI] |
| 32. | 王 娜. 黄芩苷对肝癌细胞Cx26及Cx43表达的影响. 石家庄: 河北医科大学 2012; . |
| 33. | 郭 昱, 王 娜, 高 咏梅, 姚 金锋, 李 元, 尹 崇娇, 张 文娟. 黄芩苷对肝癌细胞GJIC及Cx26、Cx43表达的影响. 世界华人消化杂志. 2012;20:3197-3202. [DOI] |
| 36. | Huang W, Chen L, Kang L, Jin M, Sun P, Xin X, Gao Z, Bae YH. Nanomedicine-based combination anticancer therapy between nucleic acids and small-molecular drugs. Adv Drug Deliv Rev. 2017;115:82-97. [PubMed] [DOI] |
| 39. | 唐 菁, 张 玲, 李 翠玲, 顾 洪涛, 杨 尚军, 阴 海鹏, 温 培娥, 姜 国胜. 淫羊藿苷与黄芩苷联合多柔比星对肝癌细胞APRIL表达和血管内皮细胞生长抑制的研究. 中华肿瘤防治杂志. 2009;16:1534-1537. |
| 40. | 张 健, 冯 丽莉, 毛 文超, 王 秀萍, 张 东星, 王 湘, 王 明琦, 蔡 大勇. 黄芩苷对二乙基亚硝胺诱发肝癌前病变小鼠肝脏功能的影响. 中华中医药杂志. 2013;28:2730-2732. |
| 43. | Zhu ML, Liang XL, Zhao LJ, Liao ZG, Zhao GW, Cao YC, Zhang J, Luo Y. Elucidation of the transport mechanism of baicalin and the influence of a Radix Angelicae Dahuricae extract on the absorption of baicalin in a Caco-2 cell monolayer model. J Ethnopharmacol. 2013;150:553-559. [PubMed] [DOI] |
| 44. | Chen Y, Minh LV, Liu J, Angelov B, Drechsler M, Garamus VM, Willumeit-Römer R, Zou A. Baicalin loaded in folate-PEG modified liposomes for enhanced stability and tumor targeting. Colloids Surf B Biointerfaces. 2016;140:74-82. [PubMed] [DOI] |