修回日期: 2018-01-15
接受日期: 2018-01-22
在线出版日期: 2018-02-28
评估大剂量阿莫西林/埃索美拉唑二联方案在幽门螺杆菌(Helicobacter pylori, H. pylori)感染初次治疗患者中的疗效及安全性.
142例H. pylori感染的初次治疗患者随机进入大剂量阿莫西林/埃索美拉唑二联方案(EA)组(埃索美拉唑20 mg qid+阿莫西林0.75 g qid, 疗程14 d)和铋剂四联方案(EBAC)组(埃索美拉唑20 mg bid+枸橼酸铋钾220 mg bid+阿莫西林1.0 g bid+克拉霉素0.5 g bid, 疗程14 d), 治疗结束后6 wk复查尿素呼气试验, 判断H. pylori根除疗效.
共131例患者完成研究, EA组按意向治疗(intention-to-treat, ITT)与按方案(per-protocol, PP)分析H. pylori根除率分别为82.9%和89.2%, EBAC组分别为86.1%和93.9%, 两组根除率的ITT、PP分析差异均无统计学意义(P>0.05). 按PP分析, EBAC组不良反应发生率明显高于EA组(15.2% vs 3.1%, P<0.05).
大剂量阿莫西林/埃索美拉唑二联方案可作为安全、有效的H. pylori感染初次治疗方案.
核心提要: 幽门螺杆菌(Helicobacter pylori, H. pylori)的耐药率不断增加, 治疗越来越困难. 治疗H. pylori的常用抗生素中, 只有阿莫西林的原发耐药率和继发耐药率都低. 本研究证实大剂量阿莫西林/埃索美拉唑二联方案可作为安全、有效的H. pylori感染初次治疗方案.
引文著录: 高采平, 肖迅, 刘培曦, 周洲, 李良平, 韩盛玺. 大剂量阿莫西林/埃索美拉唑二联方案根除幽门螺杆菌. 世界华人消化杂志 2018; 26(6): 353-359
Revised: January 15, 2018
Accepted: January 22, 2018
Published online: February 28, 2018
To evaluate the clinical efficacy and safety of high-dose amoxicillin/esomeprazole dual therapy as a first-line therapy for Helicobacter pylori (H. pylori) eradication.
One hundred and forty-two subjects infected with H. pylori and naive to treatment were randomly assigned to receive either 14-d high-dose amoxicillin/esomeprazole dual therapy (esomeprazole 20 mg and amoxicillin 0.75 g, four times a day; EA group) or bismuth-based quadruple therapy [esomeprazole 20 mg, bismuth potassium citrate 220 mg (elemental bismuth), amoxicillin 1 g, and clarithromycin 0.5 g, twice a day; EBAC group]. Six weeks after treatment, H. pylori eradication was assessed by using the urea breath test (13C or 14C).
A total of 131 subjects completed this clinical trial. H. pylori eradication rates by intention-to-treat (ITT) and per-protocol (PP) analysis in the EA group were 82.9% and 89.2%, respectively, and those in the EBAC group were 86.1% and 93.9%, respectively. No significant difference was found in H. pylori eradication rates by both ITT and PP analysis (P > 0.05). The incidence of side effects by PP analysis in the EBAC group was significantly higher than that in the EA group (15.2% vs 3.1%, P < 0.05). All the side effects disappeared after discontinuing the drugs.
High-dose amoxicillin/esomeprazole dual therapy can be used as an effective and safety first-line therapy for H. pylori infection.
- Citation: Gao CP, Xiao X, Liu PX, Zhou Z, Li LP, Han SX. High-dose amoxicillin/esomeprazole dual therapy as a first-line therapy for Helicobacter pylori eradication. Shijie Huaren Xiaohua Zazhi 2018; 26(6): 353-359
- URL: https://www.wjgnet.com/1009-3079/full/v26/i6/353.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v26.i6.353
我国是幽门螺杆菌(Helicobacter pylori , H. pylori)感染的高发地区[1]. 目前国内外多个关于H. pylori感染的共识意见均认为不管有无症状和并发症, H. pylori胃炎是一种感染性疾病, 根除H. pylori可作为预防胃癌的一级措施, 证实有H. pylori感染应考虑根除治疗[2-5]. 然而, 由于H. pylori对克拉霉素、左氧氟沙星、甲硝唑等抗生素的耐药率不断增加, 由质子泵抑制剂(proton pump inhibitor, PPI)联合两种抗生素组成的三联方案对H. pylori的根除率越来越低[1,2,4-6]. 如何克服H. pylori耐药、提高根除率已成为国内外研究热点.
治疗H. pylori的常用抗生素中, 只有阿莫西林的原发耐药率和继发耐药率都非常低[7,8]. 而且越来越多的研究发现增加阿莫西林和PPI的剂量及给药频率可以提高阿莫西林/PPI二联方案的疗效[9-16]. 一项Meta分析[17]显示, 在H. pylori根除失败的患者中, 采用大剂量阿莫西林/PPI二联方案, H. pylori根除率及安全性与目前国内外指南推荐的补救治疗方案相当. 然而, 关于大剂量阿莫西林/PPI二联方案在H. pylori初次治疗患者中的疗效及安全性的临床研究很少, 尤其是与我国指南推荐的铋剂四联方案对比, 尚未见报道. 因此, 本研究旨在通过比较大剂量阿莫西林/埃索美拉唑二联方案与铋剂四联方案作为根除H. pylori感染一线治疗的安全性及有效性, 以期为H. pylori感染初次治疗的患者选择安全有效的根除方案提供更多的选择.
1.1.1 一般情况: 选取2015-11/2017-05电子科技大学医学院附属四川省人民医院消化内科门诊就诊的H. pylori感染初次治疗患者, 共计142例患者入选, 随机进入EA组和EBAC组. EA组70例, 其中男性36例, 女性34例, 年龄19-80岁, 平均年龄50.1岁±13.5岁, 慢性胃炎44例、消化性溃疡13例、体检发现H. pylori感染要求治疗13例; EBAC组72例, 其中男33例, 女39例, 年龄23-72岁, 平均年龄48.8岁±11.4岁, 慢性胃炎48例、消化性溃疡15例、体检发现H. pylori感染要求治疗9例. 两组患者的性别、年龄、疾病组成差异均无统计学意义(P>0.05)(表1).
| 项目 | EA组 | EBAC组 | χ2值 | P值 |
| 性别 | 0.445 | 0.615 | ||
| 男 | 36 | 33 | ||
| 女 | 34 | 39 | ||
| 疾病 | 1.024 | 0.607 | ||
| 慢性胃炎 | 44 | 48 | ||
| 消化性溃疡 | 13 | 15 | ||
| 体检 | 13 | 9 |
1.1.2 入选和排除标准: 入选标准: 13C-尿素呼气试验(13C-UBT)或14C-尿素呼气试验(14C-UBT)阳性, 或者患者接受胃镜和病理检查, 病理诊断H. pylori感染. 排除标准: 年龄<18 岁, 怀孕、哺乳、严重的伴随疾病、恶性肿瘤、研究药物过敏、严重的溃疡出血或穿孔、上消化道手术病史、既往抗H. pylori治疗、4 wk内服用过PPI或者抗生素. 本研究方案经电子科技大学医学院附属四川省人民医院伦理委员会批准, 所有入选者均签署知情同意书.
患者入选后随机进入大剂量阿莫西林/埃索美拉唑二联方案(EA)组和铋剂四联方案(EBAC)组. EA组: 埃索美拉唑(阿斯利康制药有限公司)20 mg qid+阿莫西林(昆明贝克诺顿制药有限公司)0.75 g qid, 疗程14 d; EBAC组: 埃索美拉唑20 mg bid+枸橼酸铋钾(丽珠集团丽珠制药厂)220 mg bid+阿莫西林1.0 g bid+克拉霉素(上海雅培制药有限公司) 0.5 g bid, 疗程14 d. 治疗过程中, 通过服药小卡片和电话提醒患者药物服用方法.
治疗期间随访所有患者, 并记录患者发生不良反应的情况. 两组患者均在治疗结束6 wk后复查13C-UBT或14C-UBT, 结果阳性者判断为H. pylori根除失败, 阴性者根除成功[18].
统计学处理 应用SPSS21.0统计软件, H. pylori根除率分别以按意向治疗(intention-to-treat, ITT)分析和改良ITT(MITT)分析(对接受治疗并在治疗结束6 wk后复查13C-UBT或14C-UBT的患者进行分析)以及按方案(per-protocol, PP)分析表示, 组间比较采用χ2检验, P<0.05为差异有统计学意义.
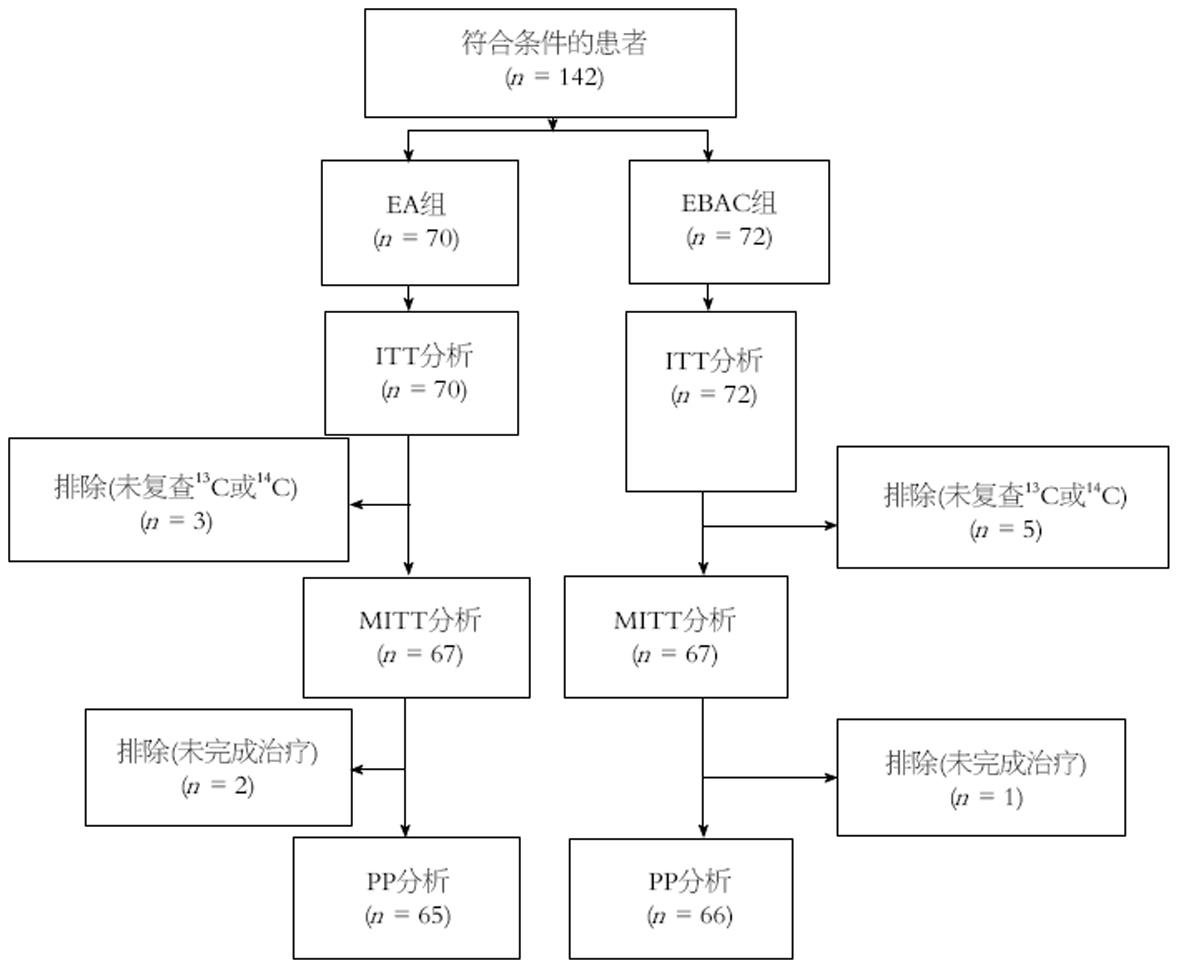
142例患者中, 共有11例患者未完成治疗方案, 其中EA组3例失访, 2例因过敏性皮疹退出试验, EBAC组5例失访, 1例因腹痛退出试验, 实际完成131例(92.3%). EA组、EBAC组分别有58、62例成功根除H. pylori(图1). 两组ITT、MITT和PP根除率差异均无统计学意义(ITT: 82.9% vs 86.1%, P>0.05; MITT: 86.6% vs 92.5%, P>0.05; PP: 89.2% vs 93.9%, P>0.05)(表2).
| 分组 | 纳入列数 | 未复查列数 | 完成列数 | 根除列数 | ITT根除率(%) | MITT根除率(%) | PP根除率(%) |
| EA组 | 70 | 3 | 65 | 58 | 82.9 | 86.6 | 89.2 |
| EBAC组 | 72 | 5 | 66 | 62 | 86.1 | 92.5 | 93.9 |
| χ2值 | 0.287 | 1.276 | 0.944 | ||||
| P值 | 0.381 | 0.199 | 0.257 |
EA组仅有2例患者在治疗过程中出现不良反应, 均为过敏性皮疹, EBAC组有10例患者出现不良反应, 其中恶心、纳差4例, 失眠1例, 头痛1例, 腹痛1例, 味觉改变3例, 其余患者未诉任何不适. EA组、EBAC组按PP分析的不良反应发生率分别为3.1% (2/65)和15.2%(10/66), EBAC组的不良反应发生率显著高于EA组(P<0.05). 所有患者的不良反应在停药后均消失, 无严重不良反应发生.
这是一项在H. pylori感染初次治疗的患者中, 大剂量阿莫西林/埃索美拉唑二联方案与铋剂四联方案对比的随机对照临床研究. 我国2012年《第四次全国幽门螺杆菌感染处理共识报告》与2016年《第五次全国幽门螺杆菌感染处理共识报告》均推荐以铋剂和PPI为基础联合两种抗生素的铋剂四联方案用于H. pylori的根除治疗[5,19]. 本研究共纳入142例H. pylori感染初次治疗的患者, 随机分为EA组和EBAC组, 比较两组根除H. pylori的有效性和安全性. EA组的PP根除率89.2%, EBAC组93.9%, 两种疗法的根除率(ITT、PP)差异无统计学意义(表2).
阿莫西林/PPI二联方案根除H. pylori的疗效存在明显争议. 一方面, 一些研究者采用标准剂量的阿莫西林(1 g/次) 和PPI每日两次给药方案, 发现该方案的H. pylori根除率多在40%-80%[20-34]. 参照Graham等[35]提出的H. pylori根除方案评定标准: A级的根除率>95%; B级的根除率为90%-94%; C级的根除率为85%-89%; D级的根除率为81%-84%; E级的根除率≤80%. 这些方案的H. pylori根除率多为E级, 不可接受. 另一方面, 缩短给药时间间隔、增加阿莫西林和PPI剂量的大剂量阿莫西林/PPI二联方案有较好的H. pylori根除率[9-16]. 比如, 在1995年德国的一项随机、多中心、双盲临床研究[9]就发现一日三次(tid)给予奥美拉唑40 mg联合阿莫西林0.75 g tid方案, H. pylori根除率91%, 为B级. 2007年日本的研究[10]发现, 对于克拉霉素耐药的H. pylori感染患者, 在胃内pH>5时, 给予阿莫西林0.5 g qid的二联方案根除率95.5%, 为A级. 2015年, 台湾的一项随机多中心临床研究[15]显示雷贝拉唑10 mg qid、阿莫西林0.75 g qid方案, H. pylori根除率达到95%, 为A级, 疗效优于序贯治疗和含左氧氟沙星的三联方案. 本研究中, EA组的PP根除率89.2%, 为C级, 属于可以接受的治疗方案, 与其他关于大剂量阿莫西林/PPI二联方案研究结论一致[9-16].
大剂量阿莫西林/PPI二联方案能够获得满意的H. pylori根除率可能与以下因素有关: (1)阿莫西林的有效血药浓度增加. 阿莫西林是时间依赖性抗生素, 给药后被快速吸收入血, 并在6-8 h后被排除体外[10]. 因此, 与每日两次给予1 g阿莫西林的方案相比, 间隔6-8 h给予0.50-0.75 g阿莫西林的方案可能维持更好的阿莫西林血药浓度; (2)胃内pH值增加. 在胃内pH值>6的环境中阿莫西林抗菌活性才稳定[36]. 胃内pH值与PPI服用剂量和时间间隔相关, 还受药物代谢基因CYP2C19基因型影响, 快代谢型患者PPI血药浓度下降快. Sahara等[37]研究显示无论CYP2C19基因型如何, 埃索美拉唑20 mg qid给药均能维持胃内pH多数时间在6以上; (3)H. pylori对治疗方案中的抗生素耐药是治疗失败的主要原因. 国内外研究均提示H. pylori对阿莫西林的原发耐药率及继发耐药率都低[7,8]; (4) 患者依从性好, 本研究中通过服药小卡片和电话提醒患者, 避免漏服药物; 而且与铋剂四联方案对比, EA组患者服药过程中药物不良反应少可增加患者的依从性.
Gao等[17]的Meta分析发现在H. pylori根除治疗失败的患者中, 大剂量阿莫西林/PPI二联方案[每日3-4次给予PPI和阿莫西林(≥2.0 g/d), 14 d]的安全性与指南推荐的补救方案疗效相当. 该研究中, 我们发现EA组的不良反应的发生率明显低于EBAC组. EA组的主要不良反应是过敏性皮疹, 考虑与阿莫西林过敏有关, 停药后皮疹消失. 阿莫西林为青霉素类药物, 安全性较好, 过敏反应是其最常见的严重不良反应, 少数患者可能出现肾功能损害[38]. EBAC组的不良反应较EA组明显, 包括恶心、纳差、失眠、头痛、腹痛和味觉改变, 可能与该方案中药物成分较EA组复杂, 增加了克拉霉素和铋剂有关. 克拉霉素的不良反应主要包括过敏反应、恶心呕吐、头痛、心律失常、肝功异常、失眠等; 铋剂有关的不良反应以胃肠道系统最常见, 如恶心、呕吐、口腔异味、腹泻、腹痛、黑便、便秘等. 这些不良反应大多轻微、短暂, 停药后消失[39,40].
本研究存在以下问题: (1)部分患者青霉素皮肤实验阴性, 但用药后出现过敏性皮疹, 考虑与阿莫西林引起的Ⅳ型迟发型过敏反应有关[38], 临床应用含阿莫西林的根除方案应在用药过程中注意观察; (2)本研究中所有患者在用药前未进行H. pylori培养和药物敏感性实验, 主要因为在我国大多数地区H. pylori对阿莫西林的耐药率低[7,8], 同时含克拉霉素的铋剂四联方案可部分克服克拉霉素耐药获得满意的根除率[39,40]; 我国《第五次全国幽门螺杆菌感染处理共识报告》也不推荐在H. pylori感染初次治疗患者中开展药物敏感性实验[5].
总之, 每日四次给予埃索美拉唑20 mg、阿莫西林0.75 g, 疗程14 d的大剂量阿莫西林/埃索美拉唑二联方案在H. pylori感染的初次治疗患者中能取得满意的根除率, 而且不良反应较指南推荐的铋剂四联方案少, 基于药敏实验的多中心、大规模临床研究可进一步明确其疗效和安全性. 此外, 对阿莫西林敏感而大剂量阿莫西林/埃索美拉唑二联方案根除失败的原因有待进一步研究.
目前国内外多个关于幽门螺杆菌(Helicobacter pylori, H. pylori)感染的共识意见均认为不管有无症状和并发症, 证实有H. pylori感染应考虑根除治疗. 然而, H. pylori耐药不断增加, 治疗越来越困难, 如何选用耐药率低的抗生素进行有效的治疗是临床亟待解决的问题.
验证大剂量阿莫西林/埃索美拉唑二联方案(H. pylori对阿莫西林的原发和继发耐药率都低)根除治疗H. pylori的有效性和安全性.
寻找一种能获得满意根除率、药物组成简单、不良反应少、继发耐药率低的H. pylori感染初次治疗方案.
前瞻性随即对照临床研究.
大剂量阿莫西林/埃索美拉唑二联方案与含克拉霉素的铋剂四联方案对比, H. pylori根除率无差异(ITT、PP分析); 大剂量阿莫西林/埃索美拉唑二联方案组不良反应的发生率明显减少.
研究发现大剂量阿莫西林/埃索美拉唑二联方案可作为安全、有效的H. pylori感染初次治疗方案.
基于药敏实验的多中心、大规模临床研究可进一步明确大剂量阿莫西林/埃索美拉唑二联方案的疗效和安全性. 对阿莫西林敏感且大剂量阿莫西林/埃索美拉唑二联方案根除失败的原因有待进一步研究.
学科分类: 胃肠病学和肝病学
手稿来源地: 四川省
同行评议报告分类
A级 (优秀): 0
B级 (非常好): B
C级 (良好): C
D级 (一般): D, D
E级 (差): 0
编辑: 马亚娟 电编:闫晋利
| 2. | Fallone CA, Chiba N, van Zanten SV, Fischbach L, Gisbert JP, Hunt RH, Jones NL, Render C, Leontiadis GI, Moayyedi P. The Toronto Consensus for the Treatment of Helicobacter pylori Infection in Adults. Gastroenterology. 2016;151:51-69.e14. [PubMed] [DOI] |
| 3. | Sugano K, Tack J, Kuipers EJ, Graham DY, El-Omar EM, Miura S, Haruma K, Asaka M, Uemura N, Malfertheiner P; faculty members of Kyoto Global Consensus Conference. Kyoto global consensus report on Helicobacter pylori gastritis. Gut. 2015;64:1353-1367. [PubMed] [DOI] |
| 4. | Malfertheiner P, Megraud F, O'Morain CA, Gisbert JP, Kuipers EJ, Axon AT, Bazzoli F, Gasbarrini A, Atherton J, Graham DY. Management of Helicobacter pylori infection-the Maastricht V/Florence Consensus Report. Gut. 2017;66:6-30. [PubMed] [DOI] |
| 5. | 刘 文忠, 谢 勇, 陆 红, 成 虹, 曾 志荣, 周 丽雅, 陈 烨, 王 江滨, 杜 奕奇, 吕 农华. 第五次全国幽门螺杆菌感染处理共识报告. 胃肠病学. 2017;22:509-524. |
| 6. | Wang B, Lv ZF, Wang YH, Wang H, Liu XQ, Xie Y, Zhou XJ. Standard triple therapy for Helicobacter pylori infection in China: a meta-analysis. World J Gastroenterol. 2014;20:14973-14985. [PubMed] [DOI] |
| 7. | Hu Y, Zhang M, Lu B, Dai J. Helicobacter pylori and Antibiotic Resistance, A Continuing and Intractable Problem. Helicobacter. 2016;21:349-363. [PubMed] [DOI] |
| 8. | Thung I, Aramin H, Vavinskaya V, Gupta S, Park JY, Crowe SE, Valasek MA. Review article: the global emergence of Helicobacter pylori antibiotic resistance. Aliment Pharmacol Ther. 2016;43:514-533. [PubMed] [DOI] |
| 9. | Bayerdörffer E, Miehlke S, Mannes GA, Sommer A, Höchter W, Weingart J, Heldwein W, Klann H, Simon T, Schmitt W. Double-blind trial of omeprazole and amoxicillin to cure Helicobacter pylori infection in patients with duodenal ulcers. Gastroenterology. 1995;108:1412-1417. [PubMed] |
| 10. | Furuta T, Shirai N, Kodaira M, Sugimoto M, Nogaki A, Kuriyama S, Iwaizumi M, Yamade M, Terakawa I, Ohashi K. Pharmacogenomics-based tailored versus standard therapeutic regimen for eradication of H. pylori. Clin Pharmacol Ther. 2007;81:521-528. [PubMed] [DOI] |
| 11. | Miehlke S, Hansky K, Schneider-Brachert W, Kirsch C, Morgner A, Madisch A, Kuhlisch E, Bästlein E, Jacobs E, Bayerdörffer E. Randomized trial of rifabutin-based triple therapy and high-dose dual therapy for rescue treatment of Helicobacter pylori resistant to both metronidazole and clarithromycin. Aliment Pharmacol Ther. 2006;24:395-403. [PubMed] [DOI] |
| 12. | Miehlke S, Kirsch C, Schneider-Brachert W, Haferland C, Neumeyer M, Bästlein E, Papke J, Jacobs E, Vieth M, Stolte M. A prospective, randomized study of quadruple therapy and high-dose dual therapy for treatment of Helicobacter pylori resistant to both metronidazole and clarithromycin. Helicobacter. 2003;8:310-319. [PubMed] |
| 13. | Shirai N, Sugimoto M, Kodaira C, Nishino M, Ikuma M, Kajimura M, Ohashi K, Ishizaki T, Hishida A, Furuta T. Dual therapy with high doses of rabeprazole and amoxicillin versus triple therapy with rabeprazole, amoxicillin, and metronidazole as a rescue regimen for Helicobacter pylori infection after the standard triple therapy. Eur J Clin Pharmacol. 2007;63:743-749. [PubMed] [DOI] |
| 14. | Kim SY, Jung SW, Kim JH, Koo JS, Yim HJ, Park JJ, Chun HJ, Lee SW, Choi JH. Effectiveness of three times daily lansoprazole/amoxicillin dual therapy for Helicobacter pylori infection in Korea. Br J Clin Pharmacol. 2012;73:140-143. [PubMed] [DOI] |
| 15. | Yang JC, Lin CJ, Wang HL, Chen JD, Kao JY, Shun CT, Lu CW, Lin BR, Shieh MJ, Chang MC. High-dose dual therapy is superior to standard first-line or rescue therapy for Helicobacter pylori infection. Clin Gastroenterol Hepatol. 2015;13:895-905.e5. [PubMed] [DOI] |
| 16. | 吕 清, 朱 凌音, 任 玲, 李 海燕, 陆 红, 李 晓波. 含芦氟沙星四联疗法和含大剂量阿莫西林二联疗法用于幽门螺杆菌根除失败后补救治疗的疗效分析. 胃肠病学. 2013;18:465-468. |
| 17. | Gao CP, Zhou Z, Wang JZ, Han SX, Li LP, Lu H. Efficacy and safety of high-dose dual therapy for Helicobacter pylori rescue therapy: A systematic review and meta-analysis. J Dig Dis. 2016;17:811-819. [PubMed] [DOI] |
| 18. | Zhang W, Chen Q, Liang X, Liu W, Xiao S, Graham DY, Lu H. Bismuth, lansoprazole, amoxicillin and metronidazole or clarithromycin as first-line Helicobacter pylori therapy. Gut. 2015;64:1715-1720. [PubMed] [DOI] |
| 19. | 刘 文忠, 谢 勇, 成 虹, 吕 农华, 胡 伏莲, 张 万岱, 周 丽雅, 陈 烨, 曾 志荣, 王 崇文. 第四次全国幽门螺杆菌感染处理共识报告. 现代消化及介入诊疗. 2012;17:358-363. |
| 20. | Attumi TA, Graham DY. Increasing the duration of dual amoxicillin plus omeprazole Helicobacter pylori eradication to 6 weeks: a pilot study. J Gastroenterol Hepatol. 2012;27:59-61. [PubMed] [DOI] |
| 21. | Attumi TA, Graham DY. High-dose extended-release lansoprazole (dexlansoprazole) and amoxicillin dual therapy for Helicobacter pylori infections. Helicobacter. 2014;19:319-322. [PubMed] [DOI] |
| 22. | Bell GD, Bate CM, Axon AT, Tildesley G, Kerr GD, Green JR, Emmas CE, Taylor MD. Addition of metronidazole to omeprazole/amoxycillin dual therapy increases the rate of Helicobacter pylori eradication: a double-blind, randomized trial. Aliment Pharmacol Ther. 1995;9:513-520. [PubMed] |
| 23. | Bell GD, Bate CM, Axon AT, Tildesley G, Martin JL, Taylor MD, Richardson PD. Symptomatic and endoscopic duodenal ulcer relapse rates 12 months following Helicobacter pylori eradication treatment with omeprazole and amoxycillin with or without metronidazole. Aliment Pharmacol Ther. 1996;10:637-644. [PubMed] |
| 24. | Kagaya H, Kato M, Komatsu Y, Mizushima T, Sukegawa M, Nishikawa K, Hokari K, Takeda H, Sugiyama T, Asaka M. High-dose ecabet sodium improves the eradication rate of helicobacter pylori in dual therapy with lansoprazole and amoxicillin. Aliment Pharmacol Ther. 2000;14:1523-1527. [PubMed] |
| 25. | Pieramico O, Zanetti MV, Innerhofer M, Malfertheiner P. Omeprazole-based dual and triple therapy for the treatment of Helicobacter pylori infection in peptic ulcer disease: a randomized trial. Helicobacter. 1997;2:92-97. [PubMed] |
| 26. | Ren L, Lu H, Li HY, Zhu LY, Xu XQ, Gu LY, Ge ZZ, Li XB. New dual therapy for primary treatment of Helicobacter pylori infection: A prospective randomized study in Shanghai, China. J Dig Dis. 2014;15:622-627. [PubMed] [DOI] |
| 27. | Saita H, Murakami M, Takahashi Y, Sou Y, Kaitani K, Nishio K, Kita T. Factors influencing Helicobacter pylori eradication with 2 week combination therapy of lansoprazole and amoxycillin: intragastric distribution of colonization and gastric mucosal atrophy. J Gastroenterol Hepatol. 1998;13:725-731. [PubMed] |
| 28. | Schmid CH, Whiting G, Cory D, Ross SD, Chalmers TC. Omeprazole plus antibiotics in the eradication of Helicobacter pylori infection: a meta-regression analysis of randomized, controlled trials. Am J Ther. 1999;6:25-36. [PubMed] |
| 29. | Wong BC, Xiao SD, Hu FL, Qian SC, Huang NX, Li YY, Hu PJ, Daldiyono , Manan C, Lesmana L. Comparison of lansoprazole-based triple and dual therapy for treatment of Helicobacter pylori-related duodenal ulcer: an Asian multicentre double-blind randomized placebo controlled study. Aliment Pharmacol Ther. 2000;14:217-224. [PubMed] |
| 30. | Cottrill MR, McKinnon C, Mason I, Chesters SA, Slatcher G, Copeman MB, Turbitt ML. Two omeprazole-based Helicobacter pylori eradication regimens for the treatment of duodenal ulcer disease in general practice. Aliment Pharmacol Ther. 1997;11:919-927. [PubMed] |
| 31. | Delchier JC, Elamine I, Goldfain D, Chaussade S, Barthelemy P, Idström JP. Omeprazole-amoxycillin versus omeprazole-amoxycillin-clarithromycin in the eradication of Helicobacter pylori. Aliment Pharmacol Ther. 1996;10:263-268. [PubMed] |
| 32. | Goh KL, Peh SC, Parasakthi N, Wong NW, Tan KK, Lo YL. Omeprazole 40 mg o.m. combined with amoxycillin alone or with amoxycillin and metronidazole in the eradication of Helicobacter pylori. Am J Gastroenterol. 1994;89:1789-1792. [PubMed] |
| 33. | Harford W, Lanza F, Arora A, Graham D, Haber M, Weissfeld A, Rose P, Siepman N. Double-blind, multicenter evaluation of lansoprazole and amoxicillin dual therapy for the cure of Helicobacter pylori infection. Helicobacter. 1996;1:243-250. [PubMed] |
| 34. | Laine L, Stein C, Neil G. Limited efficacy of omeprazole-based dual and triple therapy for Helicobacter pylori: a randomized trial employing "optimal" dosing. Am J Gastroenterol. 1995;90:1407-1410. [PubMed] |
| 35. | Graham DY, Lu H, Yamaoka Y. A report card to grade Helicobacter pylori therapy. Helicobacter. 2007;12:275-278. [PubMed] [DOI] |
| 36. | Berry V, Jennings K, Woodnutt G. Bactericidal and morphological effects of amoxicillin on Helicobacter pylori. Antimicrob Agents Chemother. 1995;39:1859-1861. [PubMed] |
| 37. | Sahara S, Sugimoto M, Uotani T, Ichikawa H, Yamade M, Kagami T, Hamaya Y, Iwaizumi M, Osawa S, Sugimoto K. Potent Gastric Acid Inhibition Over 24 Hours by 4-Times Daily Dosing of Esomeprazole 20 mg. Digestion. 2015;91:277-285. [PubMed] [DOI] |