修回日期: 2018-11-02
接受日期: 2018-11-15
在线出版日期: 2018-12-08
研究miR-346/DKK3信号轴在结肠癌中的调控作用和机制.
RT-PCR实验检测miR-346在正常结肠上皮细胞和结肠癌细胞中的表达水平, 随后检测其在结肠癌组织和对应的癌旁组织中的表达水平. MTT实验检测miR-346对结肠癌细胞增殖能力的影响. 流式细胞周期检测miR-346对结肠癌细胞周期的影响. 双荧光素酶报告基因实验验证miR-346和DKK3之间的结合关系. 利用siRNA和pcDNA-DKK3转染结肠癌细胞研究DKK3对结肠癌细胞功能的影响.
miR-346在结肠癌细胞中的表达水平显著上调. 过表达miR-346后, 结肠癌细胞的增殖能力变强, G1期细胞比例降低, S期和G2/M期细胞比例增加. 双荧光素酶报告基因实验显示miR-346能够和DKK3直接结合. 转染siRNA抑制DKK3的表达后, 结肠癌细胞增殖能力变强, G1期细胞比例降低, S期和G2/M期细胞比例增加. 过表达DKK3后, 能够部分抵消miR-346对结肠癌细胞的促增殖作用.
miR-346通过靶向结合并抑制DKK3进而促进结肠癌细胞的增殖.
核心提要: 本文首次报道miR-346在结肠癌细胞中表达出现上调并且能够促进结肠癌细胞的增殖. 过表达miR-346后, 结肠癌细胞的增殖能力变强, G1期细胞比例降低, S期和G2/M期细胞比例增加. 同时, 我们还发现miR-346促进结肠癌细胞增殖是通过靶向抑制DKK3实现的. 我们的研究结果表明miR-346/DKK3信号轴在结肠癌发生发展中扮演了重要的角色, 可能成为结肠癌潜在的诊断标记物和药物治疗靶点.
引文著录: 周薏, 孙赟晨, 高克威, 朱樑. miR-346/DKK3信号轴在结肠癌中的细胞增殖的调控. 世界华人消化杂志 2018; 26(34): 1979-1988
Revised: November 2, 2018
Accepted: November 15, 2018
Published online: December 8, 2018
To investigate the regulatory effect of the miR-346/DKK3 axis on tumor cell proliferation in colon cancer.
The expression of miR-346 in normal colon epithelial cells and colon cancer cells as well as in colon tissues and noncancerous tissues was examined by RT-PCR. The effect of miR-346 on the proliferation of colon cancer cells was examined by MTT assay. Flow cytometry was used to detect the effect of miR-346 on the colon cancer cell cycle. The dual luciferase reporter gene assay was used to validate the binding relationship between miR-346 and DKK3. The effect of DKK3 on the function of colon cancer cells was studied by transfecting colon cancer cells with siRNA and pcDNA-DKK3.
The expression of miR-346 in colon cancer cells was significantly upregulated. Overexpression of miR-346 promoted the proliferation of colon cancer cells. The proportion of cells in G1 phase decreased, and the proportion of cells in S phase and G2/M phase increased. The dual luciferase reporter assay showed that miR-346 bound directly to the 3'-UTR of DKK3. Inhibition of DKK3 using siRNA promoted the proliferation of colon cancer cells, reduced the proportion of cells in G1 phase and increased the proportion of cells in S phase and G2/M phase. Further, overexpression of DKK3 partially abrogated the proliferative effect of miR-346 on colon cancer cells.
MiR-346 promotes the proliferation of colon cancer cells by inhibiting DKK3.
- Citation: Zhou Y, Sun YC, Gao KW, Zhu L. Regulatory effect of miR-346/DKK3 axis on tumor cell proliferation in colon cancer. Shijie Huaren Xiaohua Zazhi 2018; 26(34): 1979-1988
- URL: https://www.wjgnet.com/1009-3079/full/v26/i34/1979.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v26.i34.1979
结肠癌是世界上第三大常见的肿瘤, 结肠癌的发病率和死亡率仅次于肺癌的[1]. 近年来, 随着我国人民生活水平的提高、饮食结构的变化和人口老龄化的加剧, 我国结肠癌发病率显著上升[2,3]. 目前唯一有效的治疗方法是手术, 晚期结肠癌患者的生存也依赖于化疗. 因此, 早期诊断和治疗是亟待解决的问题.
miRNA是约22个核苷酸的非编码RNA分子, 其作为转录后调节因子调控基因表达[4]. miRNA通过完全或部分互补的碱基与mRNA结合, 导致靶mRNA的降解或翻译抑制[5]. 目前, 结肠癌肿瘤组织和细胞系中存在大量异常表达miRNA. Wang等[6]人通过与相邻癌旁组织比较, 发现miR-195在结直肠癌组织中的表达下调. Ma等[7]人研究了319种miRNA对人结肠癌细胞增殖和凋亡的影响, 发现miR-491能够诱导细胞凋亡并显着降低细胞活力. miRNA不仅在结肠癌的发生中起重要作用, 而且在结肠癌的发展和转移中起重要作用. Agostini等[8]证明了miR-20与结肠癌的疾病进展密切相关. 此外最近一项研究表明, 联合检测血清CEA和miR-14l有助于检测结肠癌的远处转移. 并且miR-14l表达与肿瘤预后呈负相关[9]. 以往的研究表明, miR-346在肿瘤发生发展中扮演重要的角色[10]. 例如miR-346通过靶向SRCIN1促进乳腺癌细胞的生物学功能, 并降低其对多西紫杉醇的化学敏感性[11]. MicroRNA-346还能够通过调节XPC/ERK/Snail/E-cadherin途径促进肺癌细胞的生长和转移, 抑制肺癌细胞凋亡[12]. 但是, 迄今为止很少有关于miR-346与结肠癌的相关研究, 其在结肠癌发生发展中扮演的角色尚不清楚.
在本研究中, 我们报道miR-346在结肠癌细胞中表达上调并显著促进结肠癌细胞的增殖. 并且miR-346对结肠癌细胞的促增殖作用是通过靶向抑制DKK3. 总之, 我们的研究结果表明miR-346/DKK3信号轴在结肠癌发生发展中扮演了重要的角色, 可能成为结肠癌潜在的诊断标记物和药物治疗靶点.
FHC、HCT-116、HT-29和SW-480细胞购自中国科学院细胞库. 细胞均用含10%胎牛血清的DMEM进行培养, 培养箱的条件设置为37 ℃, 5%CO2人结肠癌组织来自于生物芯片上海国家工程研究中心的生物银行. 本研究得到生物芯片上海国家工程研究中心伦理委员会批准. 术前获得知情同意书. 为了检测样品中miRNA的表达水平, 使用TIANScript RT试剂盒将2 μg总RNA反转录为cDNA, 之后进行RT-PCR. 内参为U6. 为了检测mRNA的表达, 取100 ng总RNA, 按照说明书使用PrimeScript RT Master Mix将其反转录为cDNA. 实验过程中所用引物序列如下所示: DKK3: 正向: 5'-ACACAGACACGAAGGTTGGA-3'; 反向: 5'-CGTCTCCCACAGATGTG ATA-3'; GAPDH: 正向: 5'-GGAGCG AGATCCCTCCAAAAT-3', 反向: 5'-GGCTGTTGTCATACTTCTCATGG-3'.
1.2.1 细胞转染: 为了有效敲减DKK3的表达, 我们设计了两个siRNA, 分别作用于DKK3的不同区域. siRNA的核苷酸序列如下: siRNA-1: AAUGGUCUGGUACUUAUUCCGC,CGUUACCAGACCAUGAAUAAGG; 和siRNA-2: AUCCAUGUGCACCGAGAAA, CCAGAGAGGUCCCCGAUGA. miR-346的mimics购买自biotend公司. 我们在6孔板中提前预种好1.5×105个细胞. 24 h后, 按照说明书将mimics或siRNA和转染试剂Lipofectamine 2000混合后, 加入细胞培养基中. 转染48-72 h后, 根据具体的实验要求, 收集细胞继续后续的RT-PCR和Westernblot实验.
1.2.2 荧光素酶报告实验和质粒构建: 首先抽提基因组DNA, 通过PCR扩增含有miR-346的假定靶点的DKK3的3'-UTR片段. 将野生型和突变型片段转染到PGL3载体中, 构建相应的双荧光素酶报告质粒. 使用293FT细胞来检测miR-346和DKK3之间的关系. 将细胞接种于24孔板中, 使用10%FBS的DMEM培养基培养, 24 h后进行转染. 根据试剂说明书, 使用FuGENE(Roche)将300 ng萤火虫荧光素酶报告载体和10 ng含有海肾荧光素酶的对照载体转入细胞. 每孔加入0.2 nmol/L miR-346 mimics或对照试剂. 转染48 h后, 使用双荧光素酶报告分析系统(Promega)连续测量萤火虫和海肾荧光素酶活性. 构建DKK3过表达质粒时, 将DKK3编码序列克隆到pcDNA中获得DKK3表达载体.
1.2.3 细胞增殖和细胞周期: HCT-116转染两天后, 以3×103细胞/孔的密度种到96孔板中. 在24、48和72 h的时间点进行细胞计数. 细胞种板24、48和72 h后, 加入MTT溶液, 在37 ℃培养箱内孵育4 h. 然后每孔加入DMSO溶液, 使用分光光度计测量490 nm处的吸光度. 使用流式细胞仪进行细胞周期实验.
1.2.4 Western blotting: 收集细胞后, 加入适量裂解液提取蛋白. 用BCA蛋白定量试剂盒检测蛋白含量. 加入适量loading buffer, 99 ℃变性后, 储存于-20 ℃. 使用SDS-PAGE分离蛋白质, 转移至纯硝酸纤维素印迹膜上, 用相应抗体检测. 实验中使用的抗体包括: 抗DKK3(Bioworld, 1:3000)和抗GAPDH(BioWorld, 1:5000). 使用Image Quant LAS4000 Mini(GE Healthcare Life Sciences)扫描实验结果.
统计学处理 采用SPSS 17.0统计软件进行数据分析. 两两比较应用t检验. P<0.05认为差异有统计学意义.
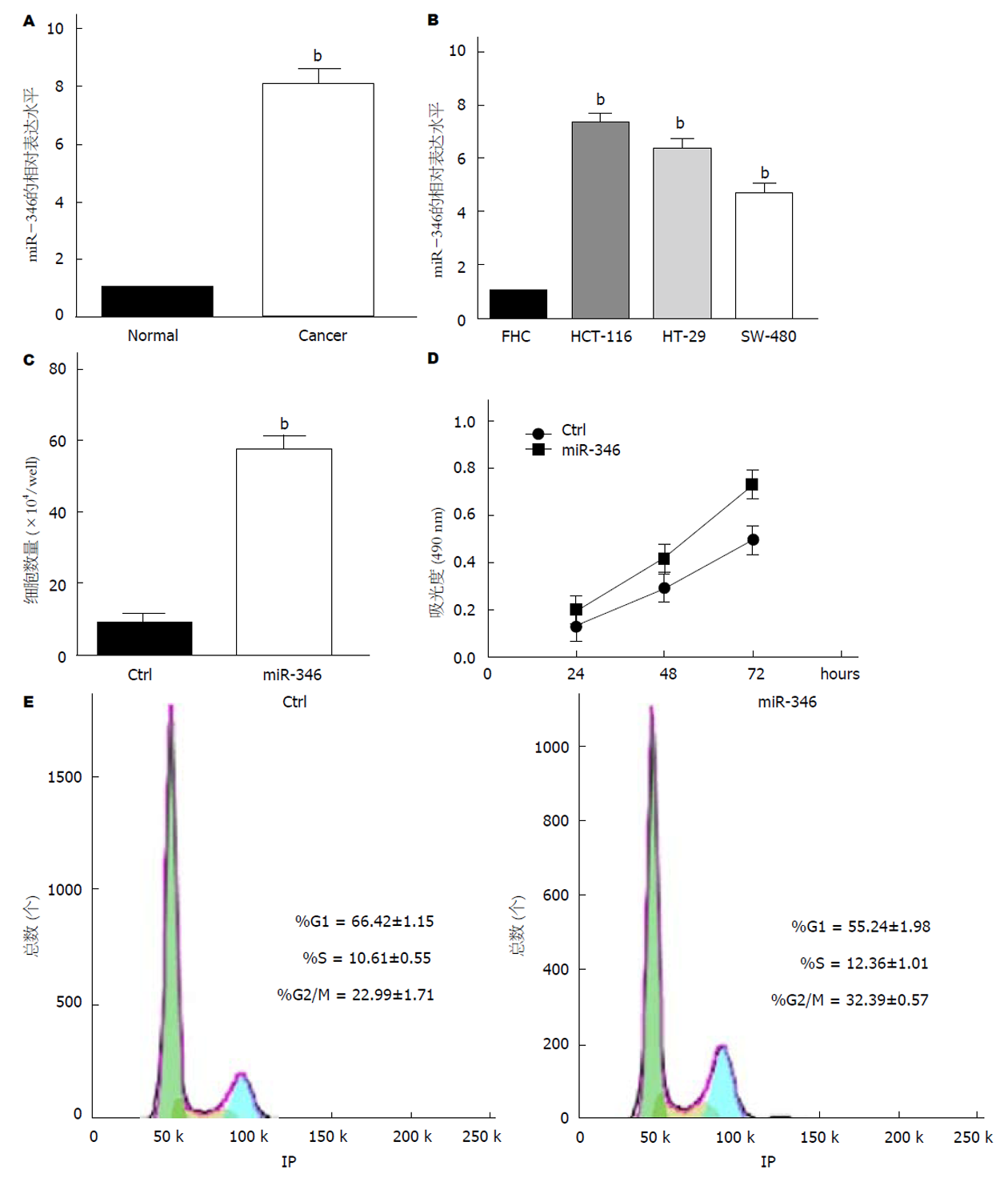
我们在三对结肠癌和对应的癌旁组织中检测miR-346的表达. 结果提示与癌旁组织相比, 结肠癌组织中miR-346的表达水平更高(图1A). 之后在结肠癌细胞系中也观察到类似的现象. miR-346在HCT-116、HT-29和SW-480三种结肠癌细胞系中的表达显着高于其在正常结肠粘液上皮细胞FHC中的表达(图1B). 为了研究miR-346对结肠癌细胞增殖的作用, 我们使用miR-346 mimics转染HCT-116, 以达到过表达miR-346的效果. 我们发现miR-346过表达实验组的细胞数多于对照组(图1C). MTT实验结果表明, miR-346的过表达可显著促进结肠癌细胞增殖(图1D). 此外, 流式细胞仪结果显示, 过表达miR-346后, G1期细胞比例显着降低, S细胞比例和G2/M期细胞比例增加(图1E).
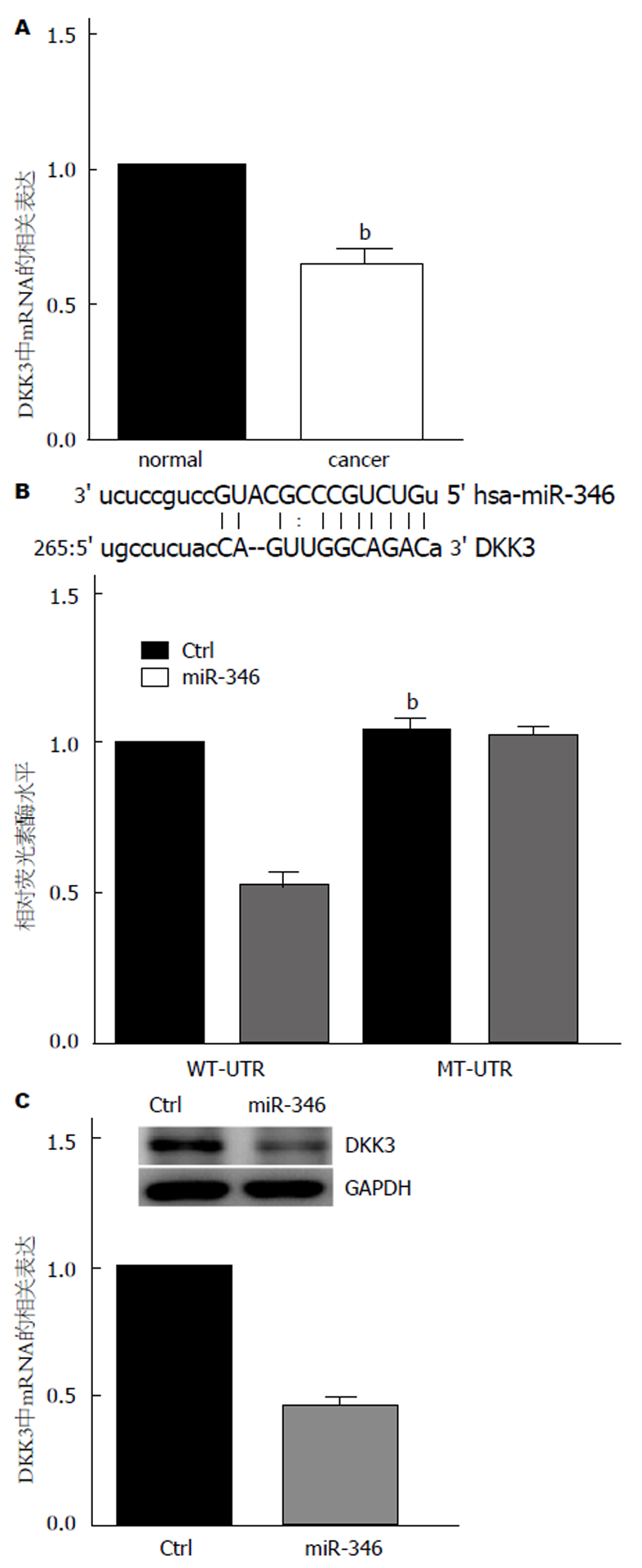
我们利用TargetScan和PicTar进行预测, 发现miR-346能够和DKK3的3'-UTR区域结合, 提示DKK3可能是miR-346的潜在靶标. 预测中DKK3和miR-346相互作用的具体序列如图2B(顶部)所示. 我们进行了荧光素酶报告实验, 构建了野生型及突变型重组双荧光素酶报告质粒. 与空载体对照组相比, miR-346 mimics的转染明显抑制了野生型DKK3 3'-UTR荧光素酶活性, 而突变型DKK3 3'-UTR破坏了miR-346和DKK3之间的碱基配对, 导致实验组与对照组之间的荧光素酶活性无明显差异(图2B, 底部). 细胞转染miR-346 mimics后, DKK3在mRNA和蛋白质水平的表达显着下降(图2C).
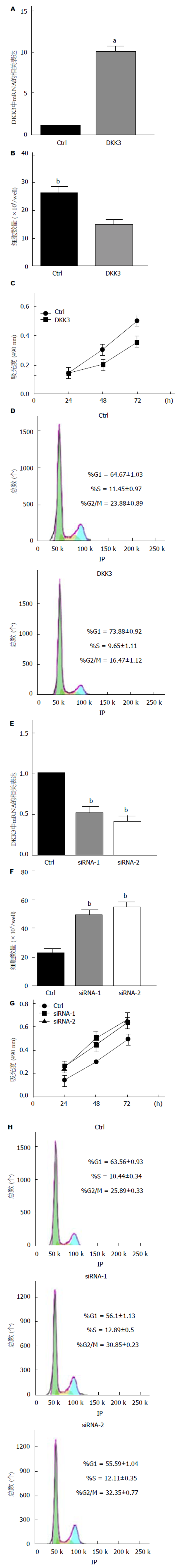
为了研究DKK3在结肠癌细胞增殖中的作用, HCT-116转染了pcDNA-DKK3或siRNA以增加或降低细胞内DDK3的表达. 我们检测到转染pcDNA-DKK3后DKK3的mRNA水平显着增加(图3A). DKK3过表达实验组的细胞数少于对照组(图3B). DKK3的过表达可显着抑制细胞增殖, 使G1期细胞比例显着增加, S期和G2/M期细胞比例减少(图3C和3D). 另一方面, siRNA-1和siRNA-2均显著干扰细胞内DKK3的表达(图3E). 转染siRNA-1/siRNA-2后DKK3表达下调的实验组细胞数多于对照组(图3F). DKK3的表达降低显着促进细胞增殖, 并且导致处于G1期的细胞比例显着降低, S期和G2/M期的细胞比例增加(图3G和3H).
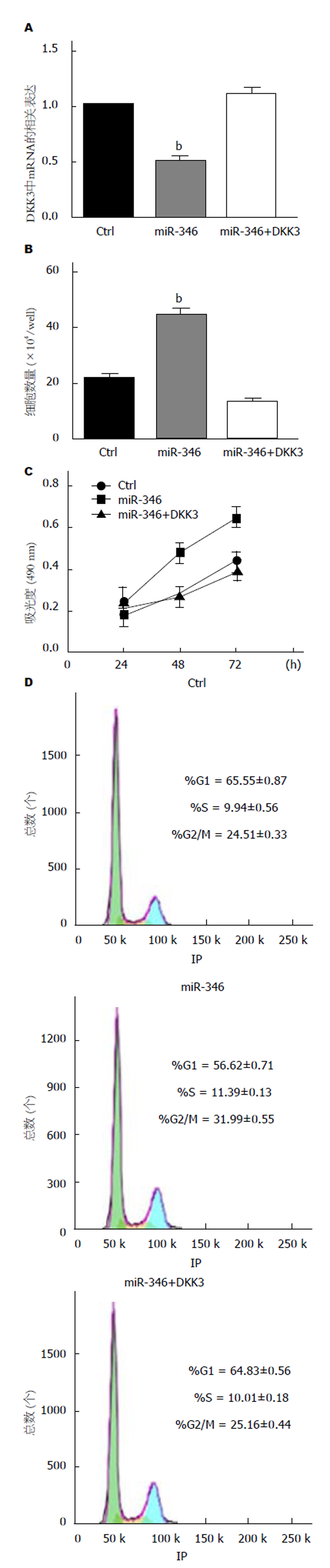
为了确认miR-346通过下调DKK3的表达来调节细胞增殖, 细胞共转染miR-346 mimics和pcDNA-DKK3. 转染miR-346 mimics后, DKK3的mRNA水平显着下降, 这表明内源性DKK3被抑制. 细胞共转染miR-346 mimics和pcDNA-DKK3后, DKK3的mRNA水平与对照组中的无统计学差异(图4A). miR-346过表达的实验组的细胞数多于对照组. 对照组与miR-346和DKK3过表达的实验组之间的细胞数没有差异(图4B). MTT实验结果显示miR-346的过表达可显着促进细胞增殖. 然而, 同时过表达DKK3会抑制了miR-346过表达对细胞增殖的促进作用(图4C). 进一步实验发现, miR-346的过表达使G1期细胞比例显着降低, S期和G2/M期细胞比例增加. 对照组与miR-346和DKK3过表达实验组之间各期细胞所占比例无显著差异(图4D).
大量研究表明miRNA在肿瘤中的表达量发生异常, 其通过调控癌基因的激活和抑癌基因的缺失, 从而影响肿瘤细胞的增殖和生长[13-15]. 有研究发现在甲状腺癌细胞系中, 过表达miR-346会促进细胞增殖, 抑制内源性miR-346表达导致细胞生长停滞[16]. 此外, miR-346还在甲状腺肿的发展过程中发挥了重要作用[17]. Alsaleh等[18]发现miR-346通过调节IL-18参与慢性炎症过程. 另一项研究报道, 在粘膜炎症期间, TNF-α通过miR-346下调上皮维生素D受体[19]. Guo等[20]研究了miR-346在宫颈癌中的作用. 他们发现miR-346在宫颈癌中高表达, 可促进宫颈癌细胞的迁移和侵袭, 并增强Argonaute2的表达. 因此, miR-346可能作为致癌基因参与肿瘤的发生和发展. 本研究发现在结肠癌和结肠癌细胞系中miR-346的表达显着增加. 然后我们在结肠癌细胞系中使用miR-346 mimics来过表达miR-346. 通过一系列实验证明, miR-346可以促进细胞增殖. 那其发挥作用的具体机制是什么?
根据TargetScan和PicTar的预测, DKK3是miR-346的潜在靶基因. DKK3属于DKK家族, 其表达的蛋白是Wnt信号通路的抑制剂[21]. Wnt信号通路参与细胞增殖、分化、炎症、癌症等多种生理病理过程等. Wnt信号通路的异常激活的情况在多种肿瘤中都有所发现[22-24]. 最近的研究发现阻断Wnt信号通路可以抑制肿瘤生长. 这表明DKK3可能是肿瘤抑制因子. DKK3在多种人类肿瘤组织和细胞系中表达减弱或消失, 包括前列腺癌、宫颈癌、胃癌、肺癌和结肠癌[25-30]. 本研究得出了类似的结果. 为了证实DKK3是miR-346的靶基因, 我们进行了双荧光素酶报告实验, 构建了野生型及突变型重组双荧光素酶报告质粒. 与空载体对照组相比, miR-346 mimics的转染明显抑制了野生型DKK3 3'-UTR荧光素酶活性, 而突变型DKK3 3'-UTR破坏了miR-346和DKK3之间的碱基配对, 导致实验组与对照组之间的荧光素酶活性无明显差异. 此外, 细胞转染miR-346 mimics后, DKK3在mRNA和蛋白质水平的表达量显着下降. 这些结果表明DKK3是miR-346的靶基因.
为了研究DKK3在结肠癌细胞增殖中的作用, HCT-116转染了pcDNA-DKK3或siRNA以增加或降低细胞内DDK3的表达. 我们发现DKK3可以显着抑制细胞增殖. 最后, 过表达miR-346可以显着促进细胞增殖. 而DKK3可以抑制miR-346对细胞增殖的促进作用. 于是, 我们猜测miR-346是通过下调DKK3来影响结肠癌的细胞增殖.
总之, 本研究的结果表明miR-346是结肠癌中的致癌基因. 它通过下调DKK3来调控结肠癌的细胞增殖. 这些研究结果表明miR-346/DKK3信号轴是潜在的临床诊断和治疗方法. 然而, 本研究仍存在一些不足之处. 首先, 未进行miR-346对结肠癌细胞的细胞凋亡、侵袭和其他生物学行为影响的实验. 其次, 未进行动物实验进一步验证miR-346在结肠癌中的生物学功能. 这些将在今后的研究中进一步改善.
非编码RNA和结肠癌之间的关系一直是医学研究的重点和热点. miR-346被发现参与了多种肿瘤的进展. 但目前尚缺少miR-346与结肠癌的相关研究. 本文拟通过细胞功能实验探究miR-346在结肠癌中的作用及机制.
本课题围绕着miR-346在结肠癌细胞中的功能作用进行研究, 揭示miR-346对结肠癌细胞的调控作用.
本论文通过研究miR-346对结肠癌细胞增殖功能的调控作用, 及寻找下游的靶基因, 揭示了miR-346在结肠癌发生发展中的作用机制.
本文采用了MTT实验研究miR-346对结肠癌细胞功能的影响, 利用流式细胞仪分析miR-346对结肠癌细胞周期的影响, 通过报告基因实验寻找miR-346下游的靶基因, 并验证两者之间的调控作用.
本研究达到实验目标. 发现miR-346能够通过抑制下游靶基因DKK3调控结肠癌细胞的增殖能力. 进一步丰富了非编码RNA与结肠癌之间的调控网络.
本研究发现miR-346能够促进结肠癌细胞增殖, 以及发现了mIR-346新的靶基因DKK3. 本研究提出miR-346通过抑制DKK3促进结肠癌细胞的增殖. 通过干预miR-346-DKK3轴调控结肠癌细胞的功能. miR-346通过抑制DKK3促进结肠癌细胞的增殖. miR-346促进结肠癌细胞增殖, G1期细胞比例显着降低, S期和G2/M期细胞比例增加. 为今后潜在的临床应用提供理论基础.
miR-346下游有许多靶基因, DKK3只是其中的一个. 寻找下游靶基因需要报告基因、WB等多个实验进行验证. 进一步研究miR-346对结肠癌细胞迁移、侵袭、凋亡的作用.
学科分类: 胃肠病学和肝病学
手稿来源地: 上海市
同行评议报告分类
A级 (优秀): 0
B级 (非常好): B, B
C级 (良好): C
D级 (一般): D, D
E级 (差): 0
编辑: 崔丽君 电编:张砚梁
| 1. | Purushotham AD, Lewison G, Sullivan R. The state of research and development in global cancer surgery. Ann Surg. 2012;255:427-432. [PubMed] [DOI] |
| 2. | Sung JJ, Lau JY, Goh KL, Leung WK; Asia Pacific Working Group on Colorectal Cancer. Increasing incidence of colorectal cancer in Asia: implications for screening. Lancet Oncol. 2005;6:871-876. [PubMed] [DOI] |
| 3. | Hong W, Dong L, Stock S, Basharat Z, Zippi M, Zhou M. Prevalence and characteristics of colonic adenoma in mainland China. Cancer Manag Res. 2018;10:2743-2755. [PubMed] [DOI] |
| 4. | Hutvágner G, McLachlan J, Pasquinelli AE, Bálint E, Tuschl T, Zamore PD. A cellular function for the RNA-interference enzyme Dicer in the maturation of the let-7 small temporal RNA. Science. 2001;293:834-838. [PubMed] [DOI] |
| 5. | Rosenfeld N, Aharonov R, Meiri E, Rosenwald S, Spector Y, Zepeniuk M, Benjamin H, Shabes N, Tabak S, Levy A. MicroRNAs accurately identify cancer tissue origin. Nat Biotechnol. 2008;26:462-469. [PubMed] [DOI] |
| 6. | Wang X, Wang J, Ma H, Zhang J, Zhou X. Downregulation of miR-195 correlates with lymph node metastasis and poor prognosis in colorectal cancer. Med Oncol. 2012;29:919-927. [PubMed] [DOI] |
| 7. | Ma R, Jiang T, Kang X. Circulating microRNAs in cancer: origin, function and application. J Exp Clin Cancer Res. 2012;31:38. [PubMed] [DOI] |
| 8. | Agostini M, Pucciarelli S, Calore F, Bedin C, Enzo M, Nitti D. miRNAs in colon and rectal cancer: A consensus for their true clinical value. Clin Chim Acta. 2010;411:1181-1186. [PubMed] [DOI] |
| 9. | Cheng H, Zhang L, Cogdell DE, Zheng H, Schetter AJ, Nykter M, Harris CC, Chen K, Hamilton SR, Zhang W. Circulating plasma MiR-141 is a novel biomarker for metastatic colon cancer and predicts poor prognosis. PLoS One. 2011;6:e17745. [PubMed] [DOI] |
| 10. | Yan HL, Li L, Li SJ, Zhang HS, Xu W. miR-346 promotes migration and invasion of nasopharyngeal carcinoma cells via targeting BRMS1. J Biochem Mol Toxicol. 2016;30:602-607. [PubMed] [DOI] |
| 11. | Yang F, Luo LJ, Zhang L, Wang DD, Yang SJ, Ding L, Li J, Chen D, Ma R, Wu JZ. MiR-346 promotes the biological function of breast cancer cells by targeting SRCIN1 and reduces chemosensitivity to docetaxel. Gene. 2017;600:21-28. [PubMed] [DOI] |
| 12. | Sun CC, Li SJ, Yuan ZP, Li DJ. MicroRNA-346 facilitates cell growth and metastasis, and suppresses cell apoptosis in human non-small cell lung cancer by regulation of XPC/ERK/Snail/E-cadherin pathway. Aging (Albany NY). 2016;8:2509-2524. [PubMed] [DOI] |
| 13. | Yang W, Lee DY, Ben-David Y. The roles of microRNAs in tumorigenesis and angiogenesis. Int J Physiol Pathophysiol Pharmacol. 2011;3:140-155. [PubMed] |
| 14. | Osman A. MicroRNAs in health and disease--basic science and clinical applications. Clin Lab. 2012;58:393-402. [PubMed] |
| 15. | Roberts AP, Lewis AP, Jopling CL. The role of microRNAs in viral infection. Prog Mol Biol Transl Sci. 2011;102:101-139. [PubMed] [DOI] |
| 16. | Weber F, Teresi RE, Broelsch CE, Frilling A, Eng C. A limited set of human MicroRNA is deregulated in follicular thyroid carcinoma. J Clin Endocrinol Metab. 2006;91:3584-3591. [PubMed] [DOI] |
| 17. | Chen J, Tian J, Tang X, Rui K, Ma J, Mao C, Liu Y, Lu L, Xu H, Wang S. MiR-346 regulates CD4+CXCR5+ T cells in the pathogenesis of Graves' disease. Endocrine. 2015;49:752-760. [PubMed] [DOI] |
| 18. | Alsaleh G, Suffert G, Semaan N, Juncker T, Frenzel L, Gottenberg JE, Sibilia J, Pfeffer S, Wachsmann D. Bruton's tyrosine kinase is involved in miR-346-related regulation of IL-18 release by lipopolysaccharide-activated rheumatoid fibroblast-like synoviocytes. J Immunol. 2009;182:5088-5097. [PubMed] [DOI] |
| 19. | Chen Y, Du J, Zhang Z, Liu T, Shi Y, Ge X, Li YC. Micro-RNA-346 mediates tumor necrosis factor α-induced downregulation of gut epithelial vitamin D receptor in inflam-matory bowel diseases. Inflamm Bowel Dis. 2014;20:1910-1918. [PubMed] [DOI] |
| 20. | Guo J, Lv J, Liu M, Tang H. miR-346 Up-regulates Argonaute 2 (AGO2) Protein Expression to Augment the Activity of Other MicroRNAs (miRNAs) and Contributes to Cervical Cancer Cell Malignancy. J Biol Chem. 2015;290:30342-30350. [PubMed] [DOI] |
| 21. | Veeck J, Dahl E. Targeting the Wnt pathway in cancer: the emerging role of Dickkopf-3. Biochim Biophys Acta. 2012;1825:18-28. [PubMed] [DOI] |
| 22. | Tai D, Wells K, Arcaroli J, Vanderbilt C, Aisner DL, Messersmith WA, Lieu CH. Targeting the WNT Signaling Pathway in Cancer Therapeutics. Oncologist. 2015;20:1189-1198. [PubMed] [DOI] |
| 23. | Wagner AH, Devarakonda S, Skidmore ZL, Krysiak K, Ramu A, Trani L, Kunisaki J, Masood A, Waqar SN, Spies NC. Recurrent WNT pathway alterations are frequent in relapsed small cell lung cancer. Nat Commun. 2018;9:3787. [PubMed] [DOI] |
| 24. | Galluzzi L, Spranger S, Fuchs E, López-Soto A. WNT Signaling in Cancer Immunosurveillance. Trends Cell Biol. 2018;. [PubMed] [DOI] |
| 25. | Zenzmaier C, Untergasser G, Hermann M, Dirnhofer S, Sampson N, Berger P. Dysregulation of Dkk-3 expression in benign and malignant prostatic tissue. Prostate. 2008;68:540-547. [PubMed] [DOI] |
| 26. | Lee EJ, Jo M, Rho SB, Park K, Yoo YN, Park J, Chae M, Zhang W, Lee JH. Dkk3, downregulated in cervical cancer, functions as a negative regulator of beta-catenin. Int J Cancer. 2009;124:287-297. [PubMed] [DOI] |
| 27. | Park JM, Kim MK, Chi KC, Kim JH, Lee SH, Lee EJ. Aberrant loss of dickkopf-3 in gastric cancer: can it predict lymph node metastasis preoperatively? World J Surg. 2015;39:1018-1025. [PubMed] [DOI] |
| 28. | Yue W, Sun Q, Dacic S, Landreneau RJ, Siegfried JM, Yu J, Zhang L. Downregulation of Dkk3 activates beta-catenin/TCF-4 signaling in lung cancer. Carcinogenesis. 2008;29:84-92. [PubMed] [DOI] |
| 29. | Stone L. DKK3 loss induces opposing effects. Nat Rev Urol. 2018;15:527. [PubMed] [DOI] |
| 30. | Kardooni H, Gonzalez-Gualda E, Stylianakis E, Saffaran S, Waxman J, Kypta RM. CRISPR-Mediated Reactivation of DKK3 Expression Attenuates TGF-β Signaling in Prostate Cancer. Cancers (Basel). 2018;10. [PubMed] [DOI] |