修回日期: 2018-10-08
接受日期: 2018-10-19
在线出版日期: 2018-11-08
分析SERPINE1基因在胃癌中的表达及临床意义.
选取TCGA数据库中胃癌数据集, 采用K-M生存曲线、COX比例风险模型、χ2检验(单因素分析)、Logistic回归对患者资料进行分析.
COX风险比例模型对影响胃癌患者预后的因素进行了分析. 结果显示SERPINE1表达情况、年龄、T分期、N分期、M分期、TNM分期均能影响胃癌患者的预后. 而其中SERPINE1表达情况、年龄和M分期是影响肿瘤预后的独立危险因素. χ2检验及Logistic回归对影响SERPINE1基因表达的危险因素进行了分析. 结果显示, 胃癌患者的基本年龄、性别、肿瘤分化程度及肿瘤分期均不会影响SERPINE1基因的表达, 而位于胃窦处胃癌的表达量较其它部位低. 我们分析了SERPINE1在胃癌组织中表达显著高于癌旁正常组织.
本研究分析发现, SERPINE1基因在胃癌中表达增高, 与胃癌的不良预后相关. SERPINE1可能成为胃癌筛查及治疗靶点.
核心提要: 癌症的精准治疗成为现今热议的话题. 我们分析发现SERPINE1在胃癌中高表达, 与胃癌的不良预后显著相关. 并且SERPINE1在胃癌组织中表达显著高于癌旁正常组织. 这提示SERPINE1可能成为预测胃癌预后及胃癌筛查指标.
引文著录: 沈苗, 钟兴伟. SERPINE1基因在胃癌中的表达及临床意义. 世界华人消化杂志 2018; 26(31): 1818-1824
Revised: October 8, 2018
Accepted: October 19, 2018
Published online: November 8, 2018
To detect the expression of the SERPINE1 gene and analyze its clinical significance in gastric cancer (GC).
The patients with GC were selected from the TCGA database. K-M survival curve, COX proportional hazards model, χ2 test and logistic regression were used to analyze the patients' data.
COX proportional risk model analysis showed that SERPINE1 expression, age, T stage, N stage, M stage, and TNM stage were prognostic factors for overall survival. Among them, SERPINE1 expression, age and M stage were independent risk factors affecting tumor prognosis. Chi-square test and logistic regression were used to analyze the risk factors affecting the expression of the SERPINE1 gene. The results showed that the age, sex, tumor differentiation and tumor stage in GC patients did not affect the expression of the SERPINE1 gene, while the expression in the gastric antrum was lower than that in other sites. SERPINE1 expression was significantly higher in GC tissues than in adjacent normal tissues.
The expression of the SERPINE1 gene in GC increases, which is associated with a poor prognosis of GC. SERPINE1 may become a target for GC screening and treatment.
- Citation: Shen M, Zhong XW. Clinical significance of expression of SERPINE1 gene in gastric cancer. Shijie Huaren Xiaohua Zazhi 2018; 26(31): 1818-1824
- URL: https://www.wjgnet.com/1009-3079/full/v26/i31/1818.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v26.i31.1818
胃癌(gastric cancer, GC)是世界上最常见的恶性肿瘤之一, 同时也是致死率最高的肿瘤之一[1]. 在中国, 尽管多年来发病率有所下降, 但GC在所有肿瘤中发病率和死亡率均排在第三位[2], 对公共健康构成严重威胁. GC可能由多种因素引起, 如饮食习惯, 激素营养素水平和其他引起慢性胃炎的因素[3,4]. 到目前为止, 目前的GC治疗技术已有明显改善, 但晚期患者 GC剩下的五年存活率仅为20%[5]. 因此, 鉴定新的治疗靶点和更好地理解GC发展的分子机制将对疾病的诊断和治疗有很大帮助.
SERPINE1, 也称为纤溶酶原激活物抑制剂1型(plasminogen activator inhibitor type 1, PAI-1), 作为组织纤溶酶原激活物(tPA)和尿激酶(uPA)的抑制剂起作用, 因此是纤维蛋白溶解抑制剂. 许多研究已经发现其在癌症中的异常表达. 例如, SERPINE1被发现在结直肠癌中高表达并且与肿瘤侵袭性和侵袭性有关[6]. 在许多其他癌症中也发现了SERPINE1的过度表达, 包括结直肠瘤[7], 食道癌[8], 膀胱癌[9], 胶质瘤[10]和肺癌[11]. 它可被视为预后不良的生物标志物. 同时, 我们进行的GC生物信息学分析也发现, SELPINE1高表达, 与患者的预后相关.
我们利用TCGA数据库(https://portal.gdc.cancer.gov/)下载GC数据集的临床信息和基因表达信息. 临床信息包括: 性别、年龄、肿瘤位置、分化程度、T分期、N分期、M分期、TNM分期、总生存期、生存状态、无病生存期. 总生存期(overall survival, OS)定义为从手术到死亡或最后失访日期为止. 无病生存期(disease-free survival, DFS)的定义是指从随机化开始至疾病复发或由于疾病进展导致患者死亡的时间. 基因表达量根据中位数分为低表达组和高表达组.
对下载的TCGA数据集进行筛选, 保留包含患者临床信息及生存信息的资料, 并将临床资料与患者基因资料整合, 删除仅有临床资料或基因资料的患者数据. 根据表达谱数据, 将SERPINE1表达从低到高排序, 取中位数作为节点, 将患者分为低表达组和高表达组. 实验中所用的GC标本来自于浙江省湖州市德清县人民医院, 并经过患者及家属知情同意. 所有标本在采集后与液氮中进行保存. 组织RNA的提取采用Qiagen RNeasy mini kit试剂盒.
统计学处理 应用SPSS 21.0对数据进行分析. 使用χ2检验(单因素分析)或logistic回归模型(多变量分析)分析影响GC患者SERPINE1表达的危险因素. 生存分析采用Kaplan-Meier法(Log-rank检验)和COX比例风险模型, 分析影响肺癌患者生存的危险因素. P值小于0.05被认为具有统计学意义.
表1总结了TCGA数据库中患者基本信息. 在本项研究中基因和临床信息相匹配的患者一共有375例. 男性241(64.3%), 女性134(35.7%); >60岁患者250(66.7%), ≤60患者为121(32.3%). 发病部位主要为胃体(34.7%)和胃窦(36.8)部; 有39.2%患者分化程度较低; T3及T4期患者占71.4%; 伴有淋巴结转移患者占65.5%; 6.7%患者伴有远处转移; 晚期患者占50.1%.
| 变量 | n (%) |
| SLC52A3 | |
| 低表达 | 187 (49.90) |
| 高表达 | 188 (50.10) |
| 性别 | |
| 男性 | 241 (64.30) |
| 女性 | 134 (35.70) |
| 年龄 | |
| ≤60岁 | 121 (32.30) |
| >60岁 | 250 (66.70) |
| 缺失 | 4 (1.10) |
| 位置 | |
| 胃食管连接处 | 41 (10.90) |
| 贲门 | 48 (12.80) |
| 胃底/胃体 | 130 (34.70) |
| 胃窦 | 138 (36.80) |
| 缺失 | 18 (4.80) |
| 分化程度 | |
| G1+G2 | 147 (39.20) |
| G3+G4 | 219 (58.40) |
| 缺失 | 9 (2.40) |
| T分期 | |
| T1+T2 | 99 (26.40) |
| T3+T4 | 268 (71.50) |
| 缺失 | 8 (2.10) |
| N分期 | |
| N0 | 111 (29.60) |
| N1+N2+N3 | 246 (65.60) |
| 缺失 | 18 (4.80) |
| M分期 | |
| M0 | 330 (88.00) |
| M1 | 25 (6.70) |
| 缺失 | 20 (5.30) |
| TNM分期 | |
| Ⅰ+Ⅱ | 164 (43.70) |
| Ⅲ+Ⅳ | 188 (50.10) |
| 缺失 | 23 (6.10) |
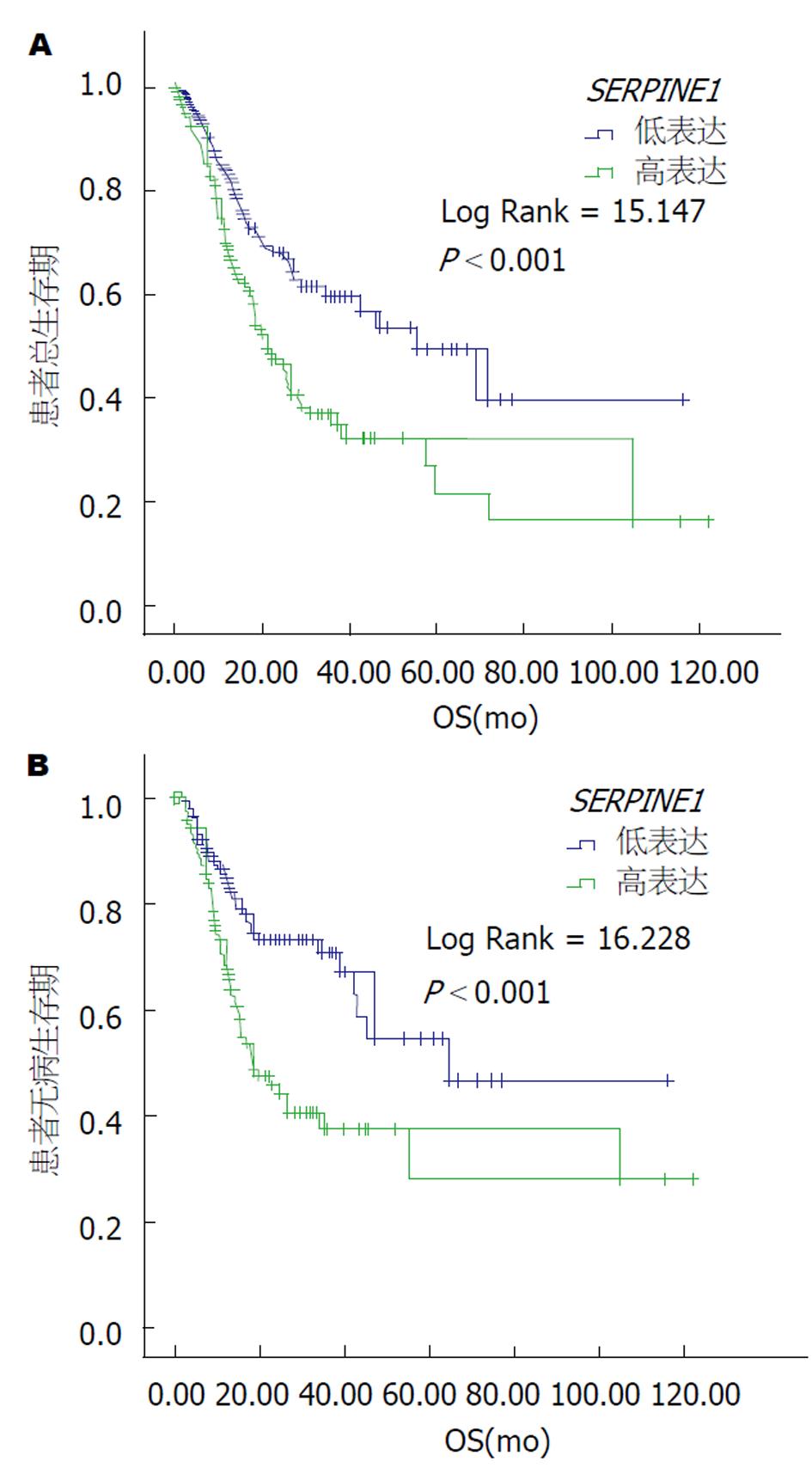
我们COX风险比例模型对影响GC患者预后的因素进行了分析. 结果显示SERPINE1表达情况、年龄、T分期、N分期、M分期、TNM分期均能影响GC患者的预后. 而其中SERPINE1表达情况、年龄和M分期是影响肿瘤预后的独立危险因素(表2). 我们应用K-M曲线对不同SERPINE1表达患者进行了生存分析, 可以看出高表达SERPINE1患者预示一个不良预后(图1A), 而且高表达SERPINE1患者更容易发生肿瘤复发(图1B).
| 变量 | 单因素COX | 多因素COX | ||||
| HR | 95%CI | P | HR | 95%CI | P | |
| SERPINE1 | <0.001 | 0.008 | ||||
| 低表达 | 1 | 1 | ||||
| 高表达 | 1.928 | 1.377-2.699 | 1.66 | 1.139-2.418 | ||
| 性别 | 0.168 | 0.187 | ||||
| 男性 | 1 | 1 | ||||
| 女性 | 0.781 | 0.549-1.11 | 0.762 | 0.509-1.141 | ||
| 年龄 | 0.018 | 0.002 | ||||
| ≤60岁 | 1 | 1 | ||||
| >60岁 | 1.566 | 1.08-2.271 | 1.935 | 1.271-2.946 | ||
| 位置 | ||||||
| 胃食管连接处 | 1 | 0.572 | 1 | 0.617 | ||
| 贲门 | 1.592 | 0.795-3.188 | 0.19 | 1.651 | 0.739-3.69 | 0.222 |
| 胃底/胃体 | 1.216 | 0.647-2.286 | 0.543 | 1.261 | 0.593-2.682 | 0.547 |
| 胃窦 | 1.251 | 0.666-2.347 | 0.486 | 1.298 | 0.606-2.777 | 0.502 |
| 分化程度 | 0.079 | 0.076 | ||||
| G1+G2 | 1 | 1 | ||||
| G3+G4 | 1.364 | 0.965-1.928 | 1.437 | 0.963-2.144 | ||
| T分期 | 0.011 | 0.333 | ||||
| T1+T2 | 1 | 1 | ||||
| T3+T4 | 1.726 | 1.136-2.622 | 1.322 | 0.751-2.33 | ||
| N分期 | 0.003 | 0.244 | ||||
| N0 | 1 | 1 | ||||
| N1+N2+N3 | 1.862 | 1.231-2.818 | 1.438 | 0.78-2.652 | ||
| M分期 | 0.004 | 0.04 | ||||
| M0 | 1 | 1 | ||||
| M1 | 2.237 | 1.286-3.894 | 2.07 | 1.034-4.144 | ||
| TNM分期 | <0.001 | 0.638 | ||||
| Ⅰ+Ⅱ | 1 | 1 | ||||
| Ⅲ+Ⅳ | 1.902 | 1.33-2.722 | 1.153 | 0.637-2.089 | ||
我们应用χ2检验及Logistic回归对影响SERPINE1基因表达的危险因素进行了分析. 结果显示(表3), GC患者的基本年龄、性别、肿瘤分化程度及肿瘤分期均不会影响SERPINE1基因的表达, 而位于胃窦处GC的表达量较其它部位低. 这些结果提示SERPINE的表达量不因肿瘤的分期及年龄、性别的不同而有所差异, 这提示SERPINE1基因可以独立的预测GC患者的预后.
| 变量 | 单因素 | 多因素 | |||
| n | P | HR | 95%CI | P | |
| 性别 | 0.799 | 0.465 | |||
| 男性 | 241 | 1 | |||
| 女性 | 134 | 0.836 | 0.518-1.351 | ||
| 年龄 | 0.941 | 0.765 | |||
| ≤60岁 | 121 | 1 | |||
| >60岁 | 250 | 1.078 | 0.657-1.769 | ||
| 位置 | 0.061 | ||||
| 胃食管连接处 | 41 | 1 | 0.015 | ||
| 贲门 | 48 | 0.789 | 0.309-2.016 | 0.62 | |
| 胃底/胃体 | 130 | 0.862 | 0.377-1.971 | 0.724 | |
| 胃窦 | 138 | 0.397 | 0.174-0.904 | 0.028 | |
| 分化程度 | 0.359 | 0.254 | |||
| G1+G2 | 147 | 1 | |||
| G3+G4 | 219 | 1.334 | 0.813-2.188 | ||
| T分期 | 0.231 | 0.765 | |||
| T1+T2 | 99 | 1 | |||
| T3+T4 | 268 | 1.1 | 0.588-2.059 | ||
| N分期 | 0.758 | 0.851 | |||
| N0 | 111 | 1 | |||
| N1+N2+N3 | 246 | 0.937 | 0.474-1.852 | ||
| M分期 | 0.505 | 0.364 | |||
| M0 | 330 | 1 | |||
| M1 | 25 | 1.574 | 0.591-4.194 | ||
| TNM分期 | 0.450 | 0.768 | |||
| Ⅰ+Ⅱ | 164 | 1 | |||
| Ⅲ+Ⅳ | 188 | 1.113 | 0.547-2.265 | ||
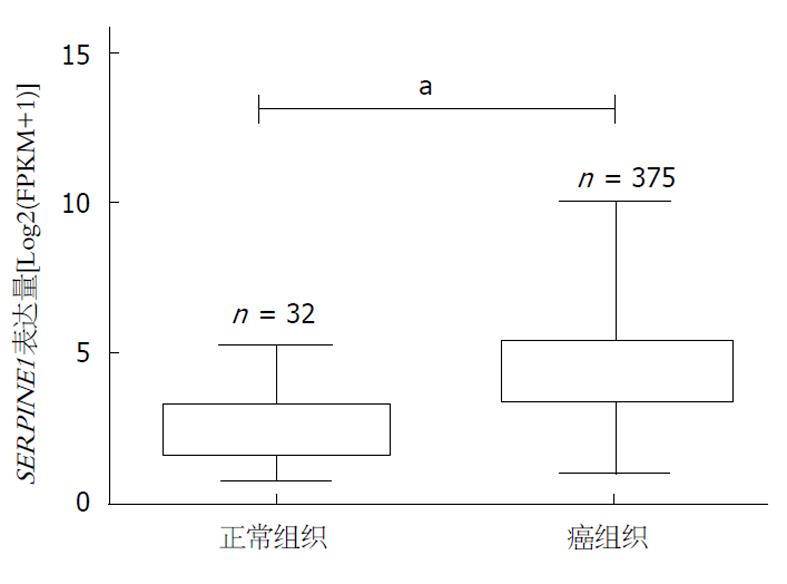
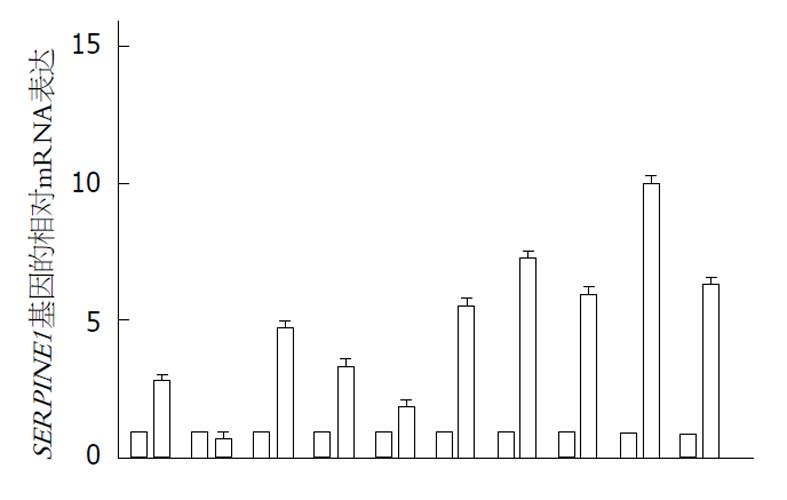
我们在TCGA数据库中筛选出了32例GC旁组织SERPINE1表达情况, 与375例GC组织SERPINE1表达情况进行了对比, 发现GC组织中SERPINE1表达显著增高(图2). 接着我们对本院10例GC及癌旁组织进行了RNA提取, 应用qRT-PCR对样本SERPINE1表达情况进行了检测分析, 结果显示其中有9例患者的GC组织中的SERPINE1表达显著增高, 1例有所降低(采用SERPINE1相对表达量计算, 癌旁组织表达为1, 癌组织表达为4.9±2.8)(图3). 这提示SERPINE1基因表达情况可能作为一个GC筛查的指标.
GC是当今世界上发病率和死亡率最高的肿瘤之一. 在中国, GC每年新发病例约为410000人, 每年死亡病例约为294000人[12]. GC的发病机制目前仍不明确, 可能与遗传背景及环境因素相关. 虽然近年来GC诊治疗效已经有了很大进展, 但在中国GC的5年生存率仅为35.9%, 远低于日本的60.3%和韩国的68.9%[13]. 早期GC患者进行根治性切除术后的5年生存率可达90%[14], GC患者预后不佳, 一方面是由于早期阶段的GC患者通常没有症状, 许多患者在去医院寻求胃病帮助时被诊断为晚期GC[15]; 另一方面可能是因为GC的治疗效果不佳. 目前GC的治疗仍以手术加放化疗为主, 并且中晚期GC化疗仍是主要治疗手段, 但是晚期GC化疗反应率仍处于较低水平[16-18]. 近年来, 随着基因组学及生物信息学技术的发展, 肿瘤的精准治疗成为目前研究的热点. GC的发病机制、驱动基因、生物标志物及靶向治疗成为目前GC相关研究的方向. 因此, 探索与GC预后的分子标志物, 以改善GC患者的预后非常重要.
SERPINE1, 也称为PAI-1, 作为组织纤溶酶原激活剂的诱饵, 用于调节纤维蛋白溶解. 许多研究表明, PAI-1可作为促肿瘤发生因子的影响因素, 有证据证明PAI-1的产生受促肿瘤因子如转化生长因子b, 白细胞介素-6和肿瘤坏死因子a[19]目前在结直肠癌[7], 食道癌[8], 膀胱癌[9], 胶质瘤[10]和肺癌[11]均发现了SERPINE1基因的表达增高, 是影响这些肿瘤预后的不良因素. 在结直肠癌中, SERPINE1表达水平与淋巴结受累, 血管侵犯和微卫星不稳定性相关, SERPINE1可能是通过抑制蛋白水解活性的促血管生成作用及通过纤溶酶原系统的蛋白水解作用和被蛋白水解机制调节基质重塑的功能促进肿瘤的转移[7,20]. 在胶质瘤中, SERPINE1高表达能够促进肿瘤的迁移、侵袭及增殖, 而高表达miR-1275能够得到相反的结果. 进一步研究发现, miR-1275能够靶向作用于SERPINE1基因, 进而激活p53信号通路, 从而抑制胶质瘤细胞的迁移、侵袭及增殖, 促进细胞凋亡[10]. 在非小细胞肺癌(NSCLC)中, SERPINE1在NSCLC复发转移患者中升高, 与NSCLC预后呈负相关. miR-34a在NSCLC转移患者中下降, 与NSCLC预后呈正相关. 此外, PAI-1证实为miR-34a的靶基因并激活Stat3信号传导途径以促进NSCLC细胞中的上皮-间质转化. PAI-1与PIAS3相互作用以调节Stat3依赖性基因表达, 并且StatR3转录抑制miR-34a通过Stat3信号传导形成正调节环[11].
本研究分析发现, SERPINE1基因在GC中表达增高, 与GC的不良预后相关. 在对SERPINE1基因表达影响因素分析中发现, SERPINE1基因表达除可能与肿瘤位置相关外, 与其他临床因素并不相关, 这提示SERPINE1表达情况可以独立的预测GC的预后. 另外, 研究发现GC组织中SERPINE1基因表达显著高于癌旁组织, 这提示SERPINE1可能成为GC筛查的指标. 总之, SERPINE1可能成为GC筛查及治疗靶点.
胃癌(gastric cancer, GC)是世界上发病率及死亡率最高的肿瘤之一. 因此GC的诊断和治疗成为热点及难点. 近年来癌症的精准治疗成为了研究热点, 寻找GC筛查及治疗的基因靶点成为亟待解决的问题.
本研究拟通过目前TCGA数据分析寻找GC早期筛查及治疗的基因靶点.
通过TCGAGC相关数据集的分析, 寻找影响GC预后的基因靶点.
通过对TCGAGC数据集临床资料及相对应的基因资料的分析, 获得GC预后独立危险因素. 探讨不同临床特征对于基因表达的影响. 分析GC组织基因表达与癌旁正常组织基因表达的差异.
SERPINE1表达情况、年龄、T分期、N分期、M分期、TNM分期均能影响GC患者的预后. 而其中SERPINE1表达情况、年龄和M分期是影响肿瘤预后的独立危险因素. GC患者的基本年龄、性别、肿瘤分化程度及肿瘤分期均不会影响SERPINE1在GC组织中表达显著高于癌旁正常组织.
我们的研究结果提示, SERPINE1是影响GC患者预后的独立因素. GC组织中SERPINE1基因表达显著高于癌旁组织.
SERPINE1的高表达与GC的不良预后相关. SERPINE1可能成为GC筛查及治疗靶点.
学科分类: 胃肠病学和肝病学
手稿来源地: 浙江省
同行评议报告分类
A级 (优秀): 0
B级 (非常好): 0
C级 (良好): C, C, C
D级 (一般): 0
E级 (差): 0
编辑: 崔丽君 电编:张砚梁
| 1. | Siegel RL, Miller KD, Jemal A. Cancer statistics, 2018. CA Cancer J Clin. 2018;68:7-30. [PubMed] [DOI] |
| 2. | Chen W, Zheng R, Baade PD, Zhang S, Zeng H, Bray F, Jemal A, Yu XQ, He J. Cancer statistics in China, 2015. CA Cancer J Clin. 2016;66:115-132. [PubMed] [DOI] |
| 3. | Yasui W, Oue N, Sentani K, Sakamoto N, Motoshita J. Transcriptome dissection of gastric cancer: identification of novel diagnostic and therapeutic targets from pathology specimens. Pathol Int. 2009;59:121-136. [PubMed] [DOI] |
| 4. | Kamangar F, Dores GM, Anderson WF. Patterns of cancer incidence, mortality, and prevalence across five continents: defining priorities to reduce cancer disparities in different geographic regions of the world. J Clin Oncol. 2006;24:2137-2150. [PubMed] |
| 5. | Zambon CF, Basso D, Navaglia F, Falda A, Belluco C, Fogar P, Greco E, Gallo N, Farinati F, Cardin R. Increased risk of noncardia gastric cancer associated with proinflammatory cytokine gene polymorphisms. Gastroenterology. 2004;126:382-384. [PubMed] |
| 6. | Zhou Q, Wang X, Yu Z, Wu X, Chen X, Li J, Zhu Z, Liu B, Su L. Transducin (β)-like 1 X-linked receptor 1 promotes gastric cancer progression via the ERK1/2 pathway. Oncogene. 2017;36:1873-1886. |
| 7. | Mazzoccoli G, Pazienza V, Panza A, Valvano MR, Benegiamo G, Vinciguerra M, Andriulli A, Piepoli A. ARNTL2 and SERPINE1: potential biomarkers for tumor aggressiveness in colorectal cancer. J Cancer Res Clin Oncol. 2012;138:501-511. [PubMed] [DOI] |
| 8. | Klimczak-Bitner AA, Kordek R, Bitner J, Musiał J, Szemraj J. Expression of MMP9, SERPINE1 and miR-134 as prognostic factors in esophageal cancer. Oncol Lett. 2016;12:4133-4138. [PubMed] [DOI] |
| 9. | Zhang G, Gomes-Giacoia E, Dai Y, Lawton A, Miyake M, Furuya H, Goodison S, Rosser CJ. Validation and clinicopathologic associations of a urine-based bladder cancer biomarker signature. Diagn Pathol. 2014;9:200. [PubMed] [DOI] |
| 10. | Wu DM, Wang S, Wen X, Han XR, Wang YJ, Fan SH, Zhang ZF, Shan Q, Lu J, Zheng YL. MircoRNA-1275 promotes proliferation, invasion and migration of glioma cells via SERPINE1. J Cell Mol Med. 2018;22:4963-4974. [PubMed] [DOI] |
| 11. | Lin X, Lin BW, Chen XL, Zhang BL, Xiao XJ, Shi JS, Lin JD, Chen X. PAI-1/PIAS3/Stat3/miR-34a forms a positive feedback loop to promote EMT-mediated metastasis through Stat3 signaling in Non-small cell lung cancer. Biochem Biophys Res Commun. 2017;493:1464-1470. [PubMed] [DOI] |
| 12. | Yang L, Zheng R, Wang N, Yuan Y, Liu S, Li H, Zhang S, Zeng H, Chen W. Incidence and mortality of stomach cancer in China, 2014. Chin J Cancer Res. 2018;30:291-298. [PubMed] [DOI] |
| 13. | Allemani C, Matsuda T, Di Carlo V, Harewood R, Matz M, Nikšić M, Bonaventure A, Valkov M, Johnson CJ, Estève J. Global surveillance of trends in cancer survival 2000-14 (CONCORD-3): analysis of individual records for 37 513 025 patients diagnosed with one of 18 cancers from 322 population-based registries in 71 countries. Lancet. 2018;391:1023-1075. [PubMed] [DOI] |
| 14. | Correa P. Gastric cancer: overview. Gastroenterol Clin North Am. 2013;42:211-217. [PubMed] [DOI] |
| 16. | Yashiro M, Matsuoka T. Sentinel node navigation surgery for gastric cancer: Overview and perspective. World J Gastrointest Surg. 2015;7:1-9. [PubMed] [DOI] |
| 17. | Wong R, Cunningham D. Optimising treatment regimens for the management of advanced gastric cancer. Ann Oncol. 2009;20:605-608. [PubMed] [DOI] |
| 18. | Zheng L, Tan W, Zhang J, Yuan D, Yang J, Liu H. Combining trastuzumab and cetuximab combats trastuzumab-resistant gastric cancer by effective inhibition of EGFR/ErbB2 heterodimerization and signaling. Cancer Immunol Immunother. 2014;63:581-586. [PubMed] [DOI] |
| 19. | Placencio VR, DeClerck YA. Plasminogen Activator Inhibitor-1 in Cancer: Rationale and Insight for Future Therapeutic Testing. Cancer Res. 2015;75:2969-2974. [PubMed] [DOI] |
| 20. | Vial D, McKeown-Longo PJ. PAI1 stimulates assembly of the fibronectin matrix in osteosarcoma cells through crosstalk between the alphavbeta5 and alpha5beta1 integrins. J Cell Sci. 2008;121:1661-1670. [PubMed] [DOI] |