修回日期: 2018-10-10
接受日期: 2018-10-19
在线出版日期: 2018-11-08
探讨miR-708-5p靶向GAGE12I对胃癌(gastric cancer, GC)细胞增殖、迁移和侵袭的影响.
qRT-PCR检测miR-708-5p在GC组织和GC细胞AGS和BGC-823中的表达; MTT法、克隆形成实验和Transwell小室法检测miR-708-5p和GAGE12I对GC细胞AGS和BGC-823增殖、迁移和侵袭的影响; 双荧光素酶报告基因实验验证miR-708-5p与GAGE12I之间的靶向关系; Western blot检测miR-708-5p对GAGE12I表达的影响; 靶标回复实验验证GAGE12I对miR-708-5p抑制GC细胞AGS和BGC-823增殖、迁移和侵袭作用的影响.
miR-708-5p在GC组织和GC细胞AGS和BGC-823中低表达; 上调miR-708-5p和沉默GAGE12I抑制GC细胞AGS增殖、迁移和侵袭; GAGE12I是miR-708-5p的靶基因, 且miR-708-5p负性调节GAGE12I表达, 过表达GAGE12I可部分逆转miR-708-5p对GC细胞AGS和BGC-823增殖、迁移和侵袭的抑制作用.
miR-708-5p可靶向GAGE12I抑制GC细胞增殖、迁移和侵袭.
核心提要: miR-708-5p可靶向GAGE12I抑制胃癌(gastric cancer, GC)细胞增殖、迁移和侵袭, GAGE12I是miR-708-5p的靶基因且miR-708-5p负性调节GAGE12I表达, 过表达GAGE12I可部分逆转miR-708-5p对GC细胞AGS和BGC-823增殖、迁移和侵袭的抑制作用.
引文著录: 李晶晶, 强锋, 邓中民. miR-708-5p靶向GAGE12I抑制胃癌细胞增殖、迁移和侵袭. 世界华人消化杂志 2018; 26(31): 1795-1804
Revised: October 10, 2018
Accepted: October 19, 2018
Published online: November 8, 2018
To explore the effect of miR-708-5p on the proliferation, migration and invasion of gastric cancer (GC) cells and the possible mechanism involved.
qRT-PCR was used to detect the expression of miR-708-5p in GC cell lines AGS and BGC-823. MTT, colony formation and Transwell chamber assays were performed to detect the effect of overexpression of miR-708-5p and silencing of GAGE12I on the proliferation, migration and invasion of AGS and BGC-823 cells. The double luciferase reporter gene experiment was performed to confirm the relationship between miR-708-5p and GAGE12I. Western blot analysis was used to detect the effect of miR-708-5p on the expression of GAGE12I. Target response assay was used to confirm the effect of GAGE12I on the inhibition of proliferation, migration and invasion of AGS and BGC-823 cells by miR-708-5p.
MiR-708-5p was downregulated in GC tissues and GC cell lines AGS and BGC-823. Upregulation of miR-708-5p and silencing of GAGE12I inhibited the proliferation, migration and invasion of AGS cells. GAGE12I was a target gene of miR-708-5p, and miR-708-5p negatively regulated GAGE12I expression. Overexpression of GAGE12I partly reversed the inhibitory effect of miR-708-5p on proliferation, migration and invasion of AGS and BGC-823 cells.
MiR-708-5p inhibits the proliferation, migration and invasion of GC cells by targeting GAGE12I.
- Citation: Li JJ, Qiang F, Deng ZM. MiR-708-5p inhibits proliferation, migration and invasion of gastric cancer cells by targeting GAGE12I. Shijie Huaren Xiaohua Zazhi 2018; 26(31): 1795-1804
- URL: https://www.wjgnet.com/1009-3079/full/v26/i31/1795.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v26.i31.1795
胃癌(gastric cancer, GC)是一种发病率和致死率极高的恶性肿瘤[1,2], 研究GC发生发展的分子机制具有重要意义. miRNA, 可通过调控其靶基因, 在GC细胞发生发展中发挥作用[3]. 研究发现, GAGE12I在GC组织中表达上调[4]. 本研究, 发现miR-708-5p可靶向GAGE12I影响GC细胞增殖、迁移侵袭, 为明确GC发生发展机制提供科学依据.
人GC细胞AGS和BGC-823及人正常胃黏膜细胞GES-1购美国自ScienCell研究实验室; F12K培养基、RPMI-1640培养基、DMEM培养基、胎牛血清、青链霉素(双抗)、胰蛋白酶购于哈灵生物; miR-708-5p mimic(miR-708-5p)和miR-NC, miR-708-5p inhibitor(anti- miR-708-5p)和negative control inhibittor(anti-miR-NC)、pcDNA3.0vector和pcDNA GAGE12I购于广州瑞博生物科技有限公司, GAGE12I基因特异性慢病毒包装载体shGAGE12I及对照载体购于上海吉玛生物公司; 细胞裂解和蛋白抽提试剂盒、BCA蛋白定量试剂盒、ECL化学发光检测试剂和抗小鼠IgG-HRP辣根过氧化物酶标记的羊抗小鼠IgG购于碧云天生物科技公司; miRNeasy EFPE试剂盒购于BioTeke公司、Trizol试剂为广州豪凯生物公司产品; 反转录试剂盒和实时定量提取试剂盒购于TAKARA公司; 细胞培养板和羊Transwell小室分别购于Nest公司和Corning 公司; Matrigel胶为BD公司产品; Lipofectamine2000转染试剂为赛默飞公司产品. GAPDH一抗、GAGE12I抗体为Epitomics公司产品; CCK8试剂为上海晶抗生物公司产品; 双荧光素酶报告基因质粒为吉满生物科技公司合成构建; 所有的引物合成为金唯智公司合成.
采用2017/2018年浙江省湖州市第一人民医院经病理专家证实为GC的石蜡包埋标本30例. 所有患者术前均未接受过放化疗. 收集患者肿瘤组织前获得患者知情并签署知情同意书. 本研究经浙江省湖州市第一人民医院医学伦理委员会批准.
1.2.1 细胞培养: 人GC细胞AGS和BGC-823分别培养于含有10%胎牛血清的F12K培养基和RPMI-1640培养基中; 人正常胃黏膜细胞GES-1培养于10%胎牛血清的DMEM培养基中, 培养基中双抗浓度为1%, 培养于95% CO2 37 ℃温箱中.
1.2.2 qRT-PCR检测miR-708-5p和GAGE12I表达: 按照实验要求, 取对数生长的细胞, 利用miRNeasy EFPE试剂盒和Trizol法提取GC组织或细胞miRNA和总RNA, 并参照对应的反转录试剂盒及引物进行操作将RNA反转成cDNA, 进行实时荧光定量PCR检测, 以U6和GAPDH作为内参, 各基因引物如下: U6引物: U6-F: 5'-CTCGCTTCGGCAGCACA-3', U6-R: 5'-AACGCTTCACGA-ATTTGCGT-3', GAPDH引物: GAPDH-F: 5'-CCACTCCTCCACCTTTGAC-3', GDF11-R: 5′-CCCAGTTAGGGGTTTC-AGTCGGT-3′, miR-708-5p引物: miR-708-5p-F: 5′-GGCGCGCAAGCAGCTTACAATC-3′, miR-708-5p-R: 5′-CTGCA GGGTCCCAGGTAT-3′. 根据2△△Ct法分析目的基因的相对表达水平.
1.2.3 细胞转染: 将对数生长期的AGS和BGC-823细胞进行转染实验, 按照实验目的将AGS细胞按如下转染分组分为8组, miR-NC组(转染miR-NC组)、miR-708-5p组(转染miR-708-5p mimic组)、anti-miR-708-5p组(转染 miR-708-5p inhibitor组)、anti-miR-NC组(转染inhibitor-NC组)、shGAGE12I组(转染慢病毒质粒shGAGE12I组)、Scrambled组(对照质粒组)、vector+miR-708-5p组(共转染pcDNA和miR-708-5p mimic)和GAGE12I+miR-708-5p组(共转染pcDNAGAGE12I和miR-708-5p mimic), 按照lipo2000转染试剂说明书进行转染, 根据实验目的进行MTT和克隆形成实验检测、Transwell小室法检测、qRT-PCR检测和Westerrn blot检测.
1.2.4 CCK-8法检测细胞增殖: 取上述转染24 h后的细胞, 将其制备呈1×104个/mL的单细胞悬液后, 每孔100 μL接种至96孔板中, 每组设置6个复孔, 观察细胞1-3 d细胞增殖特征. 将96孔板置于37 ℃恒温培养箱内继续培养, 待细胞贴壁24 h、后加入CCK-8试剂, 2 h后用酶标仪检测450 nm波长检测吸光度值, 之后48 h、72 h按照同样操作进行检测.
1.2.5 克隆形成实验: 取转染后的AGS和BGC-823细胞, 胰蛋白酶消化处理, 用含有10%胎牛血清的完全培养基终止消化制备细胞悬液, 以适当的细胞密度接种于含有10 mL 37 ℃预温好的培养皿中, 轻轻转动, 使细胞分布均匀, 置于上述培养环境下继续培养10-14 d, 每隔3 d更换一次新鲜培养液, 直至生成肉眼可见的细胞克隆为止; 弃去培养基, PBS清洗3次, 2 mL甲醇室温固定10 min, 弃去甲醇, 等量吉姆萨染色液染色30 min, 计算克隆形成数.
1.2.6 Transwell小室法检测细胞迁移侵袭: 迁移实验: 取上述转染后48 h后细胞, 将细胞制备成密度为1×105个/mL的悬液, 将200 μL细胞悬液接种至Transwell 小室上室中, 下室中加入600 μL含有15%血清的DMEM培养液, 37 ℃恒温培养箱内培养48 h, 每组设置3个复孔, 弃去培养液, PBS洗涤, 4%的多聚甲醛固定细胞, PBS洗涤去除固定液, 结晶紫染色后PBS洗涤, 使用棉签擦去膜上层细胞, 显微镜下观察, 随机选取5个视野进行细胞技术并做相应分析. 侵袭实验: 在小室底部用Matrigel胶处理, 其它步骤同迁移实验.
1.2.7 双荧光素酶报告基因实验验证miR-708-5p与GAGE12I之间的靶向关系: 通过Targetscan在线分析网站预测到miR-708-5p与GAGE12I的3′UTR存在结合位点, 构建野生型GAGE12I的3′UTR的全长质粒, 分别与miR-NC、miR-708-5p mimic、negative control inhibitor、miR-708-5p inhibitor进行共转染, 按照双荧光素酶报告基因试剂盒操作步骤进行检测.
1.2.8 Western blot检测GAGE12I表达: 收集细胞, 用RIPA蛋白裂解液提取蛋白, BCA蛋白定量试剂盒检测蛋白浓度, 100 ℃变性 10 min, 采用SDS-PAGE电泳进行蛋白, 湿转法转膜, 5%脱脂奶粉4 ℃封闭过夜, GAGE12I和GAPDH的一抗4 ℃孵育过夜, 37 ℃相应羊抗鼠二抗孵育1 h, 使用ECL发光液进行显影、曝光.
统计学处理 实验结果用mean±SD表示, 应用SPSS 19.0软件对实验中所得原始数据进行统计学分析, 使用统计软件GraphPad Prism 6.0进行分析. 两组之间的均数比较采用配对t检验; 均数之间两两比较采用LSD-t检验; P<0.05表示差异有统计学意义.
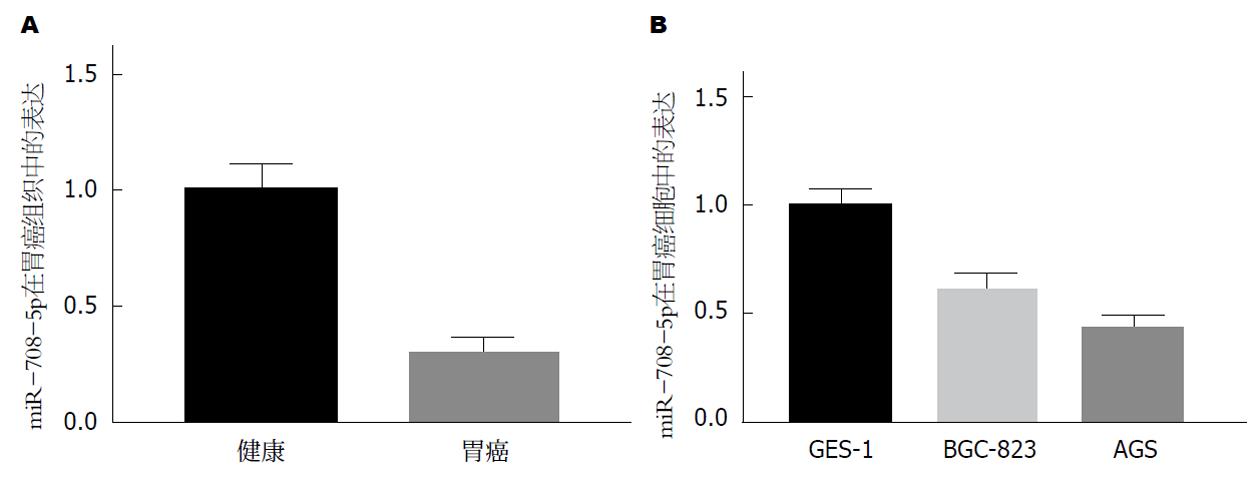
qRT-PCR检测miR-708-5p在人GC组织及其癌旁组织, 人GC细胞AGS和BGC-823及人正常胃黏膜细胞GES-1中的表达, 结果显示, 与癌旁组织和人正常胃黏膜细胞GES-1相比, miR-708-5pGC组织和GC细胞AGS和BGC-823中低表达, 差异显著(P<0.05), 见图1.
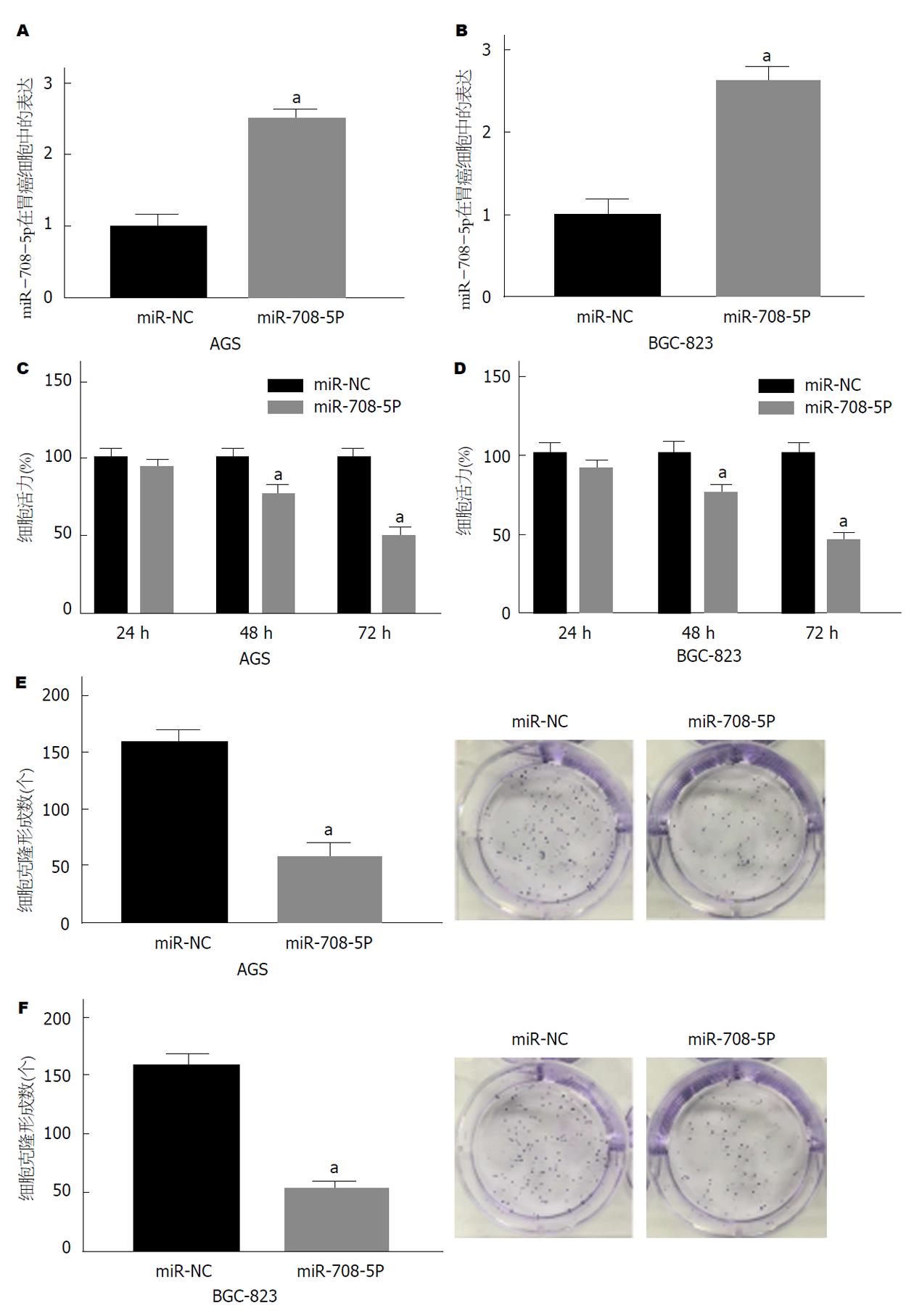
将miR-708-5p mimics转染至AGS和BGC-823细胞, qRT-PCR结果发现, 与miR-NC组相比, miR-708-5p在AGS细胞中表达上调(P<0.05)(图2A和B); CCK检测结果显示, miR-708-5p能够显著抑制细胞的生长活力(P<0.05)(图2C和D); 克隆形成实验结果显示, miR-708-5p可显著减少AGS和BGC-823细胞的克隆形成数.
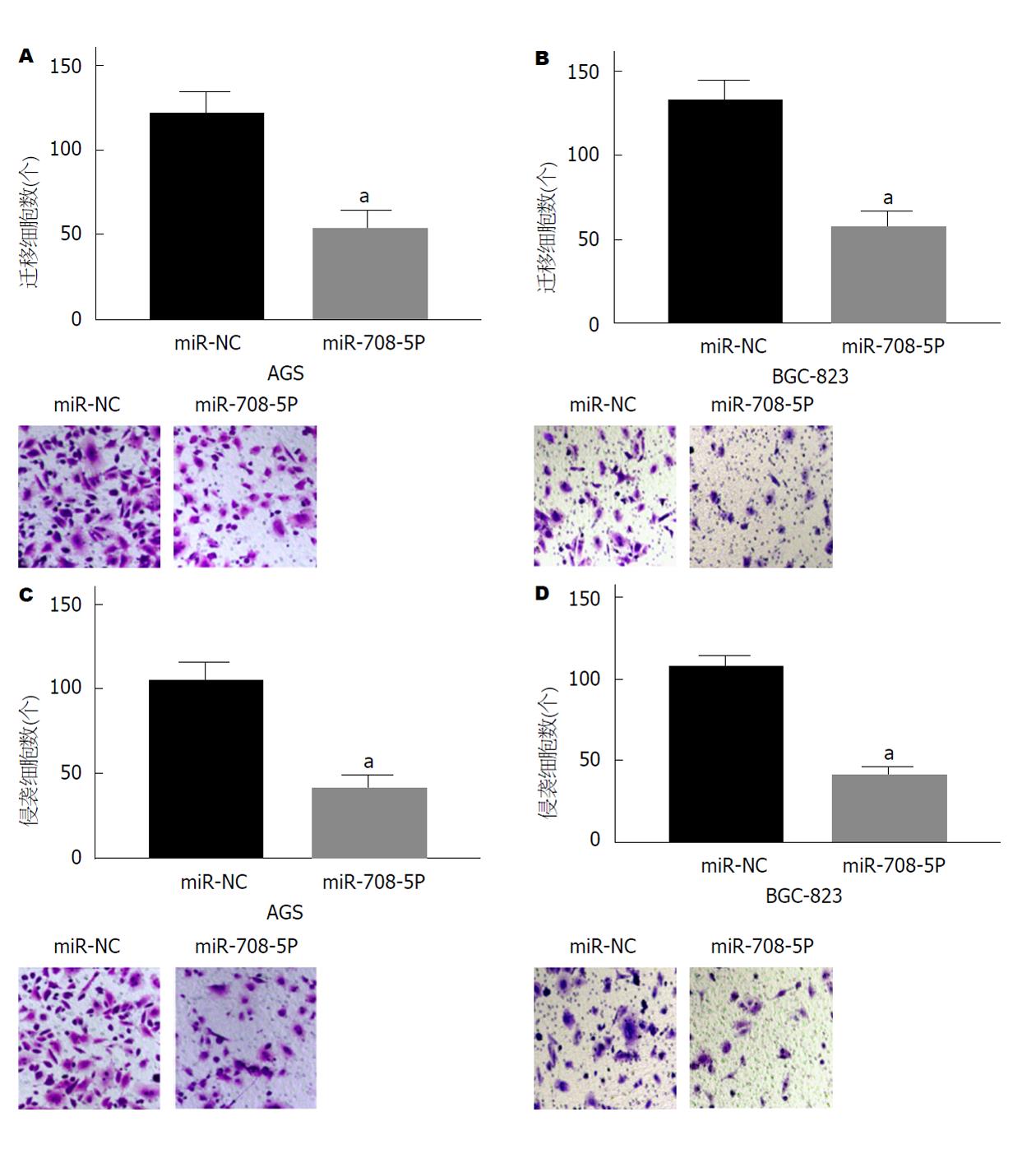
将miR-708-5p mimics转染至AGS和BGC-823细胞, Transwell法检测细胞迁移和侵袭能力. 结果显示, 与miR-NC组相比, 转染了miR-708-5p mimic的AGS和BGC-823细胞的迁移和侵袭能力显著降低. 见图3.
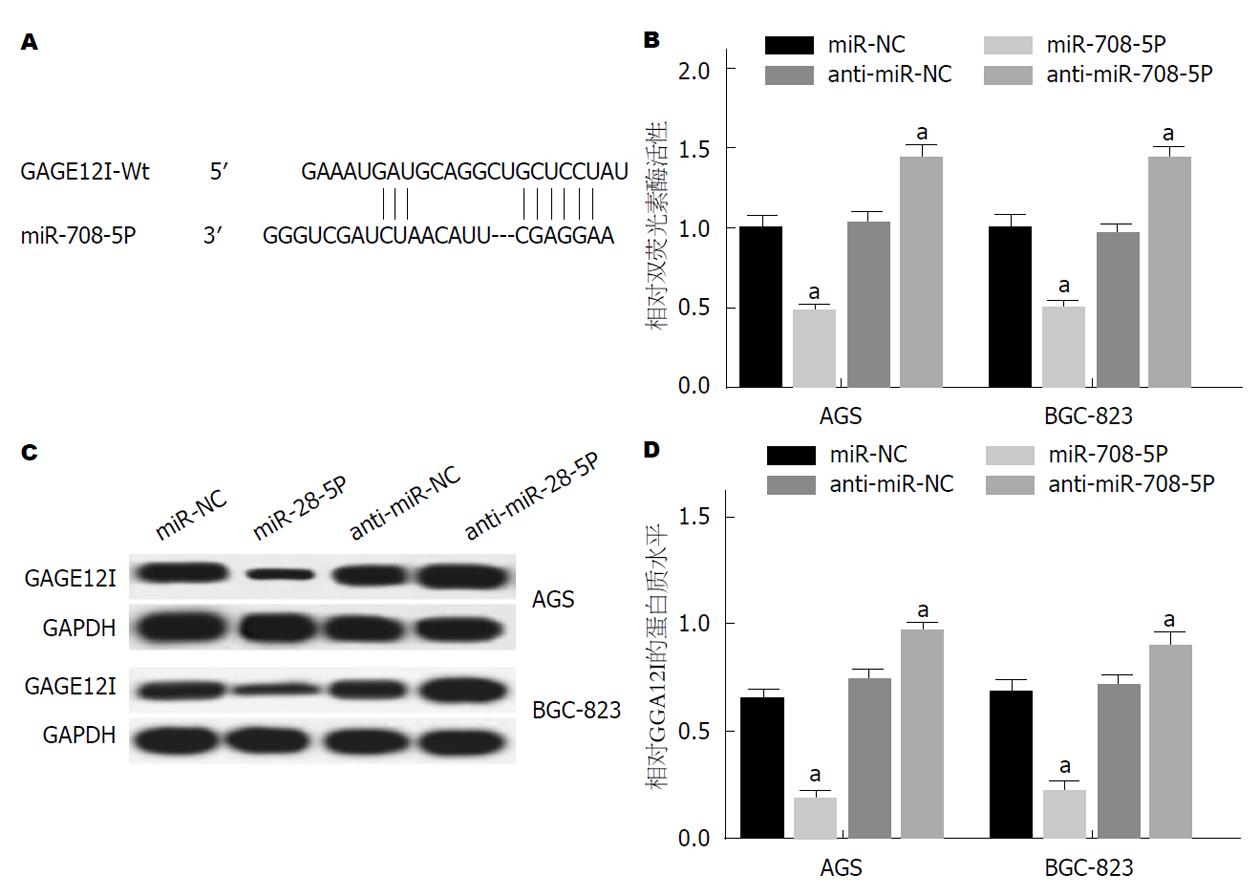
通过Targetscan在线预测分析网站预测miR-708-5p与GAGE12I的3′UTR存在结合位点(图4A), 双荧光素酶报告基因实验验证二者之间的靶向关系, 结果显示: 与miR-NC组相比, miR-708-5p mimic可显著抑制野生型MRTFA-WT的荧光素酶活性显著(P<0.05), 与anti-miR-NC组相比, miR-20a-5p inhibitor可显著增强野生型MRTFA-WT的荧光素酶活性(P<0.05)(图4B); Western blot检测miR-708-5p对GAGE12I表达的影响, 检测结果显示, 与miR-NC组相比, GAGE12I在miR-708-5p组细胞中表达显著下降(P<0.05), 与anti-miR-NC组相比, GAGE12I在miR-708-5p组细胞中表达显著升高, P<0.05)(图4C和D).
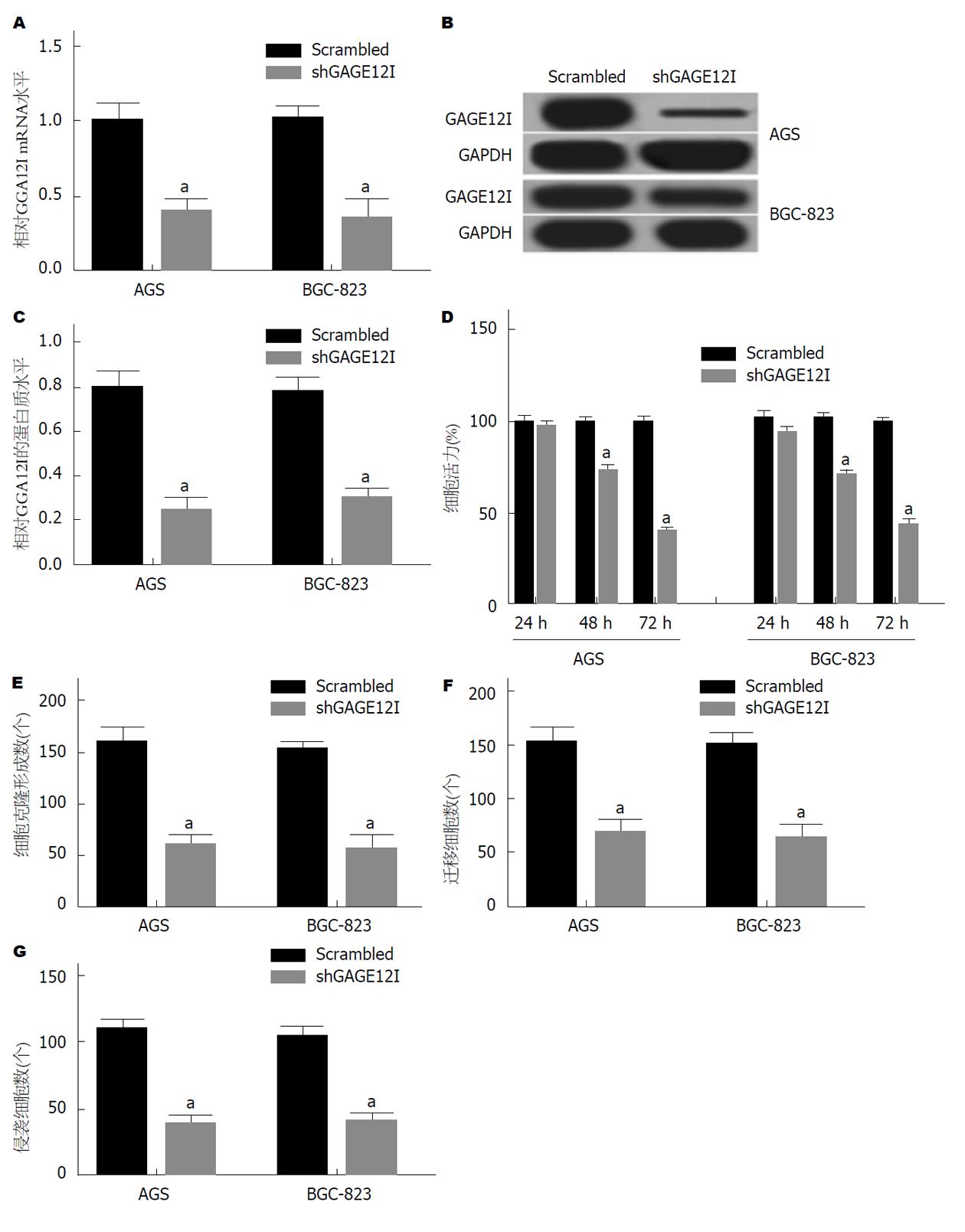
将shGAGE12I转染至AGS和BGC-823细胞中, 与Scrambled组相比, shGAGE12I组细胞中GAGE12I mRNA和蛋白水平显著下调(P<0.05)(图5A、B和C); CCK法和克隆形成实验结果显示, 与Scrambled组相比, 在转染后48 h, shGAGE12I组细胞的增殖能力降低, 克隆形成数降低(P<0.05)(图5D和E), 迁移和侵袭能力显著降低(P<0.05)(图5F和G).
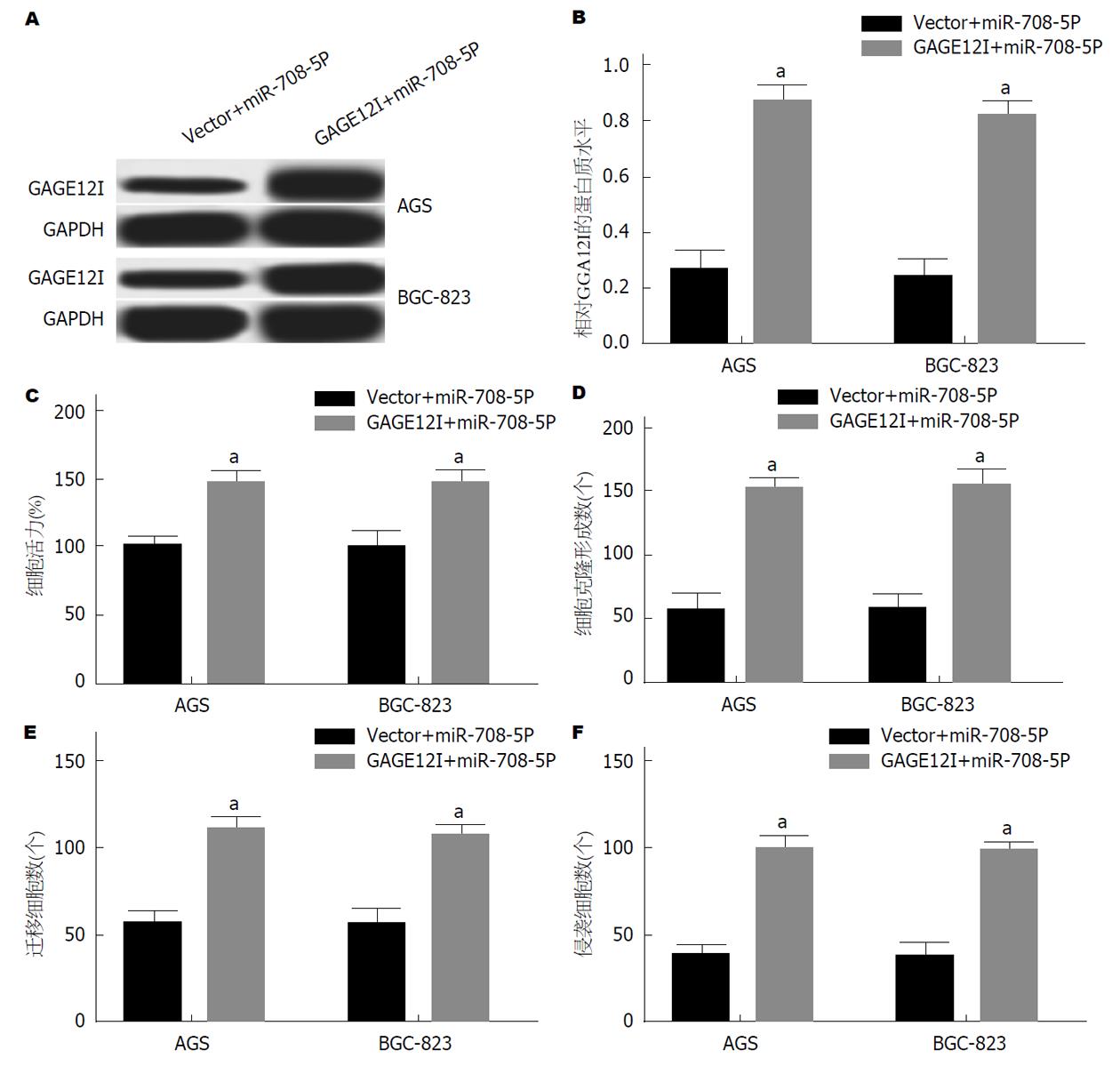
将miR-708-5p mimic和pcDNA GAGE12I共转染至AGS和BGC-823细胞. Western blot 检测结果发现, 与pcDNAVector+miR-708-5p mimic转染组相比, miR-708-5p mimic和pcDNA GAGE12I共转染组细胞中GAGE12I表达显著上调(P<0.05)(图6A和B); CCK和克隆形成实验结果显示, 与pcDNAVector+miR-708-5p mimic转染组相比, miR-708-5p mimic和pcDNA GAGE12I共转染组细胞生长活力升高, 细胞克隆形成数增加(P<0.05)(图6C和D); Transwell法检测细胞迁移和侵袭能力, 结果显示, 与pcDNAVector+miR-708-5p mimic转染组相比, miR-708-5p mimic和pcDNA GAGE12I共转染组细胞的迁移和侵袭能力显著增加(P<0.05)(图6E和F).
近些年来, 不断有研究表明miRNA与GC的发生发展密切相关[5], 如miR-1294在GC中表达下调, 可作为GC预后不良的分子标记[6], miRNA与其靶基因的相互作用可参与调控GC细胞的增殖、迁移侵袭和凋亡等生物学过程[7-12] . 如有研究发现miR520d-3p通过EphA2抑制GC细胞增殖, 迁移和侵袭[10], miR-6852可通过BOXJ1抑制细胞增殖和侵袭[11], miR-543可通过SPOP促进细胞迁移和侵袭[12]. miR-708-5p是近些年新发现的miRNA, 有研究表明miR-708-5p在多种癌症中差异表达[13], 在肺癌、人胶质瘤和乳癌中作为促肿瘤生长和疾病进展的癌基因[14-16], 但是关于miR-708-5p在GC细胞中的表达水平、生物学作用和机制尚不明确. GAGE是新近发现的与肿瘤密切相关的基因家族, 因其表达的特异性和引发免疫系统应答的特性而被认为是人体肿瘤免疫治疗的潜在靶点[17,18], 但关于GAGE的肿瘤生物学功能研究十分少. GAGE12I是GAGE基因家族中新近发现的一个具有促癌作用的基因, 有研究表明GAGE12I在非转移性和转移性GC组织中表达上调[4,19], 但关于GAGE12I在GC细胞的增殖、迁移侵袭过程中的作用仍报道较少.
本研究进一步揭示miR-708-5p参与调控GC增殖、迁移侵袭的分子机制, 为GC的靶向治疗提供实验数据, 为GC的治疗和预后提供科学依据.
本研究通过qRT-PCR、CCK法和迁移侵袭等实验验证了miR-708-5pGC细胞的增殖、迁移和侵袭的抑制效应. 同时发现miR-708-5p可通过GAGE12I参与调控GC细胞的增殖、迁移和侵袭过程, 进一步揭示了miR-708-5p参与调控GC发生发展的分子机制.
首先, 我们收集临床上30例GC组织及其癌旁组织, qRT-PCR分析miR-708-5p在GC组织中的表达情况, 结果显示miR-708-5p在GC组织中低表达, 后续研究中继续检测GC细胞中miR-708-5p的表达, 发现miR-708-5p在GC细胞AGS和BGC-823中表达同样显著下调, 提示我们miR-708-5p可能在GC的发生发展中发挥重要作用. 为了进一步揭示miR-708-5p对GC细胞的影响, 通过CCK法、克隆形成实验和Transwell小室法检测miR-708-5p对GC细胞增殖、迁移和侵袭的影响. 将miR-708-5p mimic转染至AGS和BGC-823细胞, 上调miR-708-5p表达, CCK法检测细胞增殖情况, 结果显示, 在48 h后miR-708-5p组细胞增殖活力降低; 克隆形成实验结果显示, miR-708-5p组细胞形成数显著降低; Transwell小室法检测迁移侵袭能力, 结果显示, miR-708-5p组细胞的迁移侵袭能力显著降低, 上述结果表明, miR-708-5p在GC发生发展中发挥抑癌作用. 本研究通过生物信息学在线分析软件预测到miR-708-5p与GAGE12I可能存在结合位点, 后续实验中双荧光素酶报告基因实验证实二者之间的靶向关系, Western blot检测结果显示, 在AGS细胞中, miR-708-5p mimic转染组细胞GAGE12I表达下降, 而miR-708-5p inhibitor转染组细胞中GAGE12I表达上调, 上述结果表明miR-708-5p可靶向并负性调节GAGE12I表达. CCK法、克隆形成实验和Transwell法检测沉默GAGE12I对AGS细胞增殖和迁移侵袭的影响, shGAGE12I转染组细胞的增殖、迁移和侵袭显著降低, 与上调miR-708-5p对GC细胞的影响一致. 为了进一步验证miR-708-5p是否可通过GAGE12I参与GC细胞增殖、迁移和侵袭的调控, 我们将miR-708-5p mimic和pcDNA GAGE12I共转染至AGS和BGC-823细胞; CCK法、克隆形成实验和Transwell法结果证实将pcDNA GAGE12I转染至GC细胞AGS和BGC-823, 可显著逆转miR-708-5p mimic转染组细胞增殖, 迁移和侵袭的抑制作用. 上述结果表明miR-708-5p可靶向GAGE12I抑制GC细胞AGS和BGC-823的增殖, 迁移和侵袭.
本研究发现miR-708-5p在GC组织和GC细胞AGS和BGC-823中miR-708-5p表达下调, 且上调miR-708-5p和沉默GAGE12I可抑制GC细胞AGS和BGC-823的增殖, 迁移和侵袭. miR-708-5p可靶向调控GAGE12I表达, 进而参与GC细胞增殖、迁移侵袭, 为GC的发生发展机制和靶向治疗提供依据.
总之, 本研究首次发现miR-708-5p在GC组织和细胞中低表达, 并首次在GC细胞中验证miR-708-5p与GAGE12I之间的靶向关系, 以此为基础进一步阐明了miR-708-5p靶向调控GAGE12I对GC细胞增殖、迁移侵袭的影响机制, 为miRNA参与调控GC细胞生物学功能的分子机制提供了新的实验依据.
本研究只探讨了miR-708-5p在GC细胞增殖, 迁移和侵袭的影响, 其对GC细胞凋亡及其它细胞生物学过程仍有待后续进一步研究.
近些年来, 不断有研究表明miRNA与胃癌(gastric cancer, GC)的发生发展密切相关, 如miR-1294在GC中表达下调, 可作为GC预后不良的分子标记, miRNA与其靶基因的相互作用可参与调控GC细胞的增殖、迁移侵袭和凋亡等生物学过程.
为GC的发生发展机制和靶向治疗提供依据, 为miRNA参与调控GC细胞生物学功能的分子机制提供了新的实验依据.
miR-708-5p可靶向调控GAGE12I表达, 进而参与GC细胞增殖、迁移侵袭, 为GC的发生发展机制和靶向治疗提供依据.
qRT-PCR检测miR-708-5p和GAGE12I表达, CCK-8法检测细胞增殖, Transwell小室法检测细胞迁移侵袭, Western blot 检测GAGE12I表达.
miR-708-5p在GC组织和GC细胞AGS和BGC-823中miR-708-5p表达下调, 且上调miR-708-5p和沉默GAGE12I可抑制GC细胞AGS和BGC-823的增殖, 迁移和侵袭. miR-708-5p可靶向调控GAGE12I表达, 进而参与GC细胞增殖、迁移侵袭.
miR-708-5p可靶向调控GAGE12I表达, 进而参与GC细胞增殖、迁移侵袭.
miR-708-5p可靶向调控GAGE12I表达, 进而参与GC细胞增殖、迁移侵袭, 为GC的发生发展机制和靶向治疗提供依据, 为miRNA参与调控GC细胞生物学功能的分子机制提供了新的实验依据, 其对GC细胞凋亡及其它细胞生物学过程仍有待后续进一步研究.
学科分类: 胃肠病学和肝病学
手稿来源地: 浙江省
同行评议报告分类
A级 (优秀): 0
B级 (非常好): B
C级 (良好): C
D级 (一般): D
E级 (差): 0
编辑: 崔丽君 电编:张砚梁
| 2. | Karimi P, Islami F, Anandasabapathy S, Freedman ND, Kamangar F. Gastric cancer: descriptive epidemiology, risk factors, screening, and prevention. Cancer Epidemiol Biomarkers Prev. 2014;23:700-713. [PubMed] [DOI] |
| 3. | Shin VY, Chu KM. MiRNA as potential biomarkers and therapeutic targets for gastric cancer. World J Gastroenterol. 2014;20:10432-10439. [PubMed] [DOI] |
| 4. | Lee EK, Song KA, Chae JH, Kim KM, Kim SH, Kang MS. GAGE12 mediates human gastric carcinoma growth and metastasis. Int J Cancer. 2015;136:2284-2292. [PubMed] [DOI] |
| 5. | 杜 亚琼, 姜 波健, 俞 继卫. miRNA在胃癌发生发展中的作用. 中国普外基础与临床杂志. 2016;23:499-502. [DOI] |
| 6. | Shi YX, Ye BL, Hu BR, Ruan XJ. Expression of miR-1294 is downregulated and predicts a poor prognosis in gastric cancer. Eur Rev Med Pharmacol Sci. 2018;22:5525-5530. [PubMed] [DOI] |
| 7. | 蒯 君, 秦 咏梅, 郭 晓鹤. miRNA-24通过靶向CARMA3基因调控胃癌AGS细胞的增殖和凋亡. 中国肿瘤生物治疗杂志. 2017;24:1093-1100. [DOI] |
| 8. | 王 栓虎, 骆 杰, 刘 牧林. MiRNA-509-5p靶向MDM2抑制胃癌细胞的侵袭和迁移. 中国组织化学与细胞化学杂志. 2016;25:1-7. [DOI] |
| 9. | Han C, Zhou Y, An Q, Li F, Li D, Zhang X, Yu Z, Zheng L, Duan Z, Kan Q. MicroRNA-1 (miR-1) inhibits gastric cancer cell proliferation and migration by targeting MET. Tumour Biol. 2015;36:6715-6723. [PubMed] [DOI] |
| 10. | Li R, Yuan W, Mei W, Yang K, Chen Z. MicroRNA 520d-3p inhibits gastric cancer cell proliferation, migration, and invasion by downregulating EphA2 expression. Mol Cell Biochem. 2014;396:295-305. [PubMed] [DOI] |
| 11. | Yu H, Zhang J, Wen Q, Dai Y, Zhang W, Li F, Li J. MicroRNA-6852 suppresses cell proliferation and invasion via targeting forkhead box J1 in gastric cancer. Exp Ther Med. 2018;16:3249-3255. [PubMed] [DOI] |
| 12. | Xu J, Wang F, Wang X, He Z, Zhu X. miRNA-543 promotes cell migration and invasion by targeting SPOP in gastric cancer. Onco Targets Ther. 2018;11:5075-5082. [PubMed] [DOI] |
| 13. | Monteleone NJ, Lutz CS. miR-708-5p: a microRNA with emerging roles in cancer. Oncotarget. 2017;8:71292-71316. [PubMed] [DOI] |
| 14. | Wu X, Liu T, Fang O, Dong W, Zhang F, Leach L, Hu X, Luo Z. MicroRNA-708-5p acts as a therapeutic agent against metastatic lung cancer. Oncotarget. 2016;7:2417-2432. [PubMed] [DOI] |
| 15. | Guo P, Lan J, Ge J, Nie Q, Mao Q, Qiu Y. miR-708 acts as a tumor suppressor in human glioblastoma cells. Oncol Rep. 2013;30:870-876. [PubMed] [DOI] |
| 16. | Ma L, Ma S, Zhao G, Yang L, Zhang P, Yi Q, Cheng S. miR-708/LSD1 axis regulates the proliferation and invasion of breast cancer cells. Cancer Med. 2016;5:684-692. [PubMed] [DOI] |
| 19. | Gjerstorff MF, Besir H, Larsen MR, Ditzel HJ. Expression, purification and characterization of the cancer-germline antigen GAGE12I: a candidate for cancer immunotherapy. Protein Expr Purif. 2010;73:217-222. [PubMed] [DOI] |