修回日期: 2018-01-03
接受日期: 2018-01-06
在线出版日期: 2018-01-28
系统分析IL-8启动子-251A/T多态性(rs4073)与急性胰腺炎(acute pancreatitis, AP)遗传易感性的关系.
按照统一的检索策略, 检索PubMed、EMASE、Web of Science、中国知网(CNKI)、万方数据库和VIP等数据库有关IL-8启动子-251A/T多态性与AP的相关文献, 截止时间2017-06. 按文献纳入和排除标准选择合格研究进行系统评价和Meta分析, 包括等位基因遗传模式和基因型遗传模式(同质、异质、显性和隐性模式).
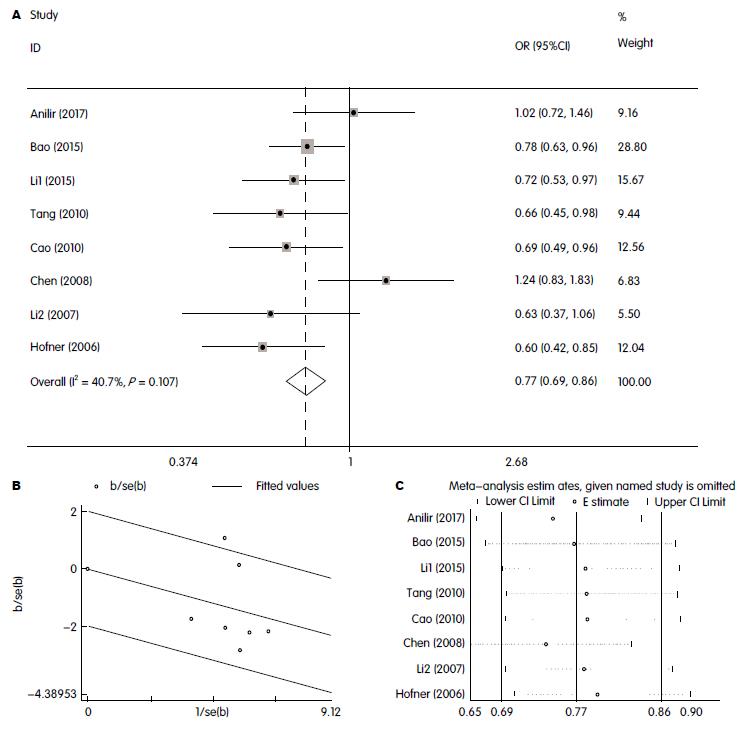
共纳入8篇合格文献, 病例组与对照组分别为1190例和1369例. Meta分析显示IL-8启动子-251A/T多态性T等位基因明显降低AP风险(OR = 0.770, 95%CI: 0.686-0.865, P<0.001); IL-8-251A/T多态性基因型与AP遗传易感性在四种遗传模式下均有统计学意义(同质: OR = 0.543, 95%CI: 0.368- 0.799, P<0.001; 异质: OR = 0.755, 95%CI: 0.602-0.947, P = 0.015; 显性: OR = 0.676, 95%CI: 0.547-0.835, P<0.001; 隐性: OR = 0.738, 95%CI: 0.623-0.873, P<0.001).
IL-8启动子-251A/T多态性可能是AP遗传易感性的保护因素.
核心提要: 本研究旨在采用Meta分析的方法对相关文献进行系统评价, 以明确IL-8启动子-251A/T多态性与急性胰腺炎(acute pancreatitis, AP)遗传易感性的相关性, 为AP的防治提供分子遗传学证据.
引文著录: 刘环, 张伟, 邓小冬, 马英, 刘云. IL-8基因-251A/T多态性与急性胰腺炎遗传易感性的Meta分析. 世界华人消化杂志 2018; 26(3): 174-181
Revised: January 3, 2018
Accepted: January 6, 2018
Published online: January 28, 2018
To systematically evaluate the association between the rs4073 (-251A/T) polymorphism in the interleukin-18 (IL-18) gene promoter and susceptibility to acute pancreatitis (AP).
According to the retrieval strategy, studies about IL-8-251A/T polymorphism and AP were selected from PubMed, EMBASE, Web of Science, CNKI, Wanfang, and VIP electronic databases up to June 2017. We conducted a systematic analysis and meta-analysis to evaluate the association between the polymorphism and AP risk based on the currently available evidence of the literature, including allele genetic model, heterozygous, homozygous, dominant, and recessive genetic models.
A total of eight studies involving 1190 cases and 1369 controls were finally included. We found that the T allele of the IL-8-251A/T polymorphism significantly decreased AP risk (OR = 0.770, 95%CI: 0.686-0.865, P < 0.001). The IL-8-251A/T polymorphism was significantly associated with genetic susceptibility to AP under all genetic models (homozygous: OR = 0.543, 95%CI: 0.368-0.799, P < 0.001; heterozygous: OR = 0.755, 95%CI: 0.602-0.947, P = 0.015; dominant: OR = 0.676, 95%CI: 0.547-0.835, P < 0.001; recessive: OR = 0.738, 95%CI: 0.623-0.873, P < 0.001).
The present meta-analysis suggests that the IL-8-251A/T polymorphism might be a protective factor for genetic susceptibility to AP.
- Citation: Liu H, Zhang W, Deng XD, Ma Y, Liu Y. Association of IL-8-251A/T polymorphism with acute pancreatitis susceptibility: A meta-analysis. Shijie Huaren Xiaohua Zazhi 2018; 26(3): 174-181
- URL: https://www.wjgnet.com/1009-3079/full/v26/i3/174.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v26.i3.174
急性胰腺炎(acute pancreatitis, AP)是以胰腺坏死和炎性细胞因子浸润为特征的常见急腹症, 主要通过腺泡内酶原激活及核因子-κB活化所致炎症反应[1-5], 炎症反应在AP病理过程中起十分重要的作用[6,7]. 研究[8]发现IL-8是AP的炎性介质级联反应中的核心因子之一. 目前, IL-8基因多态性与AP遗传易感性的相关性被广泛研究, 特别是其启动子-251A/T多态性(rs4073); 但研究结果并不一致, 甚至包括同一种族的研究[9-15], 其矛盾结果可能是单个研究或较小样本量使其统计力度较低所致. 因此, 本研究拟采用系统评价和Meta分析的方法合并单个研究及样本量较小的研究, 明确IL-8启动子-251A/T多态性与AP遗传易感性的相关性, 为AP的防治提供分子遗传学证据.
文献检索按照统一检索策略检索中、英文文献数据库, 检索截止2017-06. 以主题词"白介素-8"或"IL-8"或"CXCL8"、"急性胰腺炎"或"AP"、"-251A/T"或"rs4073"和"多态性"或"遗传性变型"或"遗传变异"等检索中国知网(CNKI)、万方、维普(VIP)和中国生物医学文献(CBM)等中文数据库; 以主题词("IL-8"or "interleukin-8"or "CXCL8")and ( "acute pancreatitis" or "AP" ) and ("-251A/T"or"rs4073") and ("polymorphism"or "SNPs"or "genetic variant" or "genetic variation")等检索PubMed、EMASE和Web of Science等英文数据库, 收集国内外公开发表IL-8启动子-251A/T多态性与AP遗传易感性的相关文献.
1.2.1 文献纳入: (1)关于人群研究IL-8启动子-251A/T(rs4073)多态性与AP遗传易感性; (2)研究对象为病例-对照设计研究, 且为一次文献; (3)中文和英文语种文献; (4)直接或间接报告研究人群的等位基因和/或基因型频率, 可计算OR值和95%CI; (5)文献研究的样本量大小不限.
1.2.2 排除标准: (1)文献不是研究IL-8启动子-251A/T多态性与AP的相关性; (2)不是病例-对照研究; (3)不能提取相关数据的文献; (4)硕士论文和会议论文; (5)综述、摘要或类似Meta分析; (6)排除重复研究文献, 如同一研究人群发表1篇以上相关文献, 纳入数据最全或最大样本量的文献.
| 文献 | 国别 | 种族 | 样本数 (n) | 基因型分布 (病例组/对照组) | 等位基因频率 (病例组/对照组) | HWE | 分型技术 | NOS质量评分 | |||
| 病例组/对照组 | TT | TA | AA | T | A | ||||||
| Hofner等[9]2006 | 凶牙利 | 高加索人群 | 92/200 | 23/82 | 45/84 | 24/34 | 91/248 | 93/152 | Yes | PCR-RFLP | 8 |
| 李赟等[10]2007 | 中国 | 亚洲人群 | 71/70 | 31/38 | 32/30 | 8/2 | 94/106 | 48/34 | Yes | PCR-RFLP | 8 |
| Chen等[15]2008 | 中国 | 亚洲人群 | 101/120 | 41/43 | 54/64 | 6/13 | 136/150 | 66/90 | No | PCR-RFLP | 5 |
| 曹得清等[11]2010 | 中国 | 亚洲人群 | 119/236 | 48/115 | 56/110 | 15/11 | 152/340 | 86/132 | Yes | PCR-RFLP | 8 |
| 唐华等[12]2010 | 中国 | 亚洲人群 | 120/132 | 54/72 | 54/56 | 12/4 | 162/200 | 78/64 | Yes | PCR-RFLP | 7 |
| Li等[14]2015 | 中国 | 亚洲人群 | 176/176 | 37/53 | 77/74 | 62/49 | 151/180 | 201/172 | Yes | PCR-RFLP | 8 |
| Bao等[13]2015 | 中国 | 亚洲人群 | 335/335 | 84/108 | 144/139 | 106/88 | 312/355 | 356/315 | No | PCR/ARMS | 5 |
| Anilir等[20]2017 | 美国 | 高加索人群 | 176/100 | 61/31 | 93/59 | 22/10 | 215/121 | 137/79 | Yes | PCR | 6 |
1.2.3 文献质量评估及数据提取: 文献质量评价参照NOS评分项目, 主要包括疾病诊断标准方法、实验组人群来源、对照组人群来源、HWE、基因检测方法和统计分析方法合理性等. 参照相关文献[16], 文献质量评分总分10分, ≥6分为高质量文献, <6分为低质量文献. 数据提取由2名不同作者按照文献的纳入及排除标准、文献质量评估项目标准独立完成, 包括第一作者、发表年限、国家和种族、实验组及对照组的样本量和基因型/等位基因数据、HWE、基因分型技术及NOS质量评分. 由第3作者核实, 争议之处共同商榷并达成一致.
统计学处理 采用Stata12.0软件进行统计学分析, 用χ2检验验证文献对照组基因型是否符合HWE, P<0.05认为对照组人群偏离HWE. 采用Q检验和I2检验评估各研究间在等位基因遗传模式(T vs A)和不同基因型遗传模式下的异质性, 基因型遗传模式包括同质模式(TT vs AA)、异质模式(AT vs AA)、显性模式(TT+AT vs AA)和隐性模式(TT vs TA+AA); 若PQ>0.10且I2<50%, 则表明纳入研究无异质性, 用固定效应模型分析合并数据, 反之则采用随机效应模型分析[17,18]. 各个研究效应加权合并用总OR值及95%CI评价-251A/T多态性与AP遗传易感性的相关性. 异质性来源采用Meta回归、亚组分析(如HWE、文献质量评分等)及结合Galbraith星状图进行分析. 敏感性分析评价Meta分析的可靠性, 发表偏倚采用Egger's和Begg's分析[19]. P<0.05为差异具有统计学意义.
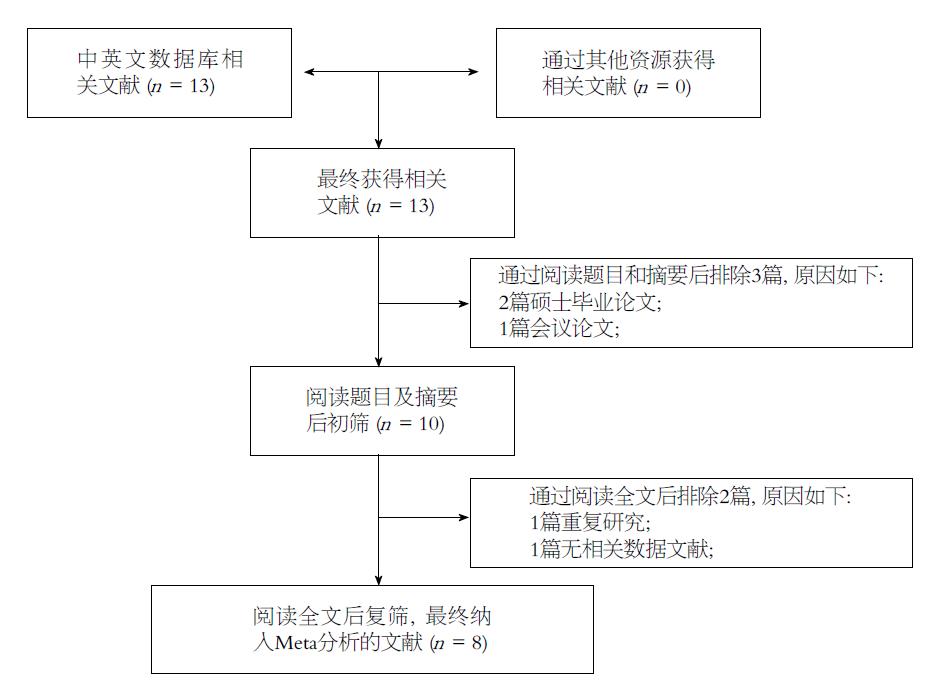
检索IL-8启动子-251A/T多态性与AP相关文献13篇(英文文献7篇, 中文文献6篇), 阅读文献标题或摘要后排除2篇硕士论文和1篇会议论文, 阅读全文后排除1篇重复文献和1篇无数据文献, 符合纳入标准的文献共8篇. 详见文献筛选流程图(图1). 在纳入的8文献中, 病例组与对照组例数分别为1190例和1369例, 高加索人群2篇[9,20]、亚洲人群6篇[10-15]. 样本量最少141例[10], 最大670例[13]. 6篇文献用PCR-RFLP基因分型技术[9-12,14,15], 1篇文献用PCR/ARMS基因分型技术[13], 1篇研究用PCR技术(未说明具体技术)[20]. 6篇研究对照组数据符合HWE[9-12,14,20], 2篇研究对照组数据不符合HWE[13,15]. 6篇文献属于高质量研究[9-12,14,20], 2篇文献属低质量研究[13,15]. 纳入文献的基本特征如表1.
表2显示IL-8-251A/T多态性与AP遗传易感性在等位基因和基因型遗传模式下主要Meta分析结果. Meta分析显示IL-8-251A/T多态性T等位基因明显降低AP的风险, T等位基因是其保护因素(OR = 0.770, 95%CI: 0.686-0.865, P<0.001); IL-8-251A/T多态性基因型与AP遗传易感性在四种遗传模式下均有统计学意义(同质: OR = 0.543, 95%CI: 0.368-0.799, P<0.001; 异质: OR = 0.755, 95%CI: 0.602-0.947, P = 0.015; 显性: OR = 0.676, 95%CI: 0.547-0.835, P<0.001; 隐性: OR = 0.738, 95%CI: 0.623-0.873, P<0.001). 亚组分析(种族、质量评分和HWE)结果与整体Meta分析结果基本一致(图2).
| 文献数 | 同质模式 | 异质模式 | 显性模式 | 隐性模式 | 等位基因模式 | ||||||||||||||||
| (病例组/对照组) | OR (95%CI) | P值 | I2 (%) | PQ值 | OR (95%CI) | P值 | I2 (%) | PQ值 | OR (95%CI) | P值 | I2 (%) | PQ值 | OR (95%CI) | P值 | I2 (%) | PQ值 | OR (95%CI) | P值 | I2 (%) | PQ值 | |
| 总体 | 8(1190/ 1369) | 0.543 (0.368 -0.799) | <0.05 | 48.6 | 0.059 | 0.755 (0.602 -0.947) | <0.05 | 27.6 | 0.208 | 0.676 (0.547 -0.835) | <0.05 | 40.8 | 0.106 | 0.738 (0.623 -0.873) | <0.05 | 26.9 | 0.313 | 0.770 (0.686 -0.865) | <0.05 | 40.7 | 0.107 |
| NOS质量评分(分) | |||||||||||||||||||||
| ≥6 | 6(754/ 914) | 0.450 (0.323 -0.626) | <0.05 | 12.5 | 0.335 | 0.636 (0.496 -0.861) | <0.05 | 6 | 0.378 | 0.562 (0.422 -0.748) | <0.05 | 12.8 | 0.333 | 0.696 (0.565 -0.858) | <0.05 | 15.7 | 0.313 | 0.718 (0.620 -0.831) | <0.05 | 6.1 | 0.378 |
| <6 | 2(436/ 455) | 1.038 (0.338 -3.183) | >0.05 | 75.4 | 0.044 | 0.941 (0.668 -1.325) | >0.05 | 45 | 0.177 | 1.069 (0.449 -2.545) | >0.05 | 65.5 | 0.089 | 0.890 (0.523 -1.515) | >0.05 | 64.6 | 0.093 | 0.951 (0.606 -1.492) | >0.05 | 75.7 | 0.043 |
| 种族 | |||||||||||||||||||||
| 亚洲人群 | 6(922/ 1069) | 0.527 (0.319 -0.869) | <0.05 | 56.7 | 0.042 | 0.758 (0.588 -0.977) | <0.05 | 48.2 | 0.086 | 0.617 (0.396 -0.963) | <0.05 | 56.3 | 0.043 | 0732 (0.606 -0.885) | <0.05 | 0 | 0.53 | 0.767 (0.673 -0.874) | <0.05 | 32.3 | 0.194 |
| 高加索人群 | 2(268/ 300) | 0.572 (0.256 -1.262) | >0.05 | 51.3 | 0.152 | 0.742 (0.450 -1.225) | >0.05 | 0 | 0.913 | 0.648 (0.402 -1.046) | >0.05 | 0 | 0.562 | 0.755 (0.312 -1.826) | >0.05 | 81.5 | 2 | 0.784 (0.464 -1.324) | >0.05 | 77.3 | 0.036 |
| HWE | |||||||||||||||||||||
| 平衡 | 6(754/ 914) | 0.450 (0.323 -0.626) | <0.05 | 12.5 | 0.335 | 0.636 (0.496 -0.861) | <0.05 | 6 | 0.378 | 0.562 (0.422 -0.748) | <0.05 | 12.8 | 0.333 | 0.696 (0.565 -0.858) | <0.05 | 15.7 | 0.313 | 0.718 (0.620 -0.831) | <0.05 | 6.1 | 0.378 |
| 不平衡 | 2(436/ 455) | 1.038 (0.338 -3.183) | >0.05 | 75.4 | 0.044 | 0.941 (0.668 -1.325) | >0.05 | 45 | 0.177 | 1.069 (0.449 -2.545) | >0.05 | 65.5 | 0.089 | 0.890 (0.523 -1.515) | >0.05 | 64.6 | 0.093 | 0.951 (0.606 -1.492) | >0.05 | 75.7 | 0.043 |
IL-8-251A/T多态性与AP遗传易感性在同质模式存在异质性(I2 = 48.6%, PQ = 0.059). Meta回归分析(参数包括人群种族、HWE、NOS评分等)显示上述参数均非异质性来源(P>0.1). 按种族、HWE和NOS质量评分进行亚组分析, 发现HWE不平衡和NOS质量评分<6分的研究可能是异质性来源(HWE不平衡: PQ = 0.043, I2 = 75.7%; NOS质量评分<6分: PQ = 0.043, I2 = 75.7%, 表2). Galbraith星状图显示Chen等[15]研究在同质模式和显性模式下均显著离群研究(值), 排除Chen等[15]文献, 异质性明显降低(同质: I2 = 19.9%, PQ = 0.277; 异质: I2 = 11.0%, PQ = 0.346; 显性: I2 = 20.1%, PQ = 0.277; 隐性: I2 = 0.0%, PQ = 0.430; 等位基因: I2 = 0.0%, PQ = 0.458), 其OR值及95%CI无实质性改变(同质: OR = 0.520, 95%CI: 0.403- 0.671, P<0.001; 异质: OR = 0.719, 95%CI: 0.569-0.908, P = 0.006; 显性: OR = 0.640, 95%CI: 0.515-0.796, P<0.001; 隐性: OR = 0.699, 95%CI: 0.585-0.835, P<0.001; 等位基因: OR = 0.736, 95%CI: 0.652-0.831, P<0.001), 表明Chen等[15]文献可能是异质性来源. 同时, Chen等[15]对照组基因型不符合HWE, 并且是低质量研究.
Begg's test(漏斗图对称)和Egger's test(P = 0.658)说明该Meta分析不存在发表偏倚; 敏感性分析表明, 当前Meta分析结果是稳定可靠.
AP是遗传和环境因素所致的胰酶在胰腺内被激活后引起胰腺组织自身消化、水肿、出血甚至坏死的炎症反应, 在发生发展过程中常合并全身炎性反应综合征及多器官功能不全综合征. 环境因素包括大量饮酒、胆结石、高钙血症、暴饮暴食、药物和创伤等[6,7], 但AP的发病机制尚不完全清楚, 研究发现炎症因子在AP病理生理过程中有重要作用[21-23], 尤其是促炎细胞因子. 其中, IL-8作为促炎细胞因子, 能激活嗜中性粒细胞的趋化细胞因子, 参与免疫应答反应[12], 被认为是引起胰腺局部和全身器官损伤重要的促炎细胞因子和级联放大反应的核心因子之一[8]. 研究发现IL-8在急性胰腺炎的动物模型和人体组织中表达明显增高, 特别是合并全身炎性反应综合征时更明显, 并与AP的严重程度相关[24,25]. 人IL-8位于染色体4q13-q21, 全长3211 bp, 包含启动子、4个外显子和3个内含子[26]. IL-8基因多态性与AP遗传易感性被广泛研究, 尤其是启动子-251A/T多态性, 但其结果并不一致[9-15]. 其原因可能是单个研究样本量较小使其统计力度不够的原因所致. 本研究采用系统评价和Meta分析的方法合并单个研究, 以明确IL-8启动子-251A/T多态性与AP遗传易感性是否存在相关性.
本研究共纳入8篇文献均为试验-对照组研究, 病例组和对照组例数分别为1190例和1369例, 主要是亚洲人群研究(6篇), 所采用的基因分型技术主要是PCR-RFLP(6篇), 有2篇文献对照组不符合HWE, 6篇文献是高质量研究.
Meta分析发现IL-8启动子-251A/T多态性T等位基因是AP遗传易感性的保护因素(OR = 0.770, 95%CI: 0.686-0.865, P<0.001), 同时-251A/T多态性基因型在同质、异质、显性和隐性遗传模式下均有统计学意义(表2), 说明携带-251A/T多态性T等位基因的个体可降低AP的发生风险. 其可能原因: (1)IL-8启动子-251A/T多态性突变基因T使组织或血清产生IL-8减少或IL-8功能减弱. 研究发现携带A等位基因(AA、AT或AA+AT)的AP患者血浆中IL-8的水平明显高于携带T等位基因患者[10-12]; (2)IL-8启动子多个位点可结合不同的转录因子调控IL-8的转录、翻译[12,27], 启动子-251A/T突变致其他基因结合位点发生改变使IL-8功能变化; (3)IL-8-251A/T多态性T等位基因与该基因其他多态性或其他基因多态性连锁遗传致IL-8功能降低; (4)IL-8-251A/T多态性使信号通路发生变化也可导致IL-8功能变化. 文献报道[28]IL-8水平的高低与AP的病情严重程度呈正相关, 抑制IL-8的释放可降低AP患者的病死率[29], 携带T等位基因的胰腺炎患者可减轻炎症反应[30]. 说明IL-8可能是AP遗传易感性的候选基因之一.
IL-8基因-251A/T多态性与AP遗传易感性在同质模式下存在显著异质性(I2 = 48.6%, PQ = 0.059, 表2). Meta回归分析显示种族、HWE和NOS评分等参数不是异质性来源(P>0.1). 亚组分析发现HWE不平衡和NOS质量评分<6分可能是异质性来源. Galbraith星状图显示在等位基因、同质模式和显性模式下Chen等[15]研究离群显著, 排除该篇文献, 异质性明显降低, OR值及95%CI无实质性改变. 说明Chen等[15]的研究可能是异质性来源, 同时该研究对照组基因型不符合HWE, 并且是低质量研究. Begg's test和Egger's test发现当前Meta分析并不存在发表偏倚; 敏感性分析表明该Meta分析结果稳定可靠.
本Meta分析存在某些局限: (1)研究只纳入中文及英文文献, 可能会造成选择性偏倚; (2)研究人群较单一(仅包括高加索人群及亚洲人群), 同时样本量较小, 故Meta分析结果不宜推广到所有人群, 如非洲人群; (3)缺乏IL-8基因的其他多态性及其他基因的多态性数据和环境因素相关数据, 未能分析基因-基因或基因-环境的相互关系; (4)亚组分析中, 文献量较少(高加索人群仅2篇文献), 故应通过随机、多中心、大样本的前瞻性试验进一步验证本实验研究结果.
总之, 当前Meta分析结果表明IL-8启动子-251A/T多态性可能是AP遗传易感性的保护因素.
急性胰腺炎(acute pancreatitis, AP)是以胰腺坏死和炎性细胞因子浸润为特征的常见急腹症, 其发病机制包括遗传因素和环境因素. 大量饮酒、胆结石、高钙血症、暴饮暴食、药物和创伤等环境因素与AP密切相关, 遗传因素在AP遗传易感性中有着十分重要的作用, 寻找AP相关遗传位点对AP的防治有重要的意义.
白介素-8(interleukin-8, IL-8)是AP的炎性介质级联反应中的核心因子之一, IL-8基因多态性与AP遗传易感性被广泛研究, 尤其是启动子-251A/T多态性, 但研究结果尚存在争议. 本研究采用系统评价和Meta分析的方法评价IL-8启动子-251A/T多态性与AP遗传易感性的关系.
本研究旨在采用Meta分析的方法合并单个研究及样本量较小的研究, 从而明确IL-8启动子-251A/T多态性与AP遗传易感性是否存在相关性, 并为AP的防治提供分子遗传学证据.
本研究搜集中国知网(CNKI)、万方、维普(VIP)、中国生物医学文献(CBM)、PubMed、EMASE和Web of Science等数据库中相关IL-8启动子-251A/T多态性与AP的病例-对照研究文献, 按照纳入标准和排除标准, 评价文献质量, 并在等位基因和不同基因型遗传模式合并数据分析IL-8启动子-251A/T多态性与AP的关系.
IL-8启动子-251A/T多态性T等位基因明显降低AP风险, -251A/T多态性基因型与AP遗传易感性在同质、异质、显性和隐性遗传模式下均有统计学意义.
IL-8启动子-251A/T多态性可能是AP遗传易感性的保护因素.
通过随机、多中心、大样本的前瞻性研究进一步验证IL-8启动子-251A/T多态性与AP遗传易感性的相关性.
手稿来源: 自由投稿
学科分类: 胃肠病学和肝病学
手稿来源地: 四川省
同行评议报告分类
A级 (优秀): A
B级 (非常好): B, B, B
C级 (良好): C, C
D级 (一般): 0
E级 (差): 0
编辑: 闫晋利 电编:杜冉冉
| 1. | Shen A, Kim HJ, Oh GS, Lee SB, Lee SH, Pandit A, Khadka D, Choe SK, Kwak SC, Yang SH. NAD<sup>+</sup> augmentation ameliorates acute pancreatitis through regulation of inflammasome signalling. Sci Rep. 2017;7:3006. [PubMed] [DOI] |
| 2. | Everhart JE, Ruhl CE. Burden of digestive diseases in the United States Part III: Liver, biliary tract, and pancreas. Gastroenterology. 2009;136:1134-1144. [PubMed] [DOI] |
| 3. | Sah RP, Garg P, Saluja AK. Pathogenic mechanisms of acute pancreatitis. Curr Opin Gastroenterol. 2012;28:507-515. [PubMed] [DOI] |
| 4. | Gravante G, Garcea G, Ong SL, Metcalfe MS, Berry DP, Lloyd DM, Dennison AR. Prediction of mortality in acute pancreatitis: a systematic review of the published evidence. Pancreatology. 2009;9:601-614. [PubMed] [DOI] |
| 5. | Kashyap AS, Anand KP, Kashyap S. Severe acute pancreatitis. JAMA. 2004;292:1305; author reply 1305. [PubMed] [DOI] |
| 6. | Mayer J, Rau B, Gansauge F, Beger HG. Inflammatory mediators in human acute pancreatitis: clinical and pathophysiological implications. Gut. 2000;47:546-552. [PubMed] [DOI] |
| 7. | Kingsnorth A. Role of cytokines and their inhibitors in acute pancreatitis. Gut. 1997;40:1-4. [PubMed] [DOI] |
| 8. | Ryschich E, Kerkadze V, Deduchovas O, Salnikova O, Parseliunas A, Märten A, Hartwig W, Sperandio M, Schmidt J. Intracapillary leucocyte accumulation as a novel antihaemorrhagic mechanism in acute pancreatitis in mice. Gut. 2009;58:1508-1516. [PubMed] [DOI] |
| 9. | Hofner P, Balog A, Gyulai Z, Farkas G, Rakonczay Z, Takács T, Mándi Y. Polymorphism in the IL-8 gene, but not in the TLR4 gene, increases the severity of acute pancreatitis. Pancreatology. 2006;6:542-548. [PubMed] [DOI] |
| 12. | 唐 华, 刘 彩云, 王 旭霞, 李 慧艳, 闻 勤生. 白细胞介素-8基因-251A/T多态性与急性胰腺炎的相关性研究. 现代生物医学进展. 2010;20:3866-3868. [DOI] |
| 13. | Bao XB, Ma Z, Gu JB, Wang XQ, Li HG, Wang WY. IL-8 -251T/A polymorphism is associated with susceptibility to acute pancreatitis. Genet Mol Res. 2015;14:1508-1514. [PubMed] [DOI] |
| 14. | Li D, Li J, Wang L, Zhang Q. Association between IL-1β, IL-8, and IL-10 polymorphisms and risk of acute pancreatitis. Genet Mol Res. 2015;14:6635-6641. [PubMed] [DOI] |
| 15. | Chen WC, Nie JS. Genetic polymorphism of MCP-1-2518, IL-8-251 and susceptibility to acute pancreatitis: a pilot study in population of Suzhou, China. World J Gastroenterol. 2008;14:5744-5748. [PubMed] [DOI] |
| 17. | Thakkinstian A, McEvoy M, Minelli C, Gibson P, Hancox B, Duffy D, Thompson J, Hall I, Kaufman J, Leung TF. Systematic review and meta-analysis of the association between {beta}2-adrenoceptor polymorphisms and asthma: a HuGE review. Am J Epidemiol. 2005;162:201-211. [PubMed] [DOI] |
| 18. | Higgins JP, Thompson SG. Quantifying heterogeneity in a meta-analysis. Stat Med. 2002;21:1539-1558. [PubMed] [DOI] |
| 19. | Egger M, Davey Smith G, Schneider M, Minder C. Bias in meta-analysis detected by a simple, graphical test. BMJ. 1997;315:629-634. [PubMed] [DOI] |
| 20. | Anilir E, Ozen F, Yildirim IH, Ozemir IA, Ozlu C, Alimoglu O. IL-8 gene polymorphism in acute biliary and non biliary pancreatitis: probable cause of high level parameters? Ann Hepatobiliary Pancreat Surg. 2017;21:30-38. [PubMed] [DOI] |
| 21. | Li J, Zhang S, Zhou R, Zhang J, Li ZF. Perspectives of traditional Chinese medicine in pancreas protection for acute pancreatitis. World J Gastroenterol. 2017;23:3615-3623. [PubMed] [DOI] |
| 22. | Shah AM, Eddi R, Kothari ST, Maksoud C, DiGiacomo WS, Baddoura W. Acute pancreatitis with normal serum lipase: a case series. JOP. 2010;11:369-372. [PubMed] |
| 24. | Motoo Y, Xie MJ, Mouri H, Sawabu N. Expression of interleukin-8 in human obstructive pancreatitis. JOP. 2004;5:138-144. [PubMed] |
| 25. | McKay CJ, Gallagher G, Brooks B, Imrie CW, Baxter JN. Increased monocyte cytokine production in association with systemic complications in acute pancreatitis. Br J Surg. 1996;83:919-923. [PubMed] [DOI] |
| 26. | 李 墨林, 方 先, 付 红勇, 康 志杰, 李 芳. 趋化因子CXCL8/IL-8与急性白血病关系的研究进展. 细胞与分子免疫学杂志. 2013;29:218-220. [DOI] |
| 27. | Jiang ZD, Okhuysen PC, Guo DC, He R, King TM, DuPont HL, Milewicz DM. Genetic susceptibility to enteroaggregative Escherichia coli diarrhea: polymorphism in the interleukin-8 promotor region. J Infect Dis. 2003;188:506-511. [PubMed] [DOI] |
| 28. | Shokuhi S, Bhatia M, Christmas S, Sutton R, Neoptolemos JP, Slavin J. Levels of the chemokines growth-related oncogene alpha and epithelial neutrophil-activating protein 78 are raised in patients with severe acute pancreatitis. Br J Surg. 2002;89:566-572. [PubMed] [DOI] |
| 29. | Abe R, Shimosegawa T, Kimura K, Abe T, Kashimura J, Koizumi M, Toyota T. The role of endogenous glucocorticoids in rat experimental models of acute pancreatitis. Gastroenterology. 1995;109:933-943. [PubMed] [DOI] |
| 30. | Pooran N, Indaram A, Singh P, Bank S. Cytokines (IL-6, IL-8, TNF): early and reliable predictors of severe acute pancreatitis. J Clin Gastroenterol. 2003;37:263-266. [PubMed] [DOI] |