修回日期: 2018-07-24
接受日期: 2018-08-01
在线出版日期: 2018-09-28
CD4+ 上皮内淋巴细胞是位于肠道上皮基底层内的一类特殊的淋巴细胞. 根据细胞表型和功能的不同, CD4+ 上皮内淋巴细胞可以分为多个亚群, 主要有Th1细胞、Th2细胞、Th17细胞. 综合现有文献及本课题组的研究结果可以发现, CD4+ 上皮内淋巴细胞在肠道稳态维持机制中发挥着重要作用. 多种转录因子、肠道微生物、营养素能够调节CD4+ 上皮内淋巴细胞在肠道中的增殖、分化与凋亡; CD4+ 上皮内淋巴细胞在炎症性肠病的发病中也发挥重要作用. 本文就CD4+ 上皮内淋巴细胞的分化调节机制以及它在肠道稳态维持机制中的重要作用作一综述, 为阐明肠道炎症性疾病发病机制提供一些新的思路.
核心提要: CD4+ 肠上皮内淋巴细胞(CD4+ intraepithelial lymphocytes, CD4+ IEL)作为肠道免疫屏障的重要组成之一在肠道稳态维持中发挥关键作用; CD4+ IEL异常也是多种肠道疾病的重要致病因素. 系统阐明CD4+ IEL分化调节机制能够进一步理解CD4+ IEL在肠道稳态维持中的作用.
引文著录: 周超, 邱远, 杨桦, 肖卫东. CD4+肠上皮内淋巴细胞分化调节机制及在肠道稳态维持中的作用. 世界华人消化杂志 2018; 26(27): 1598-1604
Revised: July 24, 2018
Accepted: August 1, 2018
Published online: September 28, 2018
CD4+ intraepithelial lymphocytes are a special type of lymphocytes located in the lower layer of the intestinal epithelium. According to the difference of cell phenotypes and functions, CD4+ intraepithelial lymphocytes can be divided into multiple subgroups, including Th1 cells, Th2 cells, and Th17 cells. The proliferation, differentiation, and apoptosis of CD4+ intraepithelial lymphocytes can be regulated by a variety of transcription factors, intestinal microbes, and nutrients. CD4+ intraepithelial lymphocytes play an important role in the pathogenesis of inflammatory bowel disease. In this article, we will review the mechanism of differentiation and regulation of CD4+ intraepithelial lymphocytes and their relationship with inflammatory bowel disease, with an aim to provide some new clues to the pathogenesis of inflammatory bowel disease.
- Citation: Zhou C, Qiu Y, Yang H, Xiao WD. Mechanism of differentiation and regulation of CD4+ intraepithelial lymphocytes: Relationship with inflammatory bowel disease. Shijie Huaren Xiaohua Zazhi 2018; 26(27): 1598-1604
- URL: https://www.wjgnet.com/1009-3079/full/v26/i27/1598.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v26.i27.1598
肠道稳态指的是肠道黏膜、肠道菌群、营养和代谢产物之间相互作用所构成的动态平衡状态, 一旦稳态失衡超出宿主的调节能力, 将导致一系列疾病的发生. 肠道黏膜屏障是维持肠道稳态的重要组成部分, 主要由肠黏膜机械屏障、化学屏障、生物屏障和免疫屏障组成. 近年来研究发现肠黏膜免疫屏障在保护机体免受外来病原微生物侵扰中扮演着重要角色. 肠上皮内淋巴细胞(intraepithelial lymphocytes, IEL)是位于肠道上皮细胞之间的一类独特的T细胞群[1]. 在肠道的不同部位其比例亦有所不同, 在小肠中每100个肠上皮细胞(intestinal epithelial cell, IEC)就有3-8个IEL, 结肠中IEL所占比例稍高, IEL/IEC为5/100 -12/100, IEL的数量还会随着年龄增长发生变化. 根据表型不同, 肠道内的IEL主要分为两大群, 其中约85%由CD8+ T细胞组成, 而CD4+ T细胞只占5%左右[2,3]. 近几年研究发现虽然肠道CD4+ IEL所占比例较少, 但是它在维持肠道稳态中扮演着重要角色[4,5]. Kenneth等[5]发现在1960年就有人在肠道固有层和上皮中发现CD4+ T细胞, 但是局限于当时研究的技术手段原因, 对其表型、数量、功能等仍不清楚. CD4+ IEL是CD4+ T淋巴细胞在一系列趋化因子诱导下迁移至肠道上皮的一群淋巴细胞. 特殊的位置决定了CD4+ IEL不仅具有常规CD4+ T淋巴细胞的特点, 还有其特有的表型及功能. 在CD4+ IEL各亚群中, 一些CD4+ IEL亚群表达叉头盒P3(forkhead box P 3, Foxp3), 这类细胞的功能主要是抑制炎症反应和阻止发生自身免疫应答, 因此也称作调节性T淋巴细胞(regulatory T cells, Treg)[6,7]. 另外, 在一些特殊情况下, CD4+ IEL能够分泌干扰素-γ(interferon-γ, IFN-γ)、肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)、白介素-1β(interleukin-1β, IL-1β)等炎症因子, 使其发挥细胞毒性作用, 促进炎症反应[8,9]. 研究表明肠道菌群及代谢产物、小分子营养物质等多种因素共同参与了CD4+ IEL的分化成熟以及功能调控, 从而维持肠道黏膜免疫稳态[10,11]. 因此, 下文将从CD4+ IEL发育、影响其分化的因素、与炎症性疾病之间的关系等多个方面进行综述.
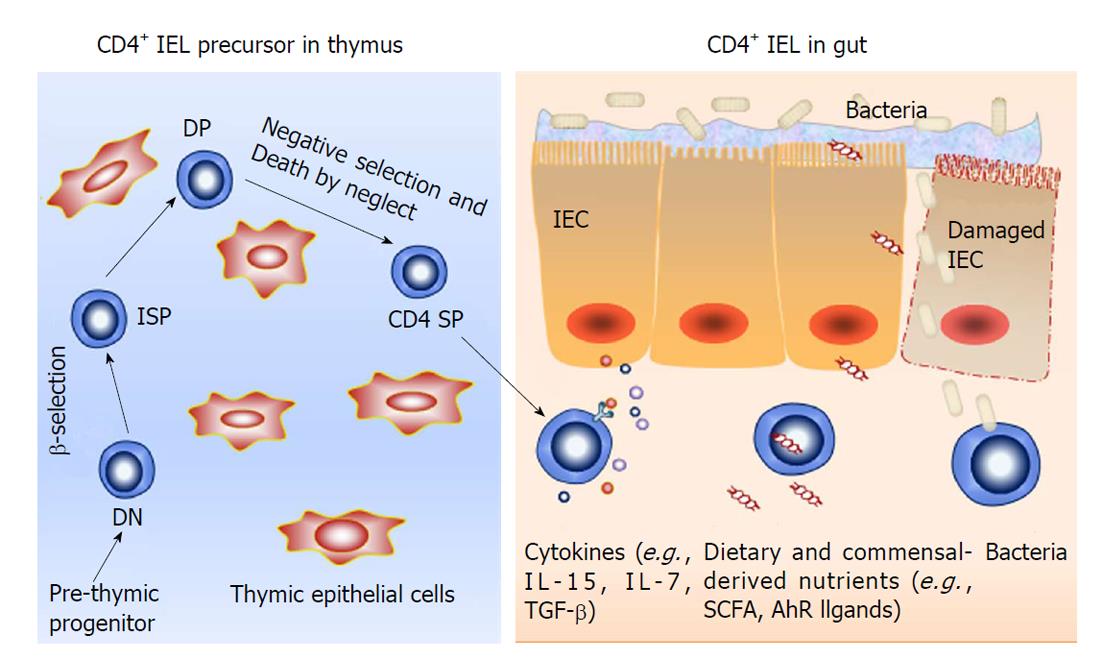
CD4+ IEL起源于骨髓, 迁移到胸腺后发育为幼稚CD4+ T细胞, 在胸腺分泌的细胞因子作用下在外周经历活化、增殖和分化后形成成熟的效应T细胞[12]. 根据功能差异, 理论上将CD4+ T细胞分为增强免疫应答的辅助性T细胞(Th细胞)和抑制免疫应答的调节性T细胞(Tr细胞). 生理情况下, 位于肠上皮细胞间的CD4+ T细胞数量极少, Th/Tr细胞的平衡维持主要在肠固有层内. 病理状态下, 外周幼稚CD4+ T细胞在IFN-γ、IL-1β、转化生长因子-β(transforming growth factor beta, TGF-β)等一系列细胞因子的诱导下迁移至肠黏膜上皮, 并在树突状细胞呈递的特异性信号刺激下, 变为成熟的CD4+ IEL[13]. 此时分布于肠黏膜上皮的Th/Tr细胞的平衡遭到破坏, 造成肠道免疫紊乱[14,15]. 然而, 根据细胞膜表面标志不同, CD4+ IEL在肠道上皮中发挥着不同作用. 部分CD4+ T上皮内淋巴细胞表达Foxp3因子发挥免疫抑制功能, 主要防止生理状态下肠道免疫细胞对肠腔食物、肠道共生菌发生免疫应答[16-19]. 另一部分CD4+ IEL在肠道细菌罗伊氏乳杆菌或者白介素-4(interleukin-4, IL-4)、白介素-15(interleukin-15, IL-15)等刺激下, 表达CD8αα, 最终成为CD4+CD8αα+ IEL[20,21]. 一方面, 该群细胞可以维持肠道内环境稳态平衡, 主要表现为它能够分泌IFN-γ、TNF-α等炎症性因子以及促使巨噬细胞产生溶菌酶, 裂解素等发挥细胞毒作用, 清除受损的肠上皮细胞[22]. 另一方面, 该群细胞也会造成肠道损伤[23], 因为CD4+CD8αα+ IEL可以分泌IL-15, 阻碍TGF-β对效应T细胞反应的抑制作用, 进而导致肠道免疫耐受遭到破坏, 造成肠道发生自身免疫性疾病[24,25].
骨髓前体T淋巴细胞离开骨髓后在胸腺内分化成熟是一个复杂的过程. 他们在胸腺中增殖、选择性分化, 在一系列转录因子调控下经历阳性选择后最终成为具有辅助作用的CD4+ T淋巴细胞和具有细胞毒性的CD8+ T淋巴细胞[26](图1). 研究发现在胸腺细胞发育过程中, 缺乏辅助T细胞诱导性POK因子(T-helper-inducing POK factor, ThPOK), 会造成主要组织相容性复合体Ⅱ(major histocompatibility complex Ⅱ, MHC-Ⅱ)类限制的胸腺细胞重新转化为CD8系淋巴细胞[27,28]. 然而当ThPOK存在时, 可以使Ⅰ类限制的胸腺细胞重定向为CD4系淋巴细胞. 表明ThPOK因子是CD4+CD8+ T淋巴细胞经历阳性选择后分化为CD4+ T淋巴细胞的关键因子. 但是, 幼稚T淋巴细胞在缺乏特异性T细胞(抗原)受体(T cell receptor, TCR)的情况下, 即使ThPOK过度表达, 该幼稚T淋巴细胞在胸腺中也不能进行阳性选择. 说明持续表达ThPOK是幼稚T淋巴细胞阳性选择为CD4+ T淋巴细胞的关键因素, 但是这一过程需要在特异性TCR的辅助下完成. Reis等[29]发现人runt相关转录因子3(runt-related transcription factor 3, Runx3)和ThPOK是IEL发育过程中的一对相互"对抗"的因子. 他们利用基因工程小鼠发现Runx3因子高表达能够抑制ThPOK表达, 从而导致CD4+ IEL数量大大减少. 另外, 研究发现转录因子T-bet(T-box expressed in T cells, T-bet)也参与IEL的分化[24,30,31], 主要表现为T-bet能够协助Runx3共同抑制ThPOK表达, 最终造成CD4+ IEL数量减少. 然而, 为了维持CD4+ IEL的数量, 组蛋白去乙酰化酶1,2(histone deacetylases, HDAC1, 2)能够对抗Runx3和T-bet对ThPOK的抑制作用. 当HDAC1, 2被抑制后, CD4+ IEL凋亡增加, 数量减少, 与此同时, 外周T细胞会自发向CD8+ IEL细胞转变, 使其数量增加. 然而HDAC1, 2功能恢复时, 表现为ThPOK表达上调, 阻止T-bet通路以及抑制Runx3表达, 使IEL向CD4+ IEL转变, 最终导致CD4+ IEL数量增加[32,33]. 说明HDAC1, 2在维持CD4+ IEL数量中也发挥了重要作用. 总之, 在IEL的分化过程中Runx3, T-bet, ThPOK等转录因子直接参与调控, 维持肠上皮间各淋巴细胞亚群数量保持动态平衡, 共同维护肠道免疫功能.
研究发现肠道微生物可通过调节肠道免疫细胞生长、分化来实现调节肠道免疫功能[34,35]. 肠道淋巴细胞在胸腺中经过阳性、阴性选择后成为幼稚T细胞(图1). 不同种属的细菌能够诱导幼稚T细胞分化为不同成熟细胞亚群[20]. Farkas等[36]研究发现分节丝状菌(segmented filamentous bacteria, SFB)能够调节CD4+ IEL向Th17细胞分化. 他们在无菌小鼠肠道中移植SFB小鼠粪便后发现, 该小鼠肠道上皮内检测到Th17细胞, 然而对照组没有出现Th17细胞. 说明分节丝状菌能够诱导CD4+ IEL向Th17细胞分化, 但是详细机制还不清楚. 另外, 有学者研究[37]发现结肠梭菌属能够诱导分布于结肠的CD4+ IEL表达Foxp3转录因子使其转化为具有免疫抑制作用的Treg细胞. 同时它们还可以刺激这群Treg细胞分泌白介素-10(interleukin-10, IL-10)以及TGF-β发挥免疫抑制作用, 防止结肠上皮内淋巴细胞与肠腔抗原发生反应. 同时, 肠道微生物还是肠道免疫损伤过程的重要激发因素. 肠道菌群通过与宿主之间的相互作用而调控肠道稳态. 轻度的肠道菌群紊乱能够刺激CD4+ IEL发挥免疫抑制作用, 减少促炎因子产生和炎症因子表达. 然而当肠道机械屏障遭受破坏, 肠道菌群侵入肠壁时, CD4+ IEL也可发生破坏作用, 主要表现为肠道细菌刺激肠上皮细胞分泌IL-15诱导CD4+CD8αα+ IEL产生大量IFN-γ、TNF-α等炎性因子促进巨噬细胞分泌溶菌酶、裂解素等物质, 从而帮助巨噬细胞吞噬溶解细菌,发挥细胞毒性作用. 但是这些细胞毒性作用同时也会破坏肠道免疫耐受, 破坏肠道稳态, 导致肠道发生自身免疫性疾病[38-40].
肠道的不同营养状态也可以影响CD4+ IEL的分化、成熟. Yang等[2]发现, 完全肠外营养(total parenteral nutrition, TPN)造成IEL数量及功能均发生改变. 主要是因为完全TPN导致肠上皮细胞分泌白介素-7(interleukin-7, IL-7)减少, 最终影响CD4+ IEL分化成熟. 说明肠道营养状态在CD4+ IEL的分化、成熟中起重要作用. 在结肠中, 短链脂肪酸作为细菌代谢产物, 不仅能够维持肠道共生菌和肠道细胞能量需求还参与肠道免疫调节[41,42]. 研究发现, 不同的短链脂肪酸在T细胞的发育过程中起不同作用. 丁酸盐能够促进外周T细胞增殖从而增加CD4+ IEL细胞数量. 丁酸盐可扮演HDAC1抑制剂角色促进Foxp3蛋白乙酰化从而增加外周T细胞稳定地增殖, 最终也可以增加CD4+ IEL的数量[43,44]. Thangaraju等[45]发现丁酸盐在外周T细胞分化中也起重要作用, 它能够作为G蛋白偶联受体的配体参与胸腺外T淋巴细胞分化. 另外, 芳香烃受体(aryl hydrocarbon receptor, AhR)激动剂也参与调节CD4+ IEL的数量及功能. 我们团队[46]在葡聚糖硫酸钠(dextran sulfate sodium, DSS)诱导小鼠结肠炎模型中, 人为添加芳香烃受体配体[6-Formylindolo(3,2-b)carbazole, FICZ]后发现与对照组相比, 小鼠肠道炎症得以缓解[47], 流式细胞分析得出活化的CD4+ IEL与CD8+ IEL数量均降低, 考虑AhR通过抑制IEL活化, 减轻了肠黏膜局部炎症[47]. Cervantes-Barragan等[20]研究发现给予AhR的另一种配体色氨酸饲养小鼠, 虽然也出现CD4+ IEL与CD8+ IEL数量降低, 但是发现CD4+CD8+ IEL数量增加, 并且数量与色氨酸浓度变化一致. 并且检测到CD4+CD8+ IEL分泌的IL-10与TGF-β上调, 抑制肠道免疫细胞发挥效应. 然而在AhR条件敲除的小鼠中未检测出CD4+CD8+ IEL, 说明在IEL的早期发育过程中, AhR能够改变IEL的分化方向. 另外, Ying等[48]利用AhR条件敲除小鼠研究发现, 缺乏AhR,小鼠肠道中依然能够检测出CD4+ IEL与CD8+ IEL并且其比例未发生改变, 但是其寿命变短. 说明AhR对IEL的发育过程影响不大, 但是对于维持其寿命以及发挥功能起重要作用. 以上结果说明AhR一方面可以减少效应细胞数量防止其发挥炎症反应造成组织损伤, 另一方面可以促进肠道免疫抑制细胞发生, 缓解已经造成的炎症损伤[49]. 总之, 肠道营养状态对免疫功能或CD4+ IEL都至关重要. 它即可以与肠上皮细胞相互交流进而间接影响IEL[50,51], 又能够通过小分子激动剂直接作用IEL内受体, 最终影响CD4+ IEL增殖、分化与成熟, 最终维护肠道稳态.
炎症性肠病(inflammatory bowel disease, IBD)是一类病因未明的累及肠道慢性非特异性炎症疾病,主要包括溃疡性结肠炎(ulcerative colitis, UC)和克罗恩病(Crohn's disease, CD). 在IBD发病早期, 肠道黏膜屏障受损, 肠道菌群侵入肠壁[52-54]. 有大量证据提示IEL在IBD的发病中发挥了重要作用, CD4+ IEL也不例外. 首先, Sarrabayrouse等[55]和Carmack等[56]发现, 在IBD患者中由于肠道菌群紊乱, CD4+CD8αα+ IEL数量远远低于正常人, 缺乏CD4+CD8αα+ IEL的免疫抑制作用可能是造成肠黏膜免疫紊乱的重要因素. 其次, CD4+ IEL功能异常也与肠道黏膜损伤相关. Cheroutre等[4]通过研究证实了CD4+ IEL功能异常在IBD的发病过程中起至关重要作用. 他们在CD患者肠道组织中发现CD4+ IEL转化而来的Th1细胞分泌大量IFN-γ、白介素-12(interleukin-12, IL-12), 使肠道发生炎症反应, 同时CD4+ IEL转化而来的Th17细胞在白介素-23(interleukin-23, IL-23)和维甲酸的诱导下大量增殖, 并抑制Treg细胞生成, 加剧肠道炎症反应, 进一步造成肠道上皮黏膜损伤[42,57,58]. 然而, 在UC患者肠道组织中发现UC的发病与CD4+ IEL转化的Th2细胞应答密切相关, 主要表现为Th2细胞分泌IL-5、IL-13、IL-23等细胞因子增多, 同时下调IL-10的表达导致致病性T细胞/调节性T细胞平衡紊乱, 造成肠道上皮黏膜发生慢性炎症[4,59]. 有意思的是, CD4+ IEL既可以抑制肠道发生自身免疫反应, 维持肠道稳态, 又能发挥细胞毒性作用, 加剧肠道损伤. 其免疫抑制作用主要表现为在IBD条件下, 该群细胞通过分泌IL-10抑制效应T细胞分化成熟, 阻止Th1细胞诱导肠道发生炎症, 发挥免疫抑制作用[37]; 其细胞毒性作用主要表现为分布于CD患者肠道中的CD4+ IEL能够分泌大量IFN-γ, 具有异常增强的细胞毒性, 这导致清除病原体的同时造成自身肠道黏膜损伤, 造成肠道机械屏障发生破坏[60,61]. 因此CD4+ IEL可以调节肠道免疫反应, 维持肠道黏膜微环境动态平衡, 但是异常的CD4+ IEL也造成肠道黏膜损伤, 加速IBD的病程进展.
学科分类: 胃肠病学和肝病学
手稿来源地: 重庆市
同行评议报告分类
A级 (优秀): 0
B级 (非常好): B, B, B
C级 (良好): 0
D级 (一般): 0
E级 (差): 0
编辑: 崔丽君 电编:张砚梁
| 1. | Binda E, Erhart D, Schenk M, Zufferey C, Renzulli P, Mueller C. Quantitative isolation of mouse and human intestinal intraepithelial lymphocytes by elutriation centrifugation. J Immunol Methods. 2009;344:26-34. [PubMed] [DOI] |
| 2. | Yang H, Gumucio DL, Teitelbaum DH. Intestinal specific overexpression of interleukin-7 attenuates the alternation of intestinal intraepithelial lymphocytes after total parenteral nutrition administration. Ann Surg. 2008;248:849-856. [PubMed] [DOI] |
| 3. | McDonald BD, Jabri B, Bendelac A. Diverse developmental pathways of intestinal intraepithelial lymphocytes. Nat Rev Immunol. 2018;18:514-525. [PubMed] [DOI] |
| 4. | Cheroutre H, Lambolez F, Mucida D. The light and dark sides of intestinal intraepithelial lymphocytes. Nat Rev Immunol. 2011;11:445-456. [PubMed] [DOI] |
| 5. | Beagley KW, Husband AJ. Intraepithelial lymphocytes: origins, distribution, and function. Crit Rev Immunol. 1998;18:237-254. [PubMed] |
| 6. | Josefowicz SZ, Lu LF, Rudensky AY. Regulatory T cells: mechanisms of differentiation and function. Annu Rev Immunol. 2012;30:531-564. [PubMed] [DOI] |
| 7. | Curotto de Lafaille MA, Lafaille JJ. Natural and adaptive foxp3+ regulatory T cells: more of the same or a division of labor? Immunity. 2009;30:626-635. [PubMed] [DOI] |
| 8. | Mucida D, Husain MM, Muroi S, van Wijk F, Shinnakasu R, Naoe Y, Reis BS, Huang Y, Lambolez F, Docherty M. Transcriptional reprogramming of mature CD4+ helper T cells generates distinct MHC class II-restricted cytotoxic T lymphocytes. Nat Immunol. 2013;14:281-289. [PubMed] [DOI] |
| 9. | Russell GJ, Nagler-Anderson C, Anderson P, Bhan AK. Cytotoxic potential of intraepithelial lymphocytes (IELs). Presence of TIA-1, the cytolytic granule-associated protein, in human IELs in normal and diseased intestine. Am J Pathol. 1993;143:350-354. [PubMed] |
| 10. | Reißig S, Hackenbruch C, Hövelmeyer N. Isolation of T cells from the gut. Methods Mol Biol. 2014;1193:21-25. [PubMed] [DOI] |
| 11. | Olivares-Villagómez D, Van Kaer L. Intestinal Intraepithelial Lymphocytes: Sentinels of the Mucosal Barrier. Trends Immunol. 2018;39:264-275. [PubMed] [DOI] |
| 12. | Lefrançois L, Puddington L. Extrathymic intestinal T-cell development: virtual reality? Immunol Today. 1995;16:16-21. [PubMed] |
| 13. | Kooy-Winkelaar YM, Bouwer D, Janssen GM, Thompson A, Brugman MH, Schmitz F, de Ru AH, van Gils T, Bouma G, van Rood JJ. CD4 T-cell cytokines synergize to induce proliferation of malignant and nonmalignant innate intraepithelial lymphocytes. Proc Natl Acad Sci USA. 2017;114:E980-E989. [PubMed] [DOI] |
| 14. | Sarrabayrouse G, Alameddine J, Altare F, Jotereau F. Microbiota-Specific CD4CD8αα Tregs: Role in Intestinal Immune Homeostasis and Implications for IBD. Front Immunol. 2015;6:522. [PubMed] [DOI] |
| 15. | Qiu Y, Yang H. Effects of intraepithelial lymphocyte-derived cytokines on intestinal mucosal barrier function. J Interferon Cytokine Res. 2013;33:551-562. [PubMed] [DOI] |
| 16. | Tanoue T, Honda K. Induction of Treg cells in the mouse colonic mucosa: a central mechanism to maintain host-microbiota homeostasis. Semin Immunol. 2012;24:50-57. [PubMed] [DOI] |
| 17. | Weissler KA, Caton AJ. The role of T-cell receptor recognition of peptide:MHC complexes in the formation and activity of Foxp3+ regulatory T cells. Immunol Rev. 2014;259:11-22. [PubMed] [DOI] |
| 18. | Ismail AS, Behrendt CL, Hooper LV. Reciprocal interactions between commensal bacteria and gamma delta intraepithelial lymphocytes during mucosal injury. J Immunol. 2009;182:3047-3054. [PubMed] [DOI] |
| 19. | Corthay A. How do regulatory T cells work? Scand J Immunol. 2009;70:326-336. [PubMed] [DOI] |
| 20. | Cervantes-Barragan L, Chai JN, Tianero MD, Di Luccia B, Ahern PP, Merriman J, Cortez VS, Caparon MG, Donia MS, Gilfillan S. Lactobacillus reuteri induces gut intraepithelial CD4 + CD8αα + T cells. Science. 2017;357:806-810. [PubMed] [DOI] |
| 21. | Naito T, Muroi S, Taniuchi I, Kondo M. Loss of Eed leads to lineage instability and increased CD8 expression of mouse CD4+ T cells upon TGFβ signaling. Mol Immunol. 2018;94:140-152. [PubMed] [DOI] |
| 22. | Das G, Augustine MM, Das J, Bottomly K, Ray P, Ray A. An important regulatory role for CD4+CD8 alpha alpha T cells in the intestinal epithelial layer in the prevention of inflammatory bowel disease. Proc Natl Acad Sci USA. 2003;100:5324-5329. [PubMed] [DOI] |
| 23. | Sasahara T, Tamauchi H, Ikewaki N, Kubota K. Unique properties of a cytotoxic CD4+CD8+ intraepithelial T-cell line established from the mouse intestinal epithelium. Microbiol Immunol. 1994;38:191-199. [PubMed] |
| 24. | Klose CS, Blatz K, d'Hargues Y, Hernandez PP, Kofoed-Nielsen M, Ripka JF, Ebert K, Arnold SJ, Diefenbach A, Palmer E. The transcription factor T-bet is induced by IL-15 and thymic agonist selection and controls CD8αα(+) intraepithelial lymphocyte development. Immunity. 2014;41:230-243. [PubMed] [DOI] |
| 25. | DePaolo RW, Abadie V, Tang F, Fehlner-Peach H, Hall JA, Wang W, Marietta EV, Kasarda DD, Waldmann TA, Murray JA. Co-adjuvant effects of retinoic acid and IL-15 induce inflammatory immunity to dietary antigens. Nature. 2011;471:220-224. [PubMed] [DOI] |
| 26. | Germain RN. T-cell development and the CD4-CD8 lineage decision. Nat Rev Immunol. 2002;2:309-322. [PubMed] [DOI] |
| 27. | He X, He X, Dave VP, Zhang Y, Hua X, Nicolas E, Xu W, Roe BA, Kappes DJ. The zinc finger transcription factor Th-POK regulates CD4 versus CD8 T-cell lineage commitment. Nature. 2005;433:826-833. [PubMed] [DOI] |
| 28. | Taniuchi I. CD4 Helper and CD8 Cytotoxic T Cell Differentiation. Annu Rev Immunol. 2018;36:579-601. [PubMed] [DOI] |
| 29. | Reis BS, Rogoz A, Costa-Pinto FA, Taniuchi I, Mucida D. Mutual expression of the transcription factors Runx3 and ThPOK regulates intestinal CD4+ T cell immunity. Nat Immunol. 2013;14:271-280. [PubMed] [DOI] |
| 30. | Reis BS, Hoytema van Konijnenburg DP, Grivennikov SI, Mucida D. Transcription factor T-bet regulates intraepithelial lymphocyte functional maturation. Immunity. 2014;41:244-256. [PubMed] [DOI] |
| 31. | Setoguchi R, Tachibana M, Naoe Y, Muroi S, Akiyama K, Tezuka C, Okuda T, Taniuchi I. Repression of the transcription factor Th-POK by Runx complexes in cytotoxic T cell development. Science. 2008;319:822-825. [PubMed] [DOI] |
| 32. | Boucheron N, Tschismarov R, Goeschl L, Moser MA, Lagger S, Sakaguchi S, Winter M, Lenz F, Vitko D, Breitwieser FP. CD4(+) T cell lineage integrity is controlled by the histone deacetylases HDAC1 and HDAC2. Nat Immunol. 2014;15:439-448. [PubMed] [DOI] |
| 33. | Kwong B, Lazarevic V. T-bet orchestrates CD8αα IEL differentiation. Immunity. 2014;41:169-171. [PubMed] [DOI] |
| 34. | Hooper LV, Macpherson AJ. Immune adaptations that maintain homeostasis with the intestinal microbiota. Nat Rev Immunol. 2010;10:159-169. [PubMed] [DOI] |
| 35. | Rooks MG, Garrett WS. Gut microbiota, metabolites and host immunity. Nat Rev Immunol. 2016;16:341-352. [PubMed] [DOI] |
| 36. | Farkas AM, Panea C, Goto Y, Nakato G, Galan-Diez M, Narushima S, Honda K, Ivanov II. Induction of Th17 cells by segmented filamentous bacteria in the murine intestine. J Immunol Methods. 2015;421:104-111. [PubMed] [DOI] |
| 37. | Atarashi K, Tanoue T, Shima T, Imaoka A, Kuwahara T, Momose Y, Cheng G, Yamasaki S, Saito T, Ohba Y. Induction of colonic regulatory T cells by indigenous Clostridium species. Science. 2011;331:337-341. [PubMed] [DOI] |
| 38. | Sujino T, London M, Hoytema van Konijnenburg DP, Rendon T, Buch T, Silva HM, Lafaille JJ, Reis BS, Mucida D. Tissue adaptation of regulatory and intraepithelial CD4+ T cells controls gut inflammation. Science. 2016;352:1581-1586. [PubMed] [DOI] |
| 39. | Abadie V, Jabri B. IL-15: a central regulator of celiac disease immunopathology. Immunol Rev. 2014;260:221-234. [PubMed] [DOI] |
| 40. | Brown DM. Cytolytic CD4 cells: Direct mediators in infectious disease and malignancy. Cell Immunol. 2010;262:89-95. [PubMed] [DOI] |
| 41. | Shen TD. Diet and Gut Microbiota in Health and Disease. Nestle Nutr Inst Workshop Ser. 2017;88:117-126. [PubMed] [DOI] |
| 42. | Arpaia N, Campbell C, Fan X, Dikiy S, van der Veeken J, deRoos P, Liu H, Cross JR, Pfeffer K, Coffer PJ. Metabolites produced by commensal bacteria promote peripheral regulatory T-cell generation. Nature. 2013;504:451-455. [PubMed] [DOI] |
| 43. | Zhang H, Xiao Y, Zhu Z, Li B, Greene MI. Immune regulation by histone deacetylases: a focus on the alteration of FOXP3 activity. Immunol Cell Biol. 2012;90:95-100. [PubMed] [DOI] |
| 44. | van Loosdregt J, Vercoulen Y, Guichelaar T, Gent YY, Beekman JM, van Beekum O, Brenkman AB, Hijnen DJ, Mutis T, Kalkhoven E. Regulation of Treg functionality by acetylation-mediated Foxp3 protein stabilization. Blood. 2010;115:965-974. [PubMed] [DOI] |
| 45. | Thangaraju M, Cresci GA, Liu K, Ananth S, Gnanaprakasam JP, Browning DD, Mellinger JD, Smith SB, Digby GJ, Lambert NA. GPR109A is a G-protein-coupled receptor for the bacterial fermentation product butyrate and functions as a tumor suppressor in colon. Cancer Res. 2009;69:2826-2832. [PubMed] [DOI] |
| 46. | Ji T, Xu C, Sun L, Yu M, Peng K, Qiu Y, Xiao W, Yang H. Aryl Hydrocarbon Receptor Activation Down-Regulates IL-7 and Reduces Inflammation in a Mouse Model of DSS-Induced Colitis. Dig Dis Sci. 2015;60:1958-1966. [PubMed] [DOI] |
| 47. | Ma Y, Wang Q, Yu K, Fan X, Xiao W, Cai Y, Xu P, Yu M, Yang H. 6-Formylindolo(3,2-b)carbazole induced aryl hydrocarbon receptor activation prevents intestinal barrier dysfunction through regulation of claudin-2 expression. Chem Biol Interact. 2018;288:83-90. [PubMed] [DOI] |
| 48. | Li Y, Innocentin S, Withers DR, Roberts NA, Gallagher AR, Grigorieva EF, Wilhelm C, Veldhoen M. Exogenous stimuli maintain intraepithelial lymphocytes via aryl hydrocarbon receptor activation. Cell. 2011;147:629-640. [PubMed] [DOI] |
| 49. | Furumatsu K, Nishiumi S, Kawano Y, Ooi M, Yoshie T, Shiomi Y, Kutsumi H, Ashida H, Fujii-Kuriyama Y, Azuma T. A role of the aryl hydrocarbon receptor in attenuation of colitis. Dig Dis Sci. 2011;56:2532-2544. [PubMed] [DOI] |
| 50. | Qiu Y, Yang Y, Yang H. The unique surface molecules on intestinal intraepithelial lymphocytes: from tethering to recognizing. Dig Dis Sci. 2014;59:520-529. [PubMed] [DOI] |
| 51. | Hoytema van Konijnenburg DP, Reis BS, Pedicord VA, Farache J, Victora GD, Mucida D. Intestinal Epithelial and Intraepithelial T Cell Crosstalk Mediates a Dynamic Response to Infection. Cell. 2017;171:783-794.e13. [PubMed] [DOI] |
| 52. | Egan CE, Maurer KJ, Cohen SB, Mack M, Simpson KW, Denkers EY. Synergy between intraepithelial lymphocytes and lamina propria T cells drives intestinal inflammation during infection. Mucosal Immunol. 2011;4:658-670. [PubMed] [DOI] |
| 53. | Levy M, Kolodziejczyk AA, Thaiss CA, Elinav E. Dysbiosis and the immune system. Nat Rev Immunol. 2017;17:219-232. [PubMed] [DOI] |
| 54. | Honda K, Littman DR. The microbiome in infectious disease and inflammation. Annu Rev Immunol. 2012;30:759-795. [PubMed] [DOI] |
| 55. | Sarrabayrouse G, Bossard C, Chauvin JM, Jarry A, Meurette G, Quévrain E, Bridonneau C, Preisser L, Asehnoune K, Labarrière N. CD4CD8αα lymphocytes, a novel human regulatory T cell subset induced by colonic bacteria and deficient in patients with inflammatory bowel disease. PLoS Biol. 2014;12:e1001833. [PubMed] [DOI] |
| 56. | Carmack SW, Lash RH, Gulizia JM, Genta RM. Lymphocytic disorders of the gastrointestinal tract: a review for the practicing pathologist. Adv Anat Pathol. 2009;16:290-306. [PubMed] [DOI] |
| 57. | Hue S, Ahern P, Buonocore S, Kullberg MC, Cua DJ, McKenzie BS, Powrie F, Maloy KJ. Interleukin-23 drives innate and T cell-mediated intestinal inflammation. J Exp Med. 2006;203:2473-2483. [PubMed] [DOI] |
| 58. | Ostanin DV, Brown CM, Gray L, Bharwani S, Grisham MB. Evaluation of the immunoregulatory activity of intraepithelial lymphocytes in a mouse model of chronic intestinal inflammation. Int Immunol. 2010;22:927-939. [PubMed] [DOI] |
| 59. | Saenz SA, Noti M, Artis D. Innate immune cell populations function as initiators and effectors in Th2 cytokine responses. Trends Immunol. 2010;31:407-413. [PubMed] [DOI] |
| 60. | van de Berg PJ, van Leeuwen EM, ten Berge IJ, van Lier R. Cytotoxic human CD4(+) T cells. Curr Opin Immunol. 2008;20:339-343. [PubMed] [DOI] |
| 61. | Nüssler NC, Stange B, Hoffman RA, Schraut WH, Bauer AJ, Neuhaus P. Enhanced cytolytic activity of intestinal intraepithelial lymphocytes in patients with Crohn's disease. Langenbecks Arch Surg. 2000;385:218-224. [PubMed] |
| 62. | Hu MD, Edelblum KL. Sentinels at the frontline: the role of intraepithelial lymphocytes in inflammatory bowel disease. Curr Pharmacol Rep. 2017;3:321-334. [PubMed] [DOI] |
| 63. | Mayassi T, Jabri B. Human intraepithelial lymphocytes. Mucosal Immunol. 2018;4. [PubMed] [DOI] |