修回日期: 2018-07-19
接受日期: 2018-08-01
在线出版日期: 2018-09-18
分析AT1受体拮抗剂(angiotensin Ⅱ AT1 receptor blockers, ARB)对脑出血大鼠伴急性胃黏膜病变的保护作用.
选取由本院实验动物中心提供健康雄性SD大鼠36只, 随机数字表法将大鼠分成两组, 治疗组(18只)与对照组(18只), 制备脑出血大鼠模型, 检测大鼠血清去甲肾上腺素(norepinephrine, NE)、肾上腺素(epinephrine, E)含量, 计算胃黏膜溃疡指数(ulcer index, UI), 免疫组化发检测大鼠胃黏膜内增殖细胞核抗原表达状况, 原位末端标记检测凋亡细胞数.
治疗组和对照组大鼠脑中风评分对比差异无统计学意义(P>0.05); 给药1、3、5 d后治疗组大鼠血清E、NE含量均低于对照组, 差异有统计学意义(P<0.05); 给药1、3、5 d治疗组UI值分别为3.86分±1.14分、20.19分±1.28分、13.86分±1.25分, 低于对照组的6.03分±1.16分、24.03分±1.31分、17.10分±1.28分, 差异均有统计学意义(P<0.05); 给药1、3、5 d后治疗组大鼠PCNA阳性细胞数均高于对照组, TUNEL凋亡细胞数均低于对照组, 差异有统计学意义(P<0.05).
ARB可降低脑出血大鼠血清内NE、E含量, 降低胃黏膜凋亡细胞, 增大增殖细胞, 从而对大鼠急性应激性胃黏膜病变起到治疗作用.
核心提要: 血管紧张素Ⅱ1型受体拮抗剂可降低脑出血大鼠血清内去甲肾上腺素、肾上腺素含量, 降低胃黏膜凋亡细胞, 增大增殖细胞, 从而对大鼠急性应激性胃黏膜病变起到治疗作用.
引文著录: 金志元, 汪凯. 血管紧张素Ⅱ1型受体拮抗剂对脑出血合并急性应激性胃黏膜病变大鼠胃黏膜病变保护影响. 世界华人消化杂志 2018; 26(26): 1545-1550
Revised: July 19, 2018
Accepted: August 1, 2018
Published online: September 18, 2018
To analyze the protective effect of angiotensin Ⅱ AT1 receptor blocker (ARB) against gastric mucosal lesions in rats with intracerebral hemorrhage combined with acute stress mucosal injury.
Thirty-six healthy male Sprague-Dawley rats were selected from our laboratory Animal Center and randomly divided into either a treatment group (18 rats) or a control group (18 rats). After intracerebral hemorrhage was induced in rats, the treatment group was given telmisartan, and the control group was given equal amount of normal saline. Serum norepinephrine (NE) and epinephrine (E) contents were detected and the gastric mucosal ulcer index (UI) was calculated. Immunohistochemistry was used to detect proliferative cell nuclear antigen (PCNA) in rat gastric mucosa (proliferative cell nuclei). Apoptotic cells were detected by transferase-mediated dUTP nick end labeling (TUNEL).
There was no significant difference in the scores of cerebral apoplexy between the treatment group and the control group (P > 0.05). After 1, 3, and 5 d of treatment, serum E and NE levels in the treatment group were significantly lower than those in the control group (P < 0.05). The UI values of the treatment group on days 1, 3, and 5 were 3.86 ± 1.14, 20.19 ± 1.28, and 13.86 ± 1.25, respectively, which were significantly lower than those of the control group (6.03 ± 1.16, 24.03 ± 1.31, and 17.10 ± 1.28, respectively; P < 0.05). After 1, 3, and 5 d of treatment, the number of PCNA positive cells in the treatment group was significantly higher than that of the control group, while the number of apoptotic cells was significantly lower than that in the control group (P < 0.05).
ARB can reduce serum contents of NE and E in rats with intracerebral hemorrhage, decrease apoptotic cells in the gastric mucosa, and increase the number of proliferating cells, thus exerting a therapeutic effect against acute stress gastric mucosal lesions.
- Citation: Jin ZY, Wang K. Protective effect of angiotensin Ⅱ type 1 receptor antagonist against gastric mucosal lesions in rats with cerebral hemorrhage and acute stress gastric mucosal injury. Shijie Huaren Xiaohua Zazhi 2018; 26(26): 1545-1550
- URL: https://www.wjgnet.com/1009-3079/full/v26/i26/1545.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v26.i26.1545
脑出血为临床较为常见疾病, 且临床患者通常会并发急性应激性胃黏膜病变, 表现为胃黏膜糜烂、充血、出血、水肿和产生溃疡等. 当前对脑出血合并急性应激性胃黏膜病变者一般使用质子泵抑制剂(proton-pump inhibitors, PPI)或者H2受体阻断剂(histamine 2 receptor antagonists, H2RA)进行治疗, 但临床疗效不太理想, 引起患者相关并发症较多[1,2]. 血管紧张素Ⅱ1型受体拮抗剂(angiotensin II AT1 receptor blockers, ARB)是传统降压药物, 临床已在肾脏病、糖尿病及心血管疾病等方面广泛使用. ARB经过结合血管紧张素Ⅱ1型受体(angiotensin Ⅱ type 1 receptor, AT1R)来发挥影响, AT1R主要在肾上腺、心、肾、脑、胃肠道及血管等器官内表达. 相关动物实验显示在冷水-束缚诱使大鼠胃溃疡模型内ARB可使大鼠胃黏膜微循环得到改善, 胃黏膜血流量增大, 进而对胃黏膜起到保护作用[3-5]. 因此, 本文通过分析ARB对脑出血合并急性应激性胃黏膜病变大鼠胃黏膜病变保护影响, 为临床患者治疗提供一些实验室依据.
选取由本院实验动物中心提供健康雄性SD大鼠36只, 6 wk龄, 体重在180-220 g间, 平均195.27 g±15.72 g, 饲养大鼠室内温度在23-26 ℃间, 湿度在40%-60%间, 光照周期为12 h:12 h, 适应性喂养1 wk后开始实验.
1.1.1 试剂、药品: 原位末端标记(transferase-mediated - dUTP nicd end labeling, TUNEL)细胞凋亡原位检测试剂盒(由南京凯基生物科技公司生产)、增殖细胞核抗原(proliferative cell nuclei antigen, PCNA)多克隆一抗(由北京中山公司生产)、替米沙坦(由德国勃林格殷格翰公司生产, 生产批号: 187415).
1.1.2 仪器: BCD-243G冷藏冷冻箱(由河南新飞公司生产)、smartline1000高压液相色谱泵(德国诺尔公司生产)、石英自动双重纯水蒸馏器(由江苏丹阳门石英玻璃厂生产)、S-3800全自动免疫组化染色仪(美国Dakocytomstion公司生产)、CS-Ⅳ摊片烤片机(由孝感电子仪器厂生产)、Leica-rm2135石蜡切片机(由德国莱卡公司生产).
1.2.1 实验分组: 依据随机数字表法将大鼠分成两组, 治疗组(18只)与对照组(18只). 制备模型: 依据李中秋等[6]人的方法制备脑出血大鼠模型, 手术前12 h禁止饮食, 4 h禁止饮水. 腹腔注入10%水合氯醛麻醉, 立体定位仪内将大鼠仰卧位固定, 常规消毒, 选取两眼间线和双耳间线正中1 cm纵切口, 暴露前卤与冠状缝. 在前卤的前1 mm中线右边3 mm位置钻圆孔, 直径是1.5 mm, 达到硬脑膜表层. 抽取2 μL Ⅳ型胶原酶, 沿着钻孔垂直进针到硬脑膜下的5.5 mm位置, 胶原酶缓慢推注到右脑尾巴状核区内. 在停针2 min后退至硬脑膜下3 mm位置, 在停针2 min后全部退出, 使用医用骨蜡将颅脑钻孔封闭, 皮肤缝合.
1.2.2 成功造模准则: 使用Bederson等[7]人6级五分评分法, 等大鼠清醒以后进行评分, 其得分≥1分则说明成功造模.
1.2.3 大鼠给药: 将30 mg/kg替米沙坦溶在2 mL生理盐水内, 治疗组在成功造模2 h以后开始灌胃给药, 对照组的大鼠每天使用等剂量生理盐水灌胃, 每天一次, 连续灌胃5 d, 以上操作均有同一工作人员在同一时间内进行. 实验期间各大鼠一般状况良好, 给药1、3、5 d每组分别选取6只大鼠处死、取材.
1.2.4 观察指标: (1)大鼠麻醉以后, 常规消毒, 腹主动脉抽血, 高效液相色谱-电化学检测器对血清去甲肾上腺素(norepinephrine, NE)、肾上腺素(epinephrine, E)含量检测; (2)取剑突下横指下正中纵行1 cm切口, 将胃切除, 剪开胃大弯, 10倍放大镜下对胃黏膜受损状况进行计算, 使用Gutn等[8]人标准对胃黏膜受损指数评定, 即点状病变为1分; 病变长度<1 mm为2分; 1-2 mm为3分; 2-4 mm为4分; 病变>4 mm为5分; 病灶宽度>1 mm时分值×2. 将所有分值相加即为此只大鼠胃黏膜溃疡指数(ulcer index, UI); (3)取胃黏膜受损最明显位置5 mm×8 mm组织切块, 石蜡包埋, HE染色后在光景下察看, 一只动物选取不连续切片5张, 一个切片随机选取5个视野; (4)免疫组化发检测大鼠胃黏膜内PCNA表达状况, PCNA主要在细胞核内表达, 细胞核内有团块或者棕褐色颗粒是阳性细胞, 光镜400倍视野下计算阳性细胞数量; (5)TUNEL检测凋亡细胞数, 正常细胞是蓝紫色, 凋亡细胞是棕色, 400倍视野下计算阳性细胞数量.
统计学处理 使用SPSS19.0统计软件进行数据分析, 计量资料采用mean±SD表示, 正态性资料采用独立样本t检验, 非正态分布资料采用非参数检验, 给药1、3、5 d数据采用重复测量方差检验, P<0.05差异有统计学意义.
治疗组和对照组大鼠脑中风评分对比差异无统计学意义(P>0.05); 给药1、3、5 d后治疗组大鼠血清E、NE含量均低于对照组, 差异有统计学意义(P<0.05)(表1).
| 分组 | 脑中分评分(分) | 血清E含量(ng/L) | 血清NE含量(ng/L) | ||||
| 给药1 d | 给药3 d | 给药5 d | 给药1 d | 给药3 d | 给药5 d | ||
| 治疗组 | 2.58 ± 1.19 | 463.20 ± 15.62 | 405.16 ± 13.28 | 227.95 ± 13.51 | 642.10 ± 23.45 | 589.04 ± 20.23 | 497.16 ± 20.85 |
| 对照组 | 2.61 ± 1.21 | 564.28 ± 15.83 | 510.27 ± 13.72 | 348.16 ± 13.54 | 693.27 ± 23.16 | 629.84 ± 20.51 | 533.09 ± 20.74 |
| t | 1.259 | 12.074 | 14.992 | 13.042 | 12.895 | 13.607 | 10.442 |
| P | 0.294 | 0.016 | 0.008 | 0.002 | 0.038 | 0.021 | 0.009 |
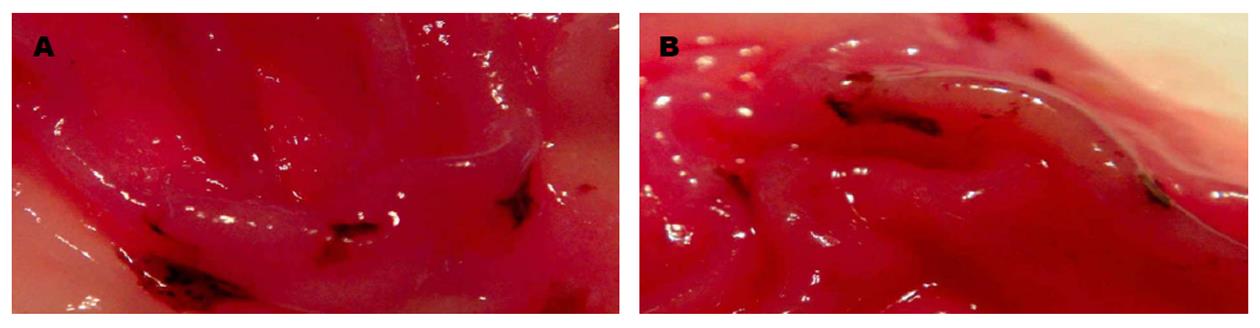
对照组大鼠第一天胃黏膜水肿充血, 产生出血点, 主要分布在胃小弯侧, 伴随时间增加而加重, 发生溃疡病灶、糜烂, 在第三天时最显著, 表征是病灶面积变大、数量变多, UI数值变大, 在第五天时损伤变轻, 病灶面积变小、数量变少, UI数值减少; 和对照组相比, 治疗组大鼠1、3、5 d时胃黏膜病灶面积、数量都比对照组少(图1).
给药1、3、5 d治疗组UI值分别为3.86分±1.14分、20.19分±1.28分、13.86分±1.25分, 低于对照组的6.03分±1.16分、24.03分±1.31分、17.10分±1.28分, 差异均有统计学意义(t = 14.072、10.278、13.552, P = 0.019、0.014、0.006).
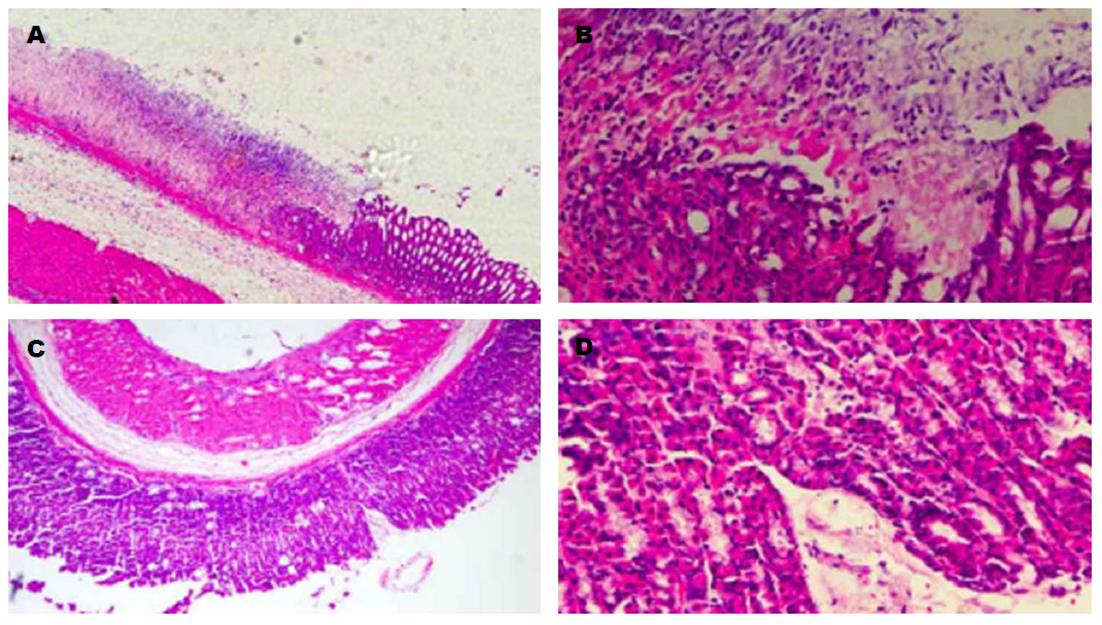
对照组的大鼠第一天时光镜下能够看到胃黏膜水肿、充血, 有炎性细胞浸润, 且腺体排列紊乱, 伴随时间增大而加重, 炎性细胞变多, 腺体和上皮组织坏死, 血管闭塞、黏膜掉落, 在第三天时最严重, 第五天时大鼠体内水肿减轻, 炎性细胞变少; 治疗组的大鼠1、3、5 d时其胃黏膜受损状况均优于对照组(图2).
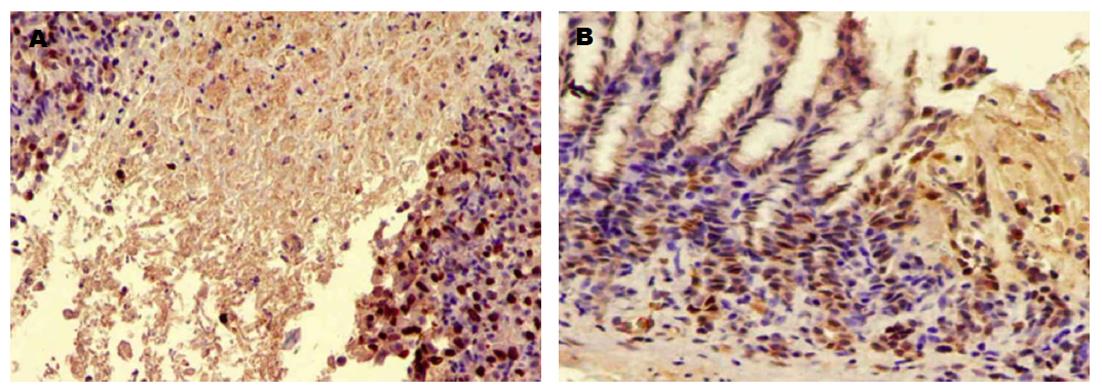
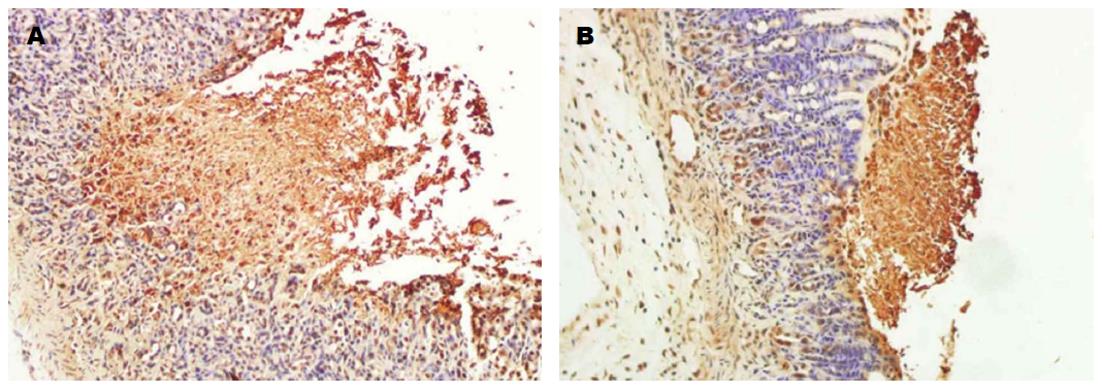
给药1、3、5 d后治疗组的大鼠PCNA阳性细胞数均高于对照组, TUNEL凋亡细胞数均低于对照组, 差异有统计学意义(P<0.05)(表2, 图3和4).
| 分组 | 增殖细胞核抗原阳性细胞(个/400倍视野) | TUNEL凋亡细胞(个/400倍视野) | ||||
| 给药1 d | 给药3 d | 给药5 d | 给药1 d | 给药3 d | 给药5 d | |
| 治疗组 | 113.02 ± 13.28 | 66.05 ± 10.27 | 75.22 ± 10.84 | 17.51 ± 6.18 | 106.73 ± 15.48 | 60.94 ± 15.26 |
| 对照组 | 89.27 ± 13.67 | 45.41 ± 10.62 | 55.42 ± 10.71 | 26.85 ± 6.13 | 162.01 ± 15.73 | 105.10 ± 15.72 |
| t | 12.083 | 14.906 | 11.773 | 12.905 | 13.475 | 13.053 |
| P | 0.029 | 0.031 | 0.015 | 0.028 | 0.019 | 0.013 |
胃黏膜的正常结构由细胞凋亡和增殖间动态平衡来保持, 任何对胃黏膜细胞凋亡与增殖间平衡损坏因素都会造成疾病出现[9-12]. 传统观点以为急性应激性胃黏膜病变为细胞被动坏死进程. 目前伴随提出凋亡观念和凋亡在疾病病理生理内影响研究显示, 急性应激性胃黏膜病变进程中有细胞凋亡参加. 相关研究已经证实细胞凋亡过多、增殖过少为应激性溃疡主要起病因素[13-16].
本文研究显示, 给药1、3、5 d后治疗组大鼠血清E、NE含量均低于对照组, 对照组大鼠第一天时光镜下能够看到胃黏膜水肿、充血, 有炎性细胞浸润, 且腺体排列紊乱, 伴随时间增大而加重, 炎性细胞变多, 腺体和上皮组织坏死, 血管闭塞、黏膜掉落, 在第三天时最严重, 第五天时大鼠体内水肿减轻, 炎性细胞变少; 治疗组的大鼠1、3、5 d时其胃黏膜受损状况均优于对照组, 给药1、3、5 d后治疗组的大鼠PCNA阳性细胞数均高于对照组, TUNEL凋亡细胞数均低于对照组, 差异有统计学意义, 说明脑出血大鼠的急性应激性胃黏膜病变在第三天时最严重, 随着时间推移而逐渐好转, 这可能是由于大鼠脑出血以后血清内NE、E含量较高造成胃黏膜连续缺血, 到第五天时伴随血清NE、E含量降低其缺血状况得到好转, 病变变轻. 脑出血时机体分泌CAs变多造成胃黏膜缺血进而致使胃黏膜攻击因子和防御因子失去平衡, 胃黏膜细胞凋亡变多而增殖变少, 最终造成出现胃黏膜病变[17-20]. 交感神经末梢AT1R兴奋会加速NE释放, 进而加速交感神经节神经传递能力, 机体肾上腺髓质AT1R兴奋会加速分泌CAs. 多种应激反应如炎症反应、固定、孤独和冷水-束缚等都会造成AT1R表达升高, 特别是穹隆下器官与下丘脑室旁核. 相关研究显示, 口服或者皮下注射ARB可以使外周与中枢内AT1R表达量降低, 使外周交感、中枢及HPA轴系统对于应激反应下降, 从而降低机体内ACTH与CRF释放, 最终阻止合成与释放CAs, 保持机体内环境稳固, 对组织器官其保护作用[21-23].
总之, ARB可降低脑出血大鼠血清内NE、E含量, 降低胃黏膜凋亡细胞, 增大增殖细胞, 从而对大鼠急性应激性胃黏膜病变起到治疗作用.
临床脑出血患者一般会并发急性应激性胃黏膜病变, 目前多采用H2受体阻断剂(histamine 2 receptor antagonists, H2RA)及质子泵抑制剂(proton-pump inhibitors, PPI)等进行治疗, 但患者临床疗效不太理想且并发症较多.
相关动物实验显示在冷水-束缚诱使大鼠胃溃疡模型内血管紧张素Ⅱ1型受体拮抗剂(angiotensin Ⅱ AT1 receptor blockers, ARB)可使大鼠胃黏膜血流量增大, 胃黏膜微循环得到改善, 进而对胃黏膜起到保护作用.
分析ARB对脑出血合并急性应激性胃黏膜病变大鼠血清去甲肾上腺素(norepinephrine, NE)、肾上腺素(epinephrine, E)含量及胃黏膜细胞影响.
随机数字表法将本院实验动物中心提供的健康雄性SD大鼠36只分成治疗组(18只)与对照组(18只), 制备脑出血合并急性应激性胃黏膜病变大鼠模型, 免疫组化发检测大鼠胃黏膜内增殖细胞核抗原(proliferative cell nuclei antigen, PCNA)表达状况, 检测大鼠血清去甲肾上腺素(norepinephrine, NE)、肾上腺素(epinephrine, E)含量.
给药1、3、5 d后治疗组大鼠血清E、NE含量均低于对照组, 给药1、3、5 d后治疗组大鼠PCNA阳性细胞数均高于对照组, TUNEL凋亡细胞数均低于对照组, 差异有统计学意义.
ARB可显著降低脑出血合并急性应激性胃黏膜病变大鼠胃黏膜凋亡细胞及血清E、NE含量, 有模型大鼠起到治疗作用.
由于人力及时间等限制, 本文研究显示ARB对脑出血大鼠胃黏膜保护机制可能和ARB与中枢及外周AT1R结合有联系, 在今后还需进一步学习相关理论知识, 并进行实验研究对其具体机制进行更深入探究.
学科分类: 胃肠病学和肝病学
手稿来源地: 浙江省
同行评议报告分类
A级 (优秀): 0
B级 (非常好): B
C级 (良好): C
D级 (一般): D
E级 (差): 0
编辑: 崔丽君 电编:张砚梁
| 2. | 邱 月. 替米沙坦对脑出血急性应激性胃黏膜病变大鼠胃黏膜细胞增殖和凋亡的影响. 中华老年心脑血管病杂志. 2015;17:83-86. [DOI] |
| 3. | Wanderer S, Mrosek J, Gessler F, Seifert V, Konczalla J. Vasomodulatory effects of the angiotensin II type 1 receptor antagonist losartan on experimentally induced cerebral vasospasm after subarachnoid haemorrhage. Acta Neurochir (Wien). 2018;160:277-284. [PubMed] [DOI] |
| 5. | Li J, Luo J, Gu D, Jie F, Pei N, Li A, Chen X, Zhang Y, Du H, Chen B. Adenovirus-Mediated Angiotensin II Type 2 Receptor Overexpression Inhibits Tumor Growth of Prostate Cancer In Vivo. J Cancer. 2016;7:184-191. [PubMed] [DOI] |
| 7. | Bederson JB, Pitts LH, Tsuji M, Nishimura MC, Davis RL, Bartkowski H. Rat middle cerebral artery occlusion: evaluation of the model and development of a neurologic examination. Stroke. 1986;17:472-476. [PubMed] |
| 8. | Guth PH, Aures D, Paulsen G. Topical aspirin plus HCl gastric lesions in the rat. Cytoprotective effect of prostaglandin, cimetidine, and probanthine. Gastroenterology. 1979;76:88-93. [PubMed] |
| 9. | Huang MM, Guo AB, Sun JF, Chen XL, Yin ZY. Angiotensin II promotes the progression of human gastric cancer. Mol Med Rep. 2014;9:1056-1060. [PubMed] [DOI] |
| 11. | Wincewicz D, Braszko JJ. Angiotensin II AT1 receptor blockade by telmisartan reduces impairment of spatial maze performance induced by both acute and chronic stress. J Renin Angiotensin Aldosterone Syst. 2015;16:495-505. [PubMed] [DOI] |
| 13. | Smith MT, Anand P, Rice AS. Selective small molecule angiotensin II type 2 receptor antagonists for neuropathic pain: preclinical and clinical studies. Pain. 2016;157 Suppl 1:S33-S41. [PubMed] [DOI] |
| 14. | 钟 湘平. 早期脑出血后细胞凋亡与p75NTR、TrkA的相关性研究. 中国微侵袭神经外科杂志. 2015;20:231-234. [DOI] |
| 16. | Chow BS, Koulis C, Krishnaswamy P, Steckelings UM, Unger T, Cooper ME, Jandeleit-Dahm KA, Allen TJ. The angiotensin II type 2 receptor agonist Compound 21 is protective in experimental diabetes-associated atherosclerosis. Diabetologia. 2016;59:1778-1790. [PubMed] [DOI] |
| 18. | 张 凡喜. Dickkopf-1在脑出血大鼠神经元凋亡中的作用及机制研究. 中国神经免疫学和神经病学杂志. 2016;23:19-24. [DOI] |
| 22. | 杨 兰. 急性脑出血患者卒中相关性肺炎发病的危险因素分析. 中国实用神经疾病杂志. 2016;19:97-98. [DOI] |