修回日期: 2018-06-30
接受日期: 2018-07-08
在线出版日期: 2018-07-28
检测结肠腺癌中DNA结合/分化抑制蛋白(inhibitor of differentiation/DNA bindings, ID)-1、ID-3和核因子-κB(nuclear factor-kappa B, NF-κB)的表达, 关注其相关性.
本实验以88例结肠腺癌患者作为观察组, 留取患者完整的临床资料及术后标本, 以34例距肿物边缘>5 cm的正常结肠黏膜组织作为对照组. 应用免疫组织化学二步法检测ID-1、ID-3和NF-κB的表达.
二组中ID-1、 ID-3和NF-κB的表达差别有统计学意义, 观察组中ID-1、ID-3和NF-κB表达与病变的增殖指数和浸润深度密切相关, ID-1和ID-3的表达与分化程度相关, NF-κB的表达与转移相关. 观察组中ID-1和ID-3的表达具有正相关性, 其它指标间未见明显相关性.
ID-1、ID-3和NF-κB在结肠腺癌中高表达, 对肿瘤的形成和发展有一定作用. ID-1和ID-3可能具有协同作用.
核心提要: DNA结合/分化抑制蛋白(inhibitor of differen-tiation/DNA bindings, ID)-1、ID-3和核因子-κB在结肠腺癌中高表达, 在细胞水平主要表达到细胞浆中, 其高表达在结肠腺癌病变形成过程中具有促进作用, 在肿瘤进展中的作用更明显, ID-1和ID-3具有协同正向作用, 参与到肿瘤的形成过程中.
引文著录: 李雪锋, 凌凯, 颜晓军. 结肠腺癌中ID-1、ID-3和NF-κB的表达及意义. 世界华人消化杂志 2018; 26(21): 1307-1312
Revised: June 30, 2018
Accepted: July 8, 2018
Published online: July 28, 2018
To detect the expression of inhibitor of differentiation/DNA binding (ID)-1, ID-3, and nuclear factor-kappa B (NF-κB) in colorectal adenocarcinoma and to analyze their clinical significance.
Eighty-eight colorectal adenocarcinoma tissues, 43 colorectal high-grade intraepithelial neoplasia tissues, and 34 normal colonic mucosal tissues (>5 cm away from the edge of tumor) were collected. Expression of ID-1, ID-3, and NF-κB in these tissue samples was detected by immunochemistry.
Expression of ID-1, ID-3, and NF-κB differed significantly between colorectal adenocarcinoma tissues and control tissues. Expression of ID-1, ID-3, and NF-κB was correlated with proliferation index and lesion depth. Expression of ID-1 and ID-3 was correlated with tumor differentiation. Expression of NF-κB was correlated with metastasis. There was a positive correlation between ID-1 and ID-3 expression in colorectal adenocarcinoma tissues.
High expression of ID-1, ID-3 and NF-κB can promote the formation and progression of colorectal adenocarcinoma. ID-1 and ID-3 may have a synergistic effect.
- Citation: Li XF, Ling K, Yan XJ. Significance of expression of ID-1, ID-3, and NF-κB in colorectal adenocarcinoma. Shijie Huaren Xiaohua Zazhi 2018; 26(21): 1307-1312
- URL: https://www.wjgnet.com/1009-3079/full/v26/i21/1307.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v26.i21.1307
结直肠腺癌临床中较为常见, 主要见于中老年人, 病变形成后具有明确的进展性[1]. 核因子-κB(nuclear factor-kappa B, NF-κB)最早于B淋巴细胞的细胞核中提取的蛋白, 其功能具有多样性[2], 近年认为其对恶性肿瘤的形成有促进作用[3]. DNA结合/分化抑制蛋白家族(inhibitor of differentiation/DNA bindings, IDs)是一类对细胞分化具有抑制作用的因子, 可以引起环-螺旋-环转录因子的抑制性作用. ID-1和ID-3是两个最重要的功能因子, 其在肿瘤中的表达作用较强, 对促进细胞的增殖和侵袭的意义明显[4]. 由于结肠腺癌表现为不同分化的肿瘤, 因此ID-1和ID-3的表现可能具有特征性. 本研究重点探讨三者的表达及相关性.
收集2017-03/2017-11在富阳区第二人民医院住院治疗、经病理医师阅片确诊、并行手术根治的患者88例作为观察组, 纳入标准: (1)临床资料完整; (2)符合WHO中的诊断标准; (3)患者或家属签属知情同意书. 排除标准: (1)有肠道手术史; (2)林奇综合征; (3)有肠道疾病手术史; (4)术前有放、化疗史. 其中男45例, 女43例, 年龄37-83岁, 平均年龄56.8岁. 选择上述患者术后标本中距肿物边缘>5 cm的正常结肠黏膜34例作为对照组. 其中男17例, 女17例, 年龄43-76岁, 平均年龄55.0岁. 二组在性别、年龄等因素的比较中无明显差别.
二组均应用免疫组织化学二步法检测ID-1、ID-3和NF-κB的表达. ID-1、 ID-3和NF-κB试剂均为标准的浓缩液, 先进行预实验, 按不同比例进行稀释, 选择染色效果最好的浓度用在正式实验(ID-1为1:200、ID-3为1:100、NF-κB为1:200). 正式实验均由同一技师进行操作, 严格按说明书进行, DAB显色, 减少误差, 并做好质控相关工作.
ID-1、ID-3和NF-κB的阳性表达部位均为细胞质和(或)细胞膜. 着色强度: 无着色0分; 弱为1分, 中等为2分, 强为3分. 选择上皮细胞分布集中区且染色较为明显的区域(热点区)计数, 共5个400倍视野, 取平均值, 以<5%为0分, 5-10%(不包括10%)为1分, 以10%-30%(不包括30%)为2分, 以20%-50%(不包括50%)为3分, 以>50%为4分. 按着色强度和阳性率的评分之和进行评定. 以≤4分为阴性, 以>4分为阳性.
统计学处理 不同组间率的比较采用χ2检验, 并进行相关分析, 均用SAS6.12软件完成. 以P<0.05为差别有统计学意义.
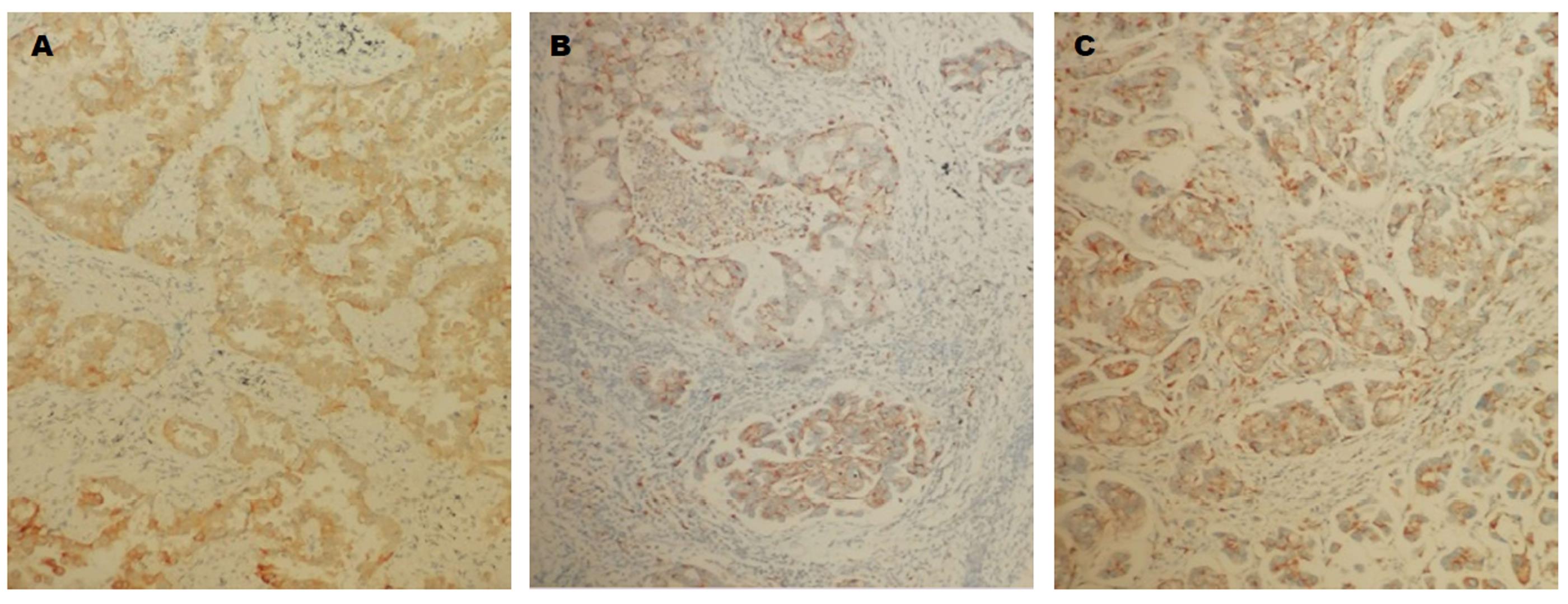
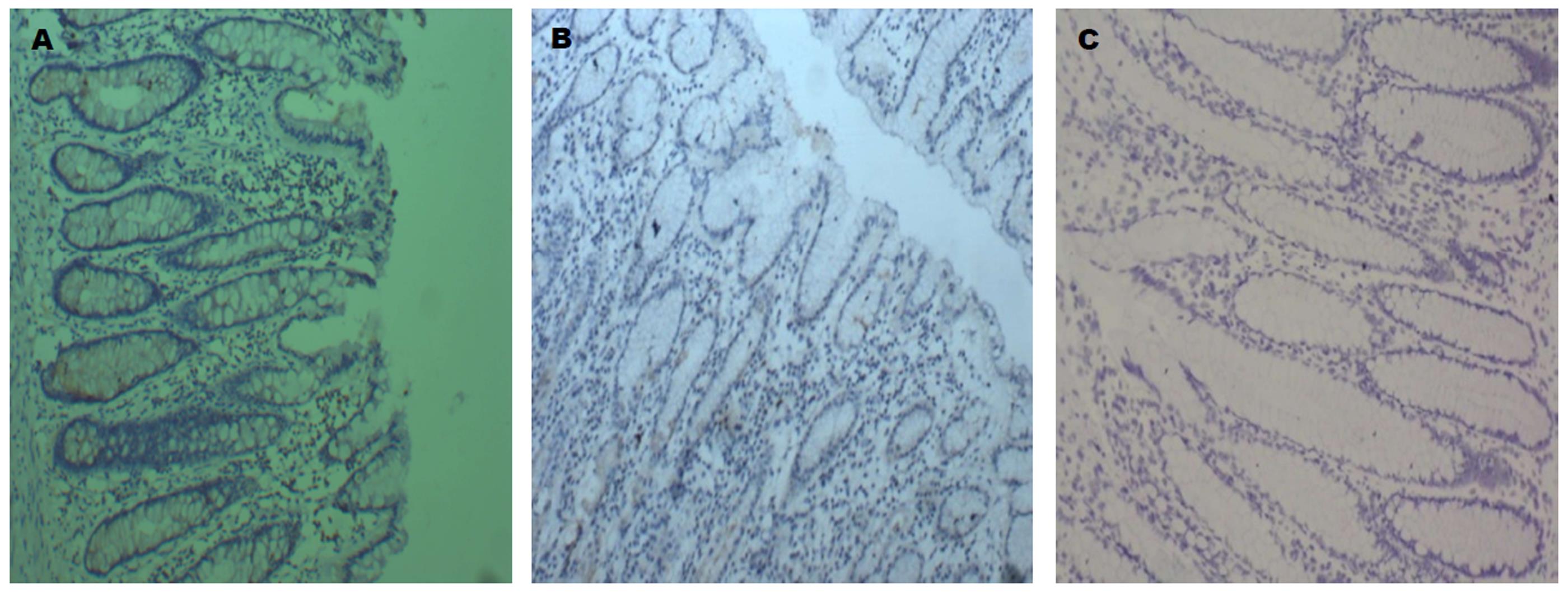
二组中ID-1、ID-3和NF-κB的阳性率差别有统计学意义. 即观察组中三者高表达(表1, 图1和图2).
| 分组 | n | ID-1 | χ2 | P | ID-3 | χ2 | P | NF-κB | χ2 | P | |||
| + | - | + | - | + | - | ||||||||
| 观察组 | 88 | 34 (38.6) | 54 (61.4) | 15.274 | 0.000 | 40 (45.5) | 48 (54.5) | 22.993 | 0.000 | 36 (40.9) | 52 (59.1) | 14.030 | 0.000 |
| 对照组 | 34 | 1 (2.9) | 33 (97.1) | 0 (0) | 34 (100) | 2 (5.9) | 32 (94.1) | ||||||
观察组中ID-1、ID-3和NF-κB表达与病变的增殖指数、浸润深度密切相关, ID-1和ID-3的表达与分化程度相关, NF-κB的表达与转移相关(见表2).
| 临床特征 | n | ID-1 | χ2 | P | ID-3 | χ2 | P | NF-κB | χ2 | P | |||
| + | - | + | - | + | - | ||||||||
| 增殖指数 | 8.722 | 0.003 | 5.194 | 0.023 | 8.209 | 0.004 | |||||||
| <25% | 38 | 8 (21.1) | 30 (78.9) | 12 (31.6) | 26 (68.4) | 9 (23.7) | 29 (76.3) | ||||||
| ≥25% | 50 | 26 (52.0) | 24 (48.0) | 28 (56.0) | 22 (44.0) | 27 (54.0) | 23 (46.0) | ||||||
| 浸润深度 | 9.067 | 0.003 | 7.789 | 0.005 | 4.962 | 0.026 | |||||||
| 未及浆膜 | 69 | 21 (30.4) | 48 (69.6) | 26 (37.7) | 43 (62.3) | 24 (34.8%) | 45 (65.2) | ||||||
| 浆膜及以外 | 19 | 13 (68.4) | 6 (31.6) | 14 (73.7%) | 5 (26.3%) | 12 (63.2%) | 7 (36.8%) | ||||||
| 分化程度 | 6.241 | 0.012 | 5.868 | 0.015 | 2.907 | 0.088 | |||||||
| 高-中 | 58 | 17 (29.3) | 41 (70.7) | 21 (36.2) | 37 (63.8) | 20 (34.5) | 38 (65.5) | ||||||
| 低 | 30 | 17 (56.7) | 13 (43.3) | 19 (63.3) | 11 (36.7) | 16 (53.3) | 14 (46.7) | ||||||
| 转移 | 0.779 | 0.377 | 0.503 | 0.478 | 7.587 | 0.006 | |||||||
| 无 | 69 | 25 (36.2) | 44 (63.8) | 30 (43.5) | 39 (56.5) | 23 (33.3) | 46 (66.7) | ||||||
| 有 | 19 | 9 (47.4) | 10 (52.6) | 10 (52.6) | 9 (47.4) | 13 (68.) | 6 (31.6) | ||||||
相关分析显示观察组中ID-1和ID-3的表达具有正相关性(r = 0.46, P = 0.036), 其它指标间未见明显相关性(P>0.05).
结肠上皮细胞的恶变与上皮内瘤变密切相关, 上皮细胞出现明显异型增生、癌变后, 对肌层和周围组织进行侵犯, 形成浸润性腺癌, 肌层浸润也是病理诊断的重要标准之一[5]. 肿瘤多为高、中分化, 具有腺管样的结构, 呈筛状或迷路样, 部分病变由于异型增生明显, 可以表现为低分化, 并伴有黏液腺癌的形态特征. 由于腺癌常伴有不同程度的分化, 因此与分化相关的蛋白常表达失调. ID-1和ID-3基因是原癌基因的一种, 在正常上皮中的表达低[6], 而在有恶变的上皮细胞中常高表达, 具有癌基因的特征[7,8]. ID-1高表达的细胞具有"永生化"的特征, 表现为阻止细胞分化、促进细胞增殖和调节肿瘤细胞周期的作用[9,10]. ID-1和ID-3过度表达能延缓细胞老化, 使肿瘤细胞呈现旺炽性生长的特点[11]. 近年研究认为显示ID-1高表达可能具有多向作用, 如对脉管生成的促进作用等[12]. 核因子家族与肿瘤的分化也有关, 同时其可以与免疫球蛋白κ轻链嵌合. 研究认为NF-κB在细胞内存在, 各种细胞中的含量不同, 其作为转录调控因子, 对维持机体免疫系统的稳定及阻止炎症形成有重要作用[13,14]. NF-κB二聚体与抑制性蛋白ivκB结合而存在于胞质中, 在细胞经外源性刺激引发改变后, NF-κB活化进入细胞核内发挥作用[15]. 研究显示ivκBa是NF-κB的主要调控因子, 这与其含有RelA的二聚体具有高亲合力, 而与其它Rel的亲合力低[16].
本研究结果显示观察组中ID-1、ID-3和NF-κB高表达, 对肿瘤形成和进展的作用明显. 结果显示观察组中ID-1、ID-3和NF-κB表达与病变的增殖指数相关, 提示三者可以促进肿瘤的生长. ID-1、ID-3和NF-κB与浸润深度相关, 提示三者可以促进肿瘤的局部侵袭性生长, 增加局部的破坏作用. 结果显示ID-1、ID-3与分化程度密切相关, 提示二者参与肿瘤的分化过程. 结果显示NF-κB的表达与转移相关, 提示其参与肿瘤进展, 尤其是转移性的病变. 结果显示ID-1和ID-3的表达具有正相关性, 提示二者具有明显的协同作用, 共同促进肿瘤的形成过程, 与二者的结构同源有关, 也与功能性相似有关. ID-1和ID-3升高时可以调节肿瘤细胞的分化, 而分化作为细胞在发育进程中的表达过程, 也是细胞生长过程中不同时期细胞形态的反映, 二者升高时, 细胞处于幼稚的不同阶段, 肿瘤细胞异型性明显, 与起源组织的差别小, 核染色深, 此类细胞具有高度增殖的特征[17]. ID家族成员具有使细胞永生化的作用, 主要是通过抑制P21WAF1转录水平, 引起pRb磷酸化, 使E2F蛋白摆脱pRb的束缚进而活化, 并引起促进更多的癌基因转录, 使细胞进入S期, 引起肿瘤细胞过度增殖[18]. 也有研究认为ID因子具有影响细胞转录和分化的作用, 主要源于其所含有2个a螺旋, 并被不同序列和长度的连接环所分割, 并通过a螺旋疏水基团间的相互作用, 形成二源体, 是转录调控不可少的[19,20]. HLH蛋白通过与CKI起抑制细胞分化的作用, 主要机制是形成特异性的异二聚体与相应的CKI基因的增强子E-box序列相结合, 激活了CKI类的转录蛋白, 使细胞周期停止于G0/G1期[21,22]. NF-κB在控制细胞生长转化的决定性基因中起重要作用, 其直接作用的基因有MYC基因, 间接作用的基因包括白介素和生长因子等[23,24].
总之, ID-1、ID-3和NF-κB在结直肠腺癌组织中表达明显升高, 对肿瘤的形成和发展有一定的调节作用. ID-1和ID-3可能具有协同作用.
结肠腺癌中蛋白表达是临床研究的热点, 目前关于DNA结合/分化抑制蛋白(inhibitor of differentiation/DNA bindings, ID)-1, ID-3在结直肠腺癌中的研究较少, 其与和核因子-κB(nuclear factor-kappa B, NF-κB)达的关系尚未见报道.
针对ID-1、ID-3和NF-κB在肿瘤中表达的差别, 本实验探讨三者与结肠腺癌的关系.
结肠腺癌中ID-1、ID-3和NF-κB的表达特征、不同临床病理特征中的关系及相关性.
前瞻性研究和对照研究. 主要实验方法为免疫组织化学检测方法.
研究达到预期目标, 主要发现了结肠腺癌中ID-1、ID-3和NF-κB高表达, 明确了ID-1、ID-3和NF-κB表达与病变的增殖指数、浸润深度密切相关, ID-1和ID-3的表达与分化程度相关, NF-κB的表达与转移相关. ID-1和ID-3的表达具有正相关性.
结肠腺癌中三者高表达是促进肿瘤形成和进展的重要因素之一, ID-1和ID-3之间可能具有协同正向作用.
未来可以应用CR等方法检测结肠腺癌中ID-1、ID-3和NF-κBmRNA的表达, 在更深层次探讨三者的关系及临床意义.
学科分类: 胃肠病学和肝病学
手稿来源地: 浙江省
同行评议报告分类
A级 (优秀): 0
B级 (非常好): 0
C级 (良好): C, C, C
D级 (一般): 0
E级 (差): 0
编辑: 崔丽君 电编:张砚梁
| 2. | Qiao Q, Sun C, Han C, Han N, Zhang M, Li G. Endoplasmic reticulum stress pathway PERK-eIF2α confers radioresistance in oropharyngeal carcinoma by activating NF-κB. Cancer Sci. 2017;108:1421-1431. [PubMed] [DOI] |
| 3. | Hu YC, Yi ZJ, Zhou Y, Li PZ, Liu ZJ, Duan SG, Gong JP. Overexpression of RIP140 suppresses the malignant potential of hepatocellular carcinoma by inhibiting NFκBmediated alternative polarization of macrophages. Oncol Rep. 2017;37:2971-2979. [PubMed] [DOI] |
| 5. | Davis MM, Freeman M, Shannon J, Coronado GD, Stange KC, Guise JM, Wheeler SB, Buckley DI. A systematic review of clinic and community intervention to increase fecal testing for colorectal cancer in rural and low-income populations in the United States - How, what and when? BMC Cancer. 2018;18:40. [PubMed] [DOI] |
| 6. | Sharma P, Chinaranagari S, Chaudhary J. Inhibitor of differentiation 4 (ID4) acts as an inhibitor of ID-1, -2 and -3 and promotes basic helix loop helix (bHLH) E47 DNA binding and transcriptional activity. Biochimie. 2015;112:139-150. [PubMed] [DOI] |
| 7. | Yuen HF, Chan YP, Chan KK, Chu YY, Wong ML, Law SY, Srivastava G, Wong YC, Wang X, Chan KW. Id-1 and Id-2 are markers for metastasis and prognosis in oesophageal squamous cell carcinoma. Br J Cancer. 2007;97:1409-1415. [PubMed] [DOI] |
| 8. | Yang J, Velikoff M, Agarwal M, Disayabutr S, Wolters PJ, Kim KK. Overexpression of inhibitor of DNA-binding 2 attenuates pulmonary fibrosis through regulation of c-Abl and Twist. Am J Pathol. 2015;185:1001-1011. [PubMed] [DOI] |
| 9. | Damdinsuren B, Nagano H, Kondo M, Yamamoto H, Hiraoka N, Yamamoto T, Marubashi S, Miyamoto A, Umeshita K, Dono K. Expression of Id proteins in human hepatocellular carcinoma: relevance to tumor dedifferentiation. Int J Oncol. 2005;26:319-327. [PubMed] |
| 10. | Zhao Y, Luo A, Li S, Zhang W, Chen H, Li Y, Ding F, Huang F, Liu Z. Inhibitor of Differentiation/DNA Binding 1 (ID1) Inhibits Etoposide-induced Apoptosis in a c-Jun/c-Fos-dependent Manner. J Biol Chem. 2016;291:6831-6842. [PubMed] [DOI] |
| 11. | Dong Z, Liu S, Zhou C, Sumida T, Hamakawa H, Chen Z, Liu P, Wei F. Overexpression of Id-1 is associated with tumor angiogenesis and poor clinical outcome in oral squamous cell carcinoma. Oral Oncol. 2010;46:154-157. [PubMed] [DOI] |
| 12. | Lee JC, Chen BH, Cho JH, Kim IH, Ahn JH, Park JH, Tae HJ, Cho GS, Yan BC, Kim DW. Changes in the expression of DNA-binding/differentiation protein inhibitors in neurons and glial cells of the gerbil hippocampus following transient global cerebral ischemia. Mol Med Rep. 2015;11:2477-2485. [PubMed] [DOI] |
| 13. | Aurora AB, Biyashev D, Mirochnik Y, Zaichuk TA, Sánchez-Martinez C, Renault MA, Losordo D, Volpert OV. NF-kappaB balances vascular regression and angiogenesis via chromatin remodeling and NFAT displacement. Blood. 2010;116:475-484. [PubMed] [DOI] |
| 14. | Cildir G, Low KC, Tergaonkar V. Noncanonical NF-κB Signaling in Health and Disease. Trends Mol Med. 2016;22:414-429. [PubMed] [DOI] |
| 15. | Wu L, Zhang X, Zhang B, Shi H, Yuan X, Sun Y, Pan Z, Qian H, Xu W. Exosomes derived from gastric cancer cells activate NF-κB pathway in macrophages to promote cancer progression. Tumour Biol. 2016;37:12169-12180. [PubMed] [DOI] |
| 16. | Chen S, Liu W, Wang K, Fan Y, Chen J, Ma J, Wang X, He D, Zeng J, Li L. Tetrandrine inhibits migration and invasion of human renal cell carcinoma by regulating Akt/NF-κB/MMP-9 signaling. PLoS One. 2017;12:e0173725. [PubMed] [DOI] |
| 18. | Higashikawa K, Yoneda S, Tobiume K, Saitoh M, Taki M, Mitani Y, Shigeishi H, Ono S, Kamata N. DeltaNp63alpha-dependent expression of Id-3 distinctively suppresses the invasiveness of human squamous cell carcinoma. Int J Cancer. 2009;124:2837-2844. [PubMed] [DOI] |
| 19. | Yang HY, Liu HL, Ke J, Wu H, Zhu H, Liu JR, Liu LX, Jiang HC. Expression and prognostic value of Id protein family in human breast carcinoma. Oncol Rep. 2010;23:321-328. [PubMed] |
| 20. | Nakatsukasa H, Zhang D, Maruyama T, Chen H, Cui K, Ishikawa M, Deng L, Zanvit P, Tu E, Jin W. The DNA-binding inhibitor Id3 regulates IL-9 production in CD4(+) T cells. Nat Immunol. 2015;16:1077-1084. [PubMed] [DOI] |
| 21. | Zhang X, Ling MT, Wong YC, Wang X. Evidence of a novel antiapoptotic factor: role of inhibitor of differentiation or DNA binding (Id-1) in anticancer drug-induced apoptosis. Cancer Sci. 2007;98:308-314. [PubMed] [DOI] |
| 22. | Qiu J, Wang G, Zheng Y, Hu J, Peng Q, Yin T. Coordination of Id1 and p53 activation by oxidized LDL regulates endothelial cell proliferation and migration. Ann Biomed Eng. 2011;39:2869-2878. [PubMed] [DOI] |
| 23. | Bonavia R, Inda MM, Vandenberg S, Cheng SY, Nagane M, Hadwiger P, Tan P, Sah DW, Cavenee WK, Furnari FB. EGFRvIII promotes glioma angiogenesis and growth through the NF-κB, interleukin-8 pathway. Oncogene. 2012;31:4054-4066. [PubMed] [DOI] |
| 24. | Zhang M, Dong X, Zhang D, Chen X, Zhu X. High expression of Snail and NF-κB predicts poor survival in Chinese hepatocellular carcinoma patients. Oncotarget. 2017;8:4543-4548. [PubMed] [DOI] |