修回日期: 2018-05-18
接受日期: 2018-05-28
在线出版日期: 2018-07-18
探讨嗅觉受体家族2亚家族W成员3(olfactory receptor family 2 subfamily W member, OR2W3)在胰腺癌(pancreatic cancer, PC)组织中的表达及其临床意义.
采用免疫组织化学法检测50例PC组织及癌旁组织石蜡切片中的OR2W3的表达, 分析OR2W3蛋白表达与临床病理因素的关系.
OR2W3蛋白在PC组织中高表达和低表达率分别为78.0%(39/50)和22.0%(11/50), 而在癌旁组织中高表达和低表达率分别为12.0%(6/50)和为88.0%(44/50), 两者差异有统计学意义(χ2 = 44.00, P<0.05). 单因素分析显示OR2W3表达与PC的组织分化程度、临床分期、淋巴结转移密切相关, 该3因素分组间的差异均有统计学意义(均P<0.05).
OR2W3的高表达可能在PC发生、发展中起重要作用.
核心提要: 胰腺癌(pancreatic cancer, PC)是最具侵袭性的恶性肿瘤之一, 其生物学机制中涉及到多个癌基因和抑癌基因的复杂变化. 本研究采用免疫组织化学方法观察到嗅觉受体家族2亚家族W成员3在PC组织中呈高表达, 且表达与肿瘤分化程度、临床病理分期及淋巴结转移有关, 可作为PC预后分析的重要指标, 而其在PC中的生物学功能需进一步研究.
引文著录: 石程剑, 赵炎, 王敏, 田锐, 李旭, 郭兴军, 彭丰, 张航, 冯业晨, 秦仁义. OR2W3在人胰腺癌中的表达及临床意义. 世界华人消化杂志 2018; 26(20): 1229-1233
Revised: May 18, 2018
Accepted: May 28, 2018
Published online: July 18, 2018
To examine the expression of olfactory receptor family 2 subfamily W member 3 (OR2W3) in human pancreatic cancer (PC) and to analyze its clinical significance.
The expression of OR2W3 in 50 paraffin-embedded PC tissues and tumor adjacent tissues was detected by immunohistochemistry, and the relationship between the expression of OR2W3 protein and the clinicopathological factors was analyzed.
The high expression and low expression rates of OR2W3 protein in PC tissues and tumor adjacent tissues were 78% (39/50) vs 12% (6/50) and 22% (11/50) vs 88% (44/50), respectively, and the differences between them were statistically significant (χ2 = 44.00, P < 0.05). Single factor analysis showed that the expression of OR2W3 was closely related to the degree of tissue differentiation, clinical stage, and lymph node metastasis of PC (P < 0.05).
Overexpression of OR2W3 may play an important role in the development and progression of PC.
- Citation: Shi CJ, Zhao Y, Wang M, Tian R, Li X, Guo XJ, Peng F, Zhang H, Feng YC, Qin RY. Clinical significance of expression of olfactory receptor family 2 subfamily W member 3 in human pancreatic cancer. Shijie Huaren Xiaohua Zazhi 2018; 26(20): 1229-1233
- URL: https://www.wjgnet.com/1009-3079/full/v26/i20/1229.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v26.i20.1229
胰腺癌(pancreatic cancer, PC)是最具侵袭性的恶性肿瘤之一, 由于起病隐敝, 多数患者确诊时处于疾病晚期, 失去手术机会, 目前患者总体5年存活率只有8%左右, 而其发生、发展的生物学机制尚未明确[1-7], 其中涉及到多个癌基因和抑癌基因的复杂变化. 嗅觉受体(olfactory receptor family, OR)蛋白主要在嗅觉上皮的神经元表面表达[8], 近来的研究发现OR家族的表达与肿瘤具有密切的关系, 逐渐在肿瘤研究领域中受到关注[9,10]. 本研究采用免疫组织化学方法, 检测50例PC组织及癌旁组织嗅觉受体家族2亚家族W成员3(olfactory receptor family 2 subfamily W member, OR2W3)蛋白的表达, 并对OR2W3蛋白的表达与临床病理特征之间的关系进行分析.
50例PC及相应的癌旁组织石蜡标本来自2016-05/2017-12华中科技大学同济医院临床手术切除标本, 临床和病理诊断均为PC. 选取的癌旁组织距癌灶距离≥1 cm, 术后病理检查未发现癌细胞. 所有患者均行手术治疗, 术前均未进行放、化疗等辅助治疗,男37例, 女13例; 平均年龄54.4(37-74)岁; 按国际抗癌联盟(UICC)制定的TNM分期进行临床病理分期. 本研究由华中科技大学同济医院伦理委员会审核批准, 并且所有标本均征得患者及家属知情同意.
1.2.1 主要试剂及实验方法: OR2W3多克隆抗体购于Sigma公司, 按1: 100比例稀释. 免疫组化染色试剂盒及DAB试剂盒购于美国Santa Cruz公司. 将切片置于65 ℃烤箱中脱蜡后, 放至95 ℃ 1×枸橼酸钠中进行抗原修复60 min, 用免疫组化染色试剂盒中山羊血清封闭标本后, 加入由PBS稀释的BVES 抗体置于4 ℃冰箱过夜, 用PBS替代一抗作阴性对照; 次日依次与二抗、辣根酶标记的链霉卵白素孵育, 用DAB显色、苏木素反染.
1.2.2 免疫组化染色判断: 双盲条件下由2名病理科的医师观察切片, 400倍光镜下随机选择20个视野, 胞浆被黄染者为阳性, 计算出阳性细胞百分率. 染色结果判断采用二级计分法, 参考Luo等[11]的方法, 阳性细胞计数: ≤5%为0分, 6%-25%为1分, 26%-50%为2分, >50%为3分; 染色强度分类: 包膜无黄染为0分, 淡黄色为1分, 棕黄色为2分, 棕色为3分; 两者计分相乘≥4为高表达, ≤3为低表达.
统计学处理 所有数据均采用SPSS17.0统计软件进行分析, OR2W3表达的组间差异比较采用χ2检验或者Fisher确切概率法检验, P<0.05为有统计学意义.
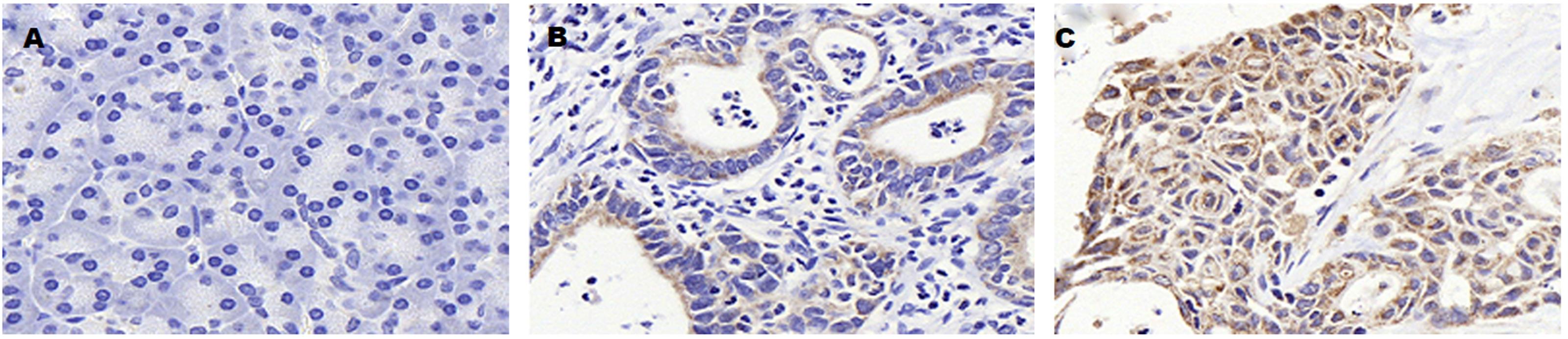
免疫组织化学结果显示, OR2W3蛋白阳性主要定位于细胞胞浆, 少量定位于细胞核上, 染色呈棕黄色(图1); OR2W3蛋白在PC组织中呈高表达(图1B和C), 而在癌旁胰腺组织中OR2W3蛋白呈低表达(图1A). 50例PC组织中OR2W3蛋白高表达39例(78.0%), 低表达11例(22.0%), 癌旁胰腺组织中OR2W3蛋白高表达6例(12.0%), 低表达44例(88.0%); OR2W3蛋白在PC组织和癌旁胰腺组织之间表达差异有统计学意义(P<0.05)(表1).
| 分组 | OR2W3的表达情况 | χ2 | P | |
| 高表达 | 低表达 | |||
| 胰腺癌组织 | 39 (78) | 11 (22) | 40.00 | 0.0001 |
| 癌旁正常组织 | 6 (12) | 44 (88) | ||
OR2W3在高分化PC组织和低分化PC组织中表达强度存在差异性, 在高分化和低分化PC组织中表达强度依次增加; TNM分期中, Ⅲ, Ⅳ期OR2W3阳性表达强度明显强于Ⅰ, Ⅱ期的阳性表达强度; 有淋巴结转移组的阳性表达强度明显高于无淋巴结转移组, 差异均有统计学意义(P<0.05)(表2), 说明OR2W3表达与PC的肿瘤分化程度、临床病理分期及淋巴结转移有关.
| 临床病理因素 | n | OR2W3的表达情况 | χ2 | P | |
| 高表达 | 低表达 | ||||
| 年龄(岁) | |||||
| <50 | 39 | 31 | 8 | 0.228 | 0.633 |
| ≥50 | 11 | 8 | 3 | ||
| 性别 | |||||
| 男 | 32 | 25 | 7 | 0.000 | 0.977 |
| 女 | 18 | 14 | 4 | ||
| 分化程度 | |||||
| 高分化 | 9 | 4 | 5 | ||
| 中分化 | 17 | 14 | 3 | 7.355 | 0.025 |
| 低分化 | 24 | 21 | 3 | ||
| TNM分期 | |||||
| Ⅰ-Ⅱ | 31 | 28 | 3 | 7.219 | 0.007 |
| Ⅲ-Ⅳ | 19 | 11 | 8 | ||
| 淋巴结转移 | |||||
| 有 | 32 | 28 | 4 | 4.675 | 0.031 |
| 无 | 18 | 11 | 7 | ||
OR基因超家族是Buck和Axel[12]于1991年首先在褐家鼠中发现并阐明其在嗅觉系统中的作用, 是由嗅觉细胞表达的一种蛋白质, 属于G蛋白偶联受体超家族[13]. 所有的嗅觉受体结构都相似, 都具有7个长度为19-26个氨基酸疏水区即7次α-螺旋跨膜蛋白形成的结构域, 总长度约为300-350个氨基酸[14]. 氨基酸链的N端在膜外侧, C端在膜内侧, 这样在细胞膜的两侧各形成3个环. OR主要在嗅觉上皮的神经元表面表达[8], 但有研究发现在前列腺[15]、肾小管上皮细胞[16]甚至原始胚胎细胞[17]上也有表达, 这表明OR的功能并不局限于嗅觉.
近来的研究发现, OR家族的表达与肿瘤具有密切的关系. 2016年Cui等[9]报道在对70例小肠神经内分泌肿瘤的研究中, 发现OR51E1在原发肿瘤和肠系膜、肝脏的转移灶中均有明显的表达, 并发现其亚细胞定位表达同囊泡单胺转运体1(SLC18A1)表达具有相关性, 被认为可作为小肠神经内分泌肿瘤的潜在治疗靶点. 2016年, Guo等[10]研究报道长链非编码OR3A4基因在胃癌组织中的表达明显高于正常胃组织, 并在胃癌细胞中应用基因过表达和基因沉默实验发现, OR3A4具有促进胃癌细胞生长、肿瘤形成和远处转移的功能; 更有研究发现OR7C1是结肠癌干细胞的一个新的标志物, 体外研究发现OR7C1+结肠癌细胞较OR7C1-细胞具有更强的增殖能力和形成肿瘤细胞球的能力, 表明OR7C1可作为结肠癌的一个潜在的治疗靶点[18].
PC是最具侵袭性的恶性肿瘤之一, 完整的手术切除是这种恶性肿瘤的唯一的潜在可治愈性治疗方法, 术后5年存活率可达到20%左右, 然而由于PC起病隐敝, 多数患者确诊时已经失去手术机会. 尽管近年来治疗方法不断得到改进, 但总体5年存活率仍徘徊在8%左右[1,2], 因此, 新的辅助治疗及治疗靶点仍需进一步研究. 目前OR家族蛋白在PC中的作用尚未见报道. 本研究用免疫组织化学法检测50例PC及相应的癌旁组织中OR2W3的表达, 观察到OR2W3在PC组织中呈高表达, 且表达与肿瘤分化程度、临床病理分期及淋巴结转移有关, 可作为PC预后分析的重要指标.
OR2W在PC中到底发挥怎样的生物学功能尚不清楚. 有研究[18]发现 OR7C1是结肠癌干细胞的一个新的标志物. 目前认为, 肿瘤干细胞是肿瘤发生、发展、治疗后复发和转移的根源[19-24], 并在多种肿瘤中鉴定并进行研究[25-30]. 因此笔者猜测OR2W3可能通过PC干细胞发挥作用, 而这种猜测须待进一步研究证实.
胰腺癌(pancreatic cancer, PC)是最具侵袭性的恶性肿瘤之一, 目前患者总体5年存活率只有8%左右, 而其发生、发展的生物学机制中涉及到多个癌基因和抑癌基因的复杂变化. 近来的研究发现嗅觉受体(olfactory receptor family, OR)家族的表达与肿瘤具有密切的关系, 逐渐在肿瘤研究领域中受到关注.
目前OR家族蛋白在PC中的作用尚未见报道, 本研究用免疫组织化学法检测癌旁组织嗅觉受体家族2亚家族W成员3(olfactory receptor family 2 subfamily W member, OR2W3)在PC及相应的癌旁组织中的表达差异, 初步明确OR2W3在PC中的表达特征, 为进一步研究其在PC中的功能奠定基础.
研究分析OR2W表达与临床病理的关系, 为进一步研究其机制提供了临床病理学基础.
检测分析50例PC及相应的癌旁组织中OR2W3的表达, 并分析其表达与肿瘤分化程度、临床病理分期及淋巴结转移的相关性.
本研究发现, OR2W3在PC组织中呈高表达, 且表达与肿瘤分化程度、临床病理分期及淋巴结转移有关, 可作为PC预后分析的重要指标.
OR2W3在PC组织中呈高表达; 有研究发现 OR7C1是结肠癌干细胞的一个新的标志物. 目前认为, 肿瘤干细胞是肿瘤发生、发展、治疗后复发和转移的根源. 因此笔者猜测OR2W3可能通过PC干细胞发挥作用.
本研究仅为OR2W3在PC中的表达特征, 且样本量偏小; 下一步我们将进一步扩大样本量, 并进一步通过干预OR2W3表达, 研究其在胰腺中的功能.
学科分类: 胃肠病学和肝病学
手稿来源地: 湖北省
同行评议报告分类
A级 (优秀): 0
B级 (非常好): B
C级 (良好): C, C, C
D级 (一般): 0
E级 (差): 0
编辑: 马亚娟 电编:张砚梁
| 1. | Rahib L, Smith BD, Aizenberg R, Rosenzweig AB, Fleshman JM, Matrisian LM. Projecting cancer incidence and deaths to 2030: the unexpected burden of thyroid, liver, and pancreas cancers in the United States. Cancer Res. 2014;74:2913-2921. [PubMed] [DOI] |
| 2. | Ducreux M, Cuhna AS, Caramella C, Hollebecque A, Burtin P, Goéré D, Seufferlein T, Haustermans K, Van Laethem JL, Conroy T. Cancer of the pancreas: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol. 2015;26 Suppl 5:v56-v68. [PubMed] [DOI] |
| 3. | Siegel RL, Miller KD, Jemal A. Cancer Statistics, 2017. CA Cancer J Clin. 2017;67:7-30. [PubMed] [DOI] |
| 4. | Kamisawa T, Wood LD, Itoi T, Takaori K. Pancreatic cancer. Lancet. 2016;388:73-85. [PubMed] [DOI] |
| 5. | Lin QJ, Yang F, Jin C, Fu DL. Current status and progress of pancreatic cancer in China. World J Gastroenterol. 2015;21:7988-8003. [PubMed] [DOI] |
| 8. | Young JM, Trask BJ. The sense of smell: genomics of vertebrate odorant receptors. Hum Mol Genet. 2002;11:1153-1160. [PubMed] |
| 9. | Cui T, Tsolakis AV, Li SC, Cunningham JL, Lind T, Öberg K, Giandomenico V. Olfactory receptor 51E1 protein as a potential novel tissue biomarker for small intestine neuroendocrine carcinomas. Eur J Endocrinol. 2013;168:253-261. [PubMed] [DOI] |
| 10. | Guo X, Yang Z, Zhi Q, Wang D, Guo L, Li G, Miao R, Shi Y, Kuang Y. Long noncoding RNA OR3A4 promotes metastasis and tumorigenicity in gastric cancer. Oncotarget. 2016;7:30276-30294. [PubMed] [DOI] |
| 11. | Luo D, Huang H, Lu ML, Zhao GF, Chang J, Zheng MY, Wang Y. Abnormal expression of adhesion protein Bves is associated with gastric cancer progression and poor survival. Pathol Oncol Res. 2012;18:491-497. [PubMed] [DOI] |
| 12. | Buck L, Axel R. A novel multigene family may encode odorant receptors: a molecular basis for odor recognition. Cell. 1991;65:175-187. [PubMed] |
| 13. | Gaillard I, Rouquier S, Chavanieu A, Mollard P, Giorgi D. Amino-acid changes acquired during evolution by olfactory receptor 912-93 modify the specificity of odorant recognition. Hum Mol Genet. 2004;13:771-780. [PubMed] [DOI] |
| 14. | Floriano WB, Vaidehi N, Goddard WA 3rd. Making sense of olfaction through predictions of the 3-D structure and function of olfactory receptors. Chem Senses. 2004;29:269-290. [PubMed] [DOI] |
| 15. | Yuan TT, Toy P, McClary JA, Lin RJ, Miyamoto NG, Kretschmer PJ. Cloning and genetic characterization of an evolutionarily conserved human olfactory receptor that is differentially expressed across species. Gene. 2001;278:41-51. [PubMed] |
| 16. | Kalbe B, Schlimm M, Wojcik S, Philippou S, Maßberg D, Jansen F, Scholz P, Luebbert H, Ubrig B, Osterloh S. Olfactory signaling components and olfactory receptors are expressed in tubule cells of the human kidney. Arch Biochem Biophys. 2016;610:8-15. [PubMed] [DOI] |
| 17. | Goto T, Salpekar A, Monk M. Expression of a testis-specific member of the olfactory receptor gene family in human primordial germ cells. Mol Hum Reprod. 2001;7:553-558. [PubMed] |
| 18. | Morita R, Hirohashi Y, Torigoe T, Ito-Inoda S, Takahashi A, Mariya T, Asanuma H, Tamura Y, Tsukahara T, Kanaseki T. Olfactory Receptor Family 7 Subfamily C Member 1 Is a Novel Marker of Colon Cancer-Initiating Cells and Is a Potent Target of Immunotherapy. Clin Cancer Res. 2016;22:3298-3309. [PubMed] [DOI] |
| 19. | Reya T, Morrison SJ, Clarke MF, Weissman IL. Stem cells, cancer, and cancer stem cells. Nature. 2001;414:105-111. [PubMed] [DOI] |
| 20. | Scadden DT. Cancer stem cells refined. Nat Immunol. 2004;5:701-703. [PubMed] [DOI] |
| 21. | Wicha MS, Liu S, Dontu G. Cancer stem cells: an old idea--a paradigm shift. Cancer Res. 2006;66:1883-90; discussion 1895-6. [PubMed] [DOI] |
| 22. | O'Brien CA, Kreso A, Dick JE. Cancer stem cells in solid tumors: an overview. Semin Radiat Oncol. 2009;19:71-77. [PubMed] [DOI] |
| 23. | Islam F, Gopalan V, Lam AK. Identification of Cancer Stem Cells in Esophageal Adenocarcinoma. Methods Mol Biol. 2018;1756:165-176. [PubMed] [DOI] |
| 24. | Liu Y, Gao X, Wang S, Yuan X, Pang Y, Chen J, Wang J. Cancer Stem Cells are Regulated by STAT3 Signalling in Wilms Tumour. J Cancer. 2018;9:1486-1499. [PubMed] [DOI] |
| 25. | Benoit YD. Identification of Novel Molecules Targeting Cancer Stem Cells. Methods Mol Biol. 2018;1765:333-347. [PubMed] [DOI] |
| 26. | Singh SK, Clarke ID, Terasaki M, Bonn VE, Hawkins C, Squire J, Dirks PB. Identification of a cancer stem cell in human brain tumors. Cancer Res. 2003;63:5821-5828. [PubMed] |
| 27. | Collins AT, Berry PA, Hyde C, Stower MJ, Maitland NJ. Prospective identification of tumorigenic prostate cancer stem cells. Cancer Res. 2005;65:10946-10951. [PubMed] [DOI] |
| 28. | Li C, Heidt DG, Dalerba P, Burant CF, Zhang L, Adsay V, Wicha M, Clarke MF, Simeone DM. Identification of pancreatic cancer stem cells. Cancer Res. 2007;67:1030-1037. [PubMed] [DOI] |
| 29. | Zhang S, Balch C, Chan MW, Lai HC, Matei D, Schilder JM, Yan PS, Huang TH, Nephew KP. Identification and characterization of ovarian cancer-initiating cells from primary human tumors. Cancer Res. 2008;68:4311-4320. [PubMed] [DOI] |
| 30. | Suvà ML, Riggi N, Stehle JC, Baumer K, Tercier S, Joseph JM, Suvà D, Clément V, Provero P, Cironi L. Identification of cancer stem cells in Ewing's sarcoma. Cancer Res. 2009;69:1776-1781. [PubMed] [DOI] |