修回日期: 2017-12-09
接受日期: 2017-12-16
在线出版日期: 2018-01-18
探讨PRR11蛋白在胃癌(gastric cancer, GC)中的表达, 分析其表达异常与GC进展和预后的关系.
应用免疫组织化学(immunohistochemistry, IHC)法检测PRR11在436例GC组织中的表达, 并用免疫印迹(Western blot)比较GC和正常胃黏膜组织中PRR11的表达, 统计学分析其与临床病理参数之间的关系.
Western blot定量分析中PRR11在GC组织中的表达显著高于正常胃黏膜组织; 同时IHC显示PRR11在GC中呈特异性表达, 其阳性定位于胞浆和胞膜, GC组织阳性表达率为41.8%(182/436), 而在正常胃黏膜组织中不表达或微弱表达. PRR11的过表达与GC的分化程度(P<0.01)、浸润深度(P = 0.03)、TNM分期(P<0.01)、淋巴结转移(P<0.01)和远处转移(P = 0.05)密切相关.
PRR11在GC中过表达, 过表达的PRR11与GC的发生、进展以及预后密切相关, PRR11可作为判断GC患者预后的重要指标.
核心提要: PRR11是一个新的肿瘤相关基因, 目前尚未出现其在胃癌(gastric cancer, GC)中的大样本量研究, 其对GC的预后价值是未被探索过的新领域. 本文探讨PRR11在436例GC中的表达及其与GC进展和预后相关的临床病理参数的关系, 研究PRR11在GC中预后意义.
引文著录: 叶美华, 赵仲生, 茹国庆, 何向蕾. PRR11蛋白的表达及其与胃癌进展和预后的关系. 世界华人消化杂志 2018; 26(2): 80-86
Revised: December 9, 2017
Accepted: December 16, 2017
Published online: January 18, 2018
To detect the expression of PRR11 in gastric cancer (GC) and to analyze its relationship with GC progression and prognosis.
Expression of PRR11 in 436 GC samples was detected by immunohistochemistry (IHC), and Western blot was used to compare PRR11 expression between GC samples and normal gastric mucosal samples. The correlation of PRR11 expression with clinicopathological parameters was analyzed.
Western blot analysis showed that the expression of PRR11 in GC samples was obviously higher than that in normal gastric mucosal samples. IHC results showed that PRR11 was specifically expressed in GC and located in the cytoplasm and membrane; PRR11 was overexpressed in 182 (41.8%) of GC samples, but none or weak expression was detected in the normal gastric mucosa. PRR11 overexpression was correlated significantly with clinicopathologic features such as tumor differentiation (P < 0.01), tumor invasion (P = 0.03), TNM stage (P < 0.01), lymph node metastasis (P < 0.01), and distant metastasis (P < 0.01).
PRR11 is overexpressed in GC, which is associated with the occurrence, progression, and prognosis of GC. These data indicate that PRR11 can be used as an important biomarker to estimate the progression and prognosis of GC.
- Citation: Ye MH, Zhao ZS, Ru GQ, He XL. Expression of PRR11 protein in gastric cancer: Correlation with disease progression and prognosis. Shijie Huaren Xiaohua Zazhi 2018; 26(2): 80-86
- URL: https://www.wjgnet.com/1009-3079/full/v26/i2/80.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v26.i2.80
胃癌(gastric cancer, GC)是我国发病率和死亡率高居不下的肿瘤疾病, 其5年生存率仅为20%-30%[1]. 在GC的发生与发展中癌基因和抑癌基因的表达失调起着关键的作用, 寻找并鉴定新的GC相关基因的表达产物对于阐明其发生发展的分子机制、寻找特异性及敏感性俱佳的GC进展和预后的分子标记、开发新的肿瘤分子诊疗方法、降低GC的发病率和死亡率至关重要. PRR11(proline-rich 11)基因是近年来被发现的位于染色体17q22的新的肿瘤相关基因[2,3], 该基因表达的精确调节在细胞周期、细胞增殖、细胞凋亡和细胞癌变等生物学进程中起着非常重要的作用, 同时其表达的蛋白可对肿瘤细胞的转移进行预测[4-7]. 有学者[8]发现其在肺癌细胞系中高表达, 且与疾病进展密切相关, 在环境因素诱发的肺癌过程中也可能发挥作用. 但目前在GC中尚未见大样本量的报道. 本研究探讨PRR11在大样本量GC中的表达情况, 以及PRR11表达异常与GC进展和预后的相关性.
浙江省人民医院诊断为GC的手术切除组织标本, 制成福尔马林固定石蜡包埋组织样本. 所有病例由病理诊断确认且术前未经任何治疗. 患者组成: 男311例, 女125例; 肿瘤部位: 胃窦218例, 贲门55例, 胃体163例; 肿瘤<5 cm 256例, ≥5 cm 180例; 组织学类型: 管状腺癌326例, 印戒细胞癌65例, 黏液腺癌29例, 乳头状腺癌16例; 在Lauren分型中, 肠型223例, 弥漫型213例; 分化程度: 高分化腺癌13例, 中分化腺癌128例, 低分化腺癌293例; TNM分期: Ⅰ期90例, Ⅱ期104例, Ⅲ期173例, Ⅳ期69例; 166例无淋巴结转移, 270例有淋巴结转移; 375例无远处转移, 6l例有远处转移. 同时取92例距离癌边缘5 cm以上的正常胃黏膜组织作对照. EDTA缓冲(北京中杉金桥生物技术有限公司); PRR11单克隆抗体(兔抗, 美国Sigma公司); 辣根过氧化物酶(horseradish peroxidase, HRP)标记的二抗(羊抗兔, 北京中杉金桥生物技术有限公司).
1.2.1 蛋白提取和Western印迹杂交: 取出其中80对冰冻过的新鲜肿瘤组织样本和相应的正常胃黏膜组织样本, 经过组织匀浆后加入蛋白裂解液, 置于冰上裂解10 min, 转移至1.5 mL离心管, 低温离心0.5 h并吸取上清液, 用BCA法对蛋白进行定量. SDS-PAGE胶分离蛋白, 电转移至硝酸纤维素膜后封闭1 h; 用TBST缓冲液(0.01 mol/L Tris-HCl, pH 8.0; 0.05%Tween-20)以1:100稀释PRR11抗体(兔抗, 美国Sigma公司), 4 ℃反应过夜; 分3次TBST洗膜, 以TBST稀释HRP标记的二抗于室温反应1 h, 膜于化学发光检测试剂下反应2 min, 暗室中用X胶片感光、显影、定影.
1.2.2 免疫组织化学染色: 采用Envison两步染色法. 病理切片经二甲苯脱蜡和各级浓度乙醇水化后, 取一定量pH 8.0 EDTA缓冲采用高压隔水修复法进行抗原修复, 待切片冷却后将其浸泡在3%H2O2溶液中封闭内源性过氧化物酶. 根据组织大小滴加PRR11单克隆抗体, 孵育后加HRP标记的二抗孵育30-40 min. PBS缓冲液冲洗后DAB显色, 苏木素复染3 min, 梯度乙醇脱水, 封片晾干后镜下观察.
1.2.3 结果判定: 根据染色强度和细胞着色百分比进行判定: 基本不着色为0分, 淡着色为1分, 适中着色为2分, 深着色为3分; 细胞着色占计数细胞的百分比≤5%为0分, 6%-25%为1分, 26%-50%为2分, ≥51%为3分. 将其染色强度与细胞着色百分比得分相乘, 0-1分为阴性(-), 2-3分为弱阳性(+), 4-6分为中等阳性(++), >6分为强阳性(+++).
统计学处理 采用SPSS19.0统计软件进行数据分析. 以χ2检验研究PRR11的表达与各个临床病理参数之间的关系, P<0.05为差异具有统计学意义.
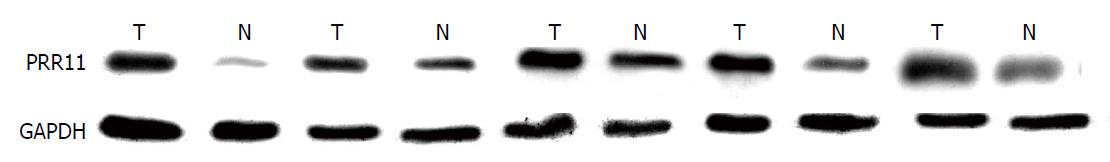
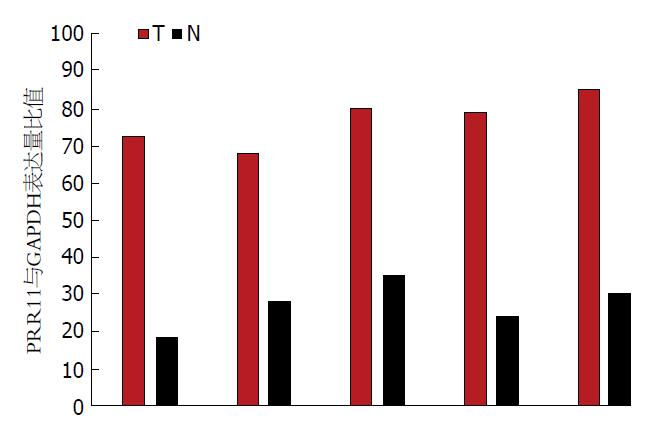
Western blot条带可见, GC组织中PRR11的表达明显高于正常组织(图1). 且根据Western blot定量分析比较也可见, PRR11在癌组织的蛋白表达量高于正常胃黏膜组织(图2).
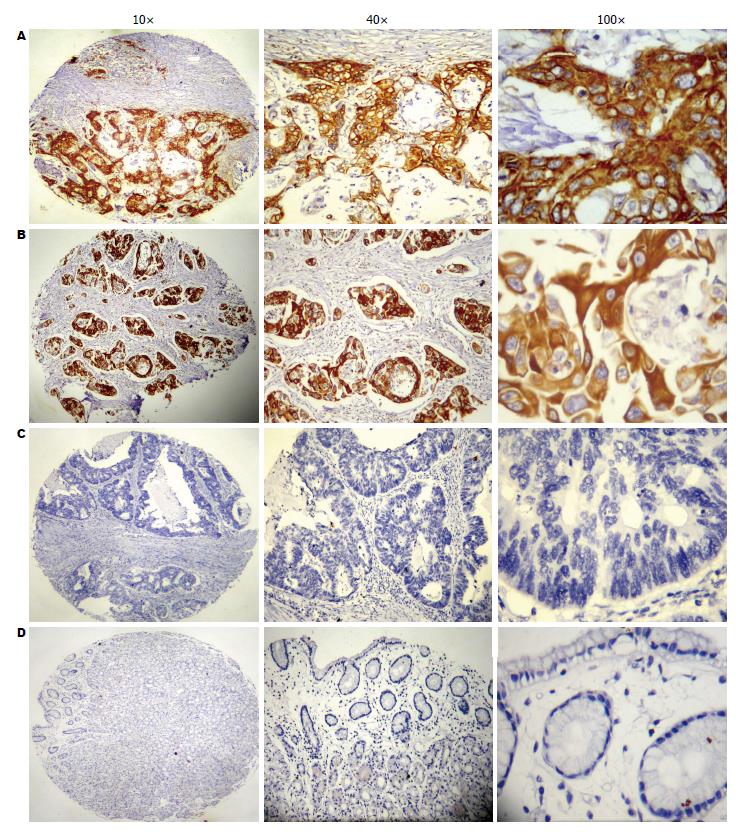
PRR11蛋白在GC组织中具有很好的特异性表达, 染色后背景清晰, 并且只在肿瘤细胞中有表达, 在平滑肌、血管内皮及纤维结缔组织等间质中均无表达. PRR11蛋白阳性染色为黄色或棕褐黄色, 定位于细胞膜和/或细胞浆. 正常胃黏膜组织不着色(图3D), GC中呈片状、弥漫分布(图3A, B). 在436例GC组织中, 共有182例为IHC阳性, PRR11的阳性表达率为41.8%(182/436).
研究了PRR11表达与常见的临床病理参数之间的关联, 例如性别、肿瘤大小、组织学类型、分化程度、浸润深度以及转移情况等等, 发现PRR11表达与分化程度(P<0.01)、浸润深度(P = 0.03)、TNM分期(P<0.01)、淋巴结转移(P<0.01)以及远处转移(P = 0.05). 以上几个临床病理参数具有极大的相关性, 而与性别、肿瘤大小、Lauren分型和组织学类型并无明显相关性(P>0.05, 表1).
| 临床病理参数 | 数量 | PRR11 [n (%)] | P值 | |
| 未表达 | 表达 | |||
| 性别 | 0.345 | |||
| 男 | 224 | 140 (62.5) | 84 (37.5) | |
| 女 | 91 | 62 (68.1) | 29 (31.9) | |
| 肿瘤大小 (cm) | 0.540 | |||
| ≤5 | 188 | 118 (46.3) | 70 (53.7) | |
| >5 | 127 | 84 (62.8) | 43 (33.9) | |
| Lauren分型 | 0.298 | |||
| 肠型 | 185 | 123 (66.5) | 62 (33.5) | |
| 弥漫型 | 130 | 79 (60.8) | 51 (39.2) | |
| 分化程度 | <0.01 | |||
| 高分化 | 13 | 13 (100) | 0 (0) | |
| 中分化 | 126 | 99 (78.6) | 27 (21.4) | |
| 低分化 | 176 | 90 (51.1) | 86 (48.9) | |
| 组织学类型 | 0.922 | |||
| 乳头状腺癌 | 14 | 10 (71.4) | 4 (28.6) | |
| 管状腺癌 | 230 | 146 (63.4) | 84 (36.5) | |
| 黏液腺癌 | 21 | 13 (61.9) | 8 (38.1) | |
| 印戒细胞癌 | 50 | 33 (66.0) | 17 (34.0) | |
| 浸润深度 | 0.03 | |||
| T1 | 40 | 38 (95.0) | 2 (5.0) | |
| T2 | 78 | 66 (84.6) | 12 (15.4) | |
| T3 | 175 | 91 (52.0) | 84 (48.0) | |
| T4 | 22 | 7 (31.8) | 15 (68.2) | |
| TNM分期 | <0.01 | |||
| Ⅰ | 65 | 63 (96.9) | 2 (3.1) | |
| Ⅱ | 85 | 61 (71.8) | 24 (28.2) | |
| Ⅲ | 106 | 57 (53.8) | 49 (46.2) | |
| Ⅳ | 59 | 21 (35.6) | 38 (64.4) | |
| 淋巴结转移 | <0.01 | |||
| 无 | 119 | 94 (78.9) | 25 (21.1) | |
| 有 | 196 | 108 (55.1) | 88 (44.9) | |
| 远处转移 | 0.05 | |||
| 无 | 271 | 181 (66.8) | 90 (33.2) | |
| 有 | 44 | 21 (47.7) | 23 (52.3) | |
我国是GC的高发国家, 全世界大约有35%的GC病例发生在中国. 我国每年死于GC的患者超过26万, 约占全部肿瘤死亡病例的20%. 虽然早期诊断率的提高和治疗手段的增进使GC患者的治疗效果和生活质量有了显著改善, 但对于进展期GC患者其生存率仍未见显著提高. 因此, 开展GC基础理论和应用研究对于阐明其发生发展的机制、GC防治、降低其发病率死亡率等都具有重要的理论和现实意义. GC的发生与发展是一个多因素作用、多基因参与的复杂过程, 其中癌基因和抑癌基因的表达失调引发的细胞生长失控对于GC的发生发展起了不可或缺的作用. 因此, 寻找并鉴定新的GC相关基因迫在眉睫, 这对于阐明GC的分子机制、寻找特异性及敏感性俱佳的GC进展和预后的分子标记、开发新的肿瘤分子诊疗方法、降低GC的发病率和死亡率非常重要.
PRR11是2000年被发现, 2002年被美国国立健康研究院哺乳动物基因收集项目组命名的, 一个位于染色体17q22的编码360个氨基酸的肿瘤热点扩增区基因[9]. 其拷贝数在多种肿瘤上显著增加且其扩增和多种肿瘤的发展、恶化和预后密切相关, 很可能是一个新的肿瘤相关基因[10-15]. 其编码的PRR11蛋白富含脯氨酸, 该蛋白蛋白可能推动细胞的S期向G2/M期转换, 致使细胞增殖异常, 对细胞周期呈正相关性调节[16]. PRR11蛋白表达异常可能会导致细胞周期调控发生紊乱, 致使肿瘤的发生、发展[17]. Weinmann等[18]发现, PRR11蛋白可以和E2FI、E2F4等控制肿瘤发生过程的转录因子相结合, 预测PRR11可能是一个新的肿瘤相关基因. Spira等[19]在研究吸烟肺癌患者基因表达时观察到PRR11的表达有所改变. Ji等[2]基于DNA芯片技术以及生物信息学分析, 在肿瘤和正常组织芯片表达数据差异分析中发现, PRR11是一个差异表达基因, 并用实验证明PRR11依赖于细胞周期呈阶段性表达, 敲除PRR11基因会引起S期阻滞、生长延迟. 半定量RT-PCR分析表明该基因在肺癌组织中比正常组织表达升高, 并与肺癌患者预后相关. 这些结果说明, PRR11在精确调节细胞周期、细胞增殖和肿瘤发生进程中起着重要作用. Chen等[20]发现在肝细胞肝癌中, PRR11呈现高表达, 与淋巴结转移和CA199水平相关, 可作为一个肝细胞肝癌的独立预后因素. 国内有研究组进一步探究了PRR11在肺癌中的意义以及相关分子机制[21,22]. 与此同时Zhou等[23]发现PRR11参与了乳腺癌的上皮间质转化过程. 目前国内外尚无对此基因的进一步研究报道, 其在GC中的研究是一个从未被探索过的全新领域, 也未出现其在GC中的大样本量研究.
本实验大规模的在GC中检测了PRR11的表达情况, 并分析了PRR11表达与GC进展和预后的关系. 在IHC实验中发现, GC组织的PRR11表达水平显著高于正常胃黏膜组织, 表达率为41.8%, 而癌旁黏膜上皮中PRR11基本不表达. 在蛋白Western blot实验中同样发现, PRR11在GC组织中的相对表达率明显高于正常胃黏膜组织. 二者充分提示PRR11在GC中过表达.
肿瘤细胞通常以去分化以为明显特点, 而组织分化越差表明其恶性程度越高. 该研究结果显示, PRR11在低分化GC中的表达率显著高于中分化和高分化的GC(P<0.01). TNM分期反映了GC的进展程度, 对于判断预后和后期治疗有重要指导意义, 本研究发现PRR11表达与TNM分期显著相关(P<0.01), 随疾病进展, Ⅲ期(46.2%)和Ⅳ期(64.4%)中PRR11表达率高于Ⅰ期(3.1%)和Ⅱ期(28.2%), 且P<0.01. 此外, PRR11的过表达还与浸润深度(P = 0.03)、淋巴结转移(P<0.01)和远处转移(P = 0.05)等预示疾病预后的因素相关. 上述数据表明, PRR11蛋白在GC组织中高表达, 其异常活化参与了GC的发生和发展. 推测PRR11可能通过调控细胞周期及进展, 参与调节各靶基因转录而发挥其对蛋白间的相互作用, 从而诱导GC细胞的增殖、侵袭与迁移, 其表达活性改变引起的细胞增殖失控与迁移能力增强可能与GC的浸润、进展和转移以及预后有关[24]. 提示PRR11可作为预测GC进展和预后的有效标记, 且PRR11过表达于晚期GC患者以及细胞恶性生物学行为较高的GC患者, 该研究也提示PRR11可作为判断GC预后的重要指标. 但其具体作用机制还有待于进一步揭示, 未来有潜力作为有效的分子靶点用于寻找新的GC诊治方法并用于开发新的抗肿瘤药物, 发挥重要的医疗、经济以及社会价值[25].
总之, PRR11是一个新发现的肿瘤相关基因, 其过表达于GC组织中, PRR11可能参与了细胞周期和细胞增殖、凋亡、迁移、侵袭等过程, 在GC的发生和发展中发挥了重要的作用. PRR11的过表达与GC的分化程度以及疾病进展程度显著相关, 可作为评价GC患者进展和预后的重要指标.
胃癌(gastric cancer, GC)在我国病死率高, 开展GC相关标志物研究对于阐明其发生发展的机制、GC防治等都具有重要意义. PRR11是一个新的肿瘤相关基因, 但目前在GC中尚未见大样本量的报道.
本研究探讨PRR11在大样本量GC中的表达情况, 以及PRR11表达异常与GC进展和预后的相关性, 以寻找特异性及敏感性俱佳的GC进展和预后的分子标记、开发新的肿瘤分子诊疗方法、降低GC的发病率和死亡率.
通过研究PRR11在GC中的表达, 探究其对GC进展和预后的预测价值. 通过该研究也提示PRR11可作为判断GC预后的重要指标. 若其在GC中的作用机制得到进一步揭示, 未来有潜力作为有效的分子靶点用于寻找新的GC诊治方法并用于开发新的抗肿瘤药物, 发挥重要的医疗、经济以及社会价值.
在436例大样本量GC组织中采用免疫组织化学法和Western blot验证蛋白表达, 用χ2检验研究PRR11表达与进展和预后相关临床病例参数的相关性.
发现PRR11在GC组织中的表达显著高于正常胃黏膜组织; 同时免疫组织化学显示PRR11在GC中呈特异性表达, 其阳性定位于胞浆和胞膜, GC组织阳性表达率为41.8%, 而在正常胃黏膜组织中不表达或微弱表达. 并发现PRR11的过表达与GC的分化程度、浸润深度、TNM分期、淋巴结转移和远处转移密切相关. 该研究提示PRR11可作为判断GC进展和预后的重要指标.
PRR11过表达于GC组织, 其过表达与GC的分化程度以及疾病进展程度显著相关. 推测PRR11可能通过调控细胞周期及进展而发挥其对蛋白间的相互作用, 从而诱导GC细胞的侵袭与迁移, 其表达活性改变引起的细胞增殖失控与迁移能力增强可能与GC的浸润、进展和转移以及预后有关, 提示PRR11可作为预测GC进展和预后的有效标记. 通过PRR11蛋白表达与某些预后参数的相关性验证其异常活化参与了GC的发生和发展. 研究证明PRR11未来有潜力作为有效的分子靶点用于寻找新的GC诊治方法并用于开发新的抗肿瘤药物, 发挥重要的医疗、经济以及社会价值.
今后PRR11在GC中的具体作用机制还有待于进一步揭示, 可由过表达这一生物学现象延伸到相关信号通路的研究, 从而探索其分子机制, 更有利于靶向药物的研制和个体化治疗的开展.
手稿来源: 自由投稿
学科分类: 胃肠病学和肝病学
手稿来源地: 浙江省
同行评议报告分类
A级 (优秀): 0
B级 (非常好): B
C级 (良好): 0
D级 (一般): 0
E级 (差): 0
编辑: 闫晋利 电编:杜冉冉
| 1. | Siegel RL, Miller KD, Jemal A. Cancer Statistics, 2017. CA Cancer J Clin. 2017;67:7-30. [PubMed] [DOI] |
| 2. | Ji Y, Xie M, Lan H, Zhang Y, Long Y, Weng H, Li D, Cai W, Zhu H, Niu Y. PRR11 is a novel gene implicated in cell cycle progression and lung cancer. Int J Biochem Cell Biol. 2013;45:645-656. [PubMed] [DOI] |
| 3. | Zhang C, Zhang Y, Li Y, Zhu H, Wang Y, Cai W, Zhu J, Ozaki T, Bu Y. PRR11 regulates late-S to G2/M phase progression and induces premature chromatin condensation (PCC). Biochem Biophys Res Commun. 2015;458:501-508. [PubMed] [DOI] |
| 4. | Tan S, Jiang Z, Hou A, Wang J, Zhang J, Dai L. Expression of PRR11 protein and its correlation with pancreatic cancer and effect on survival. Oncol Lett. 2017;13:4117-4122. [PubMed] [DOI] |
| 5. | Li J, Sun P, Yue Z, Zhang D, You K, Wang J. miR-144-3p Induces Cell Cycle Arrest and Apoptosis in Pancreatic Cancer Cells by Targeting Proline-Rich Protein 11 Expression via the Mitogen-Activated Protein Kinase Signaling Pathway. DNA Cell Biol. 2017;36:619-626. [PubMed] [DOI] |
| 7. | 艾 青, 卜 友泉, 刘 竹, 兰 欢, 吉 颖, 杜 刚, 杨 正梅, 刘 革力, 宋 方洲. 人PRR11启动子的结构与功能初步分析. 中国生物化学与分子生物学报. 2011;27:356-363. |
| 8. | 龙 银江, 吉 颖, 翁 华莉, 张 春冬, 谢 濛宇, 蔡 伟, 王 义涛, 朱 远远, 李 轶, 张 莹. siRNA介导的PRR11表达抑制导致肺癌细胞系基因表达谱变化的分析. 中国细胞生物学学报. 2013;35:196-202. |
| 10. | Wang Y, Weng H, Zhang Y, Long Y, Li Y, Niu Y, Song F, Bu Y. The PRR11-SKA2 Bidirectional Transcription Unit Is Negatively Regulated by p53 through NF-Y in Lung Cancer Cells. Int J Mol Sci. 2017;18:pii E534. [PubMed] [DOI] |
| 11. | Zhao Q. RNAi-mediated silencing of praline-rich gene causes growth reduction in human lung cancer cells. Int J Clin Exp Pathol. 2015;8:1760-1767. [PubMed] |
| 15. | 周 诣桐, 姜 战武, 翟 建, 郝 志伟, 安 杰. Trim28、PRR11在结肠癌中的表达及其发生、发展中的意义. 世界最新医学信息文摘. 2016;16:24-25. [DOI] |
| 16. | Sakai Y, Ohbayashi C, Yanagita E, Jimbo N, Kajimoto K, Sakuma T, Hirose T, Yoshimura M, Maniwa Y, Itoh T. PRR11 immunoreactivity is a weak prognostic factor in non-mucinous invasive adenocarcinoma of the lung. Pathologica. 2017;109:133-139. [PubMed] |
| 17. | Wang C, Yu L, Hu F, Wang J, Chen X, Tai S, Cheng B. Upregulation of proline rich 11 is an independent unfavorable prognostic factor for survival of tongue squamous cell carcinoma patients. Oncol Lett. 2017;14:4527-4534. [PubMed] [DOI] |
| 18. | Weinmann AS, Yan PS, Oberley MJ, Huang TH, Farnham PJ. Isolating human transcription factor targets by coupling chromatin immunoprecipitation and CpG island microarray analysis. Genes Dev. 2002;16:235-244. [PubMed] [DOI] |
| 19. | Spira A, Beane JE, Shah V, Steiling K, Liu G, Schembri F, Gilman S, Dumas YM, Calner P, Sebastiani P. Airway epithelial gene expression in the diagnostic evaluation of smokers with suspect lung cancer. Nat Med. 2007;13:361-366. [PubMed] [DOI] |
| 20. | Chen Y, Cha Z, Fang W, Qian B, Yu W, Li W, Yu G, Gao Y. The prognostic potential and oncogenic effects of PRR11 expression in hilar cholangiocarcinoma. Oncotarget. 2015;6:20419-20433. [PubMed] [DOI] |
| 23. | Zhou F, Liu H, Zhang X, Shen Y, Zheng D, Zhang A, Lai Y, Li H. Proline-rich protein 11 regulates epithelial-to-mesenchymal transition to promote breast cancer cell invasion. Int J Clin Exp Pathol. 2014;7:8692-8699. [PubMed] |
| 24. | Wang Y, Zhang Y, Zhang C, Weng H, Li Y, Cai W, Xie M, Long Y, Ai Q, Liu Z. The gene pair PRR11 and SKA2 shares a NF-Y-regulated bidirectional promoter and contributes to lung cancer development. Biochim Biophys Acta. 2015;1849:1133-1144. [PubMed] [DOI] |
| 25. | Gao Y, Chen Y, Xu D, Wang J, Yu G. Differential expression of ANXA1 in benign human gastrointestinal tissues and cancers. BMC Cancer. 2014;14:520. [PubMed] [DOI] |