修回日期: 2017-12-04
接受日期: 2017-12-12
在线出版日期: 2018-01-18
探讨miRNA-223-3p和上皮细胞转化序列2基因(epithelial cell transforming sequence 2 oncogene, ECT2)在胃癌(gastric cancer, GC)细胞周期和凋亡中的作用和机制, 并探讨其与GC临床病理因素的相关性及临床意义.
首先采用实时荧光聚合酶链反应法(real-time polymerase chain reaction, RT-PCR)和蛋白质印迹法检测正常胃黏膜(GSE-1)和GC细胞(SGC-7901, BGC-823)中ECT2和miR-223-3p的表达水平; 其次, 采用免疫组织化学RT-PCR法检测80例GC患者的癌组织及相应的癌旁组织(距癌组织边缘>5 cm)中ECT2和miR-223-3p的表达情况; miR-223-3p抑制物和模拟物转染SGC-7901细胞, RT-PCR和Western blot检测转染后miR-223-3p和ECT2的表达. 最后用流式细胞仪检测转染后细胞周期和凋亡的变化.
与正常胃黏膜细胞相比, GC细胞中ECT2和miR-223-3p的表达水平均明显升高(P<0.05); 免疫组织化学和RT-PCR结果显示, GC组织中ECT2阳性表达率显著高于癌旁组织(P<0.05); 两者表达均与GC的分化程度、Lauren分型相关(P<0.05), 与TNM分期密切相关(P<0.01), 与患者的性别、年龄、肿瘤直径、Bormann分型无明显相关(P>0.05); 两者之间表达呈显著正相关(P<0.05); 将miR-223-3p类似物转染SGC-7901细胞后ECT2表达上调, 转染抑制剂后ECT2表达下调. miR-223-3p抑制物促使肿瘤细胞的G1期阻滞和促进凋亡作用.
miR-223-3p是一种与GC细胞周期和凋亡密切相关的miRNA分子, 他可以通过影响ECT2的表达来调节GC细胞的细胞周期和凋亡; 两者可以作为反映GC生物学行为的有效指标.
核心提要: 胃癌(gastric cancer, GC)死亡率高, 研究表明miRNA在其中起重要调控作用, 但具体机制仍不明确. ECT2是与细胞增殖和凋亡相关的基因, 在多种恶性肿瘤中高表达. 本文分析ECT2同miR-223-3p在GC恶性增殖中的相互作用, 为进一步明晰GC发展机制提供思路.
引文著录: 李伦, 兴成娟, 丛玲, 万义增. miR-223-3p靶向上皮细胞转化序列2基因调控胃癌细胞周期和凋亡的相关性研究. 世界华人消化杂志 2018; 26(2): 71-79
Revised: December 4, 2017
Accepted: December 12, 2017
Published online: January 18, 2018
To explore the role of miRNA-223-3p and epithelial cell transforming sequence 2 oncogene (ECT2) in cell cycle and apoptosis of gastric cancer (GC) cells and to analyze their correlation with clinicopathological characteristics.
The expression of ECT2 and miR-223-3p in normal gastric mucosa cells (GSE-1) and GC cells (SGC-7901 and BGC-823) was detected by real-time fluorescent quantitative PCR and Western blot. Immunohistochemistry and RT-PCR were used to examine the expression of ECT2 and miR-223-3p in GC tissues and paired adjacent normal tissues, respectively. The correlation between ECT2 and miR-223-3p expression and clinicopathological characteristics was then analyzed. After miRNA-223-3p inhibitor and mimic were used to transfect SGC-7901 cells with LipofectamineTM2000, the expression of miRNA-223-3p and ECT2 was assessed by RT-PCR and Western blot in SGC-7901 cells. After another 24 h culture, the apoptosis rate and cell cycle progression were examined by flow cytometry.
The expression levels of ECT2 and miR-223-3p in GC cells were significantly increased as compared with those in normal gastric mucosa cells (P < 0.05 for both). In comparison with tumor adjacent normal tissues, the expression of ECT2 and miR-223-3p in GC tissues was significantly higher (P < 0.05). The expression of ECT2 and miR-223-3p was related to histologic differentiation (P < 0.05), Lauren type (P < 0.05), and TNM stage (P < 0.01), but not with gender, age, Bormann type, or tumor size (P > 0.05). Transfection with miR-223-3p mimic up-regulated ECT2 expression, whereas transfection of miR-223-3p inhibitor downregulated the expression of ECT2. Compared with negative control cells, the apoptosis rate of SGC-7901 cells transfected with miR-223-3p inhibitor significantly increased (P < 0.05), and the percentage of G1 phase cells also significantly increased in miR-223-3p inhibitor transfected cells (P < 0.05).
MiR-223-3p is closely related with cell cycle and apoptosis of gastric cancer cells, and it can regulate the occurrence and development of GC by influencing the expression of ECT2. ECT2 and miR-223-3p may serve as good factors to indicate the biologic behavior of GC.
- Citation: Li L, Xing CJ, Cong L, Wan YZ. MiR-223-3p targets ECT2 to regulate cell cycle and apoptosis in gastric cancer cells. Shijie Huaren Xiaohua Zazhi 2018; 26(2): 71-79
- URL: https://www.wjgnet.com/1009-3079/full/v26/i2/71.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v26.i2.71
胃癌(gastric cancer, GC)是常见的消化系恶性肿瘤, 发病率在我国位居第4位, 死亡率高居第2[1], 其主要原因是: 疾病的恶性增殖、复发转移和化疗耐药. 虽然, 围绕GC恶性增殖的机制研究取得了部分进展, 但应用于临床治疗的药物仍未获得满意的效果. 目前, 越来越多的研究表明miRNA在GC的发生发展中起到重要的调控作用, miRNA是由21-25个核苷酸组成的短链非编码RNA, 其与靶基因的3'端非翻译区(3' untranslated region, 3'-UTR)结合进而调节靶基因mRNA的表达和降解. Shrestha等[2]报道约有350余个miRNA在GC和正常黏膜中存在差异表达, 且有100余个miRNA在多篇文献被证实[3]. 有报道[4-7]指出, 上皮细胞转化序列2基因(epithelial cell transforming sequence 2 oncogene, ECT2)是与细胞增殖和凋亡相关的基因, 在多种恶性肿瘤中高表达, 与肿瘤的发生发展密切相关. 本研究通过生物信息学的方法发现ECT2和miR-223-3p存在特异性结合位点, 并通过细胞转染、Western blot和实时荧光聚合酶链反应法(real-time polymerase chain reaction, RT-PCR)等实验方法证实二者存正性调控关系. 同时选取80例临床标本在癌组织和癌旁组织中对ECT2和miR-223-3p的差异表达进行检测, 并探讨两者与GC临床病理特点的相关性及临床意义. 本文尚属国内外首次提出miR-223-3/ECT2轴同GC增殖凋亡的关系, 现将研究结果报道如下.
RPMI 1640培养液(Invitrogen公司)、胎牛血清美国(TBD公司); 鼠抗人ECT2、鼠抗人β-actin单克隆抗体(武汉博士德生物工程有限公司); 辣根过氧化物酶标记的羊抗鼠免疫球蛋白G(immunoglobulin G, IgG), 免疫组织化学试剂盒(SP法)、浓缩型DAB试剂盒(北京中杉金桥生物技术有限公司); PVDF膜(美国Millipore公司); TRIzol试剂、LipofectAMINE 2000转染试剂、miRNA提取试剂盒、反转录试剂盒和实时荧光定量PCR试剂盒(上海生工生物工程有限公司); miRNA-223类似物和抑制剂及其阴性对照(上海吉凯基因化学技术有限公司); PCR引物由上海生工生物工程股份有限公司合成; Annexin V-APC凋亡试剂盒(eBioscience公司), 碘化丙啶(propidium iodide, PI)试剂盒(Sigma公司).
1.2.1 细胞培养: 人胃腺癌细胞株SGC-7901、BGC-823及正常胃黏膜细胞GES-1取自锦州医科大学中心实验室. 于37 ℃、50 mol/L CO2培养箱中, 间隔2 d更换1次培养基.
1.2.2 组织标本: 本研究方案经本院医学伦理委员会审核通过. 本研究病例均取自锦州医科大学附属第三医院附属医院普通外科2016-01/2017-05行GC根治术的手术标本, 80例. GC患者中男67例, 女13例, 年龄33-75岁, 中位年龄62岁. 全部病例均经术后病理证为腺癌, TNM分期(UICC, 2010): Ⅰ期12例、Ⅱ期19例、Ⅲ期49例. 所有患者术前均未经化疗、放疗、靶向治疗等抗肿瘤治疗, 临床病理资料均完整.
1.2.3 靶基因预测: 生物信息学预测采用不同的网站: TargetScan(http://www.targetscan.org/), DIANA TOOLS(http://diana.imis.athena-innovation.gr/) and miRPathDB(https://mpd.bioinf.uni-sb.de/)[8]. 取交集发现ECT2是miR-223-3p的特异性结合位点.
1.2.4 细胞转染及实验分组: 取对数生长期的细胞进行转染, 按照LipofectamineTM 2000试剂说明书分别将miR-223-3p mimics、miR-223-3p inhibitor转染入SGC-7901细胞, 设空白对照组, 每个转染实验3个复孔. 分别取转录24、36、48 h的细胞进行转染效率验证, 选取合适转染时间.
1.2.5 RT-PCR: RT-PCR检测ECT2和miR-223在GC组织和细胞中的表达, 采用TRIzol法提取病理标本和细胞中的总RNA, 并检测RNA的纯度及浓度. 逆转录和PCR反应均严格按照TAKARA公司说明书进行, 以U6作为内参进行相对定量, 每组设3个复孔, 在ROCHE实时定量荧光PCR仪上进行检测. ECT2的上游引物序列为5'-GCCTTGCTTGTGAGGCCACCAA-3', 下游引物序列为5'-TCCACTGAGCCGTGGGATGTCA-3'; miR-223上游引物: 5'-TGGTGGACCTGACCTGCCGT-3', 下游引物: 5'-CAATGCCAGCCCCAGCGTCA-3'; U6的上游引物序列为5'-TTATGGGTCCTAGCCTGAC-3', 下游引物序列为5'-CACTATTGCGGGCTGC-3', 采用2-△△Ct法计算两者的相对表达量. △Ct = CtECT2--CtU6, △△Ct = △Ct癌组织-△Ct 癌旁正常组织.
1.2.6 Westren blot: 收集人胃腺癌细胞株SGC-7901、BGC-823及正常胃黏膜细胞GES-1, 分别提取细胞总蛋白, BCA法测定蛋白质浓度. 取20 μg/孔蛋白上样, 行8%SDS-PAGE(1 h), 电泳结束后将分离的蛋白条带转移至PVDF膜; 含5%脱脂奶粉的封闭液进行封闭, 分别加入鼠抗人ECT2多克隆抗体以及鼠抗人β-actin单克隆抗体(体积、稀释比例均为1:500), 4 ℃反应过夜; PBS洗膜3次, 加入辣根过氧化物酶标记的羊抗鼠IgG, 室温反应1 h; PBS洗膜3次, ECL试剂暗室曝光、压片. 以目的蛋白条带与内参β-actin条带灰度值之比表示目的蛋白的相对表达水平.
1.2.7 免疫组织化学: 标本于切下后半小时内取材, 分别取癌组织和癌旁组织, 癌组织均取自肿块中央非坏死部位, 癌旁组织距肿块边缘5 cm以上. 一部分标本用4%甲醛溶液固定, 石蜡包埋, 切片机切成4 μm厚的连续石蜡切片备用; 另一部分液氮速冻后-80 ℃冰箱保存. 光学显微镜购自奥林巴斯(Olympus)公司. 阴性对照以PBS替代一抗作为阴性对照, 用已知阳性标本作阳性对照, 已知阳性标本的表达情况的定量使用Image J软件进行阳性细胞计数.
烤片30 min, 切片常规脱蜡; 将切片浸于沸腾的柠檬酸缓冲液中用3%过氧化氢甲醇去除内源性酶; 血清封闭, 室温孵育30 min; 加入按1:500稀释的一抗兔抗ETC2多克隆抗体, 4 ℃过夜16 h; 室温孵育45 min; 加入二抗, PBS冲洗3次, 每次3 min; 甩干PBS液, 加羊抗小鼠抗体同辣根过氧化物酶复合物. 室温放置30 min, DAB显色, 苏木素复染、梯度酒精脱水、二甲苯透明、中性树胶封片.
1.2.8 免疫组织化学染色评分: 切片经2名病理科医生显微镜下阅片评分. 染色结果判定采用Remmele和Stegner[9]提出的免疫反应评分(immune response scores, IRS), 是染色强度(staining intensity, SI)和阳性细胞百分比(percentage of positive cells, PP)的乘积, 即IRS = SI×PP. SI可分为4级, 即0级为未见阳性细胞; 1级为弱阳性; 2级为中等阳性; 3级为强阳性. PP可分为5级, 即0级为阴性; 1级≤30%; 2级31%-50%; 3级51%-80%; 4级>80%. 从每一样本的不同区域随即抽取10个视野进行IRS评估, IRS的平均数作为最终值.
1.2.9 PI-FACS细胞周期: 细胞生长至覆盖率约为80%时(细胞未进入生长平台期), 收集细胞, 胰酶消化, 完全培养基重悬成细胞悬液, 收集细胞于5 mL的离心管中, 每组设3个复孔. 1300 r/min离心5 min, 弃上清, 4 ℃预冷的D-Hanks(pH = 7.2-7.4)洗涤细胞沉淀1次. 1300 r/min离心5 min, 4 ℃预冷的75%乙醇固定细胞至少1 h. 1300 r/min离心5 min去固定液, D-Hanks洗涤细胞沉淀一次. 细胞染色液配制: 40×PI母液(2 mg/mL); 100×RNase母液(10 mg/mL); 1×D-Hanks = 25:10:1000.
细胞染色: 根据细胞量, 加入一定体积的细胞染色液(0.6-1.0 mL)重悬, 使上机时细胞通过率为300-800 Cell/s. 上机检测, 数据分析.
1.2.10 Annexin V-APC单染色流式细胞仪检测细胞凋亡: 待各实验组6孔板细胞生长至覆盖率约为80%时, 收集细胞, 胰酶消化, 完全培养基重悬成细胞悬液, 与上清细胞收集于同一5 mL离心管中, 每组设3个复孔. 1300 r/min离心5 min, 弃上清, 4 ℃预冷的D-Hanks(pH = 7.2-7.4)洗涤细胞沉淀. 1×binding buffer洗涤细胞沉淀一次, 1300 r/min、3 min离心, 收集细胞. 200 μL 1×binding buffer重悬细胞沉淀. 加入10 μL Annexin V-APC染色, 室温避光10-15 mins. 根据细胞量, 补加400-800 μL 1×binding buffer, 上机检测.
统计学处理 采用SPSS19.0统计软件对数据进行处理与分析. 所有实验均独立重复3次以上. 组间比较采用Pearson χ2检验或Fisher确切概率法; 两组间均数比较运用t检验, 数据采用mean±SD表示; 相关性分析采用非参数Spearman等级相关检验. P<0.05为差异有统计学意义.
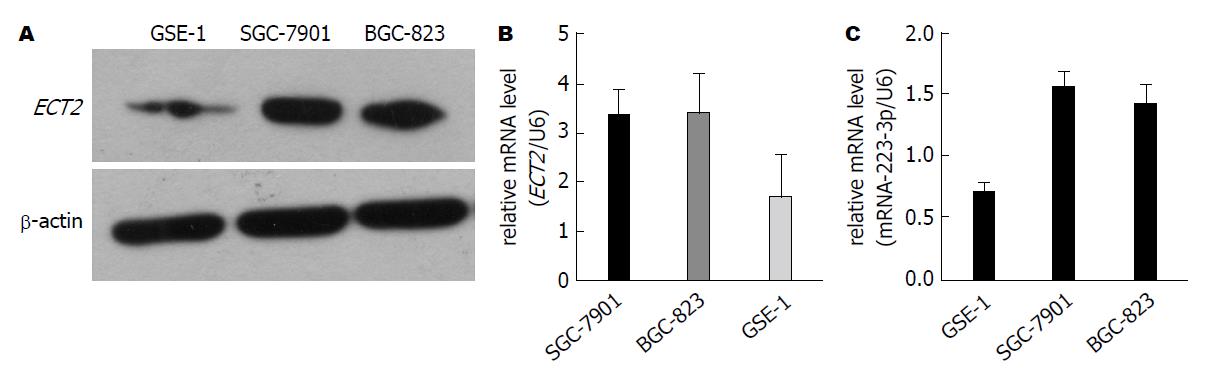
Western blot和RT-PCR结果显示(图1A, B), 与正常胃黏膜细胞GSE-1相比, GC细胞SGC-7901和BGC-823中ECT2的蛋白和mRNA明显呈过表达, 差异具有统计学意义(P<0.05). RT-PCR结果显示miR-223-3p在SGC-7901和BGC-823中的表达也显著高于其在GSE-1中的表达(图1C, P<0.05).
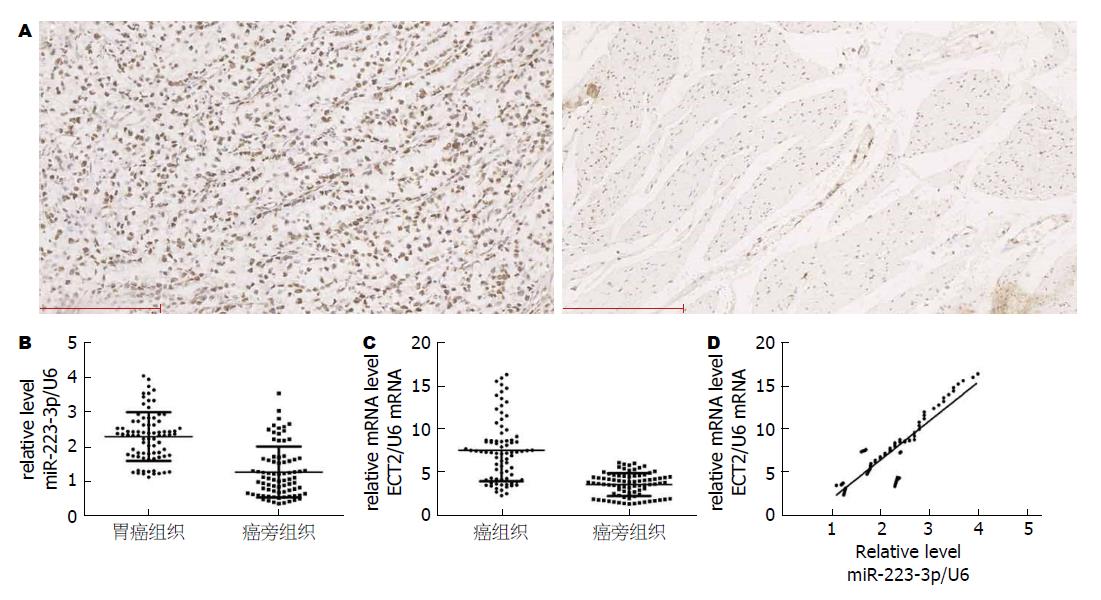
GC患者癌组织中ECT2阳性表达率为80.0%(64/80), 癌旁组织中ECT2阳性表达率为20%(16/80), 癌组织中ECT2阳性表达率显著高于癌旁组织, 差异有统计学意义(P<0.05). ECT2在GC组织中阳性信号表现为棕黄色深染颗粒, 癌旁组织中阳性染色多呈淡黄色(图2A).
RT-PCR检测结果显示(图2B, C), 80例配对GC癌组织中miR-223-3p、ECT2的相对表达量为明显高于癌旁组织, 差异有统计学意义(P<0.05). GC组织中miR-223-3p和ECT2 mRNA水平的相关性分析结果呈正相关性(图2D).
GC组织中, ECT2蛋白表达与GC的分化程度、Lauren分型相关(P<0.05), 与TNM分期密切相关(P<0.01), 与患者的性别、年龄、肿瘤直径、Bormann分型无明显相关(P>0.05, 表1).
| 临床病理因素 | n | ECT2蛋白表达 | P值 | |
| 阳性 | 阴性 | |||
| 性别 | 0.063 | |||
| 男 | 67 | 57 (85.1) | 10 (14.9) | |
| 女 | 13 | 7 (53.8) | 6 (46.2) | |
| 年龄(岁) | 0.653 | |||
| ≥60 | 44 | 36 (81.8) | 8 (18.2) | |
| <60 | 36 | 28 (77.8) | 8 (22.2) | |
| Bormann分型 | 0.074 | |||
| Ⅰ | 3 | 1 (33.3) | 2 (66.7) | |
| Ⅱ | 34 | 25 (73.5) | 9 (26.5) | |
| Ⅲ | 42 | 37 (88.1) | 5 (11.9) | |
| Ⅳ | 1 | 1 (100) | 0 (0) | |
| 肿瘤大小(cm) | 0.091 | |||
| ≥5 | 35 | 31 (88.6) | 4 (11.4) | |
| <5 | 45 | 33 (73.3) | 12 (26.7) | |
| 肿瘤位置 | 0.594 | |||
| 上部 | 21 | 18 (85.7) | 3 (14.3) | |
| 中部 | 13 | 11 (84.6) | 2 (15.4) | |
| 下部 | 46 | 35 (76.1) | 11 (23.9) | |
| Lauren分型 | 0.033 | |||
| 肠型 | 42 | 29 (69.0) | 13 (31.0) | |
| 混合型 | 18 | 16 (88.9) | 2 (11.1) | |
| 弥漫型 | 20 | 19 (95.0) | 1 (5.0) | |
| 分化程度 | 0.043 | |||
| 高中分化 | 29 | 20 (69.0) | 9 (31.0) | |
| 低未分化 | 51 | 44 (86.3) | 7 (13.7) | |
| TNM分期 | 0.000 | |||
| Ⅰ | 12 | 0 (0) | 12 (100) | |
| Ⅱ | 19 | 15 (78.9) | 4 (21.1) | |
| Ⅲ | 49 | 49 (100) | 0 (0) | |
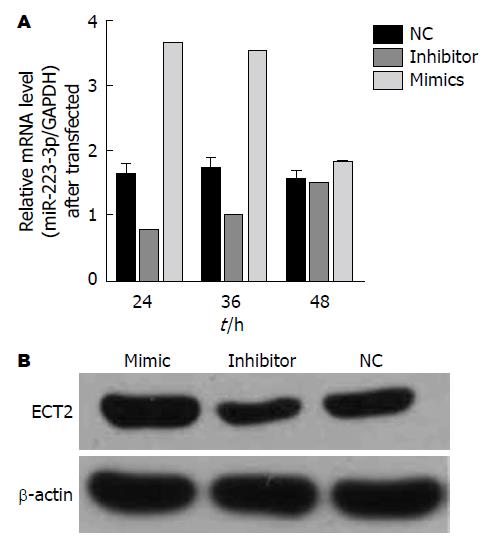
在SGC-7901细胞中转染miR-223-3p mimics和inhibitor, 进行RT-PCR实验, 结果显示: 转染24 h后, miR-223-3p mimics组与未处理(NC)组比较, miR-223-3p mimics组miR-223-3p明显上调(P<0.01); miR-223-3p inhibitor组与NC组比较, miR-223-3p inhibitor组明显抑制miR-223-3p的表达(P<0.01). 转染36 h后, miR-223-3p mimics组与NC组比较, miR-223-3p mimics组miR-223-3p明显上调(P<0.05); miR-223-3p inhibitor组与NC组比较, miR-223-3p inhibitor组明显抑制miR-223-3p的表达(P<0.05). 转染48 h后, miR-223-3p mimics组与NC组比较, miR-223-3p inhibitor组与NC组比较, 差异均无统计学差异(P>0.05, 图3). 选取转染24 h为后续实验的转染时间节点.
在SGC-7901细胞中转染miR-223-3p mimics和inhibitor 24 h后, 采用Western blot检测SGC-7901细胞中ECT2的表达情况(图3), 发现在加入miR-223-3p mimics的细胞中ECT2的表达明显上调(P<0.05), 而在加入miR-223-3pinhibitor的细胞中ECT2的表达明显下调(P<0.05), 说明miR-223-3p对ECT2存在正性调控关系.
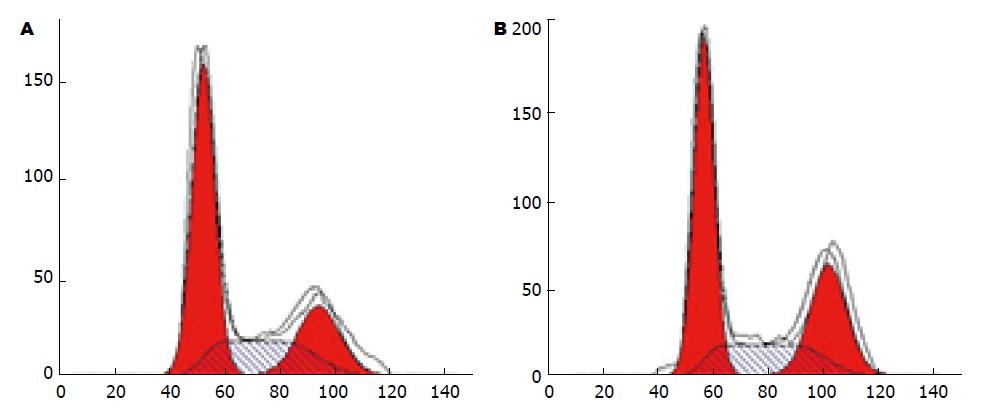
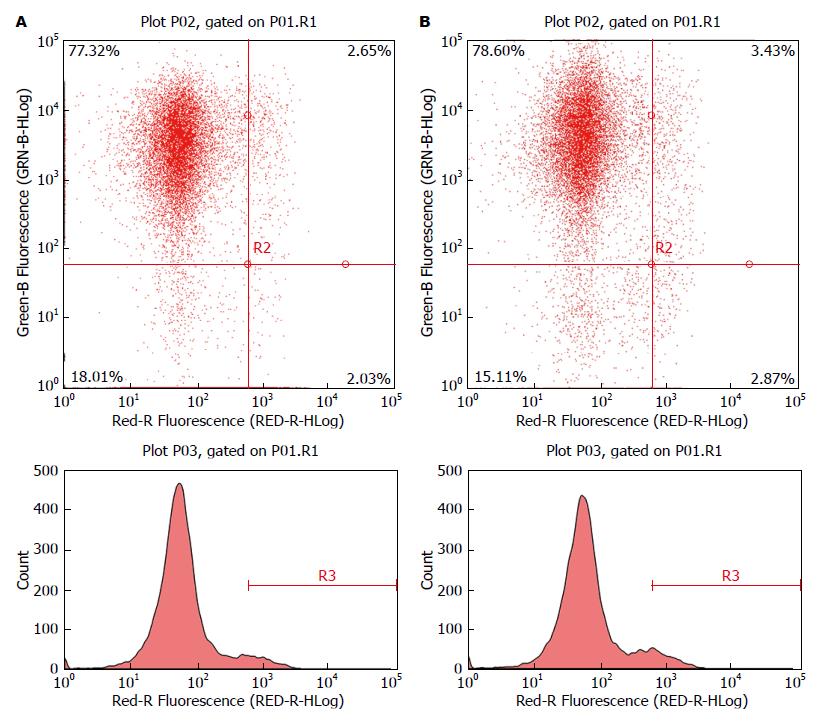
如表2和图4所示细胞周期的变化. miR-223-3p inhibitors转染组S期细胞明显低于NC组S期细胞, 差异有统计学意义(P<0.05). 该转染组G1期细胞, 明显高于其NC组G1期细胞(P<0.05).
| S期 | G1期 | PI | 凋亡率 | |
| Inhibitor | 24.12 ± 3.25 | 62.15 ± 4.30 | 37.85 ± 4.30 | 6.25 ± 0.09 |
| NC | 30.01 ± 3.58 | 45.74 ± 3.15 | 54.26 ± 3.15 | 4.50 ± 0.18 |
如表2和图5所示细胞凋亡的变化. miR-223-3p inhibitors转染组细胞凋亡率明显高于NC组细胞凋亡率(P<0.05).
ECT2首先由Miki等[10]发现, 证明其具有诱导正常上皮细胞癌变的生物学特点. ECT2位于人染色体3q26, 由883个氨基酸组成, ECT2是Rho家族(RhoA、Rac1、Cdc42)GTP酶鸟嘌呤核苷酸解离交换因子, 该家族对细胞分裂的调控至关重要[11], 使细胞周期保持动态平衡. 细胞的无限增殖是肿瘤的重要特点, 而ECT2因为其在细胞周期中的重要作用, 同肿瘤的发生发展联系到一起[12], 多项研究[13-15]表明, ECT2在诸如非小细胞肺癌、胰腺癌、乳腺癌细胞系和组织中呈过表达. 一项在非小细胞肺癌的研究[16]中发现, ECT2通过激活下游的Rac1, 从而上调PKC-Par6引起细胞的增殖变化. 本研究应用Western blot、RT-PCR和免疫组织化学证实, ECT2在GC细胞和组织中均呈过表达, 回顾80例GC患者的临床资料, 通过免疫组织化学证实ECT2的表达与患者的临床分期, 淋巴结转移和肿瘤的分化程度密切相关, 这也进一步说明ECT2在GC的发生发展中起到了重要作用, 是GC发生的一个重要基因.
寻找ECT2的上游调控机制是当务之急, 我们通过多个生物信息学的靶基因网站对ECT2的相关miRNA进行筛查, 取交集发现miR-223-3p很可能是ECT2的重要调控元件. miRNA不直接参与编码蛋白, 其主要作用机制是与靶基因mRNA的3'-UTR相结合, 在转录后水平调节靶基因表达, 参与细胞增殖、分化、凋亡等多种生物学过程. 目前研究[17]认为, miRNA至少参与调节5000个以上基因及30%以上蛋白质表达. miR-223首先因其在造血系统中高表达而被报道[18,19]. 随后的进一步相关研究表明, miR-223-3p在GC[20]等多种实体瘤中高表达[21-23]是一致癌miRNA. 曾有文献报道[24]miR-223-3p/ECT2轴在骨肉瘤的发生和增殖中起重要作用.
本文在国内外首次提出miR-223-3p/ECT2轴在GC细胞周期和凋亡中的作用. 两者在GC细胞和组织中均呈高表达, 且存在线性相关, 并且同患者的病理分期、Lauren分型、分化类型等病理预后因素密切相关. 通过细胞转染的手段干扰miR-223-3p的表达, 发现在GC细胞中, 上调miR-223-3p的表达后ECT2呈过表达; 而抑制miR-223-3p的表达后ECT2的表达也随之下调; 并且因为miR-223-3p的表达降低, ECT2介导的细胞周期和细胞凋亡也呈相应改变, 转染的细胞出现G1/S期阻滞, 增殖受到抑制, 凋亡细胞明显增加.
总之, miR-223-3p通过调节ECT2的表达, 从而影响GC细胞的细胞周期和凋亡, 在GC的发生发展中起到重要作用. 在后续的研究中, 通过更进一步的实验去验证两者之间存在的直接调控关系. 同时, 扩大临床样本量, 综合分析两者同患者预后的潜在临床意义, 为GC的分子治疗提供新靶标.
胃癌(gastric cancer, GC)是常见的消化系统恶性肿瘤, 发病率在我国位居第4位, 死亡率高居第2. 虽然, 围绕GC恶性增殖的机制研究取得了部分进展, 但应用于临床治疗的药物仍未获得满意的效果.
寻找GC恶性增殖相关的特异性分子靶标、特异性分子调控通路, 为GC的分子治疗提供新靶标.
探讨miRNA-223-3p和上皮细胞转化序列2基因(epithelial cell transforming sequence 2 oncogene, ECT2)在GC细胞周期和凋亡中的作用和相关机制, 并探讨其与GC临床病理因素的相关性及临床意义.
通过生物信息学的方法预测了miRNA-223-3p和ECT2两者的相关作用关系. 采用了RT-PCR、Western blot、免疫组织化学等方法对预测结果从基因水平、蛋白水平; 细胞水平、组织水平进行了表达验证, 并通过流式细胞仪对细胞周期和凋亡表型进行了验证. 同时, 将ECT2的表达同GC组织样本的生物学特点进行了统计分析.
GC细胞中ECT2和miR-223-3p的表达水平均较胃黏膜明显升高(P<0.05); GC组织中ECT2阳性表达率显著高于癌旁组织(P<0.05); 两者表达均与GC的分化程度、Lauren分型相关(P<0.05), 与TNM分期密切相关(P<0.01); 两者之间表达呈显著正相关(P<0.05); 两者影响GC细胞的增殖表型(P<0.05). 本研究的顺利实施为后续进一步探索ECT2相关的GC恶性增殖提供思路. 为进一步明确GC发生发展提供了一种可行性探索.
本研究发现并提出miR-223-3p是一种与GC细胞周期和凋亡密切相关的miRNA分子, 他可以通过影响ECT2的表达来调节GC细胞的细胞周期和凋亡. 并且进一步证明了非编码RNA参与肿瘤发生发展这一论点. 同时本文第一次就miR-223-3p/ECT2信号轴参与GC恶性增殖进行报道. 回顾文献, miRNA同mRNA负向调控文献较多, 而两者正向调控的文章相对较少, 本文为进一步确认miRNA同mRNA的互作关系提供论据. 总之, 研究认为ECT2和miR-223-3p可以作为反映GC生物学行为的有效指标, 为后续进一步深入的机制研究提供了坚实的理论基础.
在后续研究中, 首先, 本研究组将继续扩大样本量, 对已知研究结论进行进一步验证; 同时, 结合患者血液样本检测, 实施基础向临床的转化; 再次, 我们仍需进一步证明本文中biomarkers的直接作用关系, 并且进一步探索已获得分子通路的上下游调控机制.
手稿来源: 自由投稿
学科分类: 胃肠病学和肝病学
手稿来源地: 辽宁省
同行评议报告分类
A级 (优秀): 0
B级 (非常好): 0
C级 (良好): C
D级 (一般): D
E级 (差): 0
编辑: 马亚娟 电编:杜冉冉
| 1. | Siegel RL, Miller KD, Jemal A. Cancer Statistics, 2017. CA Cancer J Clin. 2017;67:7-30. [PubMed] [DOI] |
| 2. | Shrestha S, Hsu SD, Huang WY, Huang HY, Chen W, Weng SL, Huang HD. A systematic review of microRNA expression profiling studies in human gastric cancer. Cancer Med. 2014;3:878-888. [PubMed] [DOI] |
| 3. | Ishimoto T, Baba H, Izumi D, Sugihara H, Kurashige J, Iwatsuki M, Tan P. Current perspectives toward the identification of key players in gastric cancer microRNA dysregulation. Int J Cancer. 2016;138:1337-1349. [PubMed] [DOI] |
| 4. | Boldrup L, Gu X, Coates PJ, Norberg-Spaak L, Fahraeus R, Laurell G, Wilms T, Nylander K. Gene expression changes in tumor free tongue tissue adjacent to tongue squamous cell carcinoma. Oncotarget. 2017;8:19389-19402. [PubMed] [DOI] |
| 5. | Vazquez-Mena O, Medina-Martinez I, Juárez-Torres E, Barrón V, Espinosa A, Villegas-Sepulveda N, Gómez-Laguna L, Nieto-Martínez K, Orozco L, Roman-Basaure E. Amplified genes may be overexpressed, unchanged, or downregulated in cervical cancer cell lines. PLoS One. 2012;7:e32667. [PubMed] [DOI] |
| 6. | Chen J, Xia H, Zhang X, Karthik S, Pratap SV, Ooi LL, Hong W, Hui KM. ECT2 regulates the Rho/ERK signalling axis to promote early recurrence in human hepatocellular carcinoma. J Hepatol. 2015;62:1287-1295. [PubMed] [DOI] |
| 7. | Huff LP, Decristo MJ, Trembath D, Kuan PF, Yim M, Liu J, Cook DR, Miller CR, Der CJ, Cox AD. The Role of Ect2 Nuclear RhoGEF Activity in Ovarian Cancer Cell Transformation. Genes Cancer. 2013;4:460-475. [PubMed] [DOI] |
| 8. | Backes C, Kehl T, Stöckel D, Fehlmann T, Schneider L, Meese E, Lenhof HP, Keller A. miRPathDB: a new dictionary on microRNAs and target pathways. Nucleic Acids Res. 2017;45:D90-D96. [PubMed] [DOI] |
| 9. | Remmele W, Stegner HE. Recommendation for uniform definition of an immunoreactive score (IRS) for immunohistochemical estrogen receptor detection (ER-ICA) in breast cancer tissue. Pathologe. 1987;8:138-140. [PubMed] |
| 10. | Miki T, Smith CL, Long JE, Eva A, Fleming TP. Oncogene ect2 is related to regulators of small GTP-binding proteins. Nature. 1993;362:462-465. [PubMed] [DOI] |
| 11. | Fields AP, Justilien V. The guanine nucleotide exchange factor (GEF) Ect2 is an oncogene in human cancer. Adv Enzyme Regul. 2010;50:190-200. [PubMed] [DOI] |
| 12. | Jing J, Chen L, Fu HY, Fan K, Yao Q, Ge YF, Lu JC, Yao B. Annexin V-induced rat Leydig cell proliferation involves Ect2 via RhoA/ROCK signaling pathway. Sci Rep. 2015;5:9437. [PubMed] [DOI] |
| 13. | Justilien V, Lewis KC, Murray NR, Fields AP. Oncogenic Ect2 signaling regulates rRNA synthesis in NSCLC. Small GTPases. 2017; Jun 28. [Epub ahead of print]. [PubMed] [DOI] |
| 14. | Chen Y, Tian P, Liu Y. P53 and Protein Phosphorylation Regulate the Oncogenic Role of Epithelial Cell Transforming 2 (ECT2). Med Sci Monit. 2017;23:3154-3160. [PubMed] |
| 15. | Justilien V, Ali SA, Jamieson L. ECT2-Dependent rRNA Synthesis Is Critical for Lung Cancer Oncogenesis. Cancer Discov. 2017;7:Of9. [DOI] |
| 16. | Justilien V, Fields AP. Ect2 links the PKCiota-Par6alpha complex to Rac1 activation and cellular transformation. Oncogene. 2009;28:3597-3607. [PubMed] [DOI] |
| 17. | Varol N, Konac E, Gurocak OS, Sozen S. The realm of microRNAs in cancers. Mol Biol Rep. 2011;38:1079-1089. [PubMed] [DOI] |
| 18. | Chen CZ, Li L, Lodish HF, Bartel DP. MicroRNAs modulate hematopoietic lineage differentiation. Science. 2004;303:83-86. [PubMed] [DOI] |
| 19. | Johnnidis JB, Harris MH, Wheeler RT, Stehling-Sun S, Lam MH, Kirak O, Brummelkamp TR, Fleming MD, Camargo FD. Regulation of progenitor cell proliferation and granulocyte function by microRNA-223. Nature. 2008;451:1125-1129. [PubMed] [DOI] |
| 20. | Zhou X, Jin W, Jia H, Yan J, Zhang G. MiR-223 promotes the cisplatin resistance of human gastric cancer cells via regulating cell cycle by targeting FBXW7. J Exp Clin Cancer Res. 2015;34:28. [PubMed] [DOI] |
| 21. | Fang G, Liu J, Wang Q, Huang X, Yang R, Pang Y, Yang M. MicroRNA-223-3p Regulates Ovarian Cancer Cell Proliferation and Invasion by Targeting SOX11 Expression. Int J Mol Sci. 2017;18:pii E1208. [PubMed] [DOI] |
| 22. | Fassan M, Saraggi D, Balsamo L, Realdon S, Scarpa M, Castoro C, Coati I, Salmaso R, Farinati F, Guzzardo V. Early miR-223 Upregulation in Gastroesophageal Carcinogenesis. Am J Clin Pathol. 2017;147:301-308. [PubMed] [DOI] |
| 23. | Li R, Wu S, Chen X, Xu H, Teng P, Li W. miR-223/FBW7 axis regulates doxorubicin sensitivity through epithelial mesenchymal transition in non-small cell lung cancer. Am J Transl Res. 2016;8:2512-2524. [PubMed] |
| 24. | Xu J, Yao Q, Hou Y, Xu M, Liu S, Yang L, Zhang L, Xu H. MiR-223/Ect2/p21 signaling regulates osteosarcoma cell cycle progression and proliferation. Biomed Pharmacother. 2013;67:381-386. [PubMed] [DOI] |