修回日期: 2017-11-25
接受日期: 2017-11-27
在线出版日期: 2018-01-18
免疫球蛋白E(immunoglobulin E, IgE)是肠道重要保护物质, 在肠道免疫中有至关重要的作用. IgE由黏膜下固有层淋巴组织中浆细胞合成分泌, 在多种细胞因子、免疫细胞参与下调节肠道免疫系统功能, 当抗原侵入机体后不同的分子机制以及高亲和力IgE受体(FcεRⅠ)和低亲和力IgE受体(CD23+)在调节肠道免疫系统功能中发挥作用. 本文就肠道中IgE的结构、合成转运、分泌调节、受体分类、功能和肠道相关临床疾病的研究进展作一综述.
核心提要: 免疫球蛋白E(immunoglobulin E, IgE)是肠道内重要的保护物质, 本文基于肠道中IgE的结构、合成转运、分泌调节、降解、受体分类、功能的最新研究, 尤其是胃肠过敏性疾病的病理生理机制的联系, 相关物质的基因位点以及参与免疫调节的研究进展进行了概括.
引文著录: 仇志强, 韩渤, 张子卿, 王雪, 李利生, 徐敬东. 肠道内IgE的生物特性与消化道疾病的研究进展. 世界华人消化杂志 2018; 26(2): 110-119
Revised: November 25, 2017
Accepted: November 27, 2017
Published online: January 18, 2018
Immunoglobulin E (IgE), a crucial protective substance for the intestinal tract, plays an important role in gut immunity. IgE is secreted by plasma cells in the submucosal lamina propria upon antigenic invasion and, together with certain cytokines and immune cells, is involved in the regulation of gastrointestinal immunity in normal or abnormal conditions via the high affinity IgE receptor (FcεR I) and low affinity IgE receptor (CD23+). In this paper, we review the structure, synthetic transport, secretory regulation, receptor classification, and function of intestinal IgE as well as the related gut diseases.
- Citation: Qiu ZQ, Han B, Zhang ZQ, Wang X, Li LS, Xu JD. Biological characteristics of intestinal IgE and gut diseases. Shijie Huaren Xiaohua Zazhi 2018; 26(2): 110-119
- URL: https://www.wjgnet.com/1009-3079/full/v26/i2/110.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v26.i2.110
消化道通过口腔和肛门与外界相通, 大量的有害物质和致敏物质可以通过肠道侵入机体, 使机体内环境稳态遭到破坏, 引起一系列疾病. 肠道内存在机体最复杂的免疫系统, 其中免疫球蛋白是肠道黏膜的重要保卫者. "免疫球蛋白E(immunoglobulin E, IgE)介导的过敏"早已在免疫学及医学界对导致过敏发生的根源达成共识, 具有与肥大细胞和嗜碱性粒细胞的特异性受体结合的免疫功能, 参与Ⅰ型变态反应. IgE由抗原入侵部位的黏膜下固有层淋巴组织中的浆细胞合成分泌, 参与调节肠道免疫系统的形成, 抵抗病原菌入侵[1], 因此IgE在复杂的肠道免疫系统中起着关键作用. 本文基于肠道中IgE的结构、合成转运、分泌调节、降解、受体分类、功能的最新研究, 尤其是胃肠过敏性疾病的病理生理机制的联系予以综述.
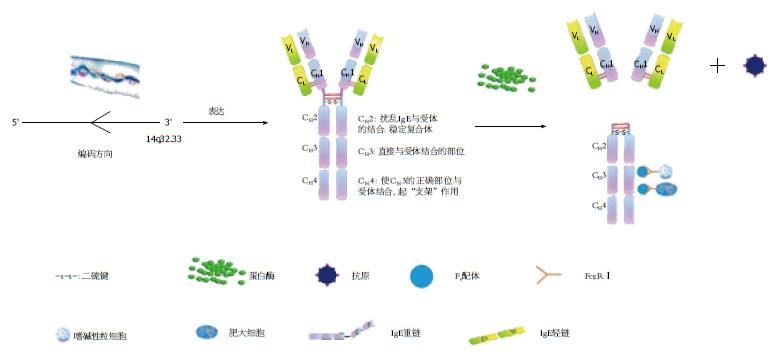
正常人血清中的IgE含量极微, 仅为50-300 ng/mL, 在机体抗体中含量最低. 如图1所示, 其通常以单体形式存在, 具有两条相同的重链(H链)和两条相同的轻链(L链), 并通过二硫键(-s-s-)的连接组成四肽链分子[2]. 免疫球蛋白重链和轻链分别由一个单独的多基因家族编码, 其中IgE重链恒定区由CH1-CH4 4个亚单位组成, 在与受体结合时各部位有各自不同的作用: CH1无特殊作用; CH2可以扰乱IgE与受体的结合, 但在结合之后可以发挥稳定复合体的作用; CH3是直接与受体结合的部位[3]; IgE的CH4可以使CH3的正确部位与受体结合, 起着"支架"的作用[4]; 人类的IgE重链是由14q32.33从3'→5'反向编码[5]. IgE经蛋白酶裂解后, 共裂解为3个片段, 即两个Fab片段和一个Fc片段, 其中Fab段是与抗原结合的主要部位, Fc段能与肥大细胞、嗜碱性粒细胞FcεRⅠ结合[6]. 近年来研究[7,8]表明, IgE在过敏性疾病的炎症反应中起重要作用, 在食物过敏或肠道寄生虫感染者血清中的含量显著增高, 与过敏反应的症状发生有密切关系. 所以, IgE在肠道免疫中发挥着不可替代的作用, 并且有着其特殊的合成转运过程以及功能.
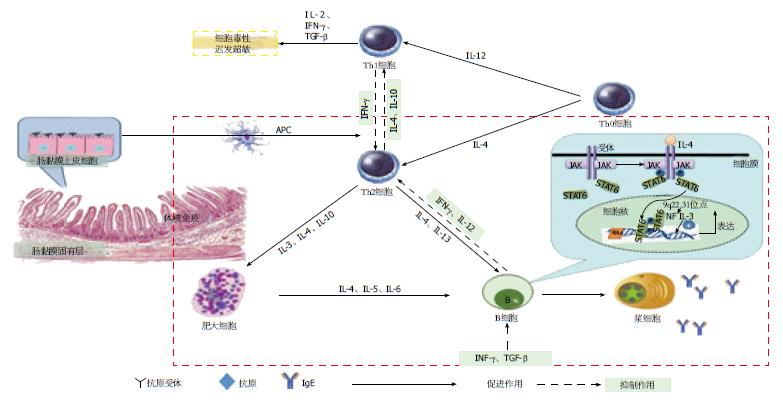
迄今为止, 发现IgE主要在气管和胃肠黏膜下固有层淋巴组织中合成并释放. 胃肠黏膜下固有层淋巴组织属于黏膜免疫系统(mucosal immune system, MIS)的一部分, MIS包括肠道黏膜相关淋巴组织(gut-associated lymphoid tissue, GALT). GALT主要是由肠道组织黏膜滤泡和肠道黏膜弥散淋巴组织构成, 前者具有诱导抗原进入GALT并由抗原呈递细胞(antigen presenting cells, APC)呈递给免疫分子诱导免疫应答的作用, 后者主要包括固有层内淋巴细胞(lamina propria lymphocytes, LPL)及上皮内淋巴细胞(intraepithelial lymphocytes, IEL), 其中LPL是免疫反应的效应区, 是浆细胞产生抗体和致敏T细胞发挥作用的部位[9]. 在通常情况下, GALT内的淋巴细胞主要分泌IgA发挥保护肠道的作用, 但大量的抗原或致敏物质入侵机体时, IgA的分泌量无法有效保护机体时, GALT同时产生大量IgE[10]. 抗原刺激GALT后, IEL能识别进入体内的抗原及致敏物质, 产生细胞因子, 发挥抗外来物质的作用, 是肠道免疫的第一道防线. 肠道组织黏膜滤泡中的APC将抗原摄取、处理、呈递给LPL内的之前已致敏过的CD4+辅助性T细胞(helper T cell, Th)2细胞. 由CD4+Th2细胞分泌的白介素(interleukin, IL)-4是产生IgE重要调节因子, 能诱导IgE的合成, 使血清IgE水平升高, 活化B细胞, 并可通过多途径上调IgE的分泌与合成(图2).
其一, IL-4对Th细胞的作用: IL-4可激活T细胞促进Th0细胞向Th2细胞分化, 并抑制向Th1细胞分化[11]. B细胞产生IgE抗体需Th细胞, 可根据分泌细胞因子种类的不同而分成为Th1和Th2两个亚群, Th1细胞分泌IL-2、干扰素(interferon, IFN)-γ和淋巴毒素, 但不分泌IL-4、IL-5和IL-6, 主要的生物学作用是增强免疫系统的细胞毒活性和介导迟发型超敏反应; 相反, Th2细胞分泌IL-4、IL-5、IL-6、IL-9和IL-10、IL-13, 但不分泌IL-2、IFN-γ和淋巴毒素, 主要在抗体形成及变态反应过程中起作用[12]. IL-4促进Th2细胞的产生, 从而使IL-4产生进一步增多, 形成正反馈, 从而使IgE+浆细胞在免疫应答时产生IgE[13]. 而Th1细胞产生的IFN-γ与IL-4的作用完全相反, 因此IL-4和IFN-γ量的比例和相互制约的平衡调节可能是IgE合成的重要决定因素, 提示Th1和Th2细胞均调控IgE的合成[14,15]. Th1和Th2两类细胞有一定的比例, 两者之间通过细胞因子而互相调节, 使人体免疫保持平衡. 由于IL-4具有激活T细胞的作用, 故对于产生IgE来说是必需的细胞因子[16], 故在"过敏体质"者往往Th2细胞占优势.
其二, IL-4对B细胞的作用: IL-4在变态炎症反应中具有活化B细胞的作用. IL-4主要通过减少对B细胞上有抑制作用的受体的表达, 并且可以通过去除CD22FcγRⅡ介导的抑制B细胞的作用, 使B细胞受体达到去抑制化的状态, 从而起到活化B细胞的作用, 进一步介导体液免疫应答[17]. 其次, IL-4信号通过Janus激酶(Janus kinase, JAK)-信号传导和转录激活因子(signal transducer and activator of transcription, STAT)途径诱导激活STAT6诱导B细胞的类别转换. Th细胞和细胞因子IgE的类别转换, 这种转换取决于Th细胞, 表明T细胞非依赖性抗原不能诱发IgE抗体的产生[18]. IL-4为B细胞提供了活化信号, IL-4可通过刺激使受体相关蛋白酪氨酸激酶(JAK)磷酸化, 之后STAT6酪氨酸磷酸化并激活, 产生二聚体转位并进入细胞核, 识别并且与特异性DNA结合位点结合, 胚系重链基因(ig germ-line ε, GLε)中的Cε外显子、一个位于Cε上游3.5 Kb和Sε区5'端的胚系ε外显子的表达[19]. 核因子IL-3(nuclear factor IL-3-regulated, NFIL3)是由位于9q22.31基因编码的[20], NFIL3可以响应脂多糖/IL-4结合Iε启动子区域正向调节GLε转录, NFIL3还可与其他转录因子或共激活因子相互作用, 因而B细胞发生转换, IgE+B细胞转型为IgE型浆细胞, 产生IgE抗体, 所以NFIL3是响应IL-4以及随后的IgE分类转换的IL-4诱导的GLε转录的关键调节剂[21].
其三, IL-4与肥大细胞的作用: IL-4参与IgE产生的正反馈效应. 肥大细胞与Th2细胞相似, 可产生IL-4[22]. 能影响肥大细胞数目、活化状态及组胺等介质释放的细胞因子使变态反应加重, 这些因子包括粒细胞-巨噬细胞集落刺激因子、IL-3、IL-4、IL-9和组胺释放的细胞因子(histamine releasing factors, HRFs)[23]. HRFs由多种细胞产生, 其主要作用是使嗜碱性粒细胞脱颗粒和释放组织胺. 有研究[24]表明, 肥大细胞的H4受体(H4 receptor, H4R)在IgE诱导的FcεRⅠ和FcεRⅠ介导的功能具有调节作用, H4R在IgE介导的FcεRⅠ上调和致敏效应中起正向调节作用. 当肥大细胞激活后, 可以释放IL-4, 促进Th2细胞的分化, 产生上调IgE的细胞因子, 从而促进IgE的产生[25].
其四, Th2细胞产生的其他细胞因子也对IgE具有重要的调节作用. IL-5、IL-9、IL-13等细胞因子可诱导产生和募集嗜酸性粒细胞、进而产生IgE[26]. 单核细胞、B细胞、肥大细胞、内皮细胞和Th2细胞产生的IL-6也能增加IgE合成, IL-6可能是增加IgE合成的一类非特异性信号[27]. IL-3和IL-5对IL-4所诱导的IgE合成也有协同作用. 这些细胞因子都对IgE的调节具有重要作用.
此外, 自然杀伤细胞(natural killer, NK)刺激因子IL-12是1989年新发现的细胞因子, 是至今发现的白介素中唯一由B细胞产生的[28], 其对IgE的产生具有明显的抑制作用. IL-12是已知的对人体T细胞和NK细胞的增殖、细胞毒性和淋巴因子的产生有直接调节作用的唯一细胞因子[29]. IL-12是IgE抗体合成的强抑制剂, 其作用机制可能是增加IFN-γ合成而抑制IgE合成[30]; 通过非IFN-γ依赖的机制使IgE合成下降; Ig类别转换因子样作用, 可下调IgE合成. IL-12很小的剂量就能显示很强的生物学效应, 在Ⅰ型超敏反应性疾病的防治中具有潜在的应用前景[31]. 有研究[32]表明IL-10能抑制小鼠T细胞产生IFN-γ, 因此可能通过下调IgE合成而缓解变态反应, 提供了哮喘治疗的新思路. 此外, 研究结果表明, IL-21可以抑制IL-4诱导产生IgE的调节作用, 还可通过其诱导的能力差异调节IL-4诱导的人IgE产生IFN-γ, 其作用某种程度上与IL-21R基因多态性的存在有关[33]. 因此, IL-21可能在调节人IgE合成中起调节作用, 而不是关键的作用[34]. 同时, 肠道内的益生菌(如唾液乳杆菌、双歧杆菌、乳酸菌等)可有效降低IL-5、IL-6、IFN-γ和总血清IgE的水平[35]. 益生菌株对致敏具有保护作用, 其可以使过敏原的特异性IgE降低, 从而减少过敏反应和肥大细胞脱颗粒, 但每种益生菌的作用机制不同: 双歧杆菌LA308菌株诱导前Th1谱细胞, 而鼠李糖乳杆菌LA305菌株诱导前Th1细胞和调节反应[36]. 目前研究最多的是唾液乳杆菌, 其为一种抗过敏的乳酸菌分离菌株, 唾液乳杆菌LA307菌株可以阻断Th1和Th2应答, 并且通过促进IL-12和INF-γ的分泌, 可有效改善过敏症状, 同时调控Th1型免疫反应, 从而抑制IgE合成, 改善Th2型免疫反应过度的现象[37]. 最新研究证据证明, 选择性STAT3抑制剂JSI-124(葫芦素Ⅰ)可选择性抑制人IgE+B细胞系CRL-8033细胞产生IgE, 而不影响IgG产生, 该项研究使得有效控制那些特异性升高IgE的患者成为可能[38].
IgE重链FcεR有两类, IgE介导的过敏反应主要由两种Fc段受体FcεRⅠ和FcεRⅡ(又称CD23)介导[39,40], 第一类称高亲和力IgE受体, 以FcεRⅠ表示; 第二类为低亲和力IgE受体, 以FcεRⅡ表示. 他们均能与IgE结合, 但他们的表达细胞、分子结构等均不同[41].
FcεRⅠ有两种结构亚型, 一种为异四聚体结构(αβγ2), 主要表达于肥大细胞、嗜碱性粒细胞表面; 另一种为三聚体结构(αγ2)的FcεRⅠ受体表型可能存在于人类单核细胞、朗格汉斯细胞及树突状细胞表面[42]. FcεRⅠ的α链编码的基因位于1q23.2, 转录翻译出Ⅰ型整合膜蛋白, 该蛋白由胞外区、一次穿膜结构和一个胞浆尾巴组成[43]. IgE的Fc段的结合区域位于α链的胞外区, 其由两个免疫球蛋白样结构域D1域-D2域(从N端到C端)组成, 这两个结构域的N端和C端均在同一侧, 即是由反向平行的方式排列的[44]; 在两结构域之间有一个接口, 接口顶端有4个由暴露于表面的色氨酸的结构, 称为"色氨酸脊", 其中2个组成抗体识别的通用功能基序, α链的胞外区的D2结构域中FG和C'袢在与IgE结合时极其重要, 且这个结构与"色氨酸脊"相邻, 这些结构构成了FcεRⅠ与IgE结合的直接结合面[45]. 研究[46]证实, FcεRⅠ是体内产生lgE介导过敏反应所必需的构件分子, IgE通过与FcεRⅠ结合诱发过敏反应. 尽管IgE的Fc段是由两条相同的轻链组成的对称结构, 但IgE与FcεRⅠ结合也是1:1的, 即一个IgE结合1个FcεRⅠ受体[47]. IgE的CH3是直接与FcεRⅠ结合的部位, 且FcεRⅠ的直接结合面由D2结构域的FG和C'袢和D1-D2接口的"色氨酸脊"组成, 其中前者与CH3一条链的12个氨基酸残基结合, 后者与CH3另一条链的10个氨基酸残基结合, 这些氨基酸残基仅有4个相同的, 这就保证了IgE与FcεRⅠ的结合是1:1的[48]. IgE与FcεRⅠ完成结合后, 交联并启动效应细胞脱颗粒, 释放组胺、白三烯等细胞活性物质, 以保护宿主免受某些感染性物质的侵害, 并对正常无害物质和组织产生过度防御, 从而引起机体产生过敏反应症状[49]; 目前通过抗IgE治疗IgE介导的过敏性疾病中, 重组人源化抗IgE单克隆抗体就是通过对于IgE的Fc段的人源化单抗来阻断IgE与FcεRⅠ结合, 从而使肥大细胞无法正常脱颗粒释放细胞活性物质, 达到治疗IgE介导过敏性疾病的目的[50].
FcεRⅡ或CD23由3个相同的亚基构成C型凝集素样超家族的物质, 主要存在于B细胞、T细胞、激活的单核细胞、嗜酸粒细胞、血小板中[51], 他由CD23a和CD23b两种形式构成, 具有调节IgE生成和T、B细胞分化、增强IgE依赖抗原呈递作用等功能[52]. FcεRⅡ的编码基因位点在19p13.3, 长约13 kb, 有11个外显子[53]. FcεRⅡ与IgE结合后形成的复合物参与许多致敏过程. 表达在肠道上皮细胞的FcεRⅡ可参与IgE-变应原免疫复合物的转运[54]; 表达在产生IgE的B细胞上时CD23-IgE相互作用参与CD23的寡聚体形式的IgE合成的调节[55,56]; 表达在APC上的CD23在促进抗原呈递(facilitated antigen presentation, FAP)的过程中也起着重要作用, APC上的CD23先将IgE-变应原免疫复合物内化, 然后将变应原的蛋白水解裂解, 蛋白水解后的肽与MHCⅡ类分子结合, 结合后再循环至细胞表面作用于Th2细胞的识别和活化, Th2细胞继而分泌细胞因子, 导致IgE合成的增加和过敏反应的加重[57]. 最新证据[58]表明, B细胞上CD23的密度决定了FAP的活性. 目前FcεRⅡ在过敏性疾病中的作用还不是很清楚, 近年来人们猜想[58,59]认为其与FcεRⅡ基因的表达增强有密不可分的关系. IgE可与T细胞上的FcεRⅡ结合, 结合后直接诱导Th2细胞反应, 并产生正反馈, 使IgE进一步增加, 这是两者相互作用的重要环节[56,60]. 有研究[61]表明, 有两种化合物YD383和YD439可以降低人B细胞淋巴瘤细胞株(BJAB细胞)的CD23分子表达, 其传导通路是由IL-4诱导的,而且具有剂量依赖性, CD23的表达随两种化合物计量的增大而减小. 雷公藤甲素通过阻断STAT6发挥作用改善患者过敏症状[62].
近年来的研究[8,63]表明在肠道某些疾病患者体内, 特异性IgE抗体的水平明显升高. 常常提示可能与某些疾病症状的发生相关.
肠道寄生虫感染时, 机体IgE水平明显升高, 尤其以蠕虫较为突出[64]. 血清中与肠道蠕虫作用的IgE分为可与蠕虫抗原结合的特异性IgE和不具有结合功能的非特异性IgE, 其中特异性IgE起主要作用. 有研究证实, 特异性IgE参与了旋毛虫急性期的免疫, 介导的Ⅰ型变态反应可直接参与消化道排虫, 主要作用为快速排出肠道内的旋毛虫脱囊幼虫[65]. 旋毛虫感染时, 旋毛虫抗原与肥大细胞上的特异性IgE抗体结合后, 肥大细胞释出组胺、白三烯等一些扩张血管、收缩平滑肌的介质, 在局部引起速发性超敏炎症反应, 由于此时血管通透性增高, 存在于血管中的IgG进入肠腔, 直接杀伤虫体[66]. 同时还可使±状细胞增生, 肠黏液分泌增加, 黏液包裹受损伤的虫体, 导致虫体的排出. 另外, 嗜酸性粒细胞膜上分布有免疫球蛋白Fc片段和补体C3的受体, 当蠕虫第二次进入体内产生了特异性IgE, 蠕虫经过特异性IgE和C3的作用后, 嗜酸性粒细胞可借助于细胞表面的Fc受体和C3受体黏着于蠕虫上, 并且利用细胞溶酶体内所含的过氧化物酶等酶类损伤蠕虫体, 且IgE是嗜酸性粒细胞发挥抗体依赖的细胞介导的细胞毒性作用效应所依赖的重要免疫球蛋白[67]. 有研究[68,69]表明, 当感染旋毛虫小鼠的IL-4和IL-5表达量明显升高, 提示IgE是小鼠旋毛虫感染急性期重要的抗体. 绝大多数情况, IgE的保护作用与肥大细胞脱颗粒和抗原入侵部位的过敏性炎症有关. 然而, 最新研究[70]表明, 在旋毛虫感染的大鼠中, IgE可以独立于肥大细胞脱颗粒参与保护机制[8]. 郭爱叶等[71]研究表明IL-4和IgE的水平与肠蠕虫感染呈正相关, 而IL-9水平随着不同的蠕虫物种和临床症状而变化.
有研究报道某些"过敏体质"者血清IgE比正常人高1-10倍. 食物过敏可以分为IgE介导的食物过敏和非IgE介导的食物过敏[72]. 国内学者普遍认为在过敏反应中IgE占主导地位. 肠道过敏反应是一种在婴儿期开始并由肠道黏膜免疫系统介导的过程. 肠道的免疫系统持续暴露于食物抗原和肠道内菌群, 黏膜免疫在耐受状态中起作用, 允许食物蛋白被吸收并且共生细菌存在于肠道中[73]. 在摄入食物后的几分钟到2 h, 食物中抗原激活肠道黏膜固有层的IgE浆细胞产生IgE, 随之与肥大细胞结合, 固定于肥大细胞表面. 当抗原再次进入人体, 与胃肠道黏膜肥大细胞表面IgE结合, 肥大细胞脱颗粒释放出一系列炎症物质, 使血管通透性增加[74]. 然而, 在食物过敏时, 特定抗原刺激强烈的适应性免疫应答[7]. 研究发现引起IgE阳性的食物特别是牛奶(80%)、蛋清(72%)和花生(50%), 还有其他坚果、鱼和大豆, 同时还会有芒果过敏, 均为常见食物, 食用后导致食物过敏发生的概率较高[75,76]. 所以, 避免食用这些食物对防治食物过敏有重大意义.
研究[77]发现, 牛奶蛋白过敏的一部分患儿发生的过敏症状也与IgE的介导相关. 然而, 肥大细胞或其他先天性炎性细胞类型(特别是未涉及IgE的病理生理学作用)尚未完全研究透彻. 同时, 有研究[78]表明分泌型免疫球蛋白A在肠道过敏性疾病中能发挥减轻炎症反应, 增强肠道屏障功能, 还能通过有效拮抗过敏物质从而防止患者血清中出现IgE发生肠道超敏反应.
自发现幽门螺杆菌(Helicobacter pylori, H. pylori)以来, H. pylori感染在慢性胃炎和消化性溃疡中的致病作用已达到学者们的共识, H. pylori对胃黏膜的致病作用有癌前病变的重要意义. 近年来有研究[79]显示, 胃内IgE与H. pylori的致病作用有关, H. pylori +其脱颗粒肥大细胞明显高于H. pylori -者, 同为H. pylori +的血清中抗H. pylori IgE+肥大细胞脱颗粒数量明显高于抗H. pylori IgE-的肥大细胞脱颗粒数, 血清中的抗H. pylori IgE含量与胃黏膜中脱颗粒的肥大细胞呈正相关, 这说明血清抗H. pylori IgE可能通过刺激肥大细胞脱颗粒, 从而导致胃黏膜损伤. 感染H. pylori的食物过敏患者血清IgE水平明显高于无H. pylori感染的食物过敏患者[80], 食物过敏患者中H. pylori的存在对过敏介质如嗜酸性阳离子蛋白和肥大细胞类胰蛋白酶的产生具有改善作用, 最新研究[81]认为H. pylori感染可能会降低食物过敏风险, H. pylori感染可能是对食物过敏的一种"保护因素".
IgE的合成受多因素的调节, IgE介导的过敏反应甚至IgE介导的过敏性疾病与肥大细胞和嗜碱性粒细胞上FcεR的活化有密切关系; IgE通过介导过敏反应抵抗病原体入侵并产生机体过敏症状. 高亲和力IgE受体(FcεRⅠ)和低亲和力IgE受体(CD23)发挥不同的作用, 阻断IgE与其受体结合的传导通路[82]治疗过敏性疾病逐渐成为近年来研究热点. 因此, IgE成为肠道功能的守卫者是毋庸置疑, 同时, IgE的免疫调节特性为临床治疗肠道寄生虫感染和食物过敏反应提供了新的治疗方向.
手稿来源: 自由投稿
学科分类: 胃肠病学和肝病学
手稿来源地: 北京市
同行评议报告分类
A级 (优秀): 0
B级 (非常好): B, B
C级 (良好): 0
D级 (一般): 0
E级 (差): 0
编辑: 马亚娟 电编:杜冉冉
| 1. | 陈 小林, 任 宏宇. 肠道微生物群组与肠道免疫的关系. 胃肠病学和肝病学杂志. 2014;23:1245-1248. |
| 2. | Gadermaier E, Flicker S, Lupinek C, Steinberger P, Valenta R. Determination of allergen specificity by heavy chains in grass pollen allergen-specific IgE antibodies. J Allergy Clin Immunol. 2013;131:1185-1193, 1193.e1-1193.e6. [PubMed] [DOI] |
| 3. | Schroeder HW Jr, Cavacini L. Structure and function of immunoglobulins. J Allergy Clin Immunol. 2010;125:S41-S52. [PubMed] [DOI] |
| 4. | Dhaliwal B, Yuan D, Pang MO, Henry AJ, Cain K, Oxbrow A, Fabiane SM, Beavil AJ, McDonnell JM, Gould HJ. Crystal structure of IgE bound to its B-cell receptor CD23 reveals a mechanism of reciprocal allosteric inhibition with high affinity receptor FcεRI. Proc Natl Acad Sci USA. 2012;109:12686-12691. [PubMed] [DOI] |
| 5. | Ng C, Hon KL, Kung JS, Pong NH, Leung TF, Wong CK. Hyper IgE in Childhood Eczema and Risk of Asthma in Chinese Children. Molecules. 2016;21. [PubMed] [DOI] |
| 6. | Garman SC, Wurzburg BA, Tarchevskaya SS, Kinet JP, Jardetzky TS. Structure of the Fc fragment of human IgE bound to its high-affinity receptor Fc epsilonRI alpha. Nature. 2000;406:259-266. [PubMed] [DOI] |
| 7. | Steele L, Mayer L, Berin MC. Mucosal immunology of tolerance and allergy in the gastrointestinal tract. Immunol Res. 2012;54:75-82. [PubMed] [DOI] |
| 8. | Negrão-Corrêa D. Importance of immunoglobulin E (IgE) in the protective mechanism against gastrointestinal nematode infection: looking at the intestinal mucosae. Rev Inst Med Trop Sao Paulo. 2001;43:291-299. [PubMed] [DOI] |
| 9. | Nochi T, Denton PW, Wahl A, Garcia JV. Cryptopatches are essential for the development of human GALT. Cell Rep. 2013;3:1874-1884. [PubMed] [DOI] |
| 10. | Orivuori L, Mustonen K, Roduit C, Braun-Fahrländer C, Dalphin JC, Genuneit J, Lauener R, Pfefferle P, Riedler J, Weber J. Immunoglobulin A and immunoglobulin G antibodies against β-lactoglobulin and gliadin at age 1 associate with immunoglobulin E sensitization at age 6. Pediatr Allergy Immunol. 2014;25:329-337. [PubMed] [DOI] |
| 11. | Mao Y, Yin S, Zhang J, Hu Y, Huang B, Cui L, Kang N, He W. A new effect of IL-4 on human γδ T cells: promoting regulatory Vδ1 T cells via IL-10 production and inhibiting function of Vδ2 T cells. Cell Mol Immunol. 2016;13:217-228. [PubMed] [DOI] |
| 12. | Romagnani S. T-cell subsets (Th1 versus Th2). Ann Allergy Asthma Immunol. 2000;85:9-18; quiz 18, 21. [PubMed] [DOI] |
| 13. | Hong GU, Park BS, Park JW, Kim SY, Ro JY. IgE production in CD40/CD40L cross-talk of B and mast cells and mediator release via TGase 2 in mouse allergic asthma. Cell Signal. 2013;25:1514-1525. [PubMed] [DOI] |
| 14. | Gaudieri S, Tulic MK, Lucas A, Lucas M. IFN-λ and IgE-mediated allergic disease: a potential future role. Biomark Med. 2012;6:151-157. [PubMed] [DOI] |
| 15. | Haas H, Falcone FH, Holland MJ, Schramm G, Haisch K, Gibbs BF, Bufe A, Schlaak M. Early interleukin-4: its role in the switch towards a Th2 response and IgE-mediated allergy. Int Arch Allergy Immunol. 1999;119:86-94. [PubMed] |
| 16. | McDonnell JM, Calvert R, Beavil RL, Beavil AJ, Henry AJ, Sutton BJ, Gould HJ, Cowburn D. The structure of the IgE Cepsilon2 domain and its role in stabilizing the complex with its high-affinity receptor FcepsilonRIalpha. Nat Struct Biol. 2001;8:437-441. [PubMed] [DOI] |
| 17. | Rudge EU, Cutler AJ, Pritchard NR, Smith KG. Interleukin 4 reduces expression of inhibitory receptors on B cells and abolishes CD22 and Fc gamma RII-mediated B cell suppression. J Exp Med. 2002;195:1079-1085. [PubMed] [DOI] |
| 18. | Wu LC, Zarrin AA. The production and regulation of IgE by the immune system. Nat Rev Immunol. 2014;14:247-259. [PubMed] [DOI] |
| 19. | Wang DZ, Cherrington A, Famakin-Mosuro B, Boothby M. Independent pathways for de-repression of the mouse Ig heavy chain germ-line epsilon promoter: an IL-4 NAF/NF-IL-4 site as a context-dependent negative element. Int Immunol. 1996;8:977-989. [PubMed] |
| 20. | Yin J, Zhang J, Lu Q. The role of basic leucine zipper transcription factor E4BP4 in the immune system and immune-mediated diseases. Clin Immunol. 2017;180:5-10. [PubMed] [DOI] |
| 21. | Kashiwada M, Levy DM, McKeag L, Murray K, Schröder AJ, Canfield SM, Traver G, Rothman PB. IL-4-induced transcription factor NFIL3/E4BP4 controls IgE class switching. Proc Natl Acad Sci USA. 2010;107:821-826. [PubMed] [DOI] |
| 22. | McLeod JJ, Baker B, Ryan JJ. Mast cell production and response to IL-4 and IL-13. Cytokine. 2015;75:57-61. [PubMed] [DOI] |
| 23. | Shakoory B, Fitzgerald SM, Lee SA, Chi DS, Krishnaswamy G. The role of human mast cell-derived cytokines in eosinophil biology. J Interferon Cytokine Res. 2004;24:271-281. [PubMed] [DOI] |
| 24. | Mirzahosseini A, Dalmadi B, Csutora P. Histamine receptor H4 regulates mast cell degranulation and IgE induced FcεRI upregulation in murine bone marrow-derived mast cells. Cell Immunol. 2013;283:38-44. [PubMed] [DOI] |
| 25. | Owen CE. Immunoglobulin E: role in asthma and allergic disease: lessons from the clinic. Pharmacol Ther. 2007;113:121-133. [PubMed] [DOI] |
| 26. | 何 清泉, 张 建国. 变应性疾病与IL-4及其受体基因多态性的相关性. 山东大学耳鼻喉眼学报. 2006;20:79-83. [DOI] |
| 27. | Cruse G, Cockerill S, Bradding P. IgE alone promotes human lung mast cell survival through the autocrine production of IL-6. BMC Immunol. 2008;9:2. [PubMed] [DOI] |
| 28. | Brunda MJ. Interleukin-12. J Leukoc Biol. 1994;55:280-288. [PubMed] |
| 29. | Matsui E, Kaneko H, Teramoto T, Fukao T, Inoue R, Kasahara K, Takemura M, Seishima M, Kondo N. Reduced IFNgamma production in response to IL-12 stimulation and/or reduced IL-12 production in atopic patients. Clin Exp Allergy. 2000;30:1250-1256. [PubMed] [DOI] |
| 30. | King CL, Hakimi J, Shata MT, Medhat A. IL-12 regulation of parasite antigen-driven IgE production in human helminth infections. J Immunol. 1995;155:454-461. [PubMed] |
| 31. | Thomas MJ, Noble A, Sawicka E, Askenase PW, Kemeny DM. CD8 T cells inhibit IgE via dendritic cell IL-12 induction that promotes Th1 T cell counter-regulation. J Immunol. 2002;168:216-223. [PubMed] [DOI] |
| 32. | Zdrenghea MT, Makrinioti H, Muresan A, Johnston SL, Stanciu LA. The role of macrophage IL-10/innate IFN interplay during virus-induced asthma. Rev Med Virol. 2015;25:33-49. [PubMed] [DOI] |
| 33. | Naradikian MS, Myles A, Beiting DP, Roberts KJ, Dawson L, Herati RS, Bengsch B, Linderman SL, Stelekati E, Spolski R. Cutting Edge: IL-4, IL-21, and IFN-γ Interact To Govern T-bet and CD11c Expression in TLR-Activated B Cells. J Immunol. 2016;197:1023-1028. [PubMed] [DOI] |
| 34. | Pène J, Guglielmi L, Gauchat JF, Harrer N, Woisetschläger M, Boulay V, Fabre JM, Demoly P, Yssel H. IFN-gamma-mediated inhibition of human IgE synthesis by IL-21 is associated with a polymorphism in the IL-21R gene. J Immunol. 2006;177:5006-5013. [PubMed] [DOI] |
| 35. | Yeşilova Y, Çalka Ö, Akdeniz N, Berktaş M. Effect of probiotics on the treatment of children with atopic dermatitis. Ann Dermatol. 2012;24:189-193. [PubMed] [DOI] |
| 36. | Neau E, Delannoy J, Marion C, Cottart CH, Labellie C, Holowacz S, Butel MJ, Kapel N, Waligora-Dupriet AJ. Three Novel Candidate Probiotic Strains with Prophylactic Properties in a Murine Model of Cow's Milk Allergy. Appl Environ Microbiol. 2016;82:1722-1733. [PubMed] [DOI] |
| 37. | Li CY, Lin HC, Hsueh KC, Wu SF, Fang SH. Oral administration of Lactobacillus salivarius inhibits the allergic airway response in mice. Can J Microbiol. 2010;56:373-379. [PubMed] [DOI] |
| 38. | Cui L, Bi J, Yan D, Ye X, Zheng M, Yu G, Wan X. JSI-124 inhibits IgE production in an IgE B cell line. Biochem Biophys Res Commun. 2017;483:669-673. [PubMed] [DOI] |
| 39. | Suzuki R, Leach S, Liu W, Ralston E, Scheffel J, Zhang W, Lowell CA, Rivera J. Molecular editing of cellular responses by the high-affinity receptor for IgE. Science. 2014;343:1021-1025. [PubMed] [DOI] |
| 40. | 陈青立, Srijana Dwa, Karmesh Bajracharya, 龚忠诚. 嗜酸性粒细胞增生性淋巴肉芽肿的免疫研究进展. 国际口腔医学杂志. 2016;43:181-186. [DOI] |
| 41. | Sutton BJ, Davies AM. Structure and dynamics of IgE-receptor interactions: FcεRI and CD23/FcεRII. Immunol Rev. 2015;268:222-235. [PubMed] [DOI] |
| 42. | Bannert C, Bidmon-Fliegenschnee B, Stary G, Hotzy F, Stift J, Nurko S, Szépfalusi Z, Fiebiger E, Dehlink E. Fc-epsilon-RI, the high affinity IgE-receptor, is robustly expressed in the upper gastrointestinal tract and modulated by mucosal inflammation. PLoS One. 2012;7:e42066. [PubMed] [DOI] |
| 43. | Auyeung P, Mittag D, Hodgkin PD, Harrison LC. Autoreactive T cells in chronic spontaneous urticaria target the IgE Fc receptor Iα subunit. J Allergy Clin Immunol. 2016;138:761-768.e4. [PubMed] [DOI] |
| 44. | Wurzburg BA, Jardetzky TS. Structural insights into the interactions between human IgE and its high affinity receptor FcepsilonRI. Mol Immunol. 2002;38:1063-1072. [PubMed] [DOI] |
| 45. | Hartman ML, Lin SY, Jouvin MH, Kinet JP. Role of the extracellular domain of Fc epsilon RI alpha in intracellular processing and surface expression of the high affinity receptor for IgE Fc epsilon RI. Mol Immunol. 2008;45:2307-2311. [PubMed] [DOI] |
| 46. | 孙 仁山, 程 天民. 高亲和力IgE受体、β亚单位与特应性体质. 国外医学(皮肤性病学分册). 2001;27:99-101. [DOI] |
| 47. | Suzuki R, Scheffel J, Rivera J. New insights on the signaling and function of the high-affinity receptor for IgE. Curr Top Microbiol Immunol. 2015;388:63-90. [PubMed] [DOI] |
| 48. | Holowka D, Sil D, Torigoe C, Baird B. Insights into immunoglobulin E receptor signaling from structurally defined ligands. Immunol Rev. 2007;217:269-279. [PubMed] [DOI] |
| 49. | Redhu NS, Gounni AS. The high affinity IgE receptor (FcεRI) expression and function in airway smooth muscle. Pulm Pharmacol Ther. 2013;26:86-94. [PubMed] [DOI] |
| 50. | Manikandan J, Kothandaraman N, Hande MP, Pushparaj PN. Deciphering the structure and function of FcεRI/mast cell axis in the regulation of allergy and anaphylaxis: a functional genomics paradigm. Cell Mol Life Sci. 2012;69:1917-1929. [PubMed] [DOI] |
| 51. | Stone KD, Prussin C, Metcalfe DD. IgE, mast cells, basophils, and eosinophils. J Allergy Clin Immunol. 2010;125:S73-S80. [PubMed] [DOI] |
| 53. | Perez-Witzke D, Miranda-García MA, Suárez N, Becerra R, Duque K, Porras V, Fuenmayor J, Montano RF. CTLA4Fcε, a novel soluble fusion protein that binds B7 molecules and the IgE receptors, and reduces human in vitro soluble CD23 production and lymphocyte proliferation. Immunology. 2016;148:40-55. [PubMed] [DOI] |
| 54. | Yang PC, Berin MC, Yu LC, Conrad DH, Perdue MH. Enhanced intestinal transepithelial antigen transport in allergic rats is mediated by IgE and CD23 (FcepsilonRII). J Clin Invest. 2000;106:879-886. [PubMed] [DOI] |
| 55. | Liu C, Richard K, Wiggins M, Zhu X, Conrad DH, Song W. CD23 can negatively regulate B-cell receptor signaling. Sci Rep. 2016;6:25629. [PubMed] [DOI] |
| 56. | Selb R, Eckl-Dorna J, Neunkirchner A, Schmetterer K, Marth K, Gamper J, Jahn-Schmid B, Pickl WF, Valenta R, Niederberger V. CD23 surface density on B cells is associated with IgE levels and determines IgE-facilitated allergen uptake, as well as activation of allergen-specific T cells. J Allergy Clin Immunol. 2017;139:290-299.e4. [PubMed] [DOI] |
| 57. | Würtzen PA, Lund G, Lund K, Arvidsson M, Rak S, Ipsen H. A double-blind placebo-controlled birch allergy vaccination study II: correlation between inhibition of IgE binding, histamine release and facilitated allergen presentation. Clin Exp Allergy. 2008;38:1290-1301. [PubMed] [DOI] |
| 58. | Dhaliwal B, Pang MO, Keeble AH, James LK, Gould HJ, McDonnell JM, Sutton BJ, Beavil AJ. IgE binds asymmetrically to its B cell receptor CD23. Sci Rep. 2017;7:45533. [PubMed] [DOI] |
| 59. | Selb R, Eckl-Dorna J, Twaroch TE, Lupinek C, Teufelberger A, Hofer G, Focke-Tejkl M, Gepp B, Linhart B, Breiteneder H. Critical and direct involvement of the CD23 stalk region in IgE binding. J Allergy Clin Immunol. 2017;139:281-289.e5. [PubMed] [DOI] |
| 60. | Carlsson F, Hjelm F, Conrad DH, Heyman B. IgE enhances specific antibody and T-cell responses in mice overexpressing CD23. Scand J Immunol. 2007;66:261-270. [PubMed] [DOI] |
| 61. | 笪 宇蓉, 邢 军, 董 学易, 宋 春华, 段 宏泉, 杨 洁. YD383和YD439对IL-4诱导的BJAB细胞CD23表达的影响. 天津医药. 2011;39:243-246. [DOI] |
| 62. | Hongqin T, Xinyu L, Heng G, Lanfang X, Yongfang W, Shasha S. Triptolide inhibits IFN-γ signaling via the Jak/STAT pathway in HaCaT keratinocytes. Phytother Res. 2011;25:1678-1685. [PubMed] [DOI] |
| 64. | Hagel I, Di Prisco MC, Goldblatt J, Le Souëf PN. The role of parasites in genetic susceptibility to allergy: IgE, helminthic infection and allergy, and the evolution of the human immune system. Clin Rev Allergy Immunol. 2004;26:75-83. [PubMed] [DOI] |
| 65. | Tsuji H, Miyoshi S, Ikegami Y, Hida N, Asada H, Togashi I, Suzuki J, Satake M, Nakamizo H, Tanaka M. Xenografted human amniotic membrane-derived mesenchymal stem cells are immunologically tolerated and transdifferentiated into cardiomyocytes. Circ Res. 2010;106:1613-1623. [PubMed] [DOI] |
| 66. | Mukai K, Karasuyama H, Kabashima K, Kubo M, Galli SJ. Differences in the Importance of Mast Cells, Basophils, IgE, and IgG versus That of CD4+ T Cells and ILC2 Cells in Primary and Secondary Immunity to Strongyloides venezuelensis. Infect Immun. 2017;85. [PubMed] [DOI] |
| 67. | Strandmark J, Rausch S, Hartmann S. Eosinophils in Homeostasis and Their Contrasting Roles during Inflammation and Helminth Infections. Crit Rev Immunol. 2016;36:193-238. [PubMed] [DOI] |
| 69. | Huang L, Appleton JA. Eosinophils in Helminth Infection: Defenders and Dupes. Trends Parasitol. 2016;32:798-807. [PubMed] [DOI] |
| 70. | Mukai K, Tsai M, Starkl P, Marichal T, Galli SJ. IgE and mast cells in host defense against parasites and venoms. Semin Immunopathol. 2016;38:581-603. [PubMed] [DOI] |
| 71. | 郭 爱叶, 蔺 西萌, 张 玉琴, 吴 惠. 细胞因子IL-4、IL-9和IgE在肠道蠕虫感染者中的水平及临床意义. 中国寄生虫学与寄生虫病杂志. 2015;33:110-113. |
| 72. | Kim EH, Burks W. Immunological basis of food allergy (IgE-mediated, non-IgE-mediated, and tolerance). Chem Immunol Allergy. 2015;101:8-17. [PubMed] [DOI] |
| 73. | El-Zaatari M, Kao JY. Role of Dietary Metabolites in Regulating the Host Immune Response in Gastrointestinal Disease. Front Immunol. 2017;8:51. [PubMed] [DOI] |
| 74. | Burton OT, Noval Rivas M, Zhou JS, Logsdon SL, Darling AR, Koleoglou KJ, Roers A, Houshyar H, Crackower MA, Chatila TA. Immunoglobulin E signal inhibition during allergen ingestion leads to reversal of established food allergy and induction of regulatory T cells. Immunity. 2014;41:141-151. [PubMed] [DOI] |
| 75. | Czaja-Bulsa G, Bulsa M. The natural history of IgE mediated wheat allergy in children with dominant gastrointestinal symptoms. Allergy Asthma Clin Immunol. 2014;10:12. [PubMed] [DOI] |
| 76. | Shah A, Gera K. Immediate hypersensitivity reaction with mango. Pneumonol Alergol Pol. 2014;82:445-453. [PubMed] [DOI] |
| 77. | Liang M, Zhang LW, Zhu MH, Chen YG. Clinical significance of determination of serum IgE in infants with milk allergy. Zhongguo Dangdai Erke Zazhi. 2015;17:618-622. [PubMed] [DOI] |
| 79. | Lee SP, Lee SY, Kim JH, Sung IK, Park HS, Shim CS, Moon HW. Correlation between Helicobacter pylori infection, IgE hypersensitivity, and allergic disease in Korean adults. Helicobacter. 2015;20:49-55. [PubMed] [DOI] |
| 80. | Konturek PC, Rienecker H, Hahn EG, Raithel M. Helicobacter pylori as a protective factor against food allergy. Med Sci Monit. 2008;14:CR452-CR458. [PubMed] |
| 81. | Kyburz A, Urban S, Altobelli A, Floess S, Huehn J, Cover TL, Müller A. Helicobacter pylori and its secreted immunomodulator VacA protect against anaphylaxis in experimental models of food allergy. Clin Exp Allergy. 2017;47:1331-1341. [PubMed] [DOI] |
| 82. | Davies AM, Allan EG, Keeble AH, Delgado J, Cossins BP, Mitropoulou AN, Pang MOY, Ceska T, Beavil AJ, Craggs G. Allosteric mechanism of action of the therapeutic anti-IgE antibody omalizumab. J Biol Chem. 2017;292:9975-9987. [PubMed] [DOI] |