修回日期: 2018-05-31
接受日期: 2018-06-02
在线出版日期: 2018-07-08
放射性125I粒子植入作为近距离组织间植入放疗手段治疗恶性肿瘤已被证实为一种安全、有效的手段. 虽然125I粒子植入治疗恶性肿瘤转移瘤的有效性已被国内外广泛认可, 但对于照射剂量的选择并没有确切的标准. 肾上腺血供丰富, 是恶性肿瘤常见的转移部位, 左肾上腺与胃毗邻, CT引导下125I放射性粒子植入治疗肾上腺转移癌疗效确切, 但可能会对周围脏器造成一定损害. 临床上对于合并左肾上腺转移癌并行放射性粒子植入治疗的患者, 应当警惕透壁性胃溃疡的发生, 在行此治疗时应尽量选用低活度粒子, 减轻放射性粒子对肿瘤周围正常组织结构造的损伤.
核心提要: 病例报告1例肾上腺转移瘤125I放射性粒子植入术后并发透壁性胃溃疡, 对于左肾上腺转移癌并行放射性粒子植入治疗的患者, 应选择CT引导下精准植入粒子, 尽量选用低活度粒子, 减轻对周围正常组织的损伤, 延长患者生存期.
引文著录: 董俊成, 孙燕滨, 姜开通. 肾上腺转移瘤125I放射性粒子植入术后并发透壁性胃溃疡1例报道及文献复习. 世界华人消化杂志 2018; 26(19): 1212-1218
Revised: May 31, 2018
Accepted: June 2, 2018
Published online: July 8, 2018
Radioactive 125I seed implantation as a means of radiotherapy for malignant tumors has been proved to be safe and effective. Although the effectiveness of 125I seed implantation in the treatment of tumor metastases has been widely recognized, there is still no standard for the selection of radiation doses. Adrenal blood supply is abundant, and it is a common metastatic site for malignant tumors. CT-guided radioactive 125I seed implantation is effective in treating adrenal metastases. However, it may cause certain damage to surrounding organs, especially the stomach. Clinically, for patients with left adrenal metastatic carcinoma and concurrent radioactive seed implantation, the occurrence of permeable gastric ulcer should not be neglected. In order to reduce the effect of radioactive particles on the normal tissue structure around the tumor, low-activity particles should be used.
- Citation: Dong JC, Sun YB, Jiang KT. Permeable gastric ulcer caused by radioactive 125I seed implantation for adrenal metastasis: A case report and literatures review. Shijie Huaren Xiaohua Zazhi 2018; 26(19): 1212-1218
- URL: https://www.wjgnet.com/1009-3079/full/v26/i19/1212.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v26.i19.1212
放射性125I粒子组织间植入是指将放射源植入肿瘤内或受肿瘤侵犯的组织中, 通过其持续发出低能量γ射线, 对靶区肿瘤产生高剂量杀伤作用, 并且具有对周围正常组织损伤小、易防护等优势[1]. 胃溃疡的发生是一种或者多种侵袭因素对黏膜破坏超过黏膜抵御损伤和自身恢复能力所导致的一种疾病. 在解剖位置上, 胃与左肾上腺毗邻, 位于左肾上腺的前面, 周围脏器的病变也可能蔓延导致胃组织的损伤. CT引导下125I放射性粒子植入治疗肾上腺转移癌疗效确切[2], 但其对周围脏器损伤的相关报道及临床研究较少, 对于125I放射性粒子植入导致透壁性胃溃疡的报道更为鲜有, 现将1例左肾上腺转移瘤125I放射性粒子植入术后并发透壁性胃溃疡的病例报道如下.
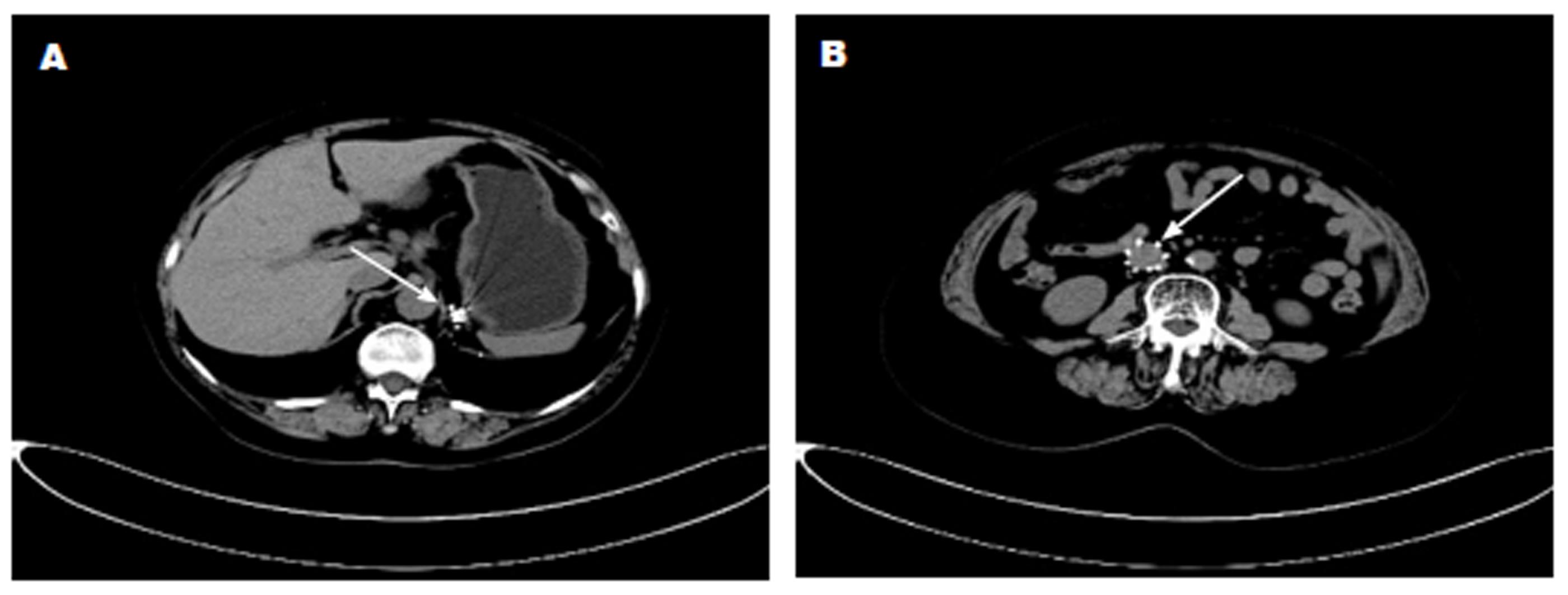
患者, 女, 56岁, 因"上腹部隐痛伴恶心、呕吐3 mo余"于2017-02-14入住临沂市人民医院. 既往病史: 子宫内膜癌术后化疗2年余, 下腔静脉滤器植入术后2年, 左肾上腺转移癌粒子植入术后1年余. 入院查体: 生命体征平稳, 神志略差, 营养差, 贫血貌, 腹平坦, 上腹部剑突下压痛, 触之硬,余未见异常. 实验室检查: 红细胞2.21×109/L, 血红蛋白59.0 g/L, 血小板382×109/L, 红细胞压积18.90%, 平均红细胞体积85.5fl. 影像学检查: 2016-11-04于我院行腹部强化CT: 左肾上腺区簇状金属影, 未见明显肿块; 右侧肾上腺未见异常. 胃充盈好, 壁不厚, 肠管未见异常. 子宫缺如, 膀胱充盈好, 双侧附件区未见异常密度. 肾静脉以下水平下腔静脉内见滤器影, 腹腔、腹膜后未见肿大淋巴结(图1).
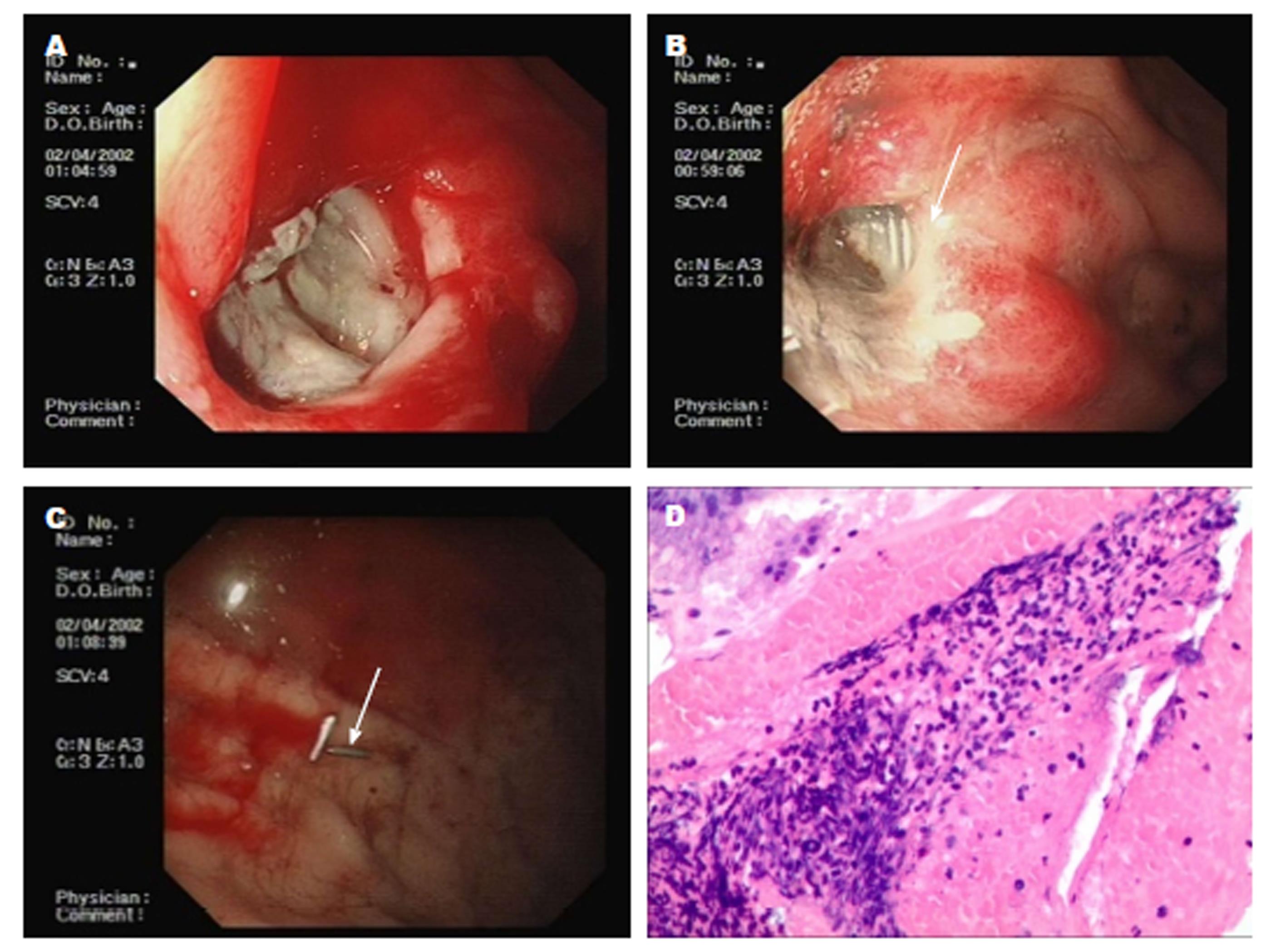
入院后给予抑酸护胃、止血、输血、能量支持及对症治疗, 症状好转后于2017-02-16行胃镜检查示: 胃腔内见较多暗红色血液, 胃体上段后壁可见一深溃疡, 底覆白苔, 边缘少量渗血, 冲洗后可见圆柱形金属物2枚, 再冲洗后见两枚长约4.5 mm金属条滞留于胃腔内, 结合患者病史, 考虑为左肾上腺肿瘤植入的放射性粒子, 咨询我院核医学科, 粒子已无放射性, 以活检钳取出1枚, 并于溃疡边缘取检3块, 质脆. 胃镜诊断: 胃溃疡并出血、穿孔, 肾上腺肿瘤放射性粒子植入术后肾上腺胃漏. 胃镜活检病理: (胃体后壁)黏膜慢性炎(轻度)记性活动(中度)伴感染坏死(图2).
放射性粒子组织间近距离治疗肿瘤已有100多年的历史. 1901年法国Pierre Curie首先提出近距离治疗的概念, 其定义是将具有包壳的放射性核素直接植入到肿瘤组织内, 通过核素持续释放射线达到对肿瘤细胞杀伤的目的. 放射性125I粒子植入是一种低剂量率、持续照射、可反复植入的近距离照射技术. 放射性125I粒子是由一根银棒吸附放射性125I核素、钛合金外壳封装组成的一种微型密封放射源.外包壳材料钛管外径 0.8 mm, 长度4.5 mm, 壁厚0.05 mm内核材料银丝尺寸0.5 mm×3 mm, 银丝表层镀有125I核素; 半衰期为59.6 d; 平均持续释放35.5 keVγ射线和27.4-31.5 keV的特征X射线和电子线,属低能放射性核素,其中部分低能射线被钛壳吸收; 组织穿透距离为1.7-2.0 cm, 而在铅中的半价层(half valuelayer, HVL)为0.25 mm, 易于隔离与防护[3]. 钛合金外壳隔绝了参与人体代谢的放射性元素与人体内环境的接触,防止放射泄露, 避免了放射源的丢失以及对周围环境的核污染.
125I放射性粒子植入治疗肿瘤主要通过释放低能的x、γ射线, 通过多种作用机制损伤肿瘤细胞. 一方面x、γ射线可使肿瘤细胞核DNA分子链中单链及双链断裂,电离水分子产生自由基, 进而引起肿瘤细胞的不可逆性损伤[4]. γ射线波长短、频率高, 具有较高的能量, 可直接损伤肿瘤细胞的DNA, 诱导肿瘤细胞凋亡[5]. 另一方面, 放射线可明显降低细胞内信号传导速率, 激活与细胞凋亡相关的基因, 肿瘤细胞失去活性而凋亡[6]. 此外放射线损伤细胞DNA后, 细胞停滞于细胞周期检查点, 进行损伤修复, 而125I粒子的持续性照射, 可持续损伤处于自我修复的细胞, 叠加细胞损伤效应, 细胞增殖停滞[7,8]. 另有研究表明125I粒子抑制血管内皮生长因子、碱性成纤维生长因子、缺氧诱导因子等的表达, 从而抑制肿瘤血管生成, 肿瘤生长受到抑制[9-12].
理论上由于其低能量及有效作用距离为2 cm以内, 正常组织不受损伤或仅有微小损伤[13], 且目前多采用超声引导下或CT引导下粒子植入, CT可以准确显示瘤体的外形、大小、位置、病灶内部的坏死空腔区及与周围器官或组织的解剖关系[14], 并通过精准实施治疗计划系统以精确计算靶区剂量, 对肿瘤细胞进行精准照射, 减少周围正常组织和重要器官受到的辐射损伤, 在显著提高疗效的同时, 能够降低并发症的发生. 但因肿瘤内近距离植入治疗是直接将粒源植入靶区, 不可避免的会对周围正常组织产生辐射并引起不同程度损伤.
国内外临床研究显示, 125I粒子组织间植入治疗盆腔恶性肿瘤, 包括复发或转移性的结直肠癌、卵巢癌、宫颈癌、骨肿瘤等, 以及在头部肿瘤、肺癌等方面可有效控制局部肿瘤, 缓解临床症状, 从而改善患者生活质量, 延长生存期. Sharma等[15]对21例妇科盆腔恶性肿瘤行125I粒子植入治疗, 15例完全缓解, 3例部分缓解, 临床有效率达85.7%, 认为125I粒子为治疗复发性盆腔恶性肿瘤提供了有效可行的选择. 其植入相关并发症包括出血、疼痛、感染、坐骨神经损伤、粒子移位等. 范卫君等[16]对18例复发性盆腔恶性肿瘤行粒子植入, 1例出现粒子迁移, 未出现邻近重要脏器损伤等严重并发症. 照射相关并发症主要包括组织纤维化、瘘道形成、放射性膀胱炎、放射性肠炎. 瘘道形成是较为严重的并发症, 包括直肠阴道瘘、膀胱阴道瘘、直肠尿道瘘等, 严重影响患者生存质量. Sharma等[15]对21例经手术或外放疗后复发的妇科盆腔恶性肿瘤行125I粒子植入, 4例出现膀胱阴道瘘, 21例出现直肠阴道瘘. 放射性肠炎的发生与结肠黏膜管腔隐窝内小动脉水肿和纤维化有关, 纤维化持续进展可导致管腔黏膜层松脆, 容易引起出血[17]. 张福君等[18]报道30例125I粒子治疗盆腔恶性肿瘤, 远期并发症有3例出现放射性肠炎, 1例出现放射性膀胱炎. Meng等[19]报道17例头颈部复发恶性肿瘤患者行在CT或超声引导下125I植入治疗, 中位局部控制时间是10 mo, 1年和2年局部控制率是66.5%和49.9%, 1年和2年生存率是51.3%和38.5%, 没有病人出现4级毒性反应; 放射性125I粒子近距离植入治疗头颈部肿瘤的并发症多为局部反应, 未见明显全身副作用; 其局部反应为局部皮肤色素沉着、皮肤破溃、窦道形成[20], 伤口愈合延迟、放射性乳突炎、听力受损等[21], 对肝、肾、骨髓等重要器官的影响不明显. Jiang等[22]人的报道也证实了以上观点, 即放射性125I粒子在头颈部肿瘤应用中并发症发生率约50%左右, 主要为皮肤溃疡损伤. 125I粒子植入治疗在肺癌治疗方面同样应用广泛. 研究发现, 与单纯化疗相比, 125I联合化疗治疗Ⅲ期肺癌患者的无进展生存期明显延长[23]. Hilaris等[24]分析术后联合近距离放疗与术后联合外放疗治疗的Ⅲ期合并纵隔淋巴结转移的肺癌患者,其联合近距离放疗患者肿瘤的局部控制率从63%升至76%, 2年生存率为51%, 中位生存期为26 mo, 表明放射性粒子125I对中晚期肺癌患者有良好的疗效. 其常见并发症为气胸、咯血、急性放射性肺炎、食管气管瘘、肺栓塞等, 以气胸及咯血较为多见. 明华等[25]对15例肺癌患者植入放射性粒子治疗肿瘤, 其中3例出现咯血, 2例出现气胸, 1例粒子脱落. 此外放射性粒子还可能出现游走迁移, Eshleman等[26]研究发现, 100例前列腺癌患者经放射性粒子植入后, 肺迁移发生率为55%. 此外, 急性放射性相关性肺炎、肺纤维化等并发症时有发生[27,28].
125I粒子植入在胃肠道肿瘤治疗方面同样广泛应用. 汪浩等[29]人对放射性125I粒子治疗中晚期胰腺癌的Meta分析结果显示, 纳入研究的689名患者中125I粒子植入组患者的总体客观缓解率、6 mo生存率、12 mo生存率和疼痛缓解率均显著优于对照组, 但两组患者之间的2年生存率和总体不良反应发生率差异无统计学差异. 其中359名患者性125I粒子植入, 随访中发现有8例患者发生粒子移位但均未引起严重并发症. 既往研究显示胰腺癌125I粒子植入术后并发症有胰瘘、胆道瘘及胃肠道出血等[30], 郭小陪等[31]对胰腺癌患者放射治疗后观察胃镜下胃、十二指肠黏膜的损伤情况, 胃镜检查可见Ⅳ级放射性损伤, 表现为十二指肠球部、降段黏膜明显充血、水肿, 溃疡形成, 表面覆着白苔. 梅雀林等[32]研究放射性125I粒子植入肝组织, 植入后粒源局部出现大片状凝固性坏死, 而谷草转氨酶、总胆红素、血肌酐、尿素氮、血红蛋白、白细胞和血小板计数没有明显变化. 直肠癌125I粒子植入术后可引起肠壁水肿、不完全肠梗阻等[33]. 本例报道为肾上腺转移瘤125I放射性粒子植入术后并发透壁性胃溃疡.
胃溃疡的发生是一种或者多种侵袭损害因素对黏膜破坏超过黏膜抵御损伤及自身修复能力所能引起的综合结果. 放疗、幽门螺旋杆菌感染、服用非甾体类抗炎药、应激等损伤因素皆可导致胃黏膜损伤, 最后导致溃疡的发生. 本例患者肾上腺转移瘤125I放射性粒子植入术后并发透壁性胃溃疡, 实质是放射性因素对胃黏膜损伤超过黏膜自我修复能力导致. 放射性胃损伤实质是一个炎症过程, Indaram等[34]人报道炎性因子如白细胞介素、IL-6、IL-8在放射性胃肠炎的患者中显著增加. 胃肠黏膜分泌的胃酸、胆汁、各种酶类、黏多糖等化学物质组成了化学屏障. 放射线可以造成这些化学物质的细胞出现水肿、坏死, 继而引发各种消化酶及相关化学物质的减少, 导致胃肠黏膜的化学屏障破坏[35]. 生物屏障由正常的胃肠道微生物群构成, 双歧杆菌、乳酸杆菌是最重要的两种细菌, 其产生的脂肪酸通过降低肠道pH值来破坏病原菌的生长环境[36]. Touchefeu等[37]研究表明辐射诱导使肠道微生物群主要成分发生变化, 这些变化可促进黏膜炎的发生. 放射性胃肠反应主要表现为腹痛、纳差、恶心呕吐, 重者便血、呕血. 内镜下具有如下情况之一称之为放射性胃、十二指肠并发症: (1)放疗后内镜检查可见胃、十二指肠黏膜破损、放射性溃疡直径>3 mm, 破损深度明显可见; (2)照射区域因黏膜损伤, 并出现自发的、活动性出血, 需要内镜下止血治疗; (3)放疗后行内镜检查或X线片、螺旋断层摄影发现的放射相关的胃肠穿孔[38,39].
本例患者左肾上腺转移癌粒子植入术后1年余, 随访临床资料粒子植入对于控制左肾上腺肿瘤病情进展取得一定的疗效, 但同时本例患者出现了上腹部隐痛伴恶心、呕吐等消化系统症状, 入院后完善相关检查可明确诊断为: 胃溃疡并出血, 肾上腺肿瘤放射性粒子植入术后并发穿透性胃溃疡. 仔细询问病史, 患者并无溃疡家族史、无饮食不规律、无服用非甾体类药物等病史, 而且从胃溃疡处发现裸露的金属棒状粒子, 胃腔内也发现脱落的粒子, 考虑可能的病因是与放射性粒子植入导致的副作用相关. 由于腹部脏器解剖关系, 放射性粒子植入位置贴近胃壁或直接种植于胃壁上, 或可能由于后期粒子移位, 导致胃壁长期受到近距离放射源的放射性损害, 同时患者合并子宫内膜癌、肾上腺转移癌等恶性肿瘤打击因素, 长期慢性消耗性疾病可能导致消化系统黏膜供血相对不足, 导致胃黏膜对放射性损害更敏感. 以上多种因素同时协作导致胃黏膜损伤、水肿、出血, 从而导致溃疡穿孔发生.
因此在临床工作中, 对于左肾上腺转移癌等行放射性粒子植入治疗的患者, 应当警惕胃溃疡的发生; 同时应行CT引导下精准植入粒子, 尽量选用低活度粒子, 减轻放射性粒子对肿瘤周围正常组织结构造成损害, 特别是要避开重要的脏器与大血管, 避免造成致命性的损害; 此外对于应用放射性粒子治疗的病人, 是否应给予胃黏膜保护药物治疗预防放射性损伤等问题应引起临床重视.
患者主要症状为: 上腹部隐痛伴恶心、呕吐3 mo余.
结合患者病史、症状体征及辅助检查结果, 诊断为: (1)胃溃疡; (2)左肾上腺转移癌粒子植入术后; (3)子宫内膜癌术后; (4)下腔静脉滤器植入术后; (5)重度贫血.
患者中年女性, 慢性病程, 上腹部隐痛伴恶心、呕吐3 mo余, 合并慢性消耗性疾病, 应与慢性胃炎、溃疡型胃癌、卓-艾综合征进行鉴别.
患者血常规检查结果: 红细胞2.21×109/L, 血红蛋白59.0 g/L, 血小板382×109/L, 红细胞压积18.90%, 平均红细胞体积85.5fl. 提示重度贫血.
腹部强化CT示: 子宫癌肉瘤术后; 左肾上腺转移瘤粒子植入术后; 下腔静脉滤器置入术后.
胃镜活检标本经HE染色处理, 200倍显微镜下观察, 病理结果: (胃体后壁)黏膜慢性炎(轻度)炎性活动(中度)伴感染坏死.
入院后予抑酸护胃、止血、输血、能量支持及对症治疗, 症状好转后行胃镜检查可见胃体上段后壁一深溃疡, 冲洗后见两枚长约4.5 mm放射性粒子条滞留于胃腔, 以活检钳取出1枚, 并于溃疡边缘取检3块送病理.
郭小陪等胃镜下观察行125I粒子植入术放射治疗的胰腺癌患者的胃、十二指肠黏膜的损伤情况, 研究发现此类患者胃镜下表现为十二指肠球部、降段黏膜明显充血、水肿, 溃疡形成, 表面覆着白苔.
透壁性溃疡: 透壁性溃疡是指溃疡较深, 以致于穿透胃壁的全层, 但被邻近的组织和器官所阻隔, 不与腹腔相通, 形成包裹或者与邻近器官发生黏连甚至穿透入邻近的器官. 发生于胃者称之为透壁性胃溃疡, 发生于十二指肠者称之为透壁性十二指肠溃疡. 胃的透壁性溃疡可以向附近的胰、脾、肝、胆等器官穿透, 以穿透入胰腺者最为多见.
临床中要详细询问患者既往病史及收集患者既往就诊资料, 根据患者临床表现完善相关检查, 明确病因. 对于腹腔肿瘤行放射性粒子植入治疗的患者, 应选择CT引导下精准植入粒子, 并尽量选用低活度粒子, 减轻放射性粒子对周围组织的损伤, 同时临床治疗过程中注意放射性粒子对周围组织造成的可能的损害, 早期发现早期治疗.
学科分类: 胃肠病学和肝病学
手稿来源地: 山东省
同行评议报告分类
A级 (优秀): A
B级 (非常好): 0
C级 (良好): C
D级 (一般): 0
E级 (差): 0
编辑: 马亚娟 电编:张砚梁
| 1. | 王 娟, 王 建华, 张 建波, 张 宏涛, 胡 智慧, 徐 建彬, 赵 静. 放射性125I粒子对家兔正常门静脉早期放射性损伤的实验研究. 中国微创外科杂志. 2010;10:650-654. [DOI] |
| 5. | El-Absy MA, Aly HF, Mousa MA, Mostafa M. Sequential distillation of fission-produced radioiodine and radioruthenium from sulfuric acid solution. J Radioanal Nucl Chem. 2004;261:163-172. [DOI] |
| 6. | Pinthus JH, Bryskin I, Trachtenberg J, Lu JP, Singh G, Fridman E, Wilson BC. Androgen induces adaptation to oxidative stress in prostate cancer: implications for treatment with radiation therapy. Neoplasia. 2007;9:68-80. [PubMed] [DOI] |
| 7. | Ma ZH, Yang Y, Zou L, Luo KY. 125I seed irradiation induces up-regulation of the genes associated with apoptosis and cell cycle arrest and inhibits growth of gastric cancer xenografts. J Exp Clin Cancer Res. 2012;31:61. [PubMed] [DOI] |
| 8. | Ma JX, Jin ZD, Si PR, Liu Y, Lu Z, Wu HY, Pan X, Wang LW, Gong YF, Gao J. Continuous and low-energy 125I seed irradiation changes DNA methyltransferases expression patterns and inhibits pancreatic cancer tumor growth. J Exp Clin Cancer Res. 2011;30:35. [PubMed] [DOI] |
| 9. | Sugawara A, Nakashima J, Shigematsu N, Kunieda E, Kubo A. Prediction of seed migration after transperineal interstitial prostate brachytherapy with I-125 free seeds. Brachytherapy. 2009;8:52-56. [PubMed] [DOI] |
| 10. | Gassmann M, Chilov D, Wenger RH. Regulation of the hypoxia-inducible factor-1 alpha. ARNT is not necessary for hypoxic induction of HIF-1 alpha in the nucleus. Adv Exp Med Biol. 2000;475:87-99. [PubMed] [DOI] |
| 13. | 罗 开元, 杨 凌, 杨 嵘, 杨 镛, 吴 松年. 实用组织间植入内放射治疗恶性肿瘤学. 北京: 人民卫生出版社 2008; 80. |
| 15. | Sharma SK, Forgione H, Isaacs JH. Iodine-125 interstitial implants as salvage therapy for recurrent gynecologic malignancies. Cancer. 1991;67:2467-2471. [PubMed] [DOI] |
| 16. | 范 卫君, 张 亮, 张 福君, 吴 沛宏, 王 俊杰, 黄 金华, 顾 仰葵, 赵 明, 李 传行, 高 飞. CT导向下125I粒子植入治疗复发性盆腔恶性肿瘤. 中国微创外科杂志. 2007;7:127-129. [DOI] |
| 17. | Donner CS. Pathophysiology and therapy of chronic radiation-induced injury to the colon. Dig Dis. 1998;16:253-261. [PubMed] [DOI] |
| 18. | 张 福君, 焦 德超, 李 传行, 吴 沛宏, 段 光峰, 吴 月霞. CT导向下125I粒子植入治疗复发/转移性盆腔恶性肿瘤的近中期疗效评价. 中华医学杂志. 2008;88:3063-3067. [DOI] |
| 19. | Meng N, Jiang YL, Wang JJ, Ran WQ, Yuan HS, Qu A, Jiang P, Yang RJ. Permanent implantation of iodine-125 seeds as a salvage therapy for recurrent head and neck carcinoma after radiotherapy. Cancer Invest. 2012;30:236-242. [PubMed] [DOI] |
| 20. | Vikram B, Mishra S. Permanent iodine-125 implants in postoperative radiotherapy for head and neck cancer with positive surgical margins. Head Neck. 1994;16:155-157. [PubMed] [DOI] |
| 21. | Smith RV, Krevitt L, Yi SM, Beitler JJ. Early wound complications in advanced head and neck cancer treated with surgery and Ir 192 brachytherapy. Laryngoscope. 2000;110:8-12. [PubMed] [DOI] |
| 22. | Jiang YL, Meng N, Wang JJ, Jiang P, Yuan HSh, Liu C, Qu A, Yang RJ. CT-guided iodine-125 seed permanent implantation for recurrent head and neck cancers. Radiat Oncol. 2010;5:68. [PubMed] [DOI] |
| 23. | Yu X, Li J, Zhong X, He J. Combination of Iodine-125 brachytherapy and chemotherapy for locally recurrent stage III non-small cell lung cancer after concurrent chemoradiotherapy. BMC Cancer. 2015;15:656. [PubMed] [DOI] |
| 24. | Hilaris BS, Gomez J, Nori D, Anderson LL, Martini N. Combined surgery, intraoperative brachytherapy, and postoperative external radiation in stage III non-small cell lung cancer. Cancer. 1985;55:1226-1231. [PubMed] [DOI] |
| 25. | 明 华, 邹 春华, 周 青春, 黄 涛金, 官 泳松. 125I粒子植入联合动脉化疗治疗晚期非小细胞肺癌. 中华介入放射学电子杂志. 2014;2:42-46. |
| 26. | Eshleman JS, Davis BJ, Pisansky TM, Wilson TM, Haddock MG, King BF, Darby CH, Lajoie WN, Oberg AL. Radioactive seed migration to the chest after transperineal interstitial prostate brachytherapy: extraprostatic seed placement correlates with migration. Int J Radiat Oncol Biol Phys. 2004;59:419-425. [PubMed] [DOI] |
| 27. | Chen A, Galloway M, Landreneau R, d'Amato T, Colonias A, Karlovits S, Quinn A, Santucci T, Kalnicki S, Brown D. Intraoperative 125I brachytherapy for high-risk stage I non-small cell lung carcinoma. Int J Radiat Oncol Biol Phys. 1999;44:1057-1063. [PubMed] [DOI] |
| 29. | 汪 浩, 霍 林, 霍 晓东, 王 丽丽, 侯 定坤, 臧 立, 王 金焕, 柴 树德, 王 俊杰, 王 海涛. CT引导下放射性125I粒子植入治疗中晚期胰腺癌的有效性和安全性的Meta分析. 中华放射医学与防护杂志. 2017;7:543-549. [DOI] |
| 30. | Peretz T, Nori D, Hilaris B, Manolatos S, Linares L, Harrison L, Anderson LL, Fuks Z, Brennan MF. Treatment of primary unresectable carcinoma of the pancreas with I-125 implantation. Int J Radiat Oncol Biol Phys. 1989;17:931-935. [PubMed] [DOI] |
| 33. | Martínez-Monge R, Nag S, Martin EW. 125Iodine brachytherapy for colorectal adenocarcinoma recurrent in the pelvis and paraortics. Int J Radiat Oncol Biol Phys. 1998;42:545-550. [PubMed] [DOI] |
| 34. | Alfonsi P, Slim K, Chauvin M, Mariani P, Faucheron JL, Fletcher D; Working Group of Société française d'anesthésie et réanimation (SFAR); Société française de chirurgie digestive (SFCD). French guidelines for enhanced recovery after elective colorectal surgery. J Visc Surg. 2014;151:65-79. [PubMed] [DOI] |
| 35. | Nguyen NP, Antoine JE, Dutta S, Karlsson U, Sallah S. Current concepts in radiation enteritis and implications for future clinical trials. Cancer. 2002;95:1151-1163. [PubMed] [DOI] |
| 36. | Turroni F, Marchesi JR, Foroni E, Gueimonde M, Shanahan F, Margolles A, van Sinderen D, Ventura M. Microbiomic analysis of the bifidobacterial population in the human distal gut. ISME J. 2009;3:745-751. [PubMed] [DOI] |
| 37. | Touchefeu Y, Montassier E, Nieman K, Gastinne T, Potel G, Bruley des Varannes S, Le Vacon F, de La Cochetière MF. Systematic review: the role of the gut microbiota in chemotherapy- or radiation-induced gastrointestinal mucositis - current evidence and potential clinical applications. Aliment Pharmacol Ther. 2014;40:409-421. [PubMed] [DOI] |
| 38. | Yeomans ND, Naesdal J. Systematic review: ulcer definition in NSAID ulcer prevention trials. Aliment Pharmacol Ther. 2008;27:465-472. [PubMed] [DOI] |
| 39. | Takatori K, Terashima K, Yoshida R, Horai A, Satake S, Ose T, Kitajima N, Kinoshita Y, Demizu Y, Fuwa N. Upper gastrointestinal complications associated with gemcitabine-concurrent proton radiotherapy for inoperable pancreatic cancer. J Gastroenterol. 2014;49:1074-1080. [PubMed] [DOI] |