修回日期: 2018-05-07
接受日期: 2018-05-19
在线出版日期: 2018-07-08
肝功能障碍相关凝血病的机制主要为大多数凝血因子和抗凝蛋白C、S合成减少, 血小板计数下降, 凝血因子Ⅷ和血管性假性血友病因子合成增加, 组织纤溶酶原激活物水平上调, 凝血状态可以呈现正常、高凝或低凝. 应用全血监测设备监测肝功能障碍患者, 可以准确判断凝血状态, 指导精准的替代治疗或抗凝治疗.
核心提要: 肝功能障碍相关凝血病可表现为高凝状态或者低凝状态, 常规凝血监测项目难以反映真实的凝血状态. 全血功能检测设备能够准确判断凝血状态, 协助临床进行精确抗凝或者替代治疗.
引文著录: 宋景春. 肝功能障碍相关凝血病的监测与应对. 世界华人消化杂志 2018; 26(19): 1156-1160
Revised: May 7, 2018
Accepted: May 19, 2018
Published online: July 8, 2018
Liver dysfunction-associated coagulopathy may manifest as hypercoagulation, hypocoagulation or normal coagulation, resulting in reduced synthesis of most coagulation factors, protein C and protein S, drop of platelet count, and increase of coagulation factor Ⅷ, Von Willebrand factor and tissue plasminogen activator. The use of viscoelastic coagulation monitoring equipment can accurately determine the coagulation state of patients with liver failure and guide accurate replacement therapy or anticoagulant therapy.
- Citation: Song JC. Monitoring and treatment of liver dysfunction-associated coagulopathy. Shijie Huaren Xiaohua Zazhi 2018; 26(19): 1156-1160
- URL: https://www.wjgnet.com/1009-3079/full/v26/i19/1156.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v26.i19.1156
肝功能障碍可引发复杂的凝血问题, 但是肝功能障碍相关凝血病的病理生理过程却常常被人忽视, 以致丧失最佳的治疗时机[1]. 肝衰竭的诊断标准中包括国际标准化比率(international normalized ratio, INR)的增高, 传统凝血实验检测项目如凝血酶原时间(prothrombin time, PT)、部分活化凝血酶原时间(partial thromboplastin time, PTT)或国际标准化比值(international normalized ratio, INR)等, 对急慢性肝脏疾病的检查结果常提示凝血状态为低凝, 并表现为出血倾向[2]. 近来较多研究显示, 很多急慢性肝功能障碍的患者不仅没有自身抗凝的证据, 反而整体上表现为高凝状态, 并在临床上出现血栓并发症[3]. 急性肝衰竭合并肝硬化的患者的出血体制更应归因于肝脏疾病本身带来的血流动力学异常, 比如门静脉和内脏血管压力的升高[4]. 应用传统的凝血项目来评价患者出血或者血栓的风险也越来越显现出局限性. 由于全血监测设备对凝血状态判断更加准确, 应用全血监测设备评估肝功能障碍时的出血或者血栓风险逐渐受到重视[5]. 同时, 全血监测设备也可用于指导精准替代治疗和抗凝治疗[6]. 因此, 本文重点介绍肝功能障碍相关凝血病的发病机制, 全血监测设备用于肝功能障碍相关凝血病的诊断方法和对治疗的指导作用.
血液凝固是细胞与凝血因子之间复杂的相互作用, 凝血稳态是基于促凝系统与抗凝系统、纤溶系统与抗纤溶系统之间的平衡状态. 因为绝大多数凝血因子都是肝脏合成, 慢性肝脏病的凝血因子水平都是减少的. 凝血因子水平下降可见于凝血因子Ⅰ、Ⅱ、Ⅴ、Ⅶ、Ⅸ、Ⅹ、Ⅺ、Ⅻ, 维生素K依赖的抗凝因子蛋白C、蛋白S和抗凝血酶Ⅲ水平也是下降的[7]. 肝硬化患者纤维蛋白原水平相对急性肝衰竭患者更低, 而急性肝衰竭患者其他的凝血因子水平较肝硬化患者更低. 凝血因子Ⅷ和血管性假性血友病因子(von willebrand factor, vWF)水平反而升高, 这是因为凝血因子Ⅷ和vWF是由血管内皮细胞合成. 肝脏疾病时, 为了平衡多数凝血因子水平下降带来的影响, 血管内皮细胞对凝血因子Ⅷ和vWF的合成明显增加, 血管性血友病因子裂解酶(a disintegrin and metalloprotease with thrombospondin 1 repeats, ADAMTS13)的活性也明显下降[8].
血小板也是维持凝血稳态的重要物质, 肝功能障碍时血小板数量通常是减少的. 具体原因主要有: (1)肝衰竭时门脉压力增高, 造成脾脏对血小板的扣留作用; (2)肝衰竭时肝脏细胞破坏, 导致肝脏合成的促血小板生成素(thrombopoietin, TPO)合成减少, 引起骨髓生成血小板的障碍[9]; (3)ADAMTS13的缺乏可导致vWF多聚体增多, vWF多聚体可激活血小板, 形成血小板性微血栓, 导致肝窦微循环障碍加重肝功能障碍[10,11]. 血小板消耗也是血小板减少的原因之一. 既往有临床研究尝试使用TPO促进血小板生成, 结果发现血小板计数增高也增加了血栓风险. 因此, 除了有出血并发症, 血小板输注也应避免.
纤溶系统与抗纤溶系统的平衡对凝血稳态也至关重要. 纤维蛋白原在肝细胞合成, 纤维蛋白原水平的降低本身就提示可能合成减少[12]. 纤维蛋白原被凝血酶激活形成纤维蛋白, 纤维蛋白再与血小板交联形成白血栓, 最后加入凝血因子ⅩⅢ形成稳定的血块. 肝病患者可以出现原发性纤溶亢进, 主要因为急慢性肝衰竭时, 组织纤溶酶原激活物(tissue plasminogen activator, tPA)水平可上调, 并促进纤维蛋白的降解. 同时具有激活纤溶抑制因子作用的纤溶酶原、抗纤维蛋白溶酶和凝血酶的水平下降, 也加重肝衰竭患者的纤溶亢进[13]. 但有部分肝衰竭患者表现为纤溶抑制, 主要原因与纤溶系统功能再平衡有关, 但详细机制尚不明确.
目前临床工作主要依靠传统凝血监测项目来判断肝功能障碍患者的凝血状态, 但PT、APTT仅能提供凝血因子活动的信息, 对内源性抗凝物质的判断没有任何帮助. 经常规凝血检测项目判断为低凝状态有出血倾向的肝功能障碍患者, 如果给予输注血制品, 反而会出现血栓并发症. 因此, 应用全血功能监测设备评估肝功能障碍相关凝血病的凝血状态是比较适宜的. 目前已经开展临床应用的全血凝血功能检测设备有血栓弹力图仪(thromboelastography, TEG)和旋转式血栓弹力装置(rotational thromboelastometry device, ROTEM)[14,15].
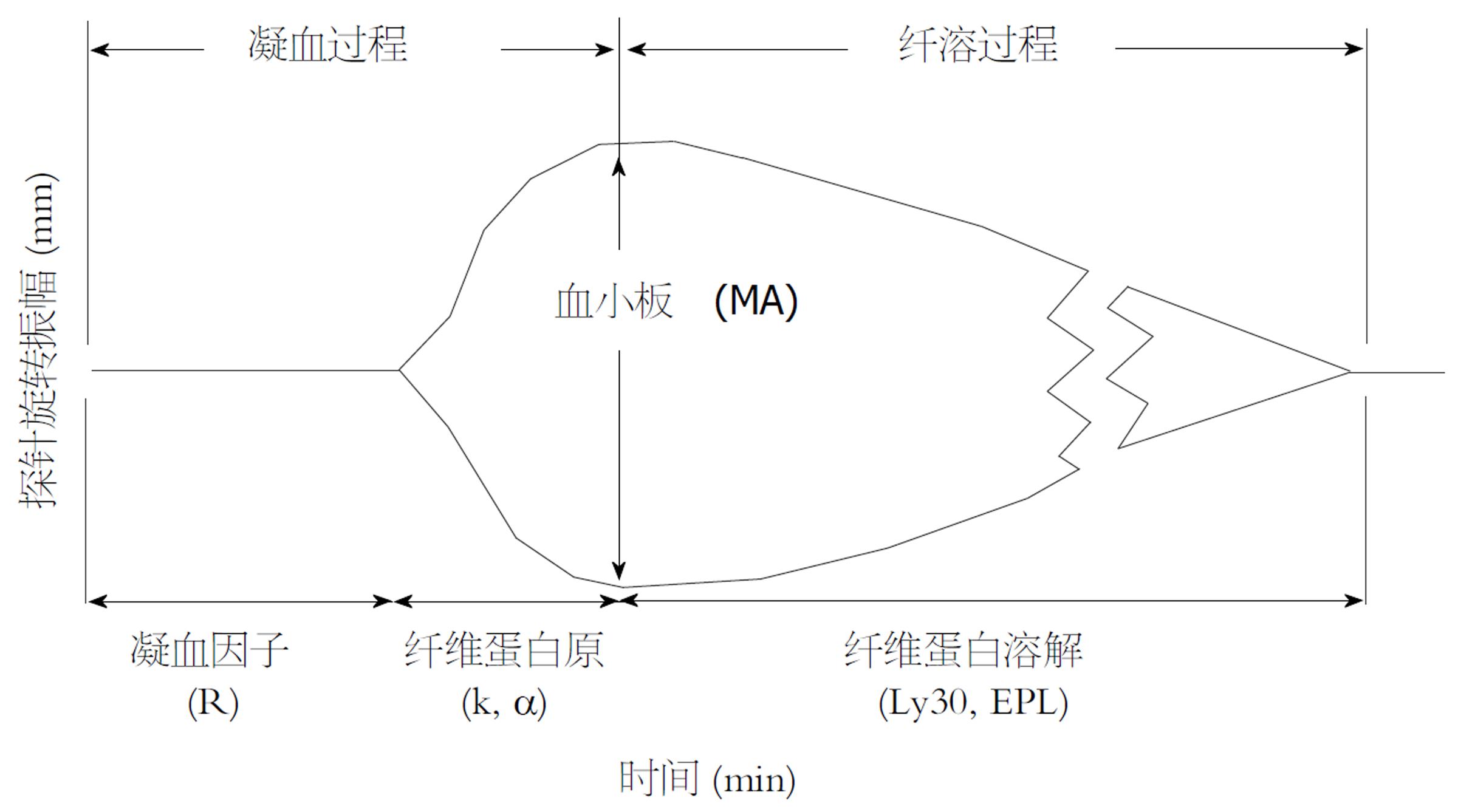
TEG曲线是由置于血标本检测杯中的金属探针受到血块形成的切应力作用, 在旋动过程中切割磁力线再经软件处理后形成. TEG的常用分析指标为R、K、α角、最大振幅、LY30和CI, 见图1[16]. R为反应时间, 反映参加凝血启动过程的凝血因子的综合作用. R值正常范围为4-8 min. K是从R时间终点到描记幅度达到20 mm所需的时间. K时间反映血凝块形成的速率, 代表纤维蛋白聚合并与血小板交互反应形成血块的过程, 正常值为1-4 min. α角是从血凝块形成点到描记图最大的曲线弧度处作切线与水平线的夹角, 正常范围为47-74°. α角度与K时间密切相关,影响因素均为纤维蛋白原和血小板. 最大振幅(maximum amplitude, MA), 反映血凝块的最大强度, 主要受血小板和凝血因子ⅩⅢ的影响, 正常值为55-73 mm. LY30表示测量在MA值确定后30 min内血凝块幅度减少的速率, 正常范围为0%-8%, 主要反映纤溶功能. CI是综合凝血指数, 反映样本在各种条件下凝血的综合状态(表1).
| LY30%>7.5%或EPL>15%表示高纤溶状态, 即纤溶亢进 | |||
| CI≥3高凝状态 | 当R<5 min时 | 凝血因子性高凝↑↑ | 有血栓风险 |
| 当 MA>70 mm时 | 血小板性高凝↑↑ | ||
| 当K<1 min/Angel>72°时 | 纤维蛋白原功能性高凝↑↑ | ||
| CI≤-3低凝状态 | 当R>10 min时 | 凝血因子性低凝↓↓ | 有出血倾向 |
| 当MA<50 mm时 | 血小板性低凝↓↓ | ||
| 当K>3 min/Angel<53°时 | 纤维蛋白原功能性低凝↓↓ | ||
| -3<CI<3 | 当R<5 min时 | 凝血因子功能偏高↑ | |
| 当R>10 min时 | 凝血因子功能偏低↓ | ||
| 当MA>70 mm时 | 血小板功能偏高↑ | ||
| 当MA<50 mm时 | 血小板功能偏低↓ | ||
| 当K<1 min/Angel>72°时 | 纤维蛋白原功能偏高↑ | ||
| 当K>3 min/Angel<53°时 | 纤维蛋白原功能偏低↓ | ||
| 当5 min<R<10 min, 50 mm<MA<70 mm, 1 min<K<3 min/53°<Angel<72°时, 凝血功能正常 | |||
除常规检测外, TEG还有肝素酶杯、血小板图和功能性纤维蛋白原杯3种检测方法. 肝素酶杯检测可以去除肝素对凝血状态的影响, 判断患者凝血真实状况, 并指导临床应用肝素剂量. 血小板图检测可以针对花生四烯酸或ADP受体监测服用阿司匹林或氯吡格雷等抗血小板药物患者的血小板抑制率, 指导抗血小板药物的使用. 纤维蛋白原功能检测是通过GPⅡb/Ⅲa受体拮抗剂完全抑制血小板聚集后, 再使用组织因子激活外源性凝血通路, 促进仅有纤维蛋白原参与的血块形成.
德国原研的ROTEM目前尚未在国内销售. 针对凝血过程的不同阶段, ROTEM也具有更多的检测类型, 如INTEM使用鞣花酸或磷脂作为诱导剂, 主要针对凝血的接触激活阶段; EXTEM使用组织因子作为诱导剂,主要针对外源性凝血途径; HEPTEM使用冻干肝素酶作为激活剂, 主要检测有无肝素的影响; APTEM使用抑肽酶作为激活剂, 主要用于检测纤溶过程; FIBTEM使用细胞松弛素作为激活剂, 主要用于分析纤维蛋白原成分; ECATEM使用蝰蛇毒作为激活剂, 主要用于分析直接凝血酶抑制剂.
现有临床研究发现, TEG与ROTEM相对于传统凝血检查项目可以更准确的判断肝功能障碍患者的凝血状态. Stravitz RT等应用TEG对51名急性肝衰竭患者进行检测, 研究结果显示8%的患者表现高凝状态, 16%的患者呈现低凝状态[17]. 急性肝衰竭患者临床症状有出血的患者, 其TEG的R值均明显延长, 但INR的异常与出血无明显相关[18]. 但目前尚缺乏有关全血监测设备对肝功能障碍相关凝血病具体诊断标准的推荐.
近年来国际上陆续发布了2014年亚太肝病协会慢加急性肝衰竭共识[19], 2017年欧洲肝病协会急性(爆发性)肝衰竭管理指南[20], 美国胃肠协会急性肝衰竭诊断和管理指南[21]等, 但这些指南对于凝血功能障碍的推荐意见比较有限, 并且缺乏有力的循证医学证据.
急慢性肝衰竭无明显凝血紊乱时不建议补充盲目补充血浆、凝血因子及血小板制剂. 除了食道静脉曲张破裂出血, 急慢性肝衰竭一般不容易出现自发性的活动性出血, 除非患者合并脓毒症后诱发高纤溶状态或者弥散性血管内凝血. 对显著凝血功能障碍者, 可在全血功能检测设备指导下补充新鲜血浆、凝血酶原复合物和纤维蛋白原等凝血因子, 血小板显著减少者可输注血小板. 肝衰竭合并出血或需进行有创操作(如颅内压监测)时需维持血小板计数>50×109/L-60×109/L, 纤维蛋白原>1.5 g/L, 血红蛋白目标为7 g/dL, 必要时也可考虑使用重组凝血因子Ⅶ(40 μg/kg). 对弥散性血管内凝血者可酌情给予小剂量低分子肝素或普通肝素, 对有纤溶亢进证据者, 如TEG LY30%>8%时, 可应用氨甲环酸等止血药物. 肝衰竭常合并维生素K缺乏, 故推荐常规使用维生素K(5-10 mg).
肝功能障碍患者也很容易并发深部静脉血栓, 肝硬化本身就是门静脉血栓的独立危险因素. 一项随机对照研究针对中重度肝硬化患者持续应用依诺肝素 4000 IU QD长达48 w来预防门静脉血栓, 结果显示死亡率和肝功能失代偿的发生率较未应用依诺肝素者下降[22,23]. 已经有多项临床研究使用低分子肝素治疗已经发生门静脉血栓的肝硬化患者, 结果显示血管再通率为36%-75%, 无效率为17%-53%, 并且没有出现出血等并发症[24-26]. 但是因为常规的INR或者抗Xa活性检测不能保证肝硬化患者抗凝治疗的安全性, 因此抗凝治疗也未得到诸多指南的明确推荐. Kapoor等[27]报道TEG检查显示肝硬化合并门静脉血栓患者呈现明显的高凝状态, 具体表现为R值缩短和MA升高, 但目前尚无应用全血监测设备指导抗凝治疗的研究报道.
肝功能障碍相关凝血病的机制比较复杂, 同时因为临床上缺乏有效的检测手段, 使得临床医生难于判断肝功能障碍时的凝血状态, 甚至常规凝血项目会带来低凝的伪像, 使得临床医生进行替代治疗, 反而促进血栓事件的发生. 又或者无法识别高凝状态, 导致不敢进行抗凝治疗, 也无法检测抗凝治疗的强度, 因为出血并发症的问题而丧失治疗时机. 应用全血监测设备监测急性肝功能障碍患者, 可以准确检测凝血状态, 进而给予患者恰当的替代治疗或抗凝治疗, 避免血栓栓塞或者出血的并发症. 这已经得到临床案例和部分临床研究的验证, 但是目前尚缺乏高质量的临床数据支持, 导致没有得到临床指南的推荐. 因此, 应用全血监测设备对肝功能障碍相关凝血病进行分期诊断, 早期预警相关血栓事件, 对抗凝方案进行合理检测, 这都是下一步研究的重点方向.
学科分类: 胃肠病学和肝病学
手稿来源地: 江西省
同行评议报告分类
A级 (优秀): 0
B级 (非常好): B, B, B
C级 (良好): 0
D级 (一般): D
E级 (差): 0
编辑: 马亚娟 电编:张砚梁
| 1. | Abuelkasem E, Tanaka KA, Planinsic RM. Recent update on coagulation management and hemostatic therapies in liver transplantation. Minerva Anestesiol. 2018;2:14. [PubMed] [DOI] |
| 2. | Mochida S, Nakayama N, Ido A, Inoue K, Genda T, Takikawa Y, Sakaida I, Terai S, Yokosuka O, Shimizu M. Proposed diagnostic criteria for acute-on-chronic liver failure in Japan. Hepatol Res. 2018;48:219-224. [PubMed] [DOI] |
| 3. | Scărlătescu E, Tomescu DR. Prothrombotic State in a Patient With Acute Liver Failure: The Question of Anticoagulation. Semin Cardiothorac Vasc Anesth. 2018;22:174-179. [PubMed] [DOI] |
| 4. | Fisher C, Patel VC, Stoy SH, Singanayagam A, Adelmeijer J, Wendon J, Shawcross DL, Lisman T, Bernal W. Balanced haemostasis with both hypo- and hyper-coagulable features in critically ill patients with acute-on-chronic-liver failure. J Crit Care. 2018;43:54-60. [PubMed] [DOI] |
| 5. | Dumitrescu G, Januszkiewicz A, Ågren A, Magnusson M, Wahlin S, Wernerman J. Thromboelastometry: Relation to the severity of liver cirrhosis in patients considered for liver transplantation. Medicine (Baltimore). 2017;96:e7101. [PubMed] [DOI] |
| 6. | Dötsch TM, Dirkmann D, Bezinover D, Hartmann M, Treckmann JW, Paul A, Saner FH. Assessment of standard laboratory tests and rotational thromboelastometry for the prediction of postoperative bleeding in liver transplantation. Br J Anaesth. 2017;119:402-410. [PubMed] [DOI] |
| 7. | Hoffman M. Coagulation in Liver Disease. Semin Thromb Hemost. 2015;41:447-454. [PubMed] [DOI] |
| 8. | Takaya H, Yoshiji H, Kawaratani H, Sakai K, Matsumoto M, Fujimura Y, Fukui H. Decreased activity of plasma ADAMTS13 are related to enhanced cytokinemia and endotoxemia in patients with acute liver failure. Biomed Rep. 2017;7:277-285. [PubMed] [DOI] |
| 9. | Giannini EG, Peck-Radosavljevic M. Platelet Dysfunction: Status of Thrombopoietin in Thrombocytopenia Associated with Chronic Liver Failure. Semin Thromb Hemost. 2015;41:455-461. [PubMed] [DOI] |
| 10. | Reuken PA, Kussmann A, Kiehntopf M, Budde U, Stallmach A, Claus RA, Bruns T. Imbalance of von Willebrand factor and its cleaving protease ADAMTS13 during systemic inflammation superimposed on advanced cirrhosis. Liver Int. 2015;35:37-45. [PubMed] [DOI] |
| 11. | Hugenholtz GC, Adelmeijer J, Meijers JC, Porte RJ, Stravitz RT, Lisman T. An unbalance between von Willebrand factor and ADAMTS13 in acute liver failure: implications for hemostasis and clinical outcome. Hepatology. 2013;58:752-761. [PubMed] [DOI] |
| 12. | Leebeek FW, Rijken DC. The Fibrinolytic Status in Liver Diseases. Semin Thromb Hemost. 2015;41:474-480. [PubMed] [DOI] |
| 13. | Oguz S, Tayar S, Topaloglu S, Calik A, Dinc H, Ozturk MH. Enhancing Hepatic Microcirculation in Postoperative Hepatic Failure With Intra-arterial Recombinant Tissue Plasminogen Activator Treatment. Exp Clin Transplant. 2017;0074. [PubMed] [DOI] |
| 14. | Abuelkasem E, Mazzeffi MA, Lu SY, Planinsic RM, Sakai T, Tanaka KA. Ex vivo evaluation of 4 different viscoelastic assays for detecting moderate to severe coagulopathy during liver transplantation. Liver Transpl. 2016;22:468-475. [PubMed] [DOI] |
| 15. | Yang Lu S, Tanaka KA, Abuelkasem E, Planinsic RM, Sakai T. Clinical applicability of rapid thrombelastography and functional fibrinogen thrombelastography to adult liver transplantation. Liver Transpl. 2014;20:1097-1105. [PubMed] [DOI] |
| 16. | Goggs R, Borrelli A, Brainard BM, Chan DL, de Laforcade A, Goy-Thollot I, Jandrey KE, Kristensen AT, Kutter A, Marschner CB. Multicenter in vitro thromboelastography and thromboelastometry standardization. J Vet Emerg Crit Care (San Antonio). 2018;28:201-212. [PubMed] [DOI] |
| 17. | Stravitz RT, Lisman T, Luketic VA, Sterling RK, Puri P, Fuchs M, Ibrahim A, Lee WM, Sanyal AJ. Minimal effects of acute liver injury/acute liver failure on hemostasis as assessed by thromboelastography. J Hepatol. 2012;56:129-136. [PubMed] [DOI] |
| 18. | Stravitz RT. Potential applications of thromboelastography in patients with acute and chronic liver disease. Gastroenterol Hepatol (NY). 2012;8:513-520. [PubMed] |
| 19. | Organization Committee of 13th Asia-Pacific Congress of Clinical Microbiology and Infection. 13th Asia-Pacific Congress of Clinical Microbiology and Infection Consensus Guidelines for diagnosis and treatment of liver failure. Hepatobiliary Pancreat Dis Int. 2013;12:346-354. [PubMed] |
| 20. | Flamm SL, Yang YX, Singh S, Falck-Ytter YT; AGA Institute Clinical Guidelines Committee. American Gastroenterological Association Institute Guidelines for the Diagnosis and Management of Acute Liver Failure. Gastroenterology. 2017;152:644-647. [PubMed] [DOI] |
| 21. | European Association for the Study of the Liver. Electronic address: easloffice@easloffice.eu. Clinical practice guidelines panel, Wendon, J Panel members, Cordoba J, Dhawan A, Larsen FS, Manns M, Samuel D, Simpson KJ, Yaron I; EASL Governing Board representative, Bernardi M. EASL Clinical Practical Guidelines on the management of acute (fulminant) liver failure. J Hepatol. 2017;66:1047-1081. [PubMed] [DOI] |
| 22. | Kwon J, Koh Y, Yu SJ, Yoon JH. Low-molecular-weight heparin treatment for portal vein thrombosis in liver cirrhosis: Efficacy and the risk of hemorrhagic complications. Thromb Res. 2018;163:71-76. [PubMed] [DOI] |
| 23. | Villa E, Cammà C, Marietta M, Luongo M, Critelli R, Colopi S, Tata C, Zecchini R, Gitto S, Petta S. Enoxaparin prevents portal vein thrombosis and liver decompensation in patients with advanced cirrhosis. Gastroenterology. 2012;143:1253-1260.e1-4. [PubMed] [DOI] |
| 24. | Bloom S, Kemp W, Lubel J. Portal hypertension: pathophysiology, diagnosis and management. Intern Med J. 2015;45:16-26. [PubMed] [DOI] |
| 25. | Licinio R, Principi M, Losurdo G, Castellaneta NM, Ierardi E, Di Leo A. Low molecular weight heparin in portal vein thrombosis of cirrhotic patients: only therapeutic purposes? Scientific World Journal. 2014;2014:895839. [PubMed] [DOI] |
| 26. | Amitrano L, Guardascione MA, Menchise A, Martino R, Scaglione M, Giovine S, Romano L, Balzano A. Safety and efficacy of anticoagulation therapy with low molecular weight heparin for portal vein thrombosis in patients with liver cirrhosis. J Clin Gastroenterol. 2010;44:448-451. [PubMed] [DOI] |
| 27. | Kapoor S, Pal S, Sahni P, Chattopadhyay TK. Thromboelastographic evaluation of coagulation in patients with extrahepatic portal vein thrombosis and non-cirrhotic portal fibrosis: a pilot study. J Gastroenterol Hepatol. 2009;24:992-997. [PubMed] [DOI] |
| 28. | Valla DC, Rautou PE. The coagulation system in patients with end-stage liver disease. Liver Int. 2015;35 Suppl 1:139-144. [PubMed] [DOI] |
| 29. | Northup PG, Caldwell SH. Coagulation in liver disease: a guide for the clinician. Clin Gastroenterol Hepatol. 2013;11:1064-1074. [PubMed] [DOI] |