修回日期: 2018-05-02
接受日期: 2018-05-09
在线出版日期: 2018-06-18
探讨结直肠腺癌组织中富含半胱氨酸61(Cysteine rich 61, Cyr61)和核因子-κB(nuclear factor-κB, NF-κB) p65的表达情况, 及其与临床病理参数和患者预后的相关性.
收集2011-05/2016-09期间在湖北黄冈市中心医院治疗的结直肠腺癌患者92例, 免疫组织化学法和western blot检测结直肠癌组织和癌旁组织中Cyr61和NF-κB p65的表达情况, 并分析肿瘤组织中Cyr61和NF-κB p65表达与临床病理特征和预后的相关性.
免疫组织化学染色和western blot结果均显示结直肠癌组织中Cyr61和NF-κB p65的蛋白表达显著高于癌旁组织(t = 24.866, P<0.001; t = 45.508, P<0.001). 结直肠癌组织中Cyr61和NF-κB p65的表达显著相关(χ2 = 14.087, P<0.001). 而且结直肠癌组织Cyr61表达与肿瘤直径、浸润深度、血管侵犯和TNM分期等临床病理参数显著相关(P<0.05). 结直肠癌组织NF-κB p65表达与肿瘤直径、淋巴结转移和TNM分期等临床病理参数显著相关(P<0.05). 而且Cyr61和NF-κB p65高表达患者的5年总体生存率41.30%、45.65%显著低于Cyr61和NF-κB p65低表达患者的5年总体生存率76.09%、71.74%(HR = 0.341, 95%CI: 0.179-0.649, P = 0.001; HR = 0.465, 95%CI: 0.245-0.881, P = 0.019).
Cyr61和NF-κB p65蛋白在结直肠癌组织中高表达, 且Cyr61和NF-κB p65蛋白高表达与结直肠癌患者的临床病理参数和预后显著相关, 可能为结直肠癌患者的诊断和治疗提供新的指标.
核心提要: Cyr61和NF-κB p65蛋白在结直肠癌组织中高表达, 且Cyr61和NF-κB p65蛋白高表达与结直肠癌患者的临床病理参数和预后显著相关, 可能为结直肠癌患者的诊断和治疗提供新的标志物.
引文著录: 吴安定, 万里鹏, 覃艳琼. 结直肠腺癌组织中Cyr61和NF-κB p65的表达及其临床病理意义. 世界华人消化杂志 2018; 26(17): 1056-1063
Revised: May 2, 2018
Accepted: May 9, 2018
Published online: June 18, 2018
To investigate the expression of cysteine rich 61 (Cyr61) and nuclear factor-κB (NF-κB) p65 in colorectal adenocarcinoma, and to explore their relationship with clinicopathologic parameters and prognosis.
Ninety-two cases of colorectal adenocarcinoma treated at Hubei Huanggang Central Hospital from May 2010 to December 2012 were collected. Immunohistochemistry and Western blot were used to detect the expression of Cyr61 and NF-κB p65 in colorectal cancer and tumor adjacent tissues. The correlation between the expression of Cyr61 and NF-κB p65 and clinicopathological features and prognosis of colorectal adenocarcinoma was analyzed.
Both immunohistochemical staining and Western blot showed that the expression of Cyr61 and NF-κB p65 proteins in colorectal cancer tissues was significantly higher than that in tumor adjacent tissues (t = 24.866, P <0.001; t = 45.508, P <0.001). The expression of Cyr61 and NF-κB p65 in colorectal cancer tissue was significantly correlated (χ2 = 14.087, P < 0.001). The expression of Cyr61 in colorectal cancer tissues was significantly correlated with tumor diameter, depth of invasion, vascular invasion, and TNM stage (P < 0.05). The expression of NF-κB p65 in colorectal cancer tissues was significantly correlated with tumor diameter, lymph node metastasis, and TNM stage (P < 0.05). The 5-year overall survival rates of patients with high expression of Cyr61 or NF-κB p65 were 41.30% and 45.65%, respectively, which were significantly lower than those of patients with low expression of Cyr61 or NF-κB p65 (76.09% and 71.74%, respectively; HR = 0.341, 95%CI: 0.179-0.649, P = 0.001; HR = 0.465, 95%CI: 0.245-0.881, P = 0.019).
Cyr61 and NF-κB p65 proteins are highly expressed in colorectal cancer tissues, and high expression of Cyr61 and NF-κB p65 proteins is significantly associated with clinicopathologic parameters and prognosis in patients with colorectal cancer.
- Citation: Wu AD, Wan LP, Qin YQ. Clinicopathologic significance of Cyr61 and NF-κB p65 expression in colorectal adenocarcinoma. Shijie Huaren Xiaohua Zazhi 2018; 26(17): 1056-1063
- URL: https://www.wjgnet.com/1009-3079/full/v26/i17/1056.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v26.i17.1056
近年来, 消化道肿瘤结直肠癌的发病率逐渐升高, 故临床工作者对参与结直肠癌进展的因素也越来越关注[1,2]. 主要表达于细胞膜和细胞质中的富含半胱氨酸61(Cysteine rich 61, Cyr61)是CCN家族的成员之一, 在伤口愈合、血管生成、炎性疾病、纤维化及肿瘤细胞增殖、侵袭和转移过程中发挥重要作用[3,4]. 核因子κB(nuclear factor,κB, NF-κB)是参与肿瘤细胞增殖、凋亡、分化的重要核转录因子, 与肿瘤的发生发展密切相关[5,6]. 文献报道, NF-κB在乳腺癌、肺癌和胃癌等多种肿瘤组织中高表达[7,8]. 近期研究发现NF-κB是Cyr61的下游调控基因之一, 但Cyr61能否通过调节NF-κB介导的炎性反应参与结肠癌的进展尚缺乏研究. 本研究拟采用免疫组织化学法和western blot检测结肠癌组织中Cyr61和NF-κB p65的蛋白表达情况, 并探讨其与结肠癌临床病理参数和预后的相关性, 以期为结直肠癌的诊断和治疗提供理论依据.
1.1.1 一般资料: 选取2011-05/2016-09间湖北黄冈市中心医院收治的结直肠癌患者92例. 患者在行结肠癌切除术的过程中留取肿瘤组织和癌旁组织, 所有患者术前均未接受过放化疗. 本研究经医院伦理学委员会审议通过, 与患者或其家属签订知情同意书. 患者的一般临床资料如下: (1)性别: 男42例, 女50例; (2)年龄: 25-85岁, 平均56.73岁±6.47岁; (3)肿瘤发生部位: 左半结肠43例, 右半结肠49例; (4)肿瘤大小: 直径≤5 cm 55例, 直径>5 cm 37例; (5)病理组织学类型: 黏液癌27例, 腺癌65例; (6)分化程度: 低分化或未分化26例, 中分化32例, 高分化34例; (7)浸润深度: 未穿透浆膜层21例, 浸润至浆膜层71例; (8)淋巴结转移: 未转移65例, 转移27例. 92例结直肠癌患者采用门诊复查、电话和病历系统信息采集等多种方式对患者进行每月随访, 随访截止日期为2017-12-31.
1.1.2 试剂: NF-κB p65小鼠单克隆抗体(Santa Cruz公司); Cyr61小鼠单克隆抗体(Santa Cruz公司); 免疫组化试剂盒(武汉博士德生物工程有限公司); β-actin小鼠单克隆抗体(武汉三鹰生物技术有限公司); ECL化学发光底物(美国Thermo公司).
免疫组织化学法检测结直肠癌组织和癌旁组织中Cyr61和NF-κB p65的蛋白表达: Cyr61抗体的稀释浓度为1:100, p65抗体的稀释浓度为1:200. Cyr61染色后肿瘤细胞胞质呈棕黄色判定为阳性. p65染色后肿瘤细胞核呈棕黄色判定为阳性. 400倍光学显微镜下, 对每个病理切片随机选取5个视野观察阳性细胞数目和阳性细胞显色强度. 阳性细胞数分级: 0%-1% = 0、1%-10% = 1、10%-50% = 2、50%-80% = 3、80%-100% = 4, 阳性细胞显色强度分级0(阴性)、1(弱阳性)、2(阳性)、3(强阳性), 免疫组化评分=阳性细胞数分级×阳性细胞显色强度分级. western blot检测结直肠癌组织和癌旁组织中Cyr61和NF-κB p65的表达: 将收集到的患者组织加入适量的蛋白裂解液, 离心后取上清液进行BCA蛋白定量. SDS,聚丙烯酰胺凝胶电泳, 湿转, 封闭后, Cyr61(1:1000)、NF-κB p65(1:1500)或内参β-actin(1:1000)4度孵育过夜, 二抗(1:2000)室温孵育2 h, ECL化学发光液处理后, 凝胶成像系统检测目的蛋白表达水平.
统计学处理 采用SPSS 19.0进行数据分析, 结肠癌组织和癌旁组织的Cyr61和NF-κB p65表达的免疫组织化学评分以均数±标准差的形式表示, 组间比较采用t检验. 应用Kaplan-Meier法绘制总体生存曲线, 并采用Log rank检验计算风险比(hazard ratio, HR)及其95%置信区间和P值. 所有检验均采用双侧假设检验, α = 0.05, 当P<0.05时认为差异具有统计学意义。
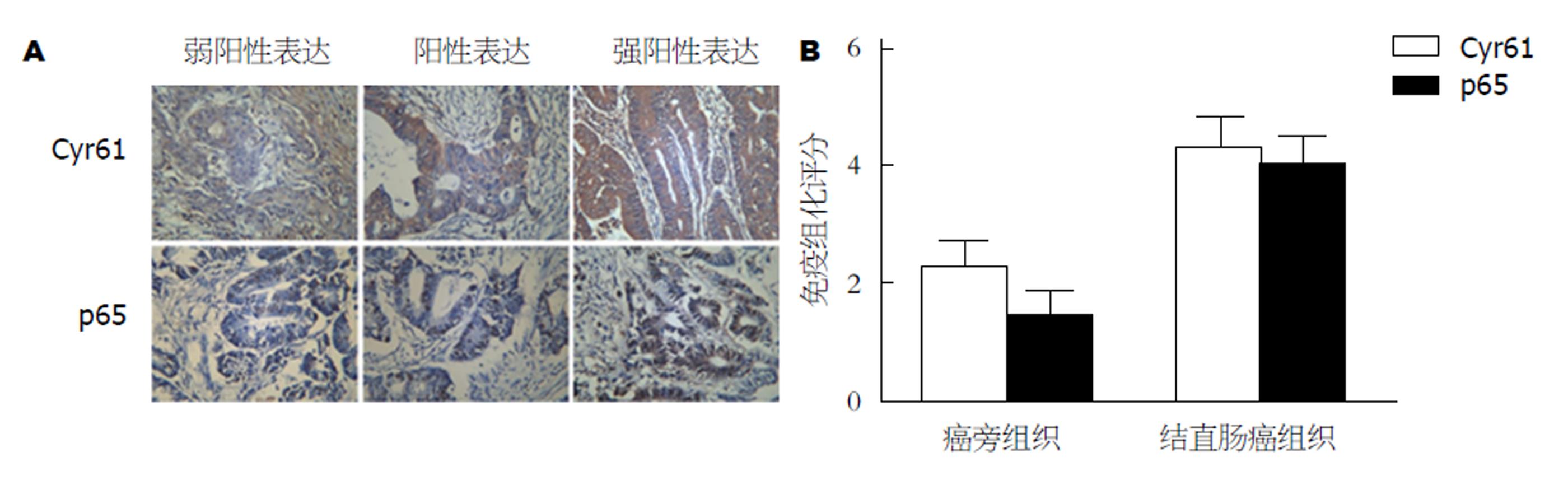
免疫组织化学结果显示, 结直肠癌组织中Cyr61和NF-κB p65的免疫组化评分显著高于癌旁组织, 差异有统计学意义(P<0.05)(图1).
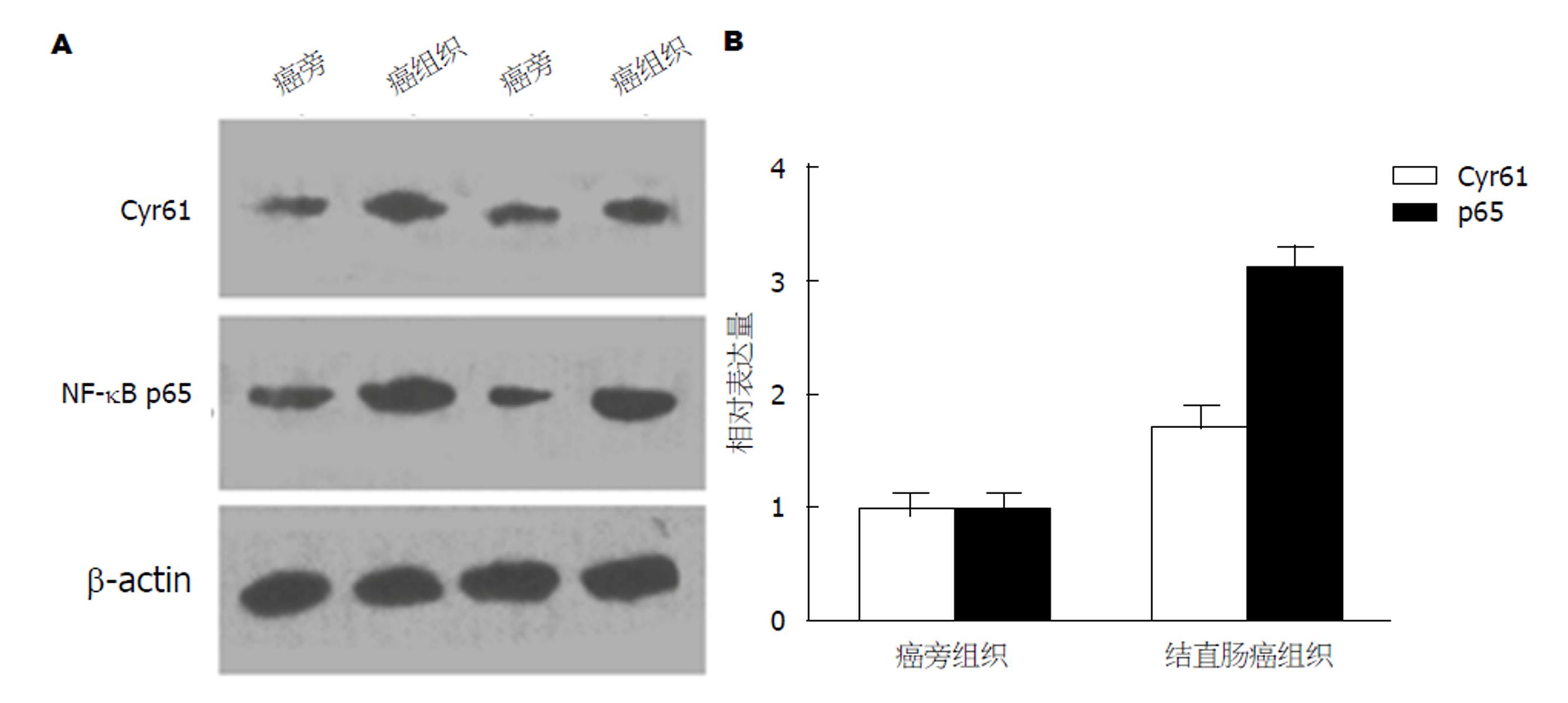
结直肠癌组织中Cyr61和NF-κB p65的蛋白表达量显著高于癌旁组织, 差异有统计学意义(P<0.05)(图2).
结直肠癌组织中Cyr61与NF-κB p65均高表达的有32例, 均为低表达的16例. 相关性分析结果显示结直肠癌组织中Cyr61与NF-κB p65表达显著相关(χ2 = 14.087, P<0.001), 见表1.
| p65 | Cyr61 | χ2 | P | |
| 高表达 | 低表达 | |||
| 高表达 | 32 | 14 | 14.087 | <0.001 |
| 低表达 | 14 | 32 | ||
结直肠癌组织Cyr61表达与肿瘤直径、浸润深度、血管侵犯和TNM分期等临床病理参数显著相关(P<0.05)(表2).
| 病理参数 | Cyr61低表达 | Cyr61高表达 | χ2 | P |
| 性别 | ||||
| 男 | 20 | 22 | 0.175 | 0.675 |
| 女 | 26 | 24 | ||
| 年龄 (岁) | ||||
| ≤50 | 17 | 19 | 0.183 | 0.669 |
| >50 | 29 | 27 | ||
| TNM分期 | ||||
| Ⅰ,Ⅱ | 22 | 12 | 4.665 | 0.031 |
| Ⅲ,Ⅳ | 24 | 34 | ||
| 浸润深度 | ||||
| T1,T2 | 26 | 13 | 7.522 | 0.006 |
| T3,T4 | 20 | 33 | ||
| 肿瘤直径 | ||||
| ≤5 cm | 29 | 16 | 7.351 | 0.007 |
| >5 cm | 17 | 30 | ||
| 分化程度 | ||||
| 高+中分化 | 15 | 18 | 0.425 | 0.514 |
| 低+未分化 | 31 | 28 | ||
| 血管侵犯 | ||||
| 有 | 17 | 22 | 1.113 | 0.291 |
| 无 | 29 | 24 | ||
| 淋巴结转移 | ||||
| 有 | 19 | 26 | 3.729 | 0.053 |
| 无 | 27 | 16 |
结直肠癌组织NF-κB p65表达与TNM分期、肿瘤直径、淋巴结转移和TNM分期等临床病理参数显著相关(P<0.05)(表3).
| 病理参数 | p65低表达 | p65高表达 | χ2 | P |
| 性别 | ||||
| 男 | 18 | 24 | 1.577 | 0.209 |
| 女 | 28 | 22 | ||
| 年龄 (岁) | ||||
| ≤50 | 20 | 24 | 0.697 | 0.404 |
| >50 | 26 | 22 | ||
| TNM分期 | ||||
| Ⅰ,Ⅱ | 11 | 21 | 4.792 | 0.028 |
| Ⅲ,Ⅳ | 35 | 25 | ||
| 浸润深度 | ||||
| T1, T2 | 23 | 16 | 2.181 | 0.140 |
| T3, T4 | 23 | 30 | ||
| 肿瘤直径 | ||||
| ≤5 cm | 30 | 18 | 6.273 | 0.012 |
| >5 cm | 16 | 28 | ||
| 分化程度 | ||||
| 高+中分化 | 17 | 21 | 0.717 | 0.397 |
| 低+未分化 | 29 | 25 | ||
| 血管侵犯 | ||||
| 有 | 21 | 22 | 0.044 | 0.834 |
| 无 | 25 | 24 | ||
| 淋巴结转移 | ||||
| 有 | 16 | 27 | 5.283 | 0.022 |
| 无 | 30 | 19 |
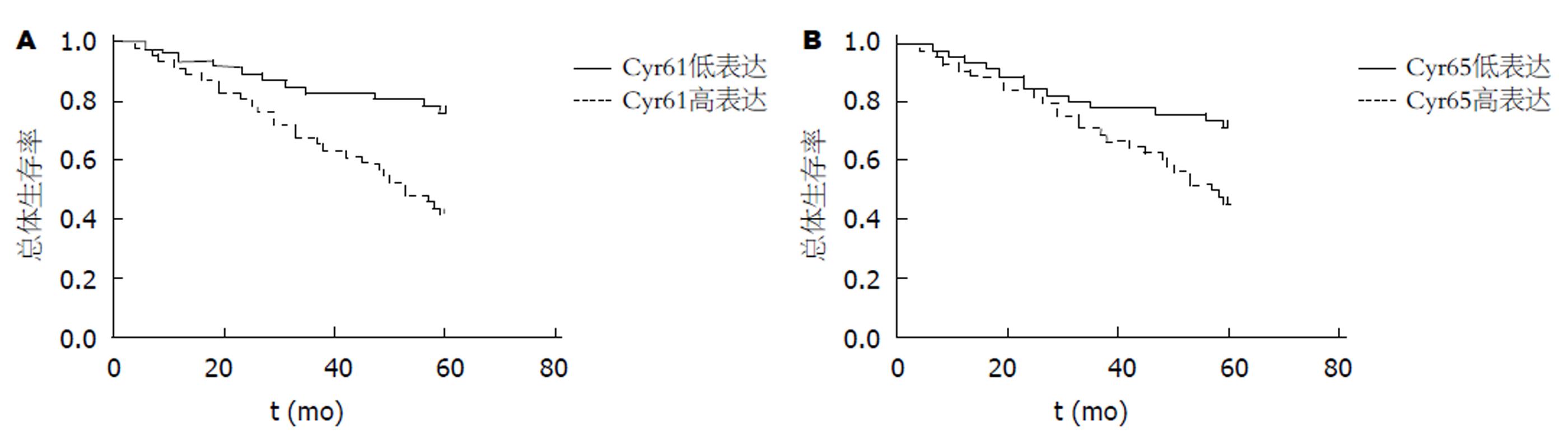
Cyr61和p65高表达的结肠癌患者的5年总体生存率显著低于Cyr61和p65低表达的结肠癌患者, 差异有统计学意义(P<0.05)(图3).
结直肠癌是一种与炎症密切相关的恶性肿瘤, 大多数结直肠癌的发生是按照腺瘤到腺癌的过程, 发展的过程较长, 通常有多种因素的参与[9,10]. CCN家族成员Cyr61是调节结缔组织生成、增殖、转移的重要因子[11,12]. Cyr61在不同肿瘤组织中的表达不同, Cyr61高表达于乳腺癌、胃腺癌、卵巢癌等, 而低表达于非小细胞肺癌和平滑肌瘤[13]. NF-κB是干扰素信号中的重要核转录因子, 通常在细胞被外界刺激后激活, 直接入核后诱导相应靶基因转录从而发挥作用[14,15]. 研究表明, NF-κB参与肿瘤的发生、分化、凋亡等多个重要的进展过程[16]. 而且NF-κB蛋白在肺癌、乳腺癌和肝癌等多种恶性肿瘤组织中均存在过度表达[17]. 但Cyr61和NF-κB p65在结直肠癌组织中的表达及其与临床病理参数和预后的相关性尚未完全阐明.
文献报道, Cyr61在胃癌等多种消化系统恶性肿瘤中过表达, 可能在肿瘤的进展中起关键作用[18,19]. 已有研究表明, Cyr61可通过调节相关信号通路介导肿瘤增殖、迁移、侵袭和血管生成等过程. 本研究发现结直肠癌组织中Cyr61的蛋白表达水平显著高于癌旁组织, 提示Cyr61可能在结直肠癌进展中发挥重要作用. 为深入研究Cyr61蛋白表达与结直肠癌生物学特征的关系, 本研究分析了Cyr61表达与结直肠癌患者临床病理参数和预后的相关性. 结果结直肠癌组织Cyr61表达与肿瘤直径、炎性细胞浸润、浸润深度、血管侵犯和TNM分期等临床病理参数显著相关. 且Cyr61高表达的患者5年总体生存率显著低于Cyr61低表达的患者, 以上结果均表明结直肠癌组织中Cyr61的表达与肿瘤的生长和转移特性密切相关. Sanghoon Han等发现沉默结肠癌细胞中的Cyr61基因能降低肿瘤细胞的增殖和侵袭能力[20]. 而且Cyr61可与整合素受体结合促进内皮细胞的增殖黏附和血管新生, 也可通过促进VEGF等血管生成因子的表达等多种机制促进肿瘤血管生成[13]. 故检测结直肠癌组织中Cyr61的表达有利于了解患者的肿瘤进展情况, 为结直肠癌的诊断和治疗提供有效依据.
NF-κB是公认的炎症发展过程中的重要核转录因子之一[21]. 肿瘤组织中NF-κB的过度激活能调控其下游的增殖、凋亡相关基因和细胞因子表达, 促进肿瘤的进展[22]. p65是NF-κB在细胞中存在的主要形式之一, 参与NF-κB调节的基因转录的起始步骤[16,23]. 本研究结果结直肠癌组织中NF-κB p65蛋白表达水平显著高于癌旁组织, 提示p65蛋白可能参与结直肠癌的进展. 而且分析p65表达与结直肠癌患者临床病理参数的相关性发现, 结直肠癌组织p65表达与TNM分期、炎性细胞浸润、肿瘤直径、淋巴结转移和TNM分期等临床病理参数显著相关. 此外, p65高表达的患者的5年总体生存率也显著低于Cyr61和p65低表达的患者. 以上结果均表明p65蛋白在结直肠癌组织的表达与肿瘤的生长、转移等生物学特性密切相关, 可能可作为预测结直肠癌患者进展的新指标. 文献报道, 正常组织中可出现NF-κB p65蛋白微弱的核表达, 表明NF-κB信号是调节细胞正常生理功能和维持动态平衡的重要通路[24]. 而当细胞受到刺激, 例如炎症和肿瘤等, 细胞内的NF-κB通路将被过度激活, 导致细胞的异常增殖或凋亡减少[25,26]. Miss Leyla Fouani[27]发现NF-κB的表达与结直肠癌的癌变过程密切相关. 本研究结果和文献报道均提示NF-κB p65的过度激活会促进结直肠癌的进展, 可能作为判定结直肠癌患者预后的指标.
另外本研究结果显示结直肠癌组织中Cyr61与NF-κB p65表达显著相关, 提示Cyr61可能通过调节NF-κB介导的炎症或凋亡等信号参与结肠癌的进展. 肿瘤细胞中过表达Cyr61可与其配体作用后, 激活NF-κB转录活性, 促进肿瘤细胞的增殖[28]. 文献报道结直肠癌细胞过表达Cyr61能激活P13K/Akt信号通路, 从而增加NF-κB的转录活性, 促进肿瘤细胞的增殖和迁移[29,30]. 以上均表明Cyr61与NF-κB 信号通路调节的炎症反应、增殖及凋亡等肿瘤进展重要过程密切相关, 因此靶向Cyr61可能通过调节NF-κB相关信号通路改善结直肠癌患者的治疗效果和预后.
总之, Cyr61和NF-κB p65蛋白在结直肠癌组织中高表达, 且Cyr61和NF-κB p65蛋白高表达与结直肠癌患者的等临床病理特征和预后显著相关, 可能为结直肠癌患者的诊断和治疗提供新的指标.
Cyr61在血管生成、炎性疾病及肿瘤细胞增殖、侵袭和转移等多种病理过程中发挥重要作用. 核因子-κB(nuclear factor-κB, NF-κB)是重要的核转录因子, 与肿瘤的发生发展密切相关. 研究发现, NF-κB在乳腺癌、肺癌和胃癌等多种肿瘤组织中高表达, 而Cyr61在肿瘤组织中的表达情况鲜有报道. Cyr61和NF-κB p65蛋白在结直肠癌组织中的表达情况及其与临床病理特征和预后的关系受到越来越多研究者的关注.
本研究探讨了结肠癌组织中Cyr61和NF-κB p65的蛋白表达与结肠癌临床病理参数和预后的相关性, 以期为结直肠癌的诊断和治疗提供理论依据.
本研究分析了结肠癌组织中Cyr61和NF-κB p65的蛋白表达与结肠癌临床病理参数和预后的相关性, 为寻找新的结直肠癌的诊断和治疗指标提供了依据.
本研究采用免疫组织化学法和western blot检测结肠癌组织中Cyr61和NF-κB p65的蛋白表达情况, 并分析其与结肠癌临床病理参数和患者5年生存率的相关性, 探讨了结肠癌组织Cyr61和 p65表达的临床意义.
本研究结果表明Cyr61和NF-κB p65蛋白在结直肠癌组织中高表达, 且Cyr61和NF-κB p65蛋白高表达与结直肠癌患者的等临床病理特征和预后显著相关, 可能为结直肠癌患者的诊断和治疗提供新的指标.
结直肠癌组织中Cyr61和NF-κB p65蛋白的高表达与结直肠癌患者的恶性进展和预后密切相关, Cyr61和p65可能在结直肠癌的进展中发挥重要作用, 值得进一步深入研究.
本研究的样本量偏小, 且结直肠癌组织中Cyr61和NF-κB p65分子表达情况仍需更多实验数据支持, 建议后期对其发挥作用的机制进行更深入的研究.
学科分类: 胃肠病学和肝病学
手稿来源地: 湖北省
同行评议报告分类
A级 (优秀): 0
B级 (非常好): 0
C级 (良好): C, C, C
D级 (一般): 0
E级 (差): E
编辑: 马亚娟 电编:张砚梁
| 1. | Arnold M, Sierra MS, Laversanne M, Soerjomataram I, Jemal A, Bray F. Global patterns and trends in colorectal cancer incidence and mortality. Gut. 2017;66:683-691. [PubMed] [DOI] |
| 2. | Aleksandrova K, Jenab M, Leitzmann M, Bueno-de-Mesquita B, Kaaks R, Trichopoulou A, Bamia C, Lagiou P, Rinaldi S, Freisling H. Physical activity, mediating factors and risk of colon cancer: insights into adiposity and circulating biomarkers from the EPIC cohort. Int J Epidemiol. 2017;46:1823-1835. [PubMed] [DOI] |
| 3. | Wang G, Gu J, Gao Y. MicroRNA target for MACC1 and CYR61 to inhibit tumor growth in mice with colorectal cancer. Tumour Biol. 2016;37:13983-13993. [PubMed] [DOI] |
| 4. | Wang Y, Wang M. Prognostic significance of expression of cysteine-rich 61 and cyclooxygenase-2 in gastric cancer. BMC Gastroenterol. 2016;16:74. [PubMed] [DOI] |
| 5. | Rinkenbaugh AL, Baldwin AS. The NF-κB Pathway and Cancer Stem Cells. Cells. 2016;5. [PubMed] [DOI] |
| 6. | Giampazolias E, Zunino B, Dhayade S, Bock F, Cloix C, Cao K, Roca A, Lopez J, Ichim G, Proïcs E. Mitochondrial permeabilization engages NF-κB-dependent anti-tumour activity under caspase deficiency. Nat Cell Biol. 2017;19:1116-1129. [PubMed] [DOI] |
| 7. | Park MH, Hong JT. Roles of NF-κB in Cancer and Inflammatory Diseases and Their Therapeutic Approaches. Cells. 2016;5. [PubMed] [DOI] |
| 8. | Kaltschmidt B, Greiner JFW, Kadhim HM, Kaltschmidt C. Subunit-Specific Role of NF-κB in Cancer. Biomedicines. 2018;6. [PubMed] [DOI] |
| 9. | Ricci-Vitiani L, Lombardi DG, Pilozzi E, Biffoni M, Todaro M, Peschle C, De Maria R. Identification and expansion of human colon-cancer-initiating cells. Nature. 2007;445:111-115. [PubMed] [DOI] |
| 10. | Lombardi VRM, Carrera I, Corzo L, Cacabelos R. Role of bioactive lipofishins in prevention of inflammation and colon cancer. Semin Cancer Biol. 2017;. [PubMed] [DOI] |
| 11. | Song YF, Xu ZB, Zhu XJ, Tao X, Liu JL, Gao FL, Wu CL, Song B, Lin Q. Serum Cyr61 as a potential biomarker for diagnosis of colorectal cancer. Clin Transl Oncol. 2017;19:519-524. [PubMed] [DOI] |
| 12. | Maity G, Haque I, Ghosh A, Dhar G, Gupta V, Sarkar S, Azeem I, McGregor D, Choudhary A, Campbell DR. The MAZ transcription factor is a downstream target of the oncoprotein Cyr61/CCN1 and promotes pancreatic cancer cell invasion via CRAF-ERK signaling. J Biol Chem. 2018;293:4334-4349. [PubMed] [DOI] |
| 14. | Pires BRB, Silva RCMC, Ferreira GM, Abdelhay E. NF-kappaB: Two Sides of the Same Coin. Genes (Basel). 2018;9. [PubMed] [DOI] |
| 15. | Afonina IS, Zhong Z, Karin M, Beyaert R. Limiting inflammation-the negative regulation of NF-κB and the NLRP3 inflammasome. Nat Immunol. 2017;18:861-869. [PubMed] [DOI] |
| 16. | Sun SC. The non-canonical NF-κB pathway in immunity and inflammation. Nat Rev Immunol. 2017;17:545-558. [PubMed] [DOI] |
| 18. | Wei J, Yu G, Shao G, Sun A, Chen M, Yang W, Lin Q. CYR61 (CCN1) is a metastatic biomarker of gastric cardia adenocarcinoma. Oncotarget. 2016;7:31067-31078. [PubMed] [DOI] |
| 19. | Sun L, Huang T, Xu W, Sun J, Lv Y, Wang Y. Advanced glycation end products promote VEGF expression and thus choroidal neovascularization via Cyr61-PI3K/AKT signaling pathway. Sci Rep. 2017;7:14925-14925. [PubMed] [DOI] |
| 20. | Han S, Bui NT, Ho MT, Kim YM, Cho M, Shin DB. Dexamethasone Inhibits TGF-β1-Induced Cell Migration by Regulating the ERK and AKT Pathways in Human Colon Cancer Cells Via CYR61. Cancer Res Treat. 2016;48:1141-1153. [PubMed] [DOI] |
| 21. | Darvishi B, Farahmand L, Eslami-S Z, Majidzadeh-A K. NF-κB as the main node of resistance to receptor tyrosine kinase inhibitors in triple-negative breast cancer. Tumour Biol. 2017;39:1010428317706919. [PubMed] [DOI] |
| 22. | Sokolova O, Naumann M. NF-κB Signaling in Gastric Cancer. Toxins (Basel). 2017;9. [PubMed] [DOI] |
| 24. | Panday A, Inda ME, Bagam P, Sahoo MK, Osorio D, Batra S. Transcription Factor NF-κB: An Update on Intervention Strategies. Arch Immunol Ther Exp (Warsz). 2016;64:463-483. [PubMed] [DOI] |
| 25. | Timucin AC, Basaga H. Pro-apoptotic effects of lipid oxidation products: HNE at the crossroads of NF-κB pathway and anti-apoptotic Bcl-2. Free Radic Biol Med. 2017;111:209-218. [PubMed] [DOI] |
| 26. | Yu L, Li L, Medeiros LJ, Young KH. NF-κB signaling pathway and its potential as a target for therapy in lymphoid neoplasms. Blood Rev. 2017;31:77-92. [PubMed] [DOI] |
| 27. | Fouani L, Kovacevic Z, Richardson DR. Targeting Oncogenic Nuclear Factor Kappa B Signaling with Redox-Active Agents for Cancer Treatment. Antioxid Redox Signal. 2018;. [PubMed] [DOI] |
| 28. | Zhang L, Ding Y, Yuan Z, Liu J, Sun J, Lei F, Wu S, Li S, Zhang D. MicroRNA-500 sustains nuclear factor-κB activation and induces gastric cancer cell proliferation and resistance to apoptosis. Oncotarget. 2015;6:2483-2495. [PubMed] [DOI] |
| 29. | Zhu X, Song Y, Wu C, Pan C, Lu P, Wang M, Zheng P, Huo R, Zhang C, Li W. Cyr61 participates in the pathogenesis of acute lymphoblastic leukemia by enhancing cellular survival via the AKT/NF-κB signaling pathway. Sci Rep. 2016;6:34018. [PubMed] [DOI] |
| 30. | Shih YL, Chou HM, Chou HC, Lu HF, Chu YL, Shang HS, Chung JG. Casticin impairs cell migration and invasion of mouse melanoma B16F10 cells via PI3K/AKT and NF-κB signaling pathways. Environ Toxicol. 2017;32:2097-2112. [PubMed] [DOI] |