修回日期: 2018-04-16
接受日期: 2018-05-16
在线出版日期: 2018-06-18
探讨溪黄草黄酮[Flavonoids from Rabdosia serra (Maxim.) Hara]对人肝癌细胞株HepG2的增殖、迁移与侵袭能力的影响, 并研究初步机制.
CCK-8法检测不同浓度溪黄草黄酮(0、1、5、10、20和40 μmol/L)对HepG2细胞活性的影响; 划痕实验和Transwell侵袭实验分别检测细胞的迁移和侵袭能力; Western blot检测Notch-1, Cyclin D1, MMP-2和MMP-9蛋白表达水平变化.
CCK-8法检测结果显示溪黄草黄酮呈浓度依赖性抑制HepG2细胞的生长, 当浓度到达20 μmol/L时, 抑制作用达到最大; 经溪黄草黄酮干预后, HepG2细胞迁移和侵袭能力显著下降, Notch-1, Cyclin D1, MMP-2和MMP-9蛋白表达水平显著下降.
溪黄草黄酮具有抑制肝癌细胞株HepG2增殖、迁移和侵袭的作用, 其作用机制可能与溪黄草黄酮抑制Notch-1-MMP-2/-9和Notch-1-Cyclin D1信号通路相关.
核心提要: 溪黄草黄酮能够抑制肝癌细胞株HepG2增殖、迁移和侵袭的恶性生物学行为, 其作用机制可能与溪黄草黄酮抑制Notch-1-MMP-2/-9和Notch-1-Cyclin D1信号通路相关.
引文著录: 李晨瑜, 张喜红. 溪黄草黄酮对肝癌细胞增殖, 迁移和侵袭的影响及相关机制. 世界华人消化杂志 2018; 26(17): 1029-1035
Revised: April 16, 2018
Accepted: May 16, 2018
Published online: June 18, 2018
To investigate the effect of flavonoids from Rabdosia serra (Maxim.) Hara on the proliferation, migration, and invasion of human hepatoma HepG2 cells and explore the possible mechanisms involved.
After HepG2 cells were treated with various concentrations of flavonoids from Rabdosia serra (Maxim.) Hara (0, 1, 5, 10, 20, or 40 μmol/L), cell viability was determined by CCK-8 assay, cell migration was examined by wound healing assay, and cell invasion was assessed by Transwell assay. Moreover, the protein expression of Notch-1, Cyclin D1, MMP-2, and MMP-9 was detected by Western blot.
CCK-8 assay showed that flavonoids from Rabdosia serra (Maxim.) Hara decreased HepG2 cell viability in a concentration-dependent manner, with the maximal effect observed at 20 μmol/L. Flavonoids from Rabdosia serra (Maxim.) significantly inhibited hepatoma cell migration and invasion. Furthermore, the protein expression of Notch-1, Cyclin D1, MMP-2, and MMP-9 was dramatically decreased after treatment with flavonoids from Rabdosia serra (Maxim.) Hara.
Our data demonstrate that the flavonoids from Rabdosia serra (Maxim.) Hara can effectively inhibit human hepatoma HepG2 cell proliferation, migration, and invasion possibly by inhibiting the Notch-1-MMP-2/-9 and Notch-1-Cyclin D1 signaling pathways.
- Citation: Li CY, Zhang XH. Effects of flavonoids from Rabdosia serra (Maxim.) Hara on proliferation, migration, and invasion of hepatocellular carcinoma cells. Shijie Huaren Xiaohua Zazhi 2018; 26(17): 1029-1035
- URL: https://www.wjgnet.com/1009-3079/full/v26/i17/1029.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v26.i17.1029
原发性肝细胞癌肝癌(hepatocelluar carcinoma, HCC)是常见的致死性肿瘤之一, 主要特征是死亡率和恶性程度高, 是全世界癌症死亡的第三大原因, 仅次于胃癌和肺癌[1]. 目前对肝癌的临床治疗以手术为主[2], 由于大部分患者确诊时已发生了临床转移, 从而导致治疗效果差, 肝癌的术后易复发[3]. 肝癌细胞不受控制的增殖和癌细胞的转移是肝癌患者死亡的主要原因[4], 因此, 抗肝癌治疗的关键在于如何控制肝癌细胞增殖和转移侵袭.
溪黄草具有清热利湿、退黄、凉血散瘀的功能, 同时具有消炎、抗菌、抗肿瘤等功效[5]. 近来, 国内学者研究发现溪黄草水煎剂具有减少肝损伤[6,7]和抗肝癌活性[8,9]. 溪黄草黄酮是溪黄草重要的药理活性之一, 是溪黄草水溶性总黄酮部位中活性药理活性成分. 近年来, 虽然有关于溪黄草关于抗肝癌方面的研究[8,9], 但是对于溪黄草黄酮研究尚不具体, 因此, 本实验观察溪黄草黄酮对人肝癌细胞株HepG2的增殖、迁移与侵袭的作用, 并探讨其初步作用机制.
人肝癌细胞株HepG2(中南大学湘雅医院细胞中心); 溪黄草黄酮(纯度>98%; 中南大学药学院); DMEM培养基、胰蛋白酶、CCK-8试剂(Sigma公司); Notch-1、Cyclin D1、MMP-2、MMP-9和GADPH抗体(Santa Cruz公司); Notch-1激动剂Jagged1、Notch-1抑制剂LY3039478(MedChemExpress公司).
1.2.1 细胞培养: 将人肝癌细胞株HepG2培养在含10%胎牛血清的DMEM培养基中, 置于5% CO2、37 ℃培养箱, 每2 d更换培养基; 用0.25%胰蛋白酶进行消化, 1:4传代.
1.2.2 CCK-8法检测各组细胞的细胞活力: 收集对数生长期的HepG2细胞, 胰蛋白酶消化, DMEM培养基重悬细胞调整为1×105个/mL, 接种于96孔板中, 每孔加入RPMI-1640培养基100 μL, 待细胞贴壁后, 改用含1%胎牛血清的DMEM细胞培养基同步化12 h, 弃旧培养基, 更换含10%胎牛血清的DMEM细胞培养基, 然后分别加入溪黄草黄酮使得最终浓度为0、1、5、10、20和40 μmol/L, 继续培养12、24和48 h, 滴入10 μL CCK-8试剂, 置于37 ℃、5% CO2培养箱, 4 h后, 于450 nm波长处检测各孔吸光度值(A), 每组设6复孔. 另设单孔仅加入培养基作为空白对照, 计算各组细胞的细胞活力.
1.2.3 实验分组: 实验分为空白对照组(Control), 不加任何处理; 溶剂对照组(Vehicle), 加入相应体积溶剂DMSO; 溪黄草黄酮组(Fla), 给予20 μmol/L溪黄草黄酮处理24 h.
1.2.4 划痕实验: 取对数生长期的HepG2细胞以2×105个/mL密度接种于24孔板中. 待细胞贴壁后, 改用含1%胎牛血清的DMEM细胞培养基同步化12 h, 弃旧培养基, 更换含10%胎牛血清的DMEM细胞培养基继续培养细胞, 待细胞铺满孔底, 用枪头垂直皿底方向划痕, PBS小心清洗培养孔三次, 然后按照"1.2.3"方法分组, 并置于37 ℃, 5%CO2培养箱继续培养24 h, 然后分别在0 h和24 h时使用倒置相差显微镜观察细胞划痕的修复情况, 进而通过划痕的愈合情况衡量细胞的迁移能力.
1.2.5 Transwell侵袭实验: 按照"1.2.3"方法分组并处理的细胞, 用含1%胎牛血清的DMEM细胞培养基同步化12 h后, 然后消化并收集各组细胞. 用含0.2%BSA的无血清DMEM细胞培养基重悬各组细胞, 制成细胞密度为2×105个/mL单细胞悬液, 200 μL细胞悬液接种至预先铺Matrigel胶的Transwell小室上室中, 下室中加入500 μL含10%胎牛血清的DMEM培养基; 将Transwell小室置于37 ℃、5% CO2的培养箱, 培养24 h后, 4%多聚甲醛固定10 min, PBS洗涤, 0.1 %结晶紫染色10 min, 漂洗, 棉球轻轻擦去基质胶和上室中未发生侵袭转移的细胞, 置于倒置显微镜下观察并拍照, 每孔随机计数6个视野, 计算穿膜细胞数取平均值并进行统计学分析.
1.2.6 Western blot检测相关蛋白表达: 按照"1.2.3"方法分组并处理的细胞, 待细胞达到观测时间点时, 弃培养基, PBS洗2次, 加入裂解液裂解细胞, 提取总蛋白, Bradford比色法测定蛋白质浓度, 取相同质量的总蛋白, 加入等体积的2×电泳加样缓冲液, 电泳, 转移至PVDF膜上, 加入封闭液封闭1 h, 加入对应一抗, 4 ℃孵育过夜, 再加入相应二抗, 室温孵育2 h, 化学发光法显色, 成像扫描分析系统保存图像.
统计学处理 实验数据采用SPSS15.0软件统计分析, 计量资料数据采用mean±SD表示, 多组间均数差异性比较采用单因素方差分析, 以P<0.05为差异有统计学意义.
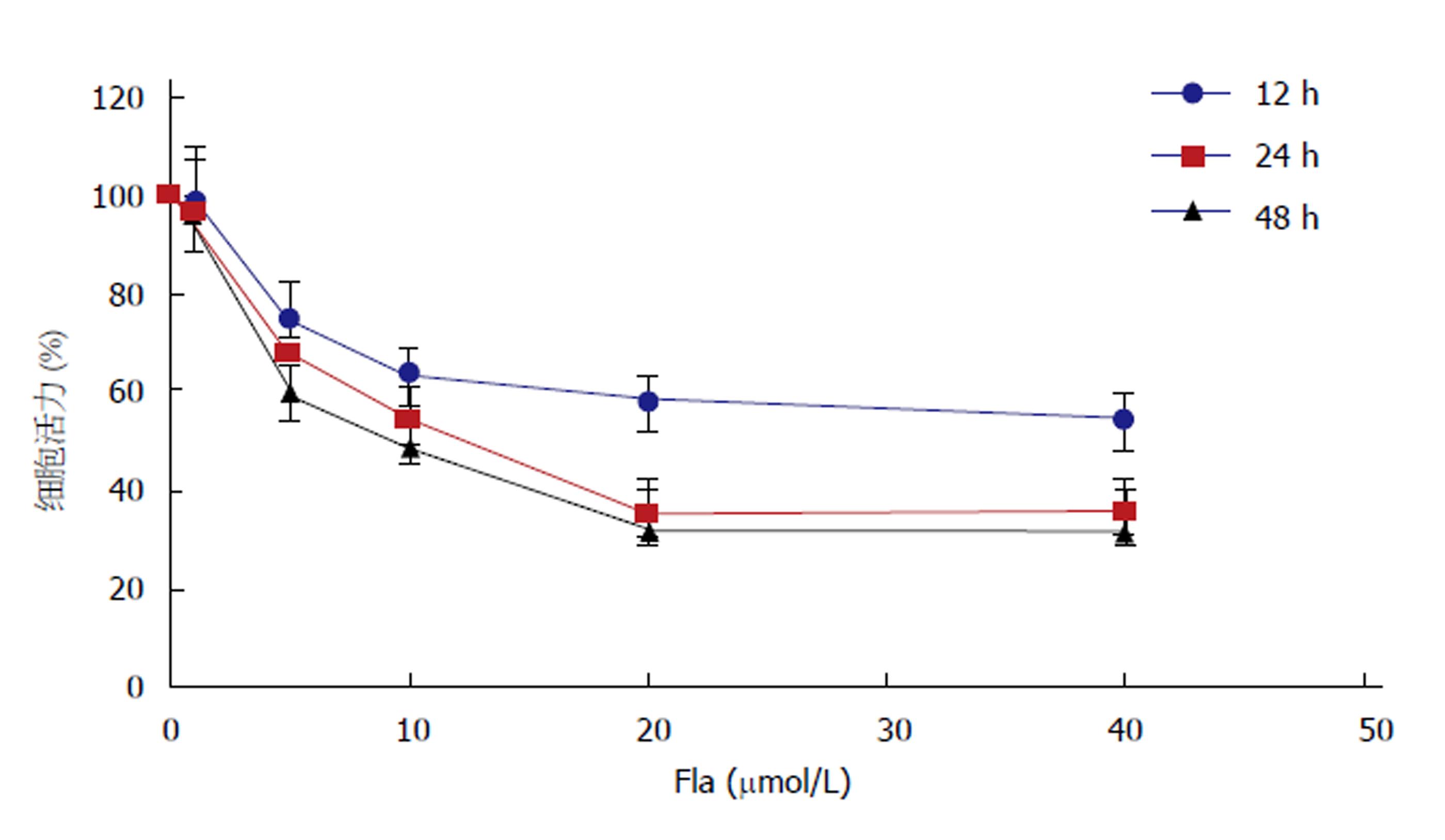
给予0-40 μmol/L的溪黄草黄酮分别处理HepG2细胞12、24和48 h后, 细胞的活力变化如图1所示, 溪黄草黄酮浓度依赖性和时间依赖性抑制HepG2细胞活力, 20 μmol/L和40 μmol/L的溪黄草黄酮处理HepG2细胞24 h与48 h, 细胞的活力显著低于其他组(P<0.05), 且20 μmol/L与40 μmol/L溪黄草黄酮培养处理24 h与48 h时, HepG2细胞活力无统计学差异(P>0.05), 综合考虑结果, 20 μmol/L的溪黄草黄酮处理24 h为溪黄草黄酮的最佳作用条件, 后续实验均采用此条件.
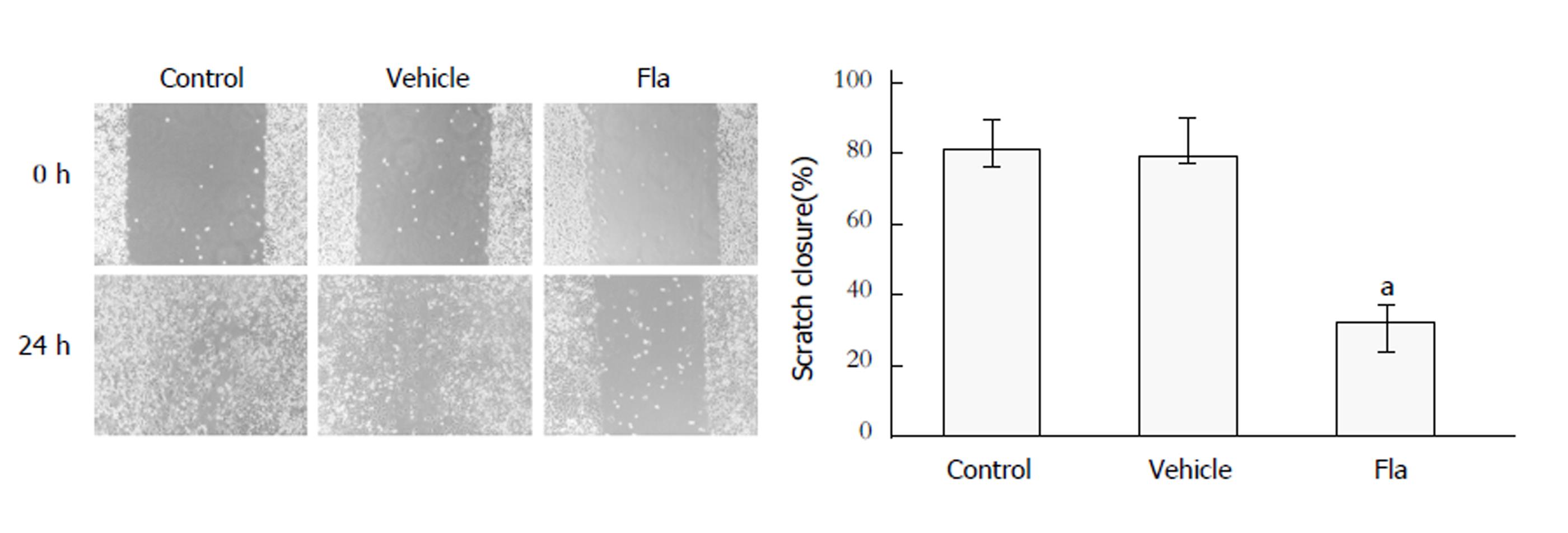
划痕实验通过创伤愈合的情况来衡量癌细胞的迁移能力. 结果如图2所示, 对照组(Control组)、溶剂对照组(Vehicle组)和溪黄草黄酮组(Fla组)HepG2细胞相对迁移率分别为81.2%±9.4%、79.6%±8.9%和32.6%±4.3%; 与对照组相比, 溪黄草黄酮组HepG2细胞相对迁移率明显降低(P<0.01). 结果表明, 溪黄草黄酮可抑制HepG2细胞迁移.
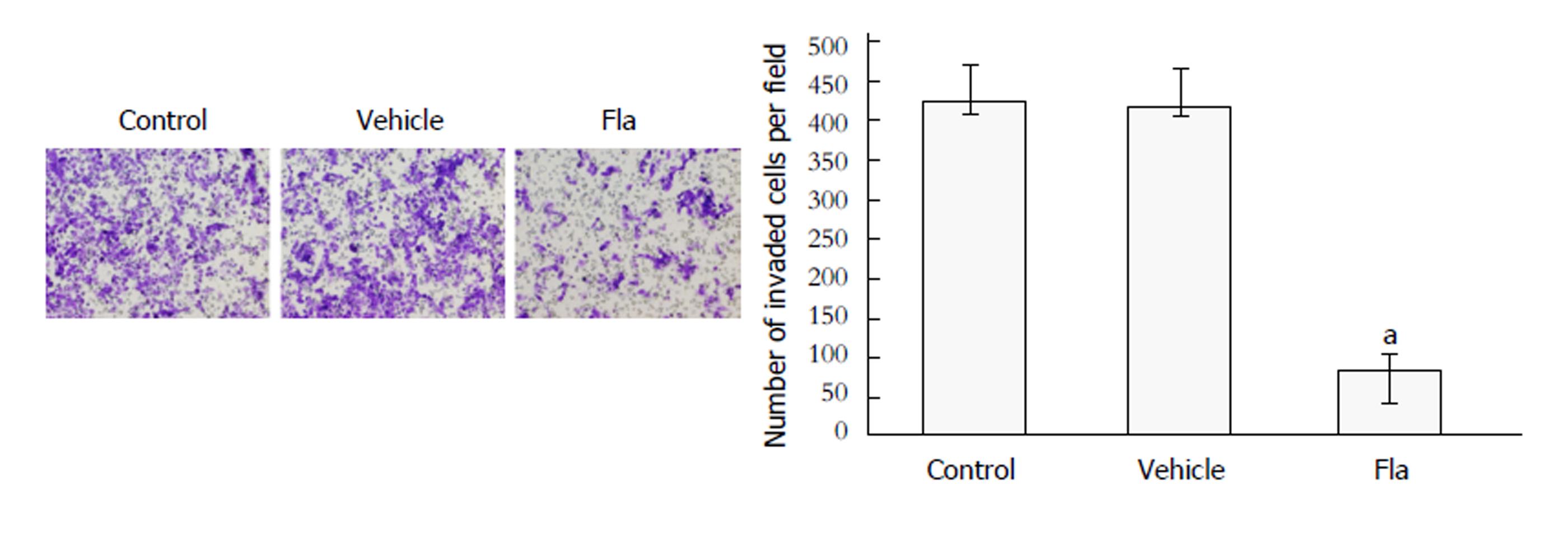
Transwell细胞侵袭实验用于检测溪黄草黄酮对HepG2细胞侵袭能力的影响. 检测结果如图3所示, 对照组(Control组)、溶剂对照组(Vehicle组)和溪黄草黄酮组(Fla组)HepG2细胞侵袭数目分别为425±43、416±41和86±12; 与对照组相比, 溪黄草黄酮组HepG2细胞侵袭数目明显减少(P<0.01). 结果表明, 说明溪黄草黄酮可抑制HepG2细胞侵袭能力.
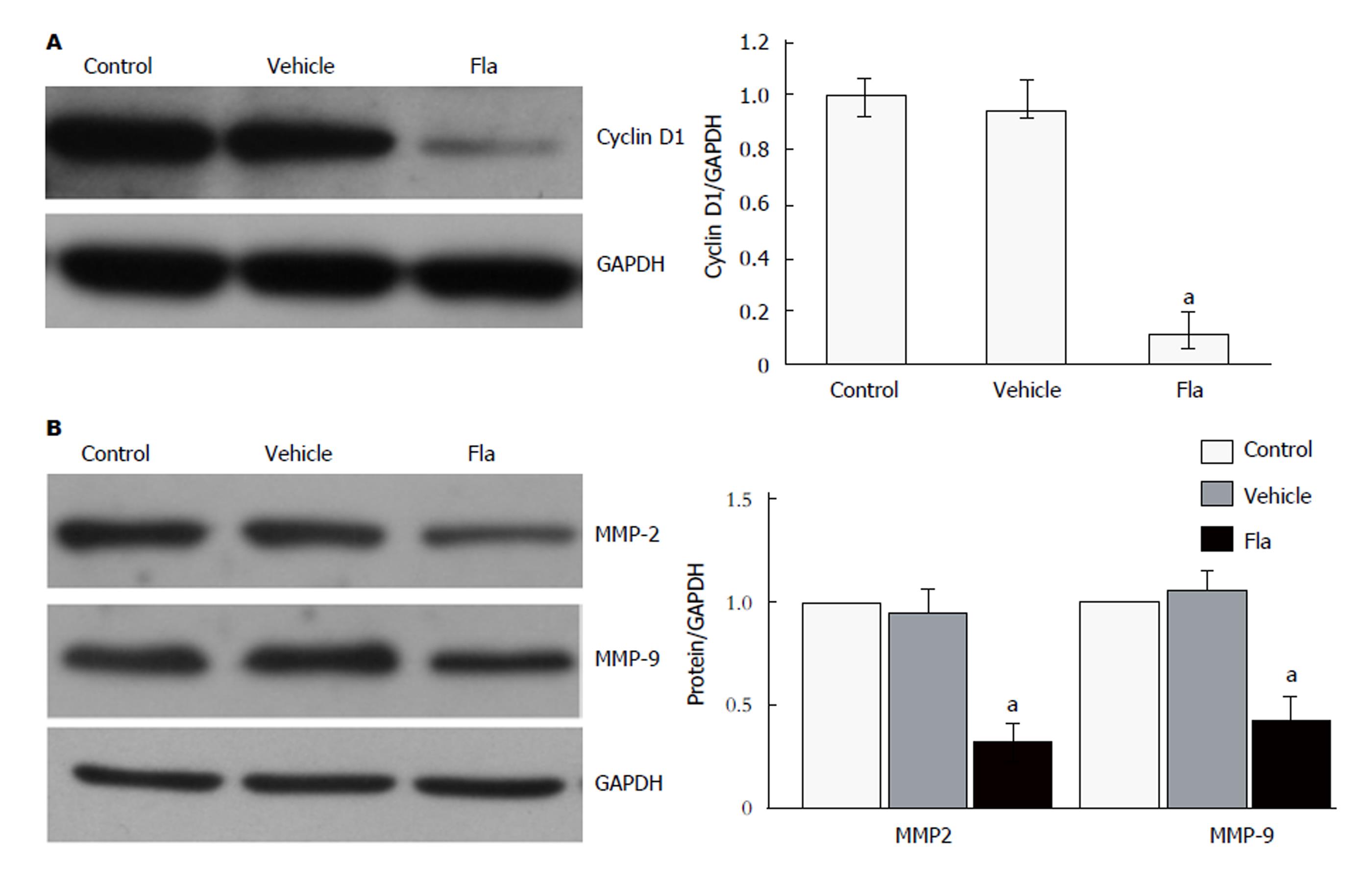
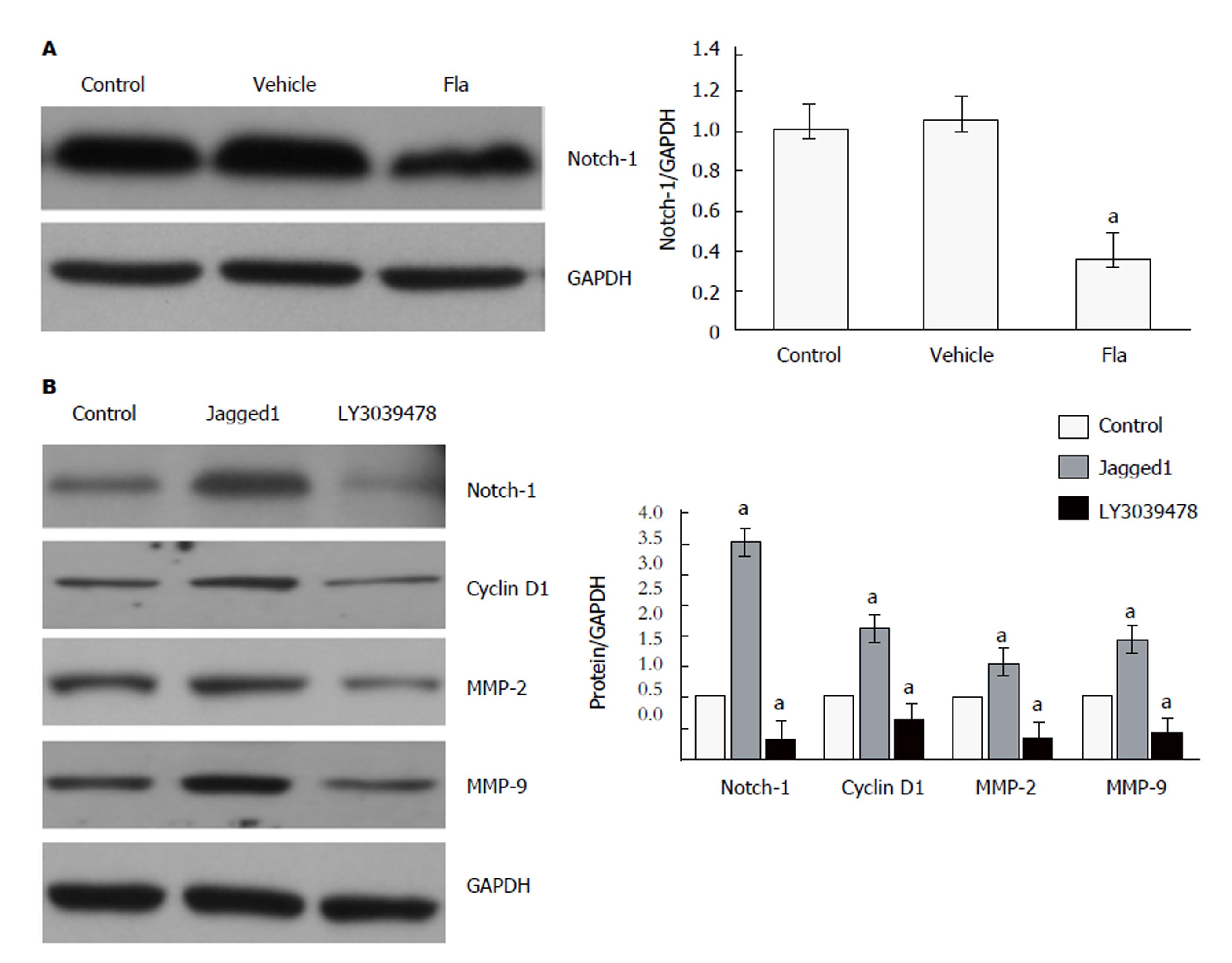
免疫印迹法结果显示, 如图4所示, 与对照组相比, 给予20 μmol/L溪黄草黄酮处理后, HepG2细胞中CyclingD1、MMP-2和MMP-9的蛋白表达水平显著降低(P<0.05).
免疫印迹法结果显示, 如图5所示, 与对照组相比, 给予20 μmol/L溪黄草黄酮处理后, HepG2细胞中Notch-1的蛋白表达水平显著降低(P<0.05). 进一步, 采用Notch-1激动剂Jagged1和Notch-1抑制剂LY3039478处理细胞, 发现Jagged1能上调Cyclin D1、MMP-2和MMP-9蛋白表达水平(P<0.05), LY3039478能下调Cyclin D1、MMP-2和MMP-9蛋白表达水平(P<0.05).
肝癌是消化系统恶性肿瘤中常见的恶性肿瘤之一, 其发病率和死亡率居消化系统恶性肿瘤的第二位, 且随着生活方式的改变和人口的老龄化呈明显上升趋势[1]. 另外, 肝癌具有因起病隐匿, 极易发生侵袭、转移且复发率高、预后差的特点[3]. 因此, 研究肝癌肿瘤细胞的生长和侵袭转移机制非常必要. 为此, 本研究从HepG2细胞的细胞增殖、迁移和侵袭探讨溪黄草黄酮的抗肝癌作用.
肿瘤细胞不受控制的增殖是肿瘤发生的根本原因[10], 所以抑制恶性肿瘤细胞增殖是治疗肿瘤的关键. 本研究首先采用CCK-8法检测溪黄草黄酮对HepG2细胞活力的影响, 发现溪黄草黄酮呈浓度依赖性抑制HepG2细胞的生长, 当浓度到达20 μmol/L时, 抑制作用达到最大. 细胞的增殖是通过细胞周期运行完成, 而细胞周期的运行受到周期相关蛋白、激酶和激酶抑制因子共同调控的影响[11]. 其中, Cyclin D1是G1期细胞增殖信号的关键周期蛋白, 其过度表达可致细胞增殖失控, 而抑制Cyclin D1表达可抑制细胞周期运行和细胞增殖[12]. 因此, 本研究进一步采用Western blot检测溪黄草黄酮对HepG2细胞Cyclin D1表达的影响, 发现溪黄草黄酮能抑制HepG2细胞Cyclin D1表达.
肿瘤侵袭转移是恶性肿瘤的基本生物学特征之一, 也是绝大多数肿瘤患者死亡的重要原因之一[13]. 本研究采用细胞划痕实验和thranswell细胞侵袭实验检测溪黄草黄酮对HepG2细胞侵袭转移能力的影响, 发现, 溪黄草黄酮能抑制HepG2细胞侵袭转移. MMPs是一类锌依赖性的蛋白水解酶, 与肿瘤迁移转移及血管重塑密切相关, 在肿瘤的侵袭转移过程中起重要作用[14]. 因此, 本研究进一步采用Western blot检测溪黄草黄酮对HepG2细胞MMP-2和MMP-9表达的影响, 发现溪黄草黄酮能抑制HepG2细胞MMP-2和MMP-9表达.
另外, 有研究发现肝癌组织中Notch-1呈高表达, 且与肝癌的转移相关[15]. 在肝癌细胞上, 另有研究同样发现Notch-1与其下游因子Hes1呈高表达, 上调Notch-1后, 肝癌细胞的增殖及侵袭转移能力增强[16]. 暗示, Notch-1信号通路参与调控肝癌的增殖及侵袭转移. 本研究发现溪黄草黄酮能抑制HepG2细胞Notch-1表达. 并进一步采用, Notch-1激动剂Jagged1、Notch-1抑制剂LY3039478分别处理HepG2细胞, 发现Jagged1能上调Cyclin D1、MMP-2和MMP-9蛋白表达水平, LY3039478能下调Cyclin D1、MMP-2和MMP-9蛋白表达水平. 说明, 溪黄草黄酮通过抑制Notch-1-Cyclin D1信号通路抑制HepG2细胞增殖, 通过抑制Notch-1-MMP-2/-9信号通路抑制HepG2细胞迁移和侵袭.
总之, 溪黄草黄酮可通过抑制Notch-1信号通路抑制HepG2细胞的增殖, 迁移与侵袭. 本实验为溪黄草黄酮抗肝癌提供了重要的实验依据.
肝癌是常见的消化系统恶性肿瘤之一, 死亡率位于所有肿瘤第三位. 且近年来, 肝癌的发病率呈上升趋势. 肝癌因起病隐匿, 大部分患者确诊时已是晚期, 且该病极易发生侵袭、转移, 手术难以根除. 肿瘤切除术及术后辅以基础化疗是标准的肝癌治疗方法. 但目前的化疗药物易出现耐药性, 导致临床上治疗效果不佳以及预后不良. 因此, 希望从祖国医学提取物筛选出毒副作用小的抗肿瘤药物.
目前研究发现溪黄草具有抗肿瘤活性, 而不同的提取方法和提取活性部位, 溪黄草提取物的抗肿瘤活性并不一致. 溪黄草黄酮是溪黄草重要的药理活性之一, 是溪黄草水溶性总黄酮部位中活性药理活性成分. 因此, 本实验观察溪黄草黄酮对人肝癌细胞株HepG2的增殖、迁移与侵袭的作用, 并探讨其初步作用机制.
本研究通过观察溪黄草黄酮对人肝癌细胞株HepG2的增殖、迁移与侵袭能力的影响, 并研究初步机制. 为溪黄草黄酮作为开发为抗肝癌药物提供实验理论依据.
本研究首先采用CCK-8法检测不同浓度溪黄草黄酮(0、1、5、10、20和40 μmol/L)对HepG2细胞活性的影响; 再使用划痕实验和Transwell侵袭实验分别检测细胞的迁移和侵袭能力; 最后采用Western blot检测Notch-1, Cyclin D1, MMP-2和MMP-9蛋白表达水平变化, 分析潜在的作用机制.
本研究发现, 溪黄草黄酮呈浓度依赖性抑制HepG2细胞的生长, 当浓度到达20 μmol/L时, 抑制作用达到最大; 经溪黄草黄酮干预后, HepG2细胞迁移和侵袭能力显著下降, Notch-1, Cyclin D1, MMP-2和MMP-9蛋白表达水平显著下降.
本研究发现, 溪黄草黄酮具有抑制肝癌细胞株HepG2增殖、迁移和侵袭的作用, 其作用机制可能与溪黄草黄酮抑制Notch-1-MMP-2/-9和Notch-1-Cyclin D1信号通路相关.
本研究发现, 溪黄草黄酮通过抑制Notch-1-MMP-2/-9和Notch-1-Cyclin D1信号通路具有抑制肝癌细胞株HepG2增殖、迁移和侵袭. 这为溪黄草黄酮在抗肝癌方面的研究指出了一个研究方向. 今后, 我们可以用溪黄草黄酮处理多种肝癌细胞系, 然后对比正常肝细胞, 检验抗肝癌的同时否具有细胞毒性, 筛选最佳各种肝癌细胞系作用浓度; 或者尝试溪黄草黄酮是否能增强肝癌细胞对常规化疗药物的敏感性等方面的研究.
学科分类: 胃肠病学和肝病学
手稿来源地: 浙江省
同行评议报告分类
A级 (优秀): 0
B级 (非常好): B, B
C级 (良好): C
D级 (一般): D
E级 (差): 0
编辑: 崔丽君 电编:张砚梁
| 1. | Kim SH, Park YN, Lim JH, Choi GH, Choi JS, Kim KS. Characteristics of combined hepatocelluar-cholangiocarcinoma and comparison with intrahepatic cholangiocarcinoma. Eur J Surg Oncol. 2014;40:976-981. [PubMed] [DOI] |
| 2. | Tang H, Lu W, Yang Z, Jiang K, Chen Y, Lu S, Dong J. Risk factors and long-term outcome for postoperative intra-abdominal infection after hepatectomy for hepatocellular carcinoma. Medicine (Baltimore). 2017;96:e6795. [PubMed] [DOI] |
| 3. | Zeeneldin AA, Eid SM, Darweesh AD, Moneer MM, Saadeldin M. Tamoxifen compared to best supportive care in advanced hepatocelluar carcinoma: A retrospective matched-cohort study. J Egypt Natl Canc Inst. 2014;26:1-7. [PubMed] [DOI] |
| 4. | Jiang D, Cho W, Li Z, Xu X, Qu Y, Jiang Z, Guo L, Xu G. MiR-758-3p suppresses proliferation, migration and invasion of hepatocellular carcinoma cells via targeting MDM2 and mTOR. Biomed Pharmacother. 2017;96:535-544. [PubMed] [DOI] |
| 8. | 陈 源红, 曾 怡, 罗 艳红. 溪黄草对肝癌细胞HepG2增殖及凋亡的影响. 山东大学学报(医学版). 2013;51:42-45. [DOI] |
| 9. | 王 佐, 王 璐, 陈 忠正, 劳 扬, 刘 杏宜, 高 雄, 燕 妮, 林 晓蓉, 张 媛媛, 李 斌. 冬凌草甲素诱导小鼠肝癌细胞醌还原酶活性及其机理研究. 食品科学. 2017;38:193-200. [DOI] |
| 10. | Zhou X, Yang F, Yang Y, Hu Y, Liu W, Huang C, Li S, Chen Z. HBV Facilitated Hepatocellular Carcinoma Cells Proliferation by Up-Regulating Angiogenin Expression Through IL-6. Cell Physiol Biochem. 2018;46:461-470. [PubMed] [DOI] |
| 11. | Turkekul K, Colpan RD, Baykul T, Ozdemir MD, Erdogan S. Esculetin Inhibits the Survival of Human Prostate Cancer Cells by Inducing Apoptosis and Arresting the Cell Cycle. J Cancer Prev. 2018;23:10-17. [PubMed] [DOI] |
| 12. | Borello U, Berarducci B, Delahaye E, Price DJ, Dehay C. SP8 Transcriptional Regulation of Cyclin D1 During Mouse Early Corticogenesis. Front Neurosci. 2018;12:119. [PubMed] [DOI] |
| 13. | Huang L, Zhou Y, Cao XP, Lin JX, Zhang L, Huang ST, Zheng M. KPNA2 promotes migration and invasion in epithelial ovarian cancer cells by inducing epithelial-mesenchymal transition via Akt/GSK-3β/Snail activation. J Cancer. 2018;9:157-165. [PubMed] [DOI] |
| 14. | Chien YC, Liu LC, Ye HY, Wu JY, Yu YL. EZH2 promotes migration and invasion of triple-negative breast cancer cells via regulating TIMP2-MMP-2/-9 pathway. Am J Cancer Res. 2018;8:422-434. [PubMed] |
| 15. | Han B, Liu SH, Guo WD, Zhang B, Wang JP, Cao YK, Liu J. Notch1 downregulation combined with interleukin-24 inhibits invasion and migration of hepatocellular carcinoma cells. World J Gastroenterol. 2015;21:9727-9735. [PubMed] [DOI] |
| 16. | You K, Sun P, Yue Z, Li J, Xiong W, Wang J. NOR1 promotes hepatocellular carcinoma cell proliferation and migration through modulating the Notch signaling pathway. Exp Cell Res. 2017;352:375-381. [PubMed] [DOI] |