修回日期: 2018-05-03
接受日期: 2018-05-16
在线出版日期: 2018-06-08
探索受体相互作用蛋白激酶3(receptor-interacting protein kinase 3, RIP3)信号通路与胃黏膜肠上皮化生(gastric intestinal metaplasia, GIM)的关系, 及其对炎性细胞因子的调控作用.
收集健康对照, 患有慢性非萎缩性胃炎、GIM和异型增生的胃黏膜组织标本, 通过免疫组化和qRT-PCR分析RIP3在GIM中的表达情况. 用脱氧胆酸钠(sodium desoxycholate, DCA)刺激GES-1人胃黏膜上皮细胞系, western blot观察肠上皮化生的关键基因CDX2与RIP3信号通路的关系, 及RIP3信号通路对炎性细胞因子的调控.
与对照组和慢性非萎缩性胃炎组相比, GIM组和异型增生组的胃黏膜RIP3 mRNA表达上调; 同时GIM组和异型增生组胃上皮细胞RIP3蛋白水平表达上调. 受DCA刺激的GES-1细胞, RIP3信号通路相关蛋白表达与CDX2蛋白表达均上调, 伴随着IL-33表达的上调; RIP3信号通路的特异性抑制剂(necrostatin-1, Nec-1)对CDX2表达无影响, 但可显著下调RIP3信号通路相关蛋白及IL-33的表达.
RIP3信号通路对GIM的发生无影响, 然而其可能通过调控肠化的胃上皮细胞IL-33的表达影响GIM进展, 提示其可能成为阻止GIM进展的潜在治疗靶点.
核心提要: 受体相互作用蛋白激酶3(receptor-interacting protein kinase 3, RIP3)作为调节炎症信号的关键因子, 其在炎症调控及肿瘤的发生发展中扮演一定的作用. 本文就RIP3信号通路在胃黏膜肠上皮化生(gastric intestinal metaplasia, GIM)发生发展中的作用机制进行了初步探讨, 在细胞水平初步发现RIP3信号通路可调控肠化胃上皮细胞IL-33的表达, 进而可能调控GIM进展.
引文著录: 刘梦静, 姜葵, 张君, 周璐, 赵经文, 王邦茂. RIP3介导肠化胃上皮细胞IL-33的表达. 世界华人消化杂志 2018; 26(16): 964-971
Revised: May 3, 2018
Accepted: May 16, 2018
Published online: June 8, 2018
To explore the relationship between receptor-interacting protein kinase 3 (RIP3) signaling pathway and gastric intestinal metaplasia (GIM), and the regulatory effect of this signaling pathway on inflammatory cytokines.
Gastric tissues from healthy controls, patients with chronic non-atrophic gastritis, patients with GIM, and patients with dysplasia were collected to detect the expression of RIP3 in GIM by immunohistochemistry and RT-PCR. Human gastric epithelial cell line GES-1 was stimulated with sodium deoxycholate (DCA) to observe the relationship between CDX2, a key gene involved in intestinal metaplasia, and RIP3 signaling pathway. The regulation of inflammatory cytokines by RIP3 was also assessed.
Compared with the control and chronic non-atrophic gastritis groups, the expression of RIP3 mRNA in the gastric mucosa of GIM patients and dysplasia patients was up-regulated, and the expression of RIP3 protein in the gastric epithelium of GIM patients and dysplasia patients was also up-regulated. In GES-1 cells stimulated with DCA, the expression of CDX2 protein and the RIP3 signaling pathway-associated proteins was increased in a concentration-dependent manner, accompanied by up-regulation of IL-33 expression. Necrostatin-1 (Nec-1), a specific inhibitor of the RIP3 signaling pathway, had no effect on CDX2 expression, but significantly down-regulated the expression of RIP3 and IL-33.
RIP3 has no effect on the occurrence of GIM, but it may affect GIM progression by regulating the expression of IL-33 in gastric epithelial cells with intestinal metaplasia, suggesting that it may be a potential therapeutic target for preventing GIM progression.
- Citation: Liu MJ, Jiang K, Zhang J, Zhou L, Zhao JW, Wang BM. RIP3 mediates IL-33 production in gastric epithelial cells with intestinal metaplasia. Shijie Huaren Xiaohua Zazhi 2018; 26(16): 964-971
- URL: https://www.wjgnet.com/1009-3079/full/v26/i16/964.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v26.i16.964
胃黏膜肠上皮化生(gastric intestinal metaplasia, GIM)作为胃癌的独立危险因素, 参与慢性炎症状态所触发的慢性萎缩性胃炎、肠上皮化生、异型增生及肠型胃癌发生的多步骤演化过程, 与胃癌的发病存在密切联系. 然而, 到目前为止对于GIM进展至胃癌的相关分子机制知之甚少, 其中一个重要原因即造模困难. 在实验中给予小鼠幽门螺杆菌灌胃, 小鼠没有出现典型的GIM和胃癌的病理学特征[1]. 目前认为尾型同源盒基因家族2(caudal-related homeobox gene family, cdx2)是肠上皮化生的重要调节因子, cdx2的异位表达在肠上皮化生的发生发展中起着至关重要的作用. 在肠化生形成过程中, cdx2基因的表达要早于与cdx2属同一基因家族的cdx1和其他肠上皮特异基因, 提示cdx2基因的表达是肠化生的原因.
近年来, 慢性炎症与胃癌的关系已成为研究热点之一, 目前大量研究证实, 慢性炎症的持续存在在启动、维持、促进胃癌生长中发挥重要作用. 细胞因子作为炎症反应的主要成分, 与胃癌的发生发展密切相关. 研究发现IL-8、IL-1β等炎性细胞因子基因多态性可影响GIM进展[2-4]. 此外, 研究发现在70%的胃癌(gastric cancer, GC)患者主要表现为3种致癌途径失调: 增殖/干细胞通路(40%), NF-κB通路(46%)和Wnt /β-连环蛋白途径(39%)[5]. NF-κB和STAT3通路是促炎细胞因子释放的关键调控因子, 也是肿瘤增殖和慢性炎症持续存在的重要介质. 研究表明, GC的发生与细胞因子过度表达密切相关, 特别是受NF-κB调节的IL-1, IL-6, TNF, 且这种相关性大于良性疾病如胃炎[6]. STAT3通过促进细胞因子活化驱动胃癌发生和发展, IL-6和IL-11为肿瘤发生提供了基础[7].
最新研究表明受体相互作用蛋白3(receptor-interacting protein 3, RIP3)是调节炎症信号的关键因子, 越来越多的研究已证实, RIP3可通过诱导坏死性凋亡或促进炎性细胞因子的产生引发炎症. 有研究证实, 在许多炎症性疾病的小鼠模型中, RIP3缺陷小鼠呈现减少的炎症反应[8,9], 证明RIP3信号与炎症反应的密切联系. 已知危险相关模式分子(DAMPs)是重要的炎症介质, 通常情况下, 细胞凋亡只产生很少的DAMPs不足于引起炎症反应, 然而坏死性凋亡可释放大量的DAMPs[10]. 此外, 研究发现高迁移率族蛋白B1(high mobility group protein B1, HMGB1)、 线粒体DNA(mtDNA)及IL-33等DAMPs 分子与坏死性凋亡导致的炎症反应密切相关[11]. 此外, RIP3可刺激NLRP3 炎症小体活化, 包括受体分子、凋亡相关斑点样蛋白(ASC)及pro-caspase-1等大分子, 进而释放促炎因子IL-1家族成员释放, 是炎症反应的重要分子机制之一[12-14]. 因此, 了解RIP3信号通路与GIM的关系, 及其对炎性细胞因子的调控作用对探索GIM进展有重要作用.
收集天津医科大学总医院2017-04/05经内镜及病理诊断为正常、慢性非萎缩性胃炎、GIM和异型增生的患者胃黏膜标本两块, 一块用于免疫组化检查, 一块用于实时荧光定量PCR(qRT-PCR). 正常组10例, 男6例, 女4例, 年龄54-60岁, 平均年龄57.3岁; 慢性非萎缩性胃炎组15例, 男8例, 女7例, 年龄40-70岁, 平均年龄55.1岁; 肠化组26例, 男18例, 女18例, 年龄41-74岁, 平均年龄56.7岁; 异型增生组12例, 男6例, 女6例, 年龄40-65岁, 平均年龄53岁. 患者同意进入本研究, 签订知情同意书.
1.2.1 免疫组化: 新鲜胃黏膜组织样本置于10%甲醛溶液中固定, 常规石蜡包埋. 切片常规脱蜡水化, 取一定量pH6.0柠檬酸盐缓冲液于微波炉中加热进行抗原修复后滴加3% H2O2孵育10 min, 一抗工作液4 ℃孵育过夜. 二抗工作液室温孵育30 min, 滴加DAB液显色20 min, 淡苏木紫复染细胞核30 s, 脱水封片, 晾干后观察.
1.2.2 胃黏膜组织样本RNA提取和cDNA合成: 将新鲜胃黏膜组织样本置于Trizol中,使用组织研磨器研磨后加入氯仿离心. 吸取上层液体加入异丙醇沉淀RNA, 乙醇漂洗, 加入DEPC水溶解沉淀检测浓度. 根据TIANScript cDNA第一链合成试剂盒进行逆转录反应, 合成cDNA.
1.2.3 qRT-PCR: 检测IL-33、IL-1β、IL-10、TNFα、CDX2、RIP3的表达. 引物序列参照Gene Bank 数据库中基因的序列, 使用 ABI公司的 Primer Express Software 2.0设计, 由金唯智生物科技有限公司合成(表1).
| 引物名称 | 引物序列 (5'→3') |
| GAPDH | 上游: CCCTTCATTGACCTCAACTACATGG |
| 下游: CATGGTGGTGAAGACGCCAG | |
| IL-33 | 上游: TGACGGTGTTGATGGTAAGATG |
| 下游: ACAGAGTGTTCCTTGTTGTTGG | |
| IL-1β | 上游: ATGCACCTGTACGATCACTG |
| 下游: ACAAAGGACATGGAGAACACC | |
| IL-10 | 上游: CGCATGTGAACTCCCTGG |
| 下游: TAGATGCCTTTCTCTTGGAGC | |
| TNFα | 上游: ACTTTGGAGTGATCGGCC |
| 下游: GCTTGAGGGTTTGCTACAAC | |
| CDX2 | 上游: GCTATAAATGCCAGAGCCAACC |
| 下游: CACAGACCAACAACCCAAACAG | |
| RIP3 | 上游: TGGCGGTCAAGATCGTAAAC |
| 下游: AATTTAGTCACCAGAGCCGG |
1.2.4 细胞培养: 人胃黏膜上皮细胞系(GES-1)购自于北京肿瘤研究所, 用含10% 胎牛血清的DMEM高糖培养液培养, 置于37 ℃、5% CO2细胞培养箱中, 2 d换液1次, 1:2-1:3传代.
1.2.5 Western blot: 提取细胞总蛋白, BCA 试剂盒检测蛋白浓度. SDS-PAGE分离蛋白, 转至PVDF膜, 封闭. 一抗孵育4 ℃过夜. 洗涤后二抗室温孵育1 h, 再次洗涤. 用ECL检测液发光显影定影, Quantity One软件分析.
统计学处理 应用SPSS22.0软件包录入数据并进行数据处理分析. 计量资料以mean±SD表示正态分布数据, 组间差异显著性采用单因素方差分析(One-Way ANOVA)进行统计学分析, 组间的两两比较采用LSD法, 以P<0.05为差异具有统计学意义.
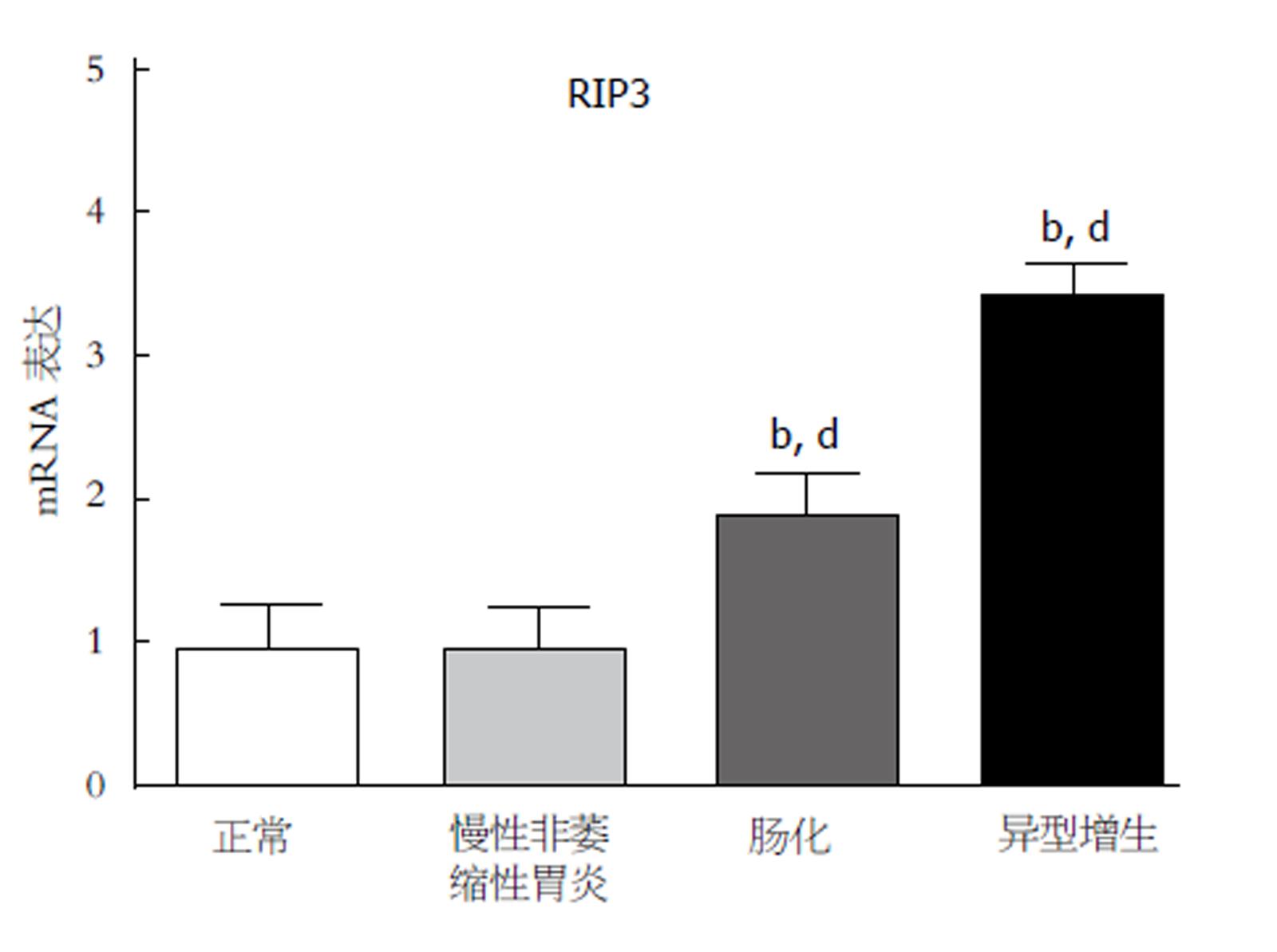
用qRT-PCR检测正常组、慢性非萎缩性胃炎组、肠化组、异型增生组RIP3 mRNA表达水平. 结果显示, 与正常对照组相比, 慢性非萎缩性胃炎组RIP3 mRNA表达无统计学差异, 但肠化组和异型增生组表达水平显著升高(P均<0.01). 与慢性非萎缩性胃炎组相比, 肠化组和异型增生组RIP3 mRNA表达水平显著升高(P均<0.01)(图1).
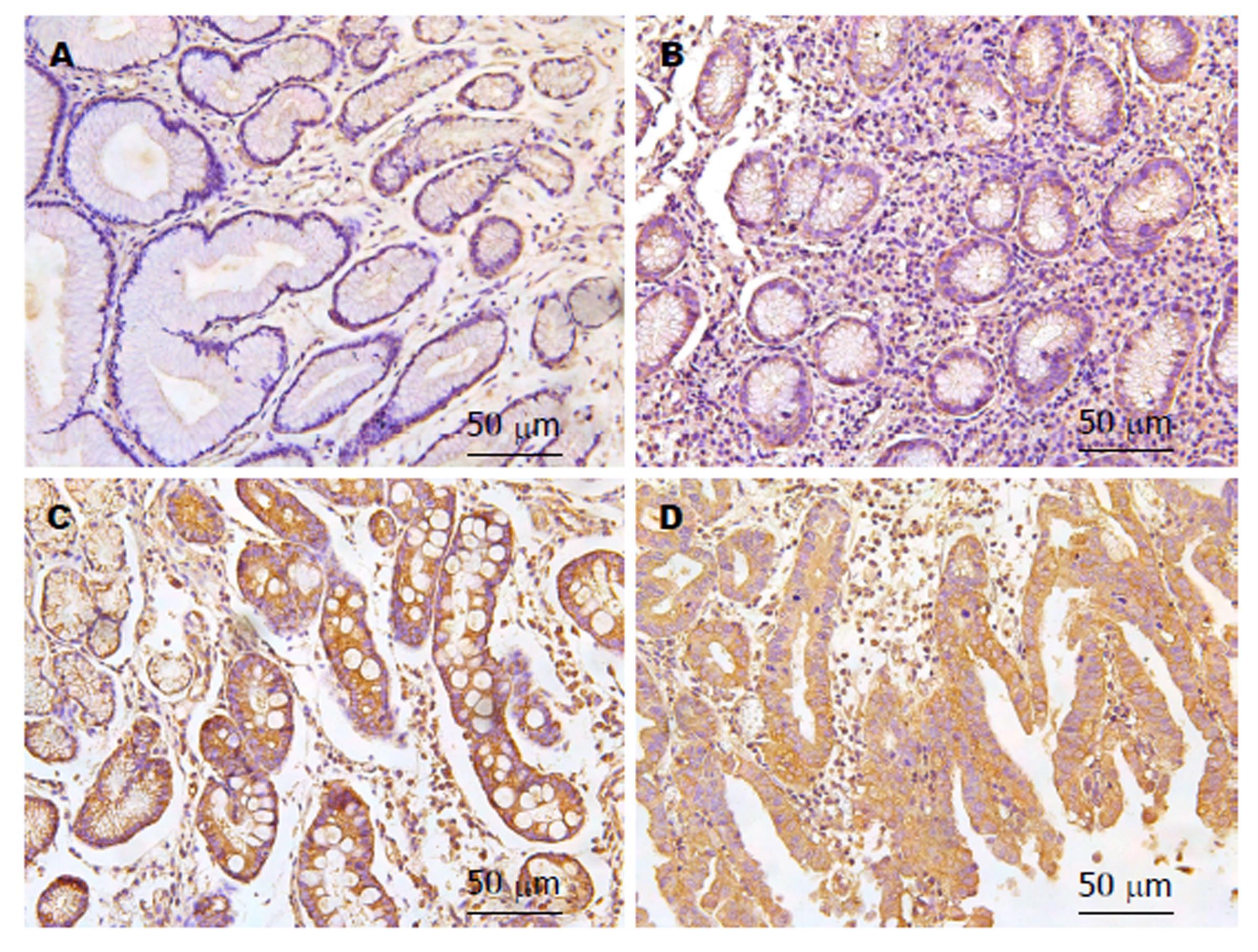
应用免疫组化观察RIP3蛋白(炎症信号调节的关键蛋白)在正常组、慢性非萎缩性胃炎组、 肠化组和异型增生组的胃上皮细胞中的表达情况. 结果显示, 与正常对照组相比, 慢性非萎缩性胃炎组RIP3 蛋白表达无差异, 但肠化组和异型增生组表达水平显著升高. 与慢性非萎缩性胃炎组相比, 肠化组和异型增生组RIP3 蛋白表达水平显著升高, 结果与基因表达水平一致. 这些发现表明在肠化的胃上皮细胞中RIP3信号通路活性升高(图2).
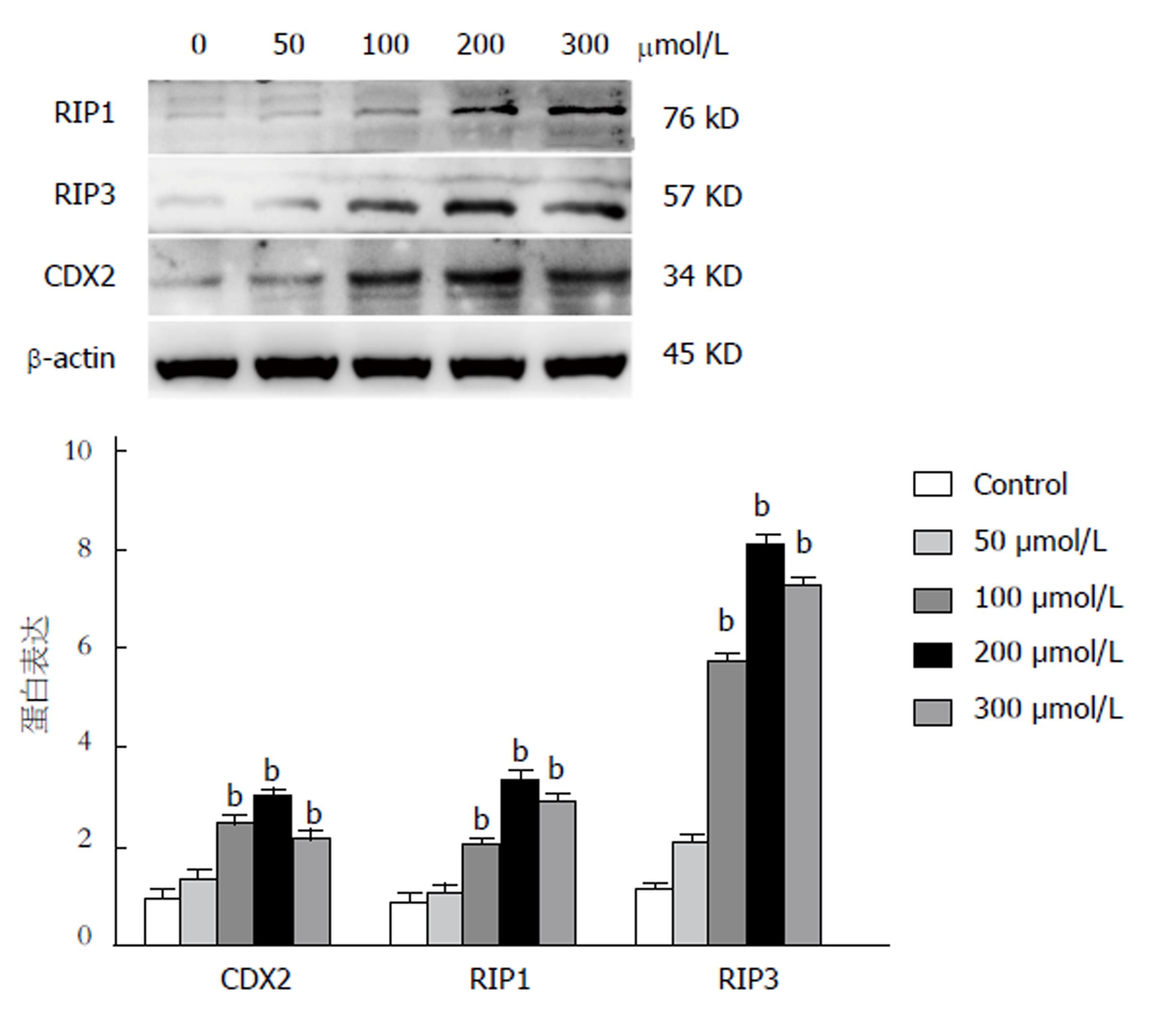
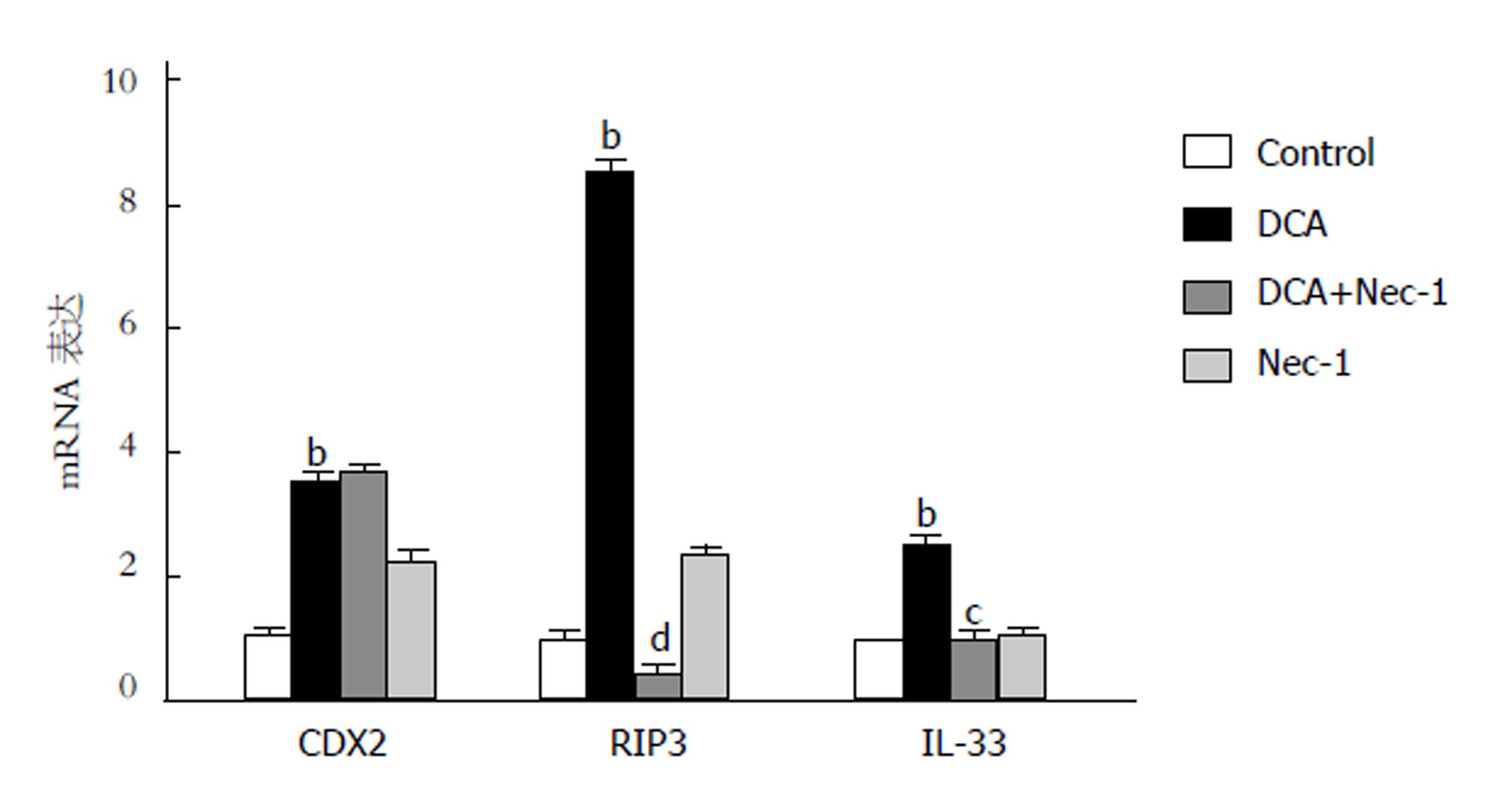
DCA可诱导GES-1细胞表达肠上皮化生的关键基因cdx2[15,16]. 为进一步证实RIP3信号通路在肠化的胃上皮细胞中的表达情况, 我们在体外给予不同浓度DCA(0 μmol/L、50 μmol/L、100 μmol/L、200 μmol/L、300 μmol/L)刺激GES-1 12h, 应用Western blot检测CDX2、RIP1(RIP3上游信号分子)、RIP3蛋白的表达水平. 结果显示: 对照组GES-1细胞的CDX2蛋白微表达(P>0.05), 随着DCA浓度逐渐升高到200 μmol/L, GES-1细胞的CDX2蛋白表达逐渐增强呈浓度依赖性, 浓度升高为300 μmol/L时CDX2蛋白表达减弱, 提示DCA可诱导CDX2表达, 且在一定范围内呈浓度依赖性升高; 同时RIP1、RIP3蛋白表达水平与CDX2蛋白表达呈现相同趋势, 进一步证明RIP3信号通路在肠化的胃上皮细胞中活化(图3).
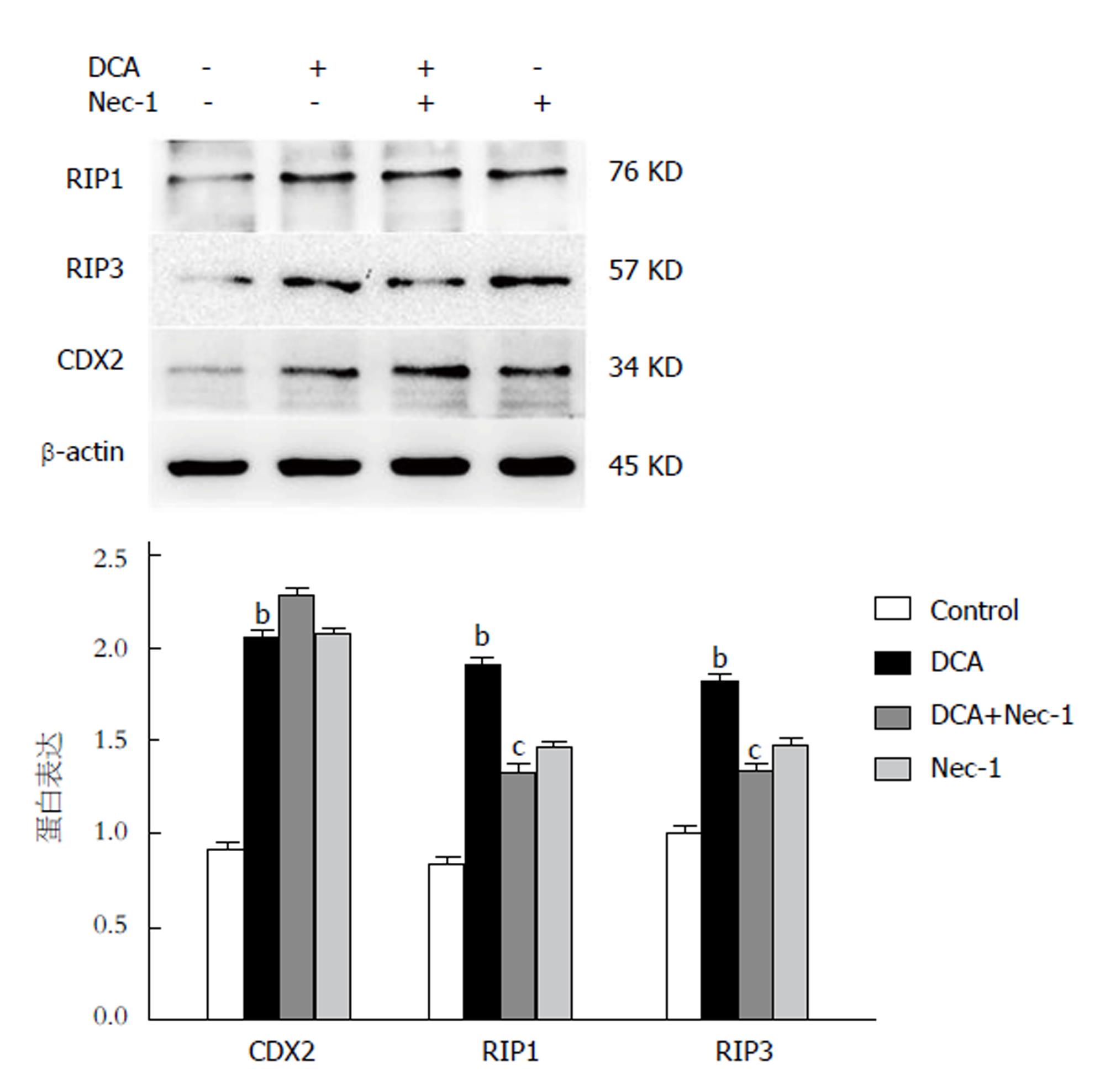
为探索RIP3信号通路与GIM的关系, 用RIP3信号通路的特异性抑制剂Nec-1作用于细胞, 观察CDX2与RIP3信号通路的表达情况. 与对照组相比, DCA组CDX2与RIP3信号通路相关蛋白表达水平均升高; 与DCA组相比, DCA+Nec-1组CDX2蛋白表达水平无统计学差异(P>0.05), 然而RIP3信号通路相关蛋白表达水平降低(P均<0.01), 证明RIP3信号通路与GIM的发生无关, 而是胃上皮细胞肠化后激活该信号通路, 提示RIP3信号通路可能与GIM进展有关(图4).
我们用qRT-PCR检测GES-1细胞在不同条件下炎性细胞因子IL-33、IL-1β、TNFα、IL-10的表达情况. 结果显示: 与对照组相比, DCA组IL-33 mRNA表达水平升高(P<0.01), IL-1β、TNFα、IL-10的表达无统计学差异; 与DCA组相比, DCA+Nec-1组IL-33 mRNA表达水平显著降低(P<0.05). 结果表明, RIP3信号通路可调控IL-33的表达(图5).
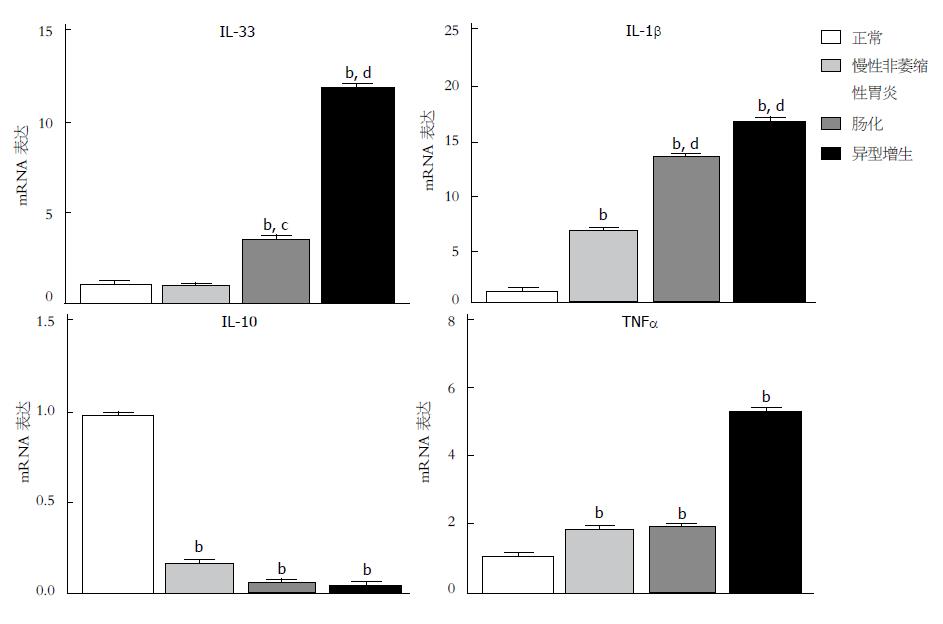
同时, 我们用RT-PCR检测正常组、慢性胃炎组、肠化组、异型增生组各组的IL-33、IL-10、IL-1β、TNFα mRNA的表达水平. 结果显示, 与正常对照组相比, 慢性胃炎组IL-33mRNA表达无统计学差异, 但肠化组和异型增生组表达水平升高(P均<0.05); 与正常对照组相比, 慢性胃炎组、肠化组和轻度异型增生组IL-1β和TNFα mRNA表达水平均升高(P均<0.05), IL-10 mRNA表达降低(P<0.05). 另外, 与慢性胃炎组对比, 肠化组和异型增生组IL-33、IL-1β mRNA表达水平显著升高(P均<0.05), IL-10和TNFαmRNA表达水平无统计学差异(P均>0.05)(图6).
本研究发现肠化的胃黏膜RIP3 mRNA表达升高, 同时肠化的胃上皮细胞RIP3蛋白表达水平升高. 此外, 体外实验发现RIP3信号通路对肠化关键基因CDX2表达无影响, 但可调控IL-33的表达.
GIM被认为是一种癌前病变, 但其进展为肠型胃癌的具体分子机制仍未明确. 研究表明胃黏膜萎缩、肠化、异型增生及癌变均与胃黏膜的炎性微环境有关[17,18]. 同时, 越来越多的研究证实RIP3信号通路是炎症信号的关键调节因子, 通过坏死性凋亡或其他途径[19]. 本研究发现肠化的胃上皮细胞RIP3信号通路活性升高, 同时DCA刺激GES-1后CDX2与RIP3相关通路蛋白表达均升高, 证明RIP3信号通路与GIM有关. 给予RIP3信号通路特异性抑制剂后, 发现RIP3相关蛋白表达下降, 而CDX2蛋白表达无变化, 证明RIP3信号通路与GIM的发生无关, 而是胃黏膜肠上皮化生后激活RIP3信号通路, 表明RIP3信号通路可能与GIM的进展有关.
本研究中发现受DCA刺激GES-1细胞, RIP3信号通路活化, 同时上调IL-33的产生, 对IL-1β、TNFα、IL-10的表达无影响; 抑制RIP3信号通路, IL-33表达降低, 表明RIP3信号通路可调控肠化胃上皮细胞IL-33的产生. 此外, 我们研究发现相比于慢性胃炎组, 肠化及异型增生组胃黏膜组织标本中IL-33、IL-1β基因表达水平明显升高, TNFα、IL-10没有明显变化, 揭示RIP3信号通路可能通过影响肠化胃上皮细胞IL-33的表达影响GIM进展.
IL-33作为IL-1家族的一个成员, 既可作为可溶性细胞因子调节Th2免疫反应, 刺激肥大细胞产生前炎性因子, 又可以作为核因子起抑制转录的作用, 在炎症和肿瘤等多种疾病中发挥重要的调控作用. 有研究结果发现IL-33在肺癌、乳腺癌和肝癌中表达异常升高, 并且能够促进肿瘤的生长和转移[20-22]. 此外, 有研究发现IL-33在胃癌患者的肿瘤组织和血清中表达升高, 促进胃癌细胞的侵袭能力[23,24]. 同时有研究表明给予小鼠高浓度IL-33可通过促进IL-6和IL-9产生, 促进骨髓源性免疫细胞在胃内的聚集, 从而引起胃黏膜炎症、萎缩和肠化[25]. 另有研究发现IL-33可使胃内巨噬细胞极化为M2型巨噬细胞, 通过IL-33/IL-13途径促进解痉多肽表达性化生进展[26], 证明IL-33对GIM的进展和胃癌的发生与发展有着极为重要的作用.
总之, RIP3信号通路对GIM的发生无影响, 但其可能通过调控IL-33的表达影响GIM进展, 表明其可能是阻止GIM进展的潜在靶点.
胃黏膜肠上皮化生(gastric intestinal metaplasia, GIM)与胃癌的发病存在密切联系. 受体相互作用蛋白激酶3(receptor-interacting protein kinase 3, RIP3)是调节炎症信号的关键因子, 研究已证实 RIP3可通过诱导坏死性凋亡或促进炎性细胞因子的产生而引发炎症.
本次实验通过研究RIP3信号通路与GIM发生发展之间的关系, 初步探讨RIP3信号通路在GIM中的重要作用, 提示其可能成为阻止GIM进展的潜在治疗靶点.
本次实验拟初步探索RIP3与GIM之间的关系及其对炎性细胞因子的调控作用, 为以后进一步研究GIM的防治提供依据, 对预防胃癌的发生有重要意义.
本研究通过收集健康对照, 慢性非萎缩性胃炎、GIM和异型增生患者胃黏膜标本, 采用免疫组化和qRT-PCR检测肠化细胞中RIP3的表达. 同时通过体外培养GES-1细胞系, 采用不同浓度DCA刺激细胞, RIP3抑制剂Nec-1干预细胞. 用Western blot检测CDX2、RIP3等相关指标的表达.
本次实验发现GIM中RIP3信号通路表达升高. RIP3信号通路相关蛋白表达以及CDX2 蛋白表达均上调; RIP3信号通路的特异性抑制剂Necrostatin-1对CDX2表达无影响, RIP3信号通路相关蛋白及IL-33的表达显著下调.
RIP3信号通路可能通过调控肠化的胃上皮细胞IL-33的表达而影响GIM进展, 可能成为潜在治疗靶点从而阻止GIM进展.
本次实验由于时间限制, 暂只完成细胞水平相关实验. 拟于以后进一步完善细胞转染和相关动物实验.
学科分类: 胃肠病学和肝病学
手稿来源地: 天津市
同行评议报告分类
A级 (优秀): A
B级 (非常好): B
C级 (良好): C, C, C, C
D级 (一般): D
E级 (差): 0
编辑: 崔丽君 电编:张砚梁
| 1. | Varon C, Dubus P, Mazurier F, Asencio C, Chambonnier L, Ferrand J, Giese A, Senant-Dugot N, Carlotti M, Mégraud F. Helicobacter pylori infection recruits bone marrow-derived cells that participate in gastric preneoplasia in mice. Gastroenterology. 2012;142:281-291. [PubMed] [DOI] |
| 2. | Kumar S, Kumari N, Mittal RD, Mohindra S, Ghoshal UC. Association between pro-(IL-8) and anti-inflammatory (IL-10) cytokine variants and their serum levels and H. pylori-related gastric carcinogenesis in northern India. Meta Gene. 2015;6:9-16. [PubMed] [DOI] |
| 3. | Leung WK, Chan MC, To KF, Man EP, Ng EK, Chu ES, Lau JY, Lin SR, Sung JJ. H. pylori genotypes and cytokine gene polymorphisms influence the development of gastric intestinal metaplasia in a Chinese population. Am J Gastroenterol. 2006;101:714-720. [PubMed] [DOI] |
| 4. | Li ZW, Wu Y, Sun Y, Liu LY, Tian MM, Feng GS, You WC, Li JY. Inflammatory cytokine gene polymorphisms increase the risk of atrophic gastritis and intestinal metaplasia. World J Gastroenterol. 2010;16:1788-1794. [PubMed] |
| 5. | Ooi CH, Ivanova T, Wu J, Lee M, Tan IB, Tao J, Ward L, Koo JH, Gopalakrishnan V, Zhu Y. Oncogenic pathway combinations predict clinical prognosis in gastric cancer. PLoS Genet. 2009;5:e1000676. [PubMed] [DOI] |
| 6. | Yin Y, Si X, Gao Y, Gao L, Wang J. The nuclear factor-κB correlates with increased expression of interleukin-6 and promotes progression of gastric carcinoma. Oncol Rep. 2013;29:34-38. [PubMed] [DOI] |
| 7. | Giraud AS, Menheniott TR, Judd LM. Targeting STAT3 in gastric cancer. Expert Opin Ther Targets. 2012;16:889-901. [PubMed] [DOI] |
| 8. | McComb S, Cheung HH, Korneluk RG, Wang S, Krishnan L, Sad S. cIAP1 and cIAP2 limit macrophage necroptosis by inhibiting Rip1 and Rip3 activation. Cell Death Differ. 2012;19:1791-1801. [PubMed] [DOI] |
| 9. | Moriwaki K, Balaji S, McQuade T, Malhotra N, Kang J, Chan FK. The necroptosis adaptor RIPK3 promotes injury-induced cytokine expression and tissue repair. Immunity. 2014;41:567-578. [PubMed] [DOI] |
| 10. | Pasparakis M, Vandenabeele P. Necroptosis and its role in inflammation. Nature. 2015;517:311-320. [PubMed] [DOI] |
| 11. | Kaczmarek A, Vandenabeele P, Krysko DV. Necroptosis: the release of damage-associated molecular patterns and its physiological relevance. Immunity. 2013;38:209-223. [PubMed] [DOI] |
| 13. | De Nardo D, De Nardo CM, Latz E. New insights into mechanisms controlling the NLRP3 inflammasome and its role in lung disease. Am J Pathol. 2014;184:42-54. [PubMed] [DOI] |
| 15. | Li S, Chen X, Zhou L, Wang BM. Farnesoid X receptor signal is involved in deoxycholic acid-induced intestinal metaplasia of normal human gastric epithelial cells. Oncol Rep. 2015;34:2674-2682. [PubMed] [DOI] |
| 16. | Tatsugami M, Ito M, Tanaka S, Yoshihara M, Matsui H, Haruma K, Chayama K. Bile acid promotes intestinal metaplasia and gastric carcinogenesis. Cancer Epidemiol Biomarkers Prev. 2012;21:2101-2107. [PubMed] [DOI] |
| 17. | Fox JG, Li X, Cahill RJ, Andrutis K, Rustgi AK, Odze R, Wang TC. Hypertrophic gastropathy in Helicobacter felis-infected wild-type C57BL/6 mice and p53 hemizygous transgenic mice. Gastroenterology. 1996;110:155-166. [PubMed] |
| 18. | Wang TC, Goldenring JR, Dangler C, Ito S, Mueller A, Jeon WK, Koh TJ, Fox JG. Mice lacking secretory phospholipase A2 show altered apoptosis and differentiation with Helicobacter felis infection. Gastroenterology. 1998;114:675-689. [PubMed] |
| 20. | Jovanovic IP, Pejnovic NN, Radosavljevic GD, Pantic JM, Milovanovic MZ, Arsenijevic NN, Lukic ML. Interleukin-33/ST2 axis promotes breast cancer growth and metastases by facilitating intratumoral accumulation of immunosuppressive and innate lymphoid cells. Int J Cancer. 2014;134:1669-1682. [PubMed] [DOI] |
| 21. | Hu LA, Fu Y, Zhang DN, Zhang J. Serum IL-33 as a diagnostic and prognostic marker in non- small cell lung cancer. Asian Pac J Cancer Prev. 2013;14:2563-2566. [PubMed] |
| 22. | Zhang P, Liu XK, Chu Z, Ye JC, Li KL, Zhuang WL, Yang DJ, Jiang YF. Detection of interleukin-33 in serum and carcinoma tissue from patients with hepatocellular carcinoma and its clinical implications. J Int Med Res. 2012;40:1654-1661. [PubMed] [DOI] |
| 23. | Yu XX, Hu Z, Shen X, Dong LY, Zhou WZ, Hu WH. IL-33 Promotes Gastric Cancer Cell Invasion and Migration Via ST2-ERK1/2 Pathway. Dig Dis Sci. 2015;60:1265-1272. [PubMed] [DOI] |
| 24. | Sun P, Ben Q, Tu S, Dong W, Qi X, Wu Y. Serum interleukin-33 levels in patients with gastric cancer. Dig Dis Sci. 2011;56:3596-3601. [PubMed] [DOI] |
| 25. | Buzzelli JN, Chalinor HV, Pavlic DI, Sutton P, Menheniott TR, Giraud AS, Judd LM. IL33 Is a Stomach Alarmin That Initiates a Skewed Th2 Response to Injury and Infection. Cell Mol Gastroenterol Hepatol. 2015;1:203-221.e3. [PubMed] [DOI] |