修回日期: 2018-03-30
接受日期: 2018-04-04
在线出版日期: 2018-05-08
评价应用超声造影技术(contrast - enhanced ultrasound, CEUS)与核磁共振成像(magnetic resonance imaging, MRI)在肝外胆管癌(extrahepatic cholangiocarcinoma, EHCC)诊断中的效果差异.
选择2015-01/2017-12间我院确诊的肝外胆管癌患者46例(ECHH组), 并选择同时期确诊的肝外胆管结石46例(CBDS组)以及胰头癌/十二指肠乳头疾病患者46例(PD组), 分别使用B超(B-mode ultrasonography, BUS)、CEUS和MRI检查, 以病理学诊断作为"金标准", 应用受试者工作曲线(receiver operating characteristic curves, ROC)比较三种检查方式对于ECHH的诊断价值以及诊断效能(包括诊断准确率、敏感性、特异性、阳性预测值和阴性预测值等).
CEUS和MRI在动脉期的增强水平间不存在统计学差异(χ2 = 1.105, P = 0.602); CEUS在门脉期和延迟期显示低增强的比例分别为86.96%和100.00%, 明显高于MRI的13.04%和13.04%(χ2 = 50.261, 70.769; P = 0.000, 0.000). ROC曲线显示, 应用MRI和CEUS诊断肝外胆管癌的曲线下面积(area under curve, AUC = 0.924, 0.897)较高, 而BUS较低(AUC = 0.690). BUS诊断肝外胆管癌的准确率、灵敏度、特异度、阳性预测值和阴性预测值均显著低于CEUS(χ2 = 0.175, 0.066, 11.467, 37.260, 6.328; P = 0.000, 0.010, 0.001, 0.000, 0.012)和MRI(χ2 = 0.227, 0.098, 13.378, 41.170, 9.082; P = 0.000, 0.002, 0.000, 0.000, 0.003), CEUS和MRI诊断肝外胆管癌的各项诊断效能间不存在统计学差异(χ2 = 0.464, 0.383, 0.000, 0.001, 0.334; P = 0.496, 0.536, 1.000, 0.972, 0.563).
超声造影技术在肝外胆管癌诊断中具有较高的价值, 可以作为与核磁共振成像的重要补充.
核心提要: 本研究通过对比不同类型肝外胆管疾患以及十二指肠乳头周围病变患者的常规超声、超声造影以及核磁共振成像(magnetic resonance imaging, MRI)增强扫描图像, 分析上述疾病的影像学特点, 探究不同影像学检查方式对于诊断肝外胆管癌的诊断效能, 结果显示超声造影的诊断效能与MRI增强扫描相当.
引文著录: 朱伟年. 超声造影技术与核磁共振成像在肝外胆管癌诊断中的价值对比. 世界华人消化杂志 2018; 26(13): 796-802
Revised: March 30, 2018
Accepted: April 4, 2018
Published online: May 8, 2018
To compare the value of contrast-enhanced ultrasound and magnetic resonance imaging in the diagnosis of extrahepatic cholangiocarcinoma (EHCC).
Forty-six patients with extrahepatic cholangiocarcinoma (ECHH group) diagnosed at our hospital from January 2015 to December 2017 were enrolled. Forty-six patients with extrahepatic bile duct stones (CBDS group) and 46 patients with pancreatic head carcinomas or duodenum papilla disease (PD group) were also included. All patients underwent B-mode ultrasonography (BUS), CEUS, and MRI. Using the pathological diagnosis as the "gold standard", the receiver operating characteristic (ROC) curves were plotted to compare the diagnostic efficacy (including diagnostic accuracy, sensitivity, specificity, positive predictive value, and negative predictive value) of the three examination methods for EHCC.
There was no significant difference between CEUS and MRI in the arterial phase (χ2 = 1.105, P = 0.602). CEUS showed low enhancement in 86.96% and 100.00% of patients in the portal phase and delayed phase, respectively, which were significantly higher than those of MRI (13.04% and 13.04%, respectively; χ2 = 50.261, 70.769; P = 0.000, 0.000). The ROC curve analysis showed that the area under the curve (AUC) of MRI and CEUS for the diagnosis of EHCC was higher that of BUS (0.924, 0.897 vs 0.690). The diagnostic accuracy, sensitivity, specificity, positive predictive value, and negative predictive value of BUS for EHCC were significantly lower than those of CEUS (χ2 = 0.175, 0.066, 11.467, 37.260, 6.328; P = 0.000, 0.010, 0.001, 0.000, 0.012) and MRI (χ2 = 0.227, 0.098, 13.378, 41.170, 9.082; P = 0.000, 0.002, 0.000, 0.000, 0.003). There was no significant difference in the diagnostic efficacy of CEUS and MRI for EHCC (χ2 = 0.464, 0.383, 0.000, 0.001, 0.334; P = 0.496, 0.536, 1.000, 0.972, 0.563).
CEUS has high value in the diagnosis of EHCC and can be used as an important complement to MRI.
- Citation: Zhu WN. Diagnostic value of contrast-enhanced ultrasound versus magnetic resonance imaging in extrahepatic cholangiocarcinoma. Shijie Huaren Xiaohua Zazhi 2018; 26(13): 796-802
- URL: https://www.wjgnet.com/1009-3079/full/v26/i13/796.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v26.i13.796
肝外胆管癌(extrahepatic cholangiocarcinoma, EHCC)是一种相对少见的消化系统肿瘤, 腺癌是其主要的组织类型, 根据解剖学位置(以胆囊管和肝总管汇合处为分界)可以分为肝门部胆管癌和远端胆管癌[1]. 由于肝外胆管癌早期表现缺乏特异性, 发生位置较深(特别是远端胆管癌), 且与周围组织的毗邻关系较为密切, 和肝外胆管结石以及胰头癌/十二指肠乳头疾病的鉴别诊断较为困难, 早期确诊率较低. 增强核磁共振成像(magnetic resonance imaging, MRI)是目前EHCC主要的检查方式, 但其存在一定的应用限制, 且经济性较差; 超声检查是肝胆系统疾病常用的检查方法, 结合多普勒技术和实施造影技术, 超声造影技术(contrast - enhanced ultrasound, CEUS)能够较好地反应病变组织的血供以及周围浸润情况, 在肝细胞肝癌[2]、结肠癌[3]等消化道疾病和卵巢癌[4]以及前列腺癌[5]等其他系统疾病的诊断中有较好的应用价值[6]. 为了探究应用CEUS与MRI在EHCC诊断中的效果差异, 我院对46例EHCC患者和92例胆管相关疾病患者进行了一项横断面分析, 报告如下:
选择2015-01/2017-12月间我院确诊的肝外胆管癌患者46例(ECHH组), 纳入标准: (1)经术后病理学检查确诊的肝外胆管癌患者[7]; (2)病灶均为单发; (3)术前未进行化疗后放疗. 排除标准: (1)合并肝癌、胆囊癌等其他肿瘤; (2)对本研究所用造影剂过敏或存在严重过敏倾向; (3)存在MRI检查禁忌症; (4)合并心脏病、重度肺高压和严重肺部疾患的患者这. 此外, 选择同时期确诊的肝外胆管结石46例(CBDS组); 选择胰头癌患者16例, 十二指肠乳头炎患者30例作为PD组. 所有患者均签署知情同意书, 见表1.
| 指标 | EHCC组 | CBDS组 | PD组 | F/χ2 | P |
| 年龄 (岁) | 50.62 ± 4.18 | 51.33 ± 5.59 | 49.93 ± 5.33 | 0.877 | 0.418 |
| 性别, n (%) | |||||
| 男性 | 28 (60.87) | 25 (54.35) | 23 (50.00) | 1.156 | 0.282 |
| 女性 | 18 (39.13) | 21 (45.65) | 23 (50.00) | ||
| BMI (kg/m2) | 22.24 ± 1.46 | 23.04 ± 1.89 | 22.51 ± 1.55 | 2.821 | 0.063 |
1.2.1 BUS常规检查: 使用Affiniti 50彩色超声多普勒系统(荷兰Philips)及其配套S4-2超声探头(频率4-2 MHz); 患者扫描前空腹8 h, 充分暴露腹部后, 取平卧位和右侧卧位, 常规扫描肝脏、胆管、胆囊和胰腺等结构, 明确病灶的位置、大小、形态以及与周围组织的关系.
1.2.2 CEUS检查: 在BUS常规扫描的基础上, 给予超声造影剂注射用六氟化硫微泡(商品名声诺维, 瑞士Bracco Suisse, 国药准字J20030117 s, 59 mg), 在使用前向瓶内注入无菌氯化钠注射液5 mL, 然后用力振摇, 直至冻干粉末完全分散, 将微泡混悬液抽吸至注射器后应立即注入外周静脉(一般为肘部静脉). 在注入超声造影剂后分别在动脉期(注射后10-30 s)、门脉期(31-120 s)和延迟期(注射120 s以后)进行扫描, 生成时间-强度曲线(time-intensity cure, TIC).
1.2.3 MRI增强扫描: 应用HDi型1.5T超导型磁共振成像系统(美国GE Healthcare)进行扫描, 患者检查前空腹8 h, 取平卧位, 行包括脂肪饱和的T1加权序列和脂肪抑制的T2WI序列在内的MRI平扫, 并做上腹部冠状位、横断位和矢状位检查. 在平扫后行增强扫描, 使用MRI造影剂钆喷酸葡胺注射液(商品名马根维显, 德国拜耳医药保健, 国药准字J20080065, 剂量为0.2 mL/kg, 经肘部静脉注射以3 mL/s的速度团注. 注入造影剂后分别在动脉期(注射后20-25 s)、门脉期(70-90 s)和延迟期(注射120-180 s以后)进行扫描.
1.2.4 图像判读: 图像的研读均采用双盲法. 超声诊断由2名高年资超声专业主治医师分别判读; MRI诊断由2名高年资MRI专业主治医师分别判读, 如果诊断结果存在明显差异, 则由1名副主任医师或主任医师共同商讨后做出诊断.
比较CEUS和增强MRI在不同时期(动脉期、门脉期和延迟期)的强化水平(分为高增强、等增强和低增强3个等级)的差异, 以病理学诊断作为"金标准", 应用受试者工作曲线(receiver operating characteristic curves, ROC)比较三种检查方式对于ECHH的诊断价值以及诊断效能. 诊断效能(包括诊断准确率、敏感性、特异性、阳性预测值和阴性预测值等). 准确率 = 诊断符合人数/总例数×100%, 敏感性 = 真阳性人数/(真阳性人数+假阴性人数)×100%, 特异性 = 真阴性人数/(真阴性人数+假阳性人数)×100%, 阳性预测值 = 真阳性人数/(真阳性人数+假阳性人数)×100%, 阴性预测值 = 真阴性人数/(真阴性人数+假阴性人数)×100%.
统计学处理 采用软件SPSS23.0进行数据处理, 计量资料以均数±标准差(mean±SD)的形式表示, 组间比较采用方差分析, 两两比较采用SNK法; 计数资料采用例数(构成比)n(%)的形式表示, χ2检验比较组间差异. 直线回归模型探究指标间的相关性; 采用ROC曲线评价预测效能, 绘制ROC曲线图, 并计算曲线下面积(area under curve, AUC)及其95%CI、标准误和P值. 以P<0.05认为具有统计学差异。
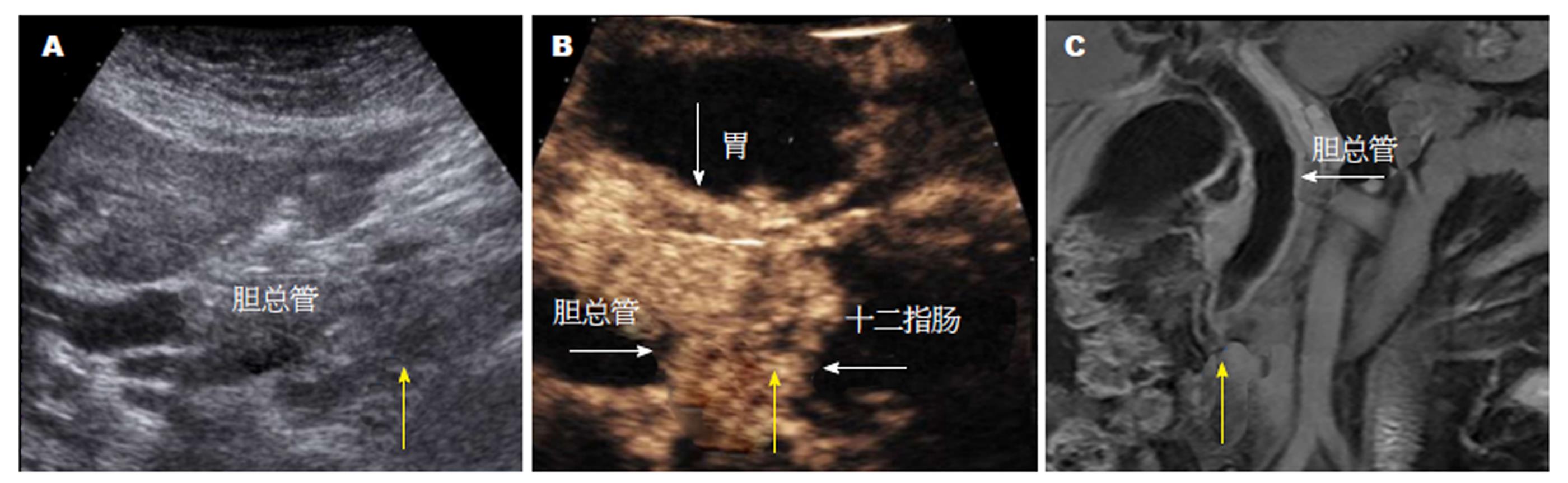
图1A为UBS模糊显示下的远端胆总管(CBD)以及肿瘤(黄色箭头所指位置). 图1B为CEUS图像, 可见CEUS下清晰显示的CBD远端肿瘤, 肿瘤形状不规则, 且呈不均匀增强(黄色箭头所指位置); 肿瘤的上缘是扩大的胃(白色箭头所指), 近端边界是扩张的远端CBD(白色箭头所指); 远端边界是扩大的十二指肠(白色箭头所指); 图1-c为脂肪饱和的T1加权的增强MRI图像, 冠状位下可见CBD远端靠近壶腹部的肿瘤强化灶(黄色箭头所指位置).
CEUS和MRI在动脉期的增强水平间不存在统计学差异(χ2 = 1.105, P = 0.602); CEUS在门脉期和延迟期显示低增强的比例分别为86.96%和100.00%, 明显高于MRI的13.04%和13.04%(χ2 = 50.261, 70.769; P = 0.000, 0.000), 见表2.
| 检查方法 | 动脉期 | 门脉期 | 延迟期 | ||||||
| 高增强 | 等增强 | 低增强 | 高增强 | 等增强 | 低增强 | 高增强 | 等增强 | 低增强 | |
| MRI | 30 (65.22) | 10 (21.74) | 6 (13.04) | 0 (0.00) | 6 (13.04) | 40 (86.96) | 0 (0.00) | 0 (0.00) | 46 (100.00) |
| CEUS | 33 (71.74) | 8 (17.39) | 5 (10.87) | 10 (21.74) | 30 (65.22) | 6 (13.04) | 28 (60.87) | 12 (26.09) | 6 (13.04) |
| χ2 | 1.105 | 51.130 | 70.769 | ||||||
| P | 0.602 | 0.000 | 0.000 | ||||||
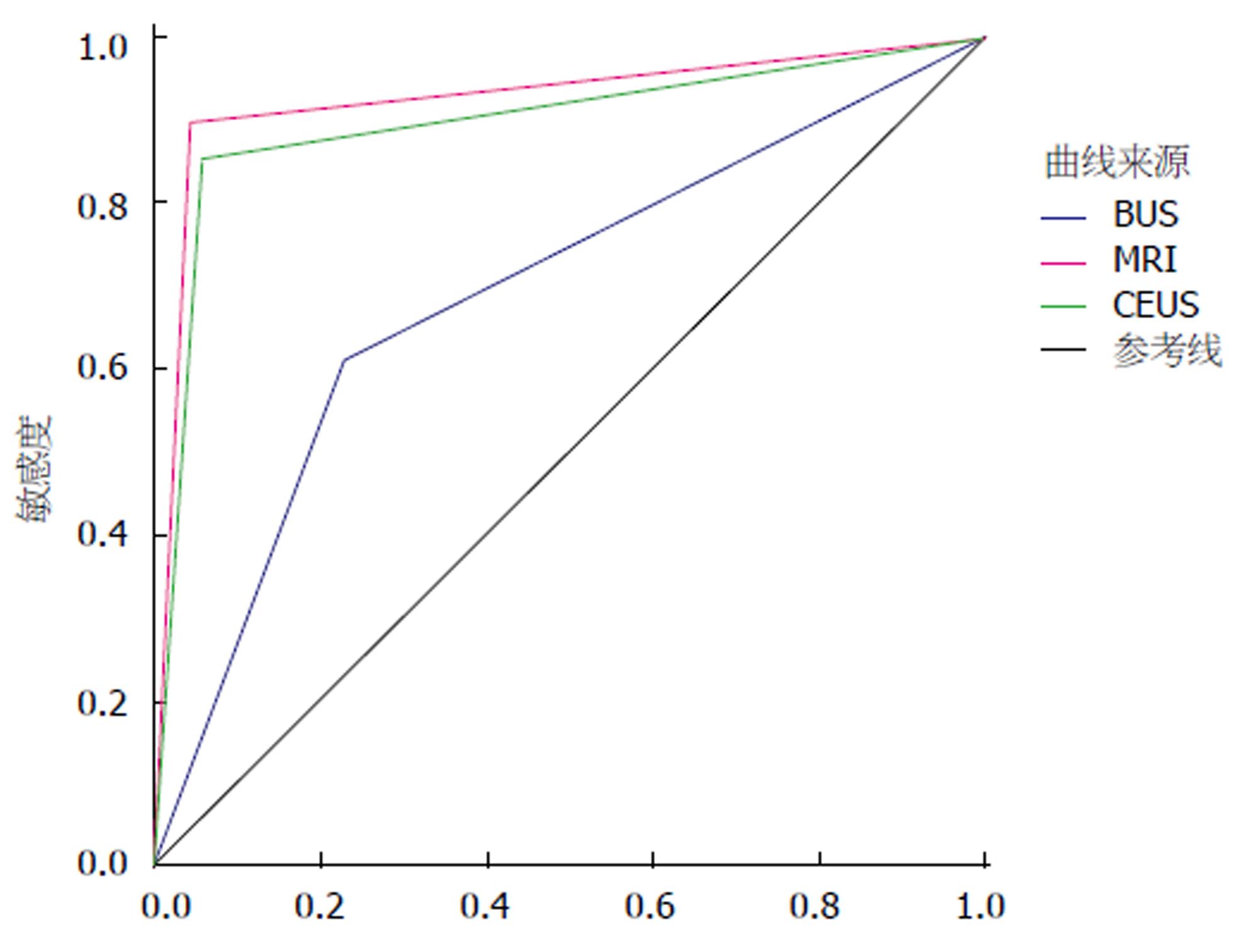
ROC曲线显示, 应用MRI和CEUS诊断肝外胆管癌的曲线下面积(AUC = 0.924, 0.897)较高, 而BUS较低(AUC = 0.690), 详见图2, 表3.
| 检验结果变量 | 区域 | 标准误差 | P | 95%CI | |
| 下限 | 上限 | ||||
| BUS | 0.690 | 0.050 | 0.000 | 0.593 | 0.787 |
| MRI | 0.924 | 0.029 | 0.000 | 0.866 | 0.982 |
| CEUS | 0.897 | 0.034 | 0.000 | 0.830 | 0.963 |
BUS诊断肝外胆管癌的准确率、敏感性、特异度、阳性预测值和阴性预测值均显著低于CEUS(χ2 = 0.175, 0.066, 11.467, 37.260, 6.328; P = 0.000, 0.010, 0.001, 0.000, 0.012)和MRI(χ2 = 0.227, 0.098, 13.378, 41.170, 9.082; P = 0.000, 0.002, 0.000, 0.000, 0.003), CEUS和MRI诊断肝外胆管癌的各项诊断效能间不存在统计学差异(χ2 = 0.464, 0.383, 0.000, 0.001, 0.334; P = 0.496, 0.536, 1.000, 0.972, 0.563), 见表4.
尽管EHCC是一种发病率较低的肿瘤, 但其起病隐匿, 恶性程度较高[8], 5年生存率不足20%[9], 而近年来的流行病学研究显示, EHCC的发病率呈明显的升高趋势[10]. 早期发现和治疗有助于提高EHCC的治疗效果, 改善患者的生活质量和生存预期[11]. 超声技术是一种快捷、经济和简便的肝胆系统疾病筛查方式; CEUS通过结合超声造影剂, 能够克服普通超声以及多普勒技术应用的局限[12,13], 实时、动态连续地呈现出组织的微循环灌注水平, 将超声技术由形态学成像向功能性成像过渡[14].
本研究通过对46例EHCC患者以及92例胆道疾病、十二指肠乳头疾病和胰腺疾病患者分别进行普通超声、CEUS和增强MRI检查, 由图1可以看出, 三种检查方式均能较好地反应检查区域的解剖学结构、病变位置和形态特点; 而与普通超声相比, CEUS和增强MRI可以通过造影剂的动态变化, 更好地反应肿瘤组织的血供情况, 还可以进一步明确病变界限以及浸润程度, 为临床治疗提供更加全面的证据[15]. 此外, 通过对比CEUS和MRI在不同时期的增强水平, 结果显示, CEUS和MRI在动脉期的增强水平间不存在统计学差异(P>0.05), 但CEUS在门脉期和延迟期显示低增强的比例分别均明显高于MRI, 这与超声造影所应用造影剂与增强MRI的类型不同有关[16]. 目前临床广泛应用的为第二代超声造影剂, 其主要成分为内含六氟化硫(SFu6)气体的微泡[17], 此类型造影剂的稳定性高, 在低机械指数造影模式下, SF6与超声波发生背向散射效应以及非线性效应, 从而为实时超声成像提供了基础[18]. CT、MR所使用的造影剂相比, 超声造影剂是一种纯血池造影剂, 其平均直径为2.5 μm, 故可以进入微血管而无法由血管内皮细胞的间隙进入组织[19]. 由于超声造影剂不能进入组织, CEUS在门脉期和延迟期无增强显示, 从而可以更好地反映病变与正常组织的差异[20], 这与增强CT和MRI扫描中常用的造影剂存在明显的差异[21], 且其检查费用较低, 更实用于治疗评价和随访[22,23].
ROC曲线是评价诊断方法的常用统计学工具, ROC曲线显示, 应用MRI和CEUS诊断肝外胆管癌的曲线下面积(AUC = 0.924, 0.897)较高且无明显差异, 而BUS较低(AUC = 0.690). 而对比3种检查方式的诊断效能, CEUS和MRI诊断肝外胆管癌的准确率、敏感性、特异度、阳性预测值和阴性预测值均显著高于BUS, CEUS和MRI诊断肝外胆管癌的各项诊断效能间不存在统计学差异. 这提示应用CEUS诊断EHCC的诊断效果不劣于增强MRI, 而CEUS快速、简便、经济等优点则更适用于初步诊断和筛查, 且CEUS对于胆管结石、狭窄等情况具有更好的敏感性, 这可以与MRI形成有效的互补[24]. Zhang等[25]对包含远端胆总管癌、胆总管结石、胰头癌和十二指肠疾患的181例患者所进行的研究还显示, CEUS可以提高对于普通B超扫描无法显示的壶腹周围病变情况, 其诊断效能与增强MRI类似, 可以作为MRI的一种有效补充, Sparchez等[26]研究也得出了类似结论. Granata等[27]对肝转移癌患者分别应用CEUS和增强MRI检查后指出, CEUS在胆管转移癌的诊断中的效能与MRI相似, 且对病灶形态的区分尚存在一定的优势.
总之, 超声造影技术在肝外胆管癌诊断中具有较高的价值, 可以作为与核磁共振成像的重要补充.
肝外胆管癌(extrahepatic cholangiocarcinoma, EHCC)为较为少见的消化系统肿瘤, 由于其发生位置较深, 与周围组织的毗邻关系较为密切, 早期诊断较为困难, 远期预后较差.
为了提高EHCC的早期诊断能力, 寻找核磁共振增强扫描的补充替代方案, 为早期筛查和存在核磁共振增强扫描禁忌的患者提供新的诊断途径.
本研究旨在分析不同类型肝外胆管疾患以及十二指肠乳头周围病变患者的常规超声、超声造影以及核磁共振成像(magnetic resonance imaging, MRI)增强扫描图像的特征, 评估常用检查方式对于诊断EHCC的效能, 为指导临床应用提供参考.
本研究通过对比不同类型肝外胆管疾患以及十二指肠乳头周围病变患者的常规超声、超声造影以及MRI增强扫描图像, 比较上述疾病的MRI和CEUS影像学特点(特别是不同增强时期的特点), 应用ROC曲线评价不同影像学检查方式对于诊断EHCC的诊断效能.
超声造影技术在EHCC以及十二指肠乳头周围病变诊断中能够较好地反应病变情况, 其诊断效能与核磁共振增强扫描相近.
本研究通过对常用的检查手段在EHCC以及十二指肠乳头周围病变诊断时的图像特点进行分析, 证实了不同检查对于此类疾病的显像特点; 其中, 超声造影技术在EHCC诊断中具有较高的价值, 其在不同强化周期中的影像学表现与核磁共振增强扫描存在差异, 可以较好地反应病变组织的微循环情况, 能够作为与核磁共振成像的重要补充.
本研究为小样本、单中心回顾性研究, 诊断方式采用定性诊断, 后期研究可继续扩大样本量和医院范围, 并对超声造影时间-强度曲线的指标进行定量分析, 为定量诊断提供依据.
学科分类: 胃肠病学和肝病学
手稿来源地: 浙江省
同行评议报告分类
A级 (优秀): 0
B级 (非常好): 0
C级 (良好): C, C
D级 (一般): 0
E级 (差): 0
编辑: 马亚娟 电编:张砚梁
| 1. | Torgeson A, Lloyd S, Boothe D, Cannon G, Garrido-Laguna I, Whisenant J, Lewis M, Kim R, Scaife C, Tao R. Chemoradiation Therapy for Unresected Extrahepatic Cholangiocarcinoma: A Propensity Score-Matched Analysis. Ann Surg Oncol. 2017;24:4001-4008. [PubMed] [DOI] |
| 2. | Jin C, Zhang XY, Li JW, Li C, Peng W, Wen TF, Luo Y, Lu Q, Zhong XF, Zhang JY. Impact of tumor size and cirrhotic background for differentiating HCC and ICC with CEUS: does it matter for patients undergoing hepatectomy? Oncotarget. 2017;8:83698-83711. [PubMed] [DOI] |
| 8. | Goral V. Cholangiocarcinoma: New Insights. Asian Pac J Cancer Prev. 2017;18:1469-1473. [PubMed] [DOI] |
| 9. | Ahn DH, Bekaii-Saab T. Biliary cancer: intrahepatic cholangiocarcinoma vs. extrahepatic cholangiocarcinoma vs. gallbladder cancers: classification and therapeutic implications. J Gastrointest Oncol. 2017;8:293-301. [PubMed] [DOI] |
| 10. | Petrick JL, Yang B, Altekruse SF, Van Dyke AL, Koshiol J, Graubard BI, McGlynn KA. Risk factors for intrahepatic and extrahepatic cholangiocarcinoma in the United States: A population-based study in SEER-Medicare. PLoS One. 2017;12:e0186643. [PubMed] [DOI] |
| 11. | 中国研究型医院学会消化道肿瘤专业委员会; 中国医师协会外科医师分会多学科综合治疗专业委员会. 肝脏及胆道恶性肿瘤多学科综合治疗协作组诊疗模式专家共识. 中国实用外科杂志. 2017;37:32-34. [DOI] |
| 12. | Battaglia V, Cervelli R. Liver investigations: Updating on US technique and contrast-enhanced ultrasound (CEUS). Eur J Radiol. 2017;96:65-73. [PubMed] [DOI] |
| 13. | Pandey P, Lewis H, Pandey A, Schmidt C, Dillhoff M, Kamel IR, Pawlik TM. Updates in hepatic oncology imaging. Surg Oncol. 2017;26:195-206. [PubMed] [DOI] |
| 14. | D'Onofrio M, Crosara S, De Robertis R, Canestrini S, Mucelli RP. Contrast-Enhanced Ultrasound of Focal Liver Lesions. AJR Am J Roentgenol. 2015;205:W56-W66. [PubMed] [DOI] |
| 15. | 赵 莹莹, 李 永杰, 李 东, 李 杰, 陈 鸣. 超声造影与动态增强磁共振成像观察局限性子宫腺肌病微波消融治疗效果及分析. 中华医学超声杂志(电子版). 2017;14:314-318. [DOI] |
| 16. | Kim TK, Noh SY, Wilson SR, Kono Y, Piscaglia F, Jang HJ, Lyshchik A, Dietrich CF, Willmann JK, Vezeridis A. Contrast-enhanced ultrasound (CEUS) liver imaging reporting and data system (LI-RADS) 2017 - a review of important differences compared to the CT/MRI system. Clin Mol Hepatol. 2017;23:280-289. [PubMed] [DOI] |
| 17. | Gulati M, King KG, Gill IS, Pham V, Grant E, Duddalwar VA. Contrast-enhanced ultrasound (CEUS) of cystic and solid renal lesions: a review. Abdom Imaging. 2015;40:1982-1996. [PubMed] [DOI] |
| 18. | Ferraioli G, Meloni MF. Contrast-enhanced ultrasonography of the liver using SonoVue. Ultrasonography. 2018;37:25-35. [PubMed] [DOI] |
| 19. | Ran L, Zhao W, Zhao Y, Bu H. Value of contrast-enhanced ultrasound in differential diagnosis of solid lesions of pancreas (SLP): A systematic review and a meta-analysis. Medicine (Baltimore. ). 2017;96:e7463. [PubMed] [DOI] |
| 20. | Jang HJ, Kim TK, Burns PN, Wilson SR. CEUS: An essential component in a multimodality approach to small nodules in patients at high-risk for hepatocellular carcinoma. Eur J Radiol. 2015;84:1623-1635. [PubMed] [DOI] |
| 21. | Cantisani V, Wilson SR. CEUS: Where are we in 2015? Eur J Radiol. 2015;84:1621-1622. [PubMed] [DOI] |
| 22. | Feng C, Hu B, Hu B, Chen L, Li J, Huang J. Comparative study of conventional US, contrast enhanced US and enhanced MR for the follow-up of prostatic radiofrequency ablation. Exp Ther Med. 2017;13:3535-3542. [PubMed] [DOI] |
| 23. | Schuler A, Reuss J, Delorme S, Hagendorff A, Giesel F. [Costs of clinical ultrasound examinations - an economical cost calculation and analysis]. Ultraschall Med. 2010;31:379-386. [PubMed] [DOI] |
| 24. | Fontán FJ, Reboredo ÁR, Siso AR. Accuracy of Contrast-Enhanced Ultrasound in the Diagnosis of Bile Duct Obstruction. Ultrasound Int Open. 2015;1:E12-E18. [PubMed] [DOI] |
| 25. | Zhang T, Su ZZ, Wang P, Wu T, Tang W, Xu EJ, Ju JX, Quan XY, Zheng RQ. Double contrast-enhanced ultrasonography in the detection of periampullary cancer: Comparison with B-mode ultrasonography and MR imaging. Eur J Radiol. 2016;85:1993-2000. [PubMed] [DOI] |
| 26. | Tang S, Huang L, Wang Y, Wang Y. Contrast-enhanced ultrasonography diagnosis of fundal localized type of gallbladder adenomyomatosis. BMC Gastroenterol. 2015;15:99. [PubMed] [DOI] |
| 27. | Granata V, Fusco R, Catalano O, Avallone A, Palaia R, Botti G, Tatangelo F, Granata F, Cascella M, Izzo F. Diagnostic accuracy of magnetic resonance, computed tomography and contrast enhanced ultrasound in radiological multimodality assessment of peribiliary liver metastases. PLoS One. 2017;12:e0179951. [PubMed] [DOI] |