修回日期: 2018-04-04
接受日期: 2018-04-13
在线出版日期: 2018-05-08
探讨新辅助化疗联合腹腔镜辅助胃癌根治术治疗进展期胃癌的临床效果及对患者生活质量的影响.
回顾性分析我院在2014-02/2016-11收治的进展期胃癌患者104例, 根据患者意愿决定是否术前行新辅助化疗, 分为观察组(新辅助化疗+腹腔镜手术组)56例, 对照组(直接行腹腔镜辅助胃癌根治术组)48例, 术后均给予6个疗程XELOX化疗; 观察两组患者临床疗效、手术指标、术后恢复情况、生活质量、化疗期间不良反应发生率及复发、转移率.
新辅助化疗后腹腔镜术前观察组临床有效率48.21%, 疾病控制率为92.45%. 两组患者手术时间、术中出血量、中转开腹例数、手术切除范围、姑息性手术例数及淋巴结清扫数比较差异无统计学意义(P>0.05); 观察组手术切缘R0切除率明显高于对照组(85.71% vs 52.08%), 差异具有统计学意义(P<0.05); 两组患者术后下床活动时间、肛门排气时间、术后并发症发生率及住院时间比较差异无统计学意义(P>0.05). 观察组在化疗结束后3 mo、6 mo KPS评分(82.8±6.9 vs 91.6±8.1)明显高于对照组(76.2±5.1 vs 85.2±7.3), 差异具有统计学意义(P<0.05). 治疗期间观察组出现3级以上不良反应发生率为16.07%, 对照组为16.67%, 差异无统计学意义(P>0.05). 截止至2017-12, 随访9-46 mo, 中位随访时间为24 mo, 随访期间观察组共出现4例死亡, 10例复发、转移, 对照组出现11例死亡, 19例复发转移, 比较差异具有统计学意义(χ2 = 5.210, 6.067, P<0.05). Log-rank检验分析显示, 观察组死亡风险明显低于对照组, 差异具有统计学意义(P<0.05).
新辅助化疗联合腹腔镜辅助胃癌根治术治疗进展期胃癌疗效显著, 能够显著提高手术切缘R0切除率, 改善患者生活质量, 减少复发转移, 提高患者生存期.
核心提要: 胃癌是我国高发的恶性肿瘤, 关于进展期胃癌术前是否进行辅助化疗国内外尚未达成共识, 国内专家在进展期胃癌诊疗共识中推荐: 对患有临床分期Ⅲ期以上、淋巴结活检阳性的进展期胃癌在患者体质允许的情况下推荐术前给予2-4个疗程的新辅助化疗. 本研究旨在探讨新辅助化疗联合腹腔镜辅助胃癌根治术治疗进展期胃癌的临床疗效及对患者预后的影响.
引文著录: 江良县, 周申康, 刘帅, 叶菲菲. 新辅助化疗联合腹腔镜手术治疗进展期胃癌效果及患者生活质量情况观察. 世界华人消化杂志 2018; 26(13): 782-789
Revised: April 4, 2018
Accepted: April 13, 2018
Published online: May 8, 2018
To investigate the clinical effect of neoadjuvant chemotherapy combined with laparoscopic-assisted radical gastrectomy in treating advanced gastric cancer and the effect on the quality of life of patients.
A retrospective analysis was performed of 104 cases of advanced gastric cancer admitted from February 2014 to November 2016 at Taizhou Hospital. According to whether the patients would like to undergo neoadjuvant chemotherapy or not, they were divided into an observation group (neoadjuvant chemotherapy plus laparoscopic surgery; n = 56) or a control group (direct laparoscopic-assisted radical gastrectomy; n = 48). Both groups were given six courses of XELOX chemotherapy after operation. Clinical efficacy, operation indexes, postoperative recovery, quality of life, adverse reactions, and recurrence or metastasis were compared between the two groups.
After neoadjuvant chemotherapy, the effective rate and disease control rate in the observation group were 48.21% and 92.45%, respectively. There was no significant difference in operative time, intraoperative blood loss, number of cases of conversion to open laparotomy, surgical excision range, number of cases of palliative surgery, or number of lymph nodes dissected between the two groups (P > 0.05). The R0 resection rate in the observation group was significantly higher than that of the control group (85.71% vs 52.08%, P < 0.05). There was no significant difference in time to ambulation, time to anal exhaust, postoperative complications, or hospital stay between the two groups (P > 0.05). The KPS scores of the observation group at 3 and 6 months after chemotherapy were significantly higher than those of the control group (82.8 ± 6.9 vs 76.2 ± 5.1, 91.6 ± 8.1 vs 85.2 ± 7.3, P < 0.05). As of December 2017, the follow-up period ranged from 9 to 46 mo, and the median follow-up time was 24 mo. During the follow-up period, four patients died and ten patients developed recurrence or metastasis in the observation group. In the control group, 11 patients died and 19 developed recurrence or metastasis. There was a significant difference in the rates of death and recurrence/metastasis between the two groups (χ2 = 5.210, 6.067, P < 0.05). Log-rank test analysis showed that the risk of death in the observation group was significantly lower than that of the control group (P < 0.05).
Neoadjuvant chemotherapy combined with laparoscopic radical gastrectomy for advanced gastric cancer has significant curative effects and can significantly improve the resection rate and quality of life, reduce recurrence and metastasis, and improve the survival of patients.
- Citation: Jiang LX, Zhou SK, Liu S, Ye FF. Neoadjuvant chemotherapy combined with laparoscopic surgery for treatment of advanced gastric cancer: Efficacy and impact on quality of life. Shijie Huaren Xiaohua Zazhi 2018; 26(13): 782-789
- URL: https://www.wjgnet.com/1009-3079/full/v26/i13/782.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v26.i13.782
胃癌是我国高发的恶性肿瘤, 早期症状隐匿, 多数患者就诊时已达进展期, 五年生存率仅为20%-50%, 严重影响患者的生命健康[1]. 自美国INT0116试验结果发表以后, 手术切除+术后辅以化疗已成为治疗进展期胃癌的标准治疗方案[2]. 但关于进展期胃癌术前是否进行辅助化疗国内外尚未达成共识, 我国专家在进展期胃癌诊疗共识中推荐[3], 对患有临床分期Ⅲ期以上、淋巴结活检阳性的进展期胃癌在患者体质允许的情况下推荐术前给予2-4个疗程的新辅助化疗. 现有的临床研究表明[3-5], 术前给予新辅助化疗能够提高患者手术切缘R0切除率, 减少复发转移. 本研究旨在探讨新辅助化疗联合腹腔镜辅助胃癌根治术治疗进展期胃癌的临床疗效及对患者预后的影响, 为临床治疗提供科学参考, 报告如下.
收集我院在2014-02/2016-11收治的进展期胃癌患者104例, 男59例, 女45例, 年龄38-61岁, 平均年龄53.3岁± 4.7岁, 纳入标准: (1)均符合第8版《外科学》中关于进展期胃癌的诊断标准[6]; (2)经内镜检查及病理学检查确诊; (3)入院前未接受任何形式的化疗、放疗及其他治疗; (4)按照UICC临床分期, ⅡB期31例, ⅢA期28例, ⅢB期21例, ⅢC期24例; (5)均行腹腔镜辅助胃癌D2根治术; (6)患者及家属知情同意, 自愿原则. 排除标准: (1)T1和T4b期胃癌; (2)术前检查发现胃癌发生远处转移者; (3)合并消化道出血、上消化道出血等需要急诊手术者; (4)存在严重的心肝肺肾功能障碍及免疫系统疾病者; (5)新辅助化疗患者术前未完成2-4个疗程化疗者; (6)其他不适合纳入本研究的情况. 按照自愿原则将患者分为观察组56例与对照组48例, 两组患者在性别、年龄、BMI及临床分期等一般资料方面比较差异无统计学意义(P>0.05), 具有可比性, 见表1.
| 相关资料 | 观察组 (n = 56) | 对照组 (n = 48) | t/χ2 | P值 |
| 性别 (男/女) | 31/25 | 28/20 | 0.093 | >0.05 |
| 平均年龄 (岁) | 53.4 ± 5.2 | 53.3 ± 4.8 | 0.101 | >0.05 |
| BMI (kg/m2) | 21.5 ± 2.7 | 21.7 ± 1.9 | 0.429 | >0.05 |
| 肿瘤直径 | ||||
| >5 cm | 32 | 26 | 0.092 | >0.05 |
| ≤5 cm | 24 | 22 | ||
| 病理学分型 | ||||
| 分化型 | 53 | 46 | 0.031 | >0.05 |
| 未分化型 | 3 | 2 | ||
| UICC分期 | ||||
| ⅡB | 17 | 14 | 0.633 | >0.05 |
| ⅢA | 16 | 12 | ||
| ⅢB | 11 | 10 | ||
| ⅢC | 12 | 12 |
1.2.1 治疗方法: 观察组患者术前先行FOLFOX6方案新辅助化疗: 奥沙利铂(浙江海正药业股份有限公司, 国药准字: H20093487) 85 mg/m2, 静滴(>2 h),第一天; 四氢叶酸(重庆药友制药有限责任公司, 国药准字: H20010615) 400 mg/m2, 静滴, 第一天; 氟尿嘧啶(上海旭东海普药业有限公司, 国药准字: H31020593) 2400 mg/m2, 静脉滴注46 h, 第二天; 2 wk为一周期. 在行第三个周期化疗前行超声胃镜检查, 若肿瘤出现增大、浸润进展及远处转移, 肿瘤标志物明显升高则转为手术治疗; 若排除肿瘤进展, 则再行2个周期化疗后行手术治疗. 手术方式: 两组均采用腹腔镜辅助胃癌D2根治术, 完善术前准备, 常规消毒铺单, 头高脚低20-30°, 术者站在患者左侧, 两位助手分别站在右侧和双腿之间, 严格按照2002版日本胃癌治疗规范和中国腹腔镜胃癌根治术手术治疗控制专家共识(2017版)[6]进行手术操作; 腹腔镜下完成血管结扎、淋巴结清扫及解剖结构分离, 在上腹正中做一6-8 cm切口, 直视下完成胃切除和消化道重建术. 术后给予胃肠减压、肠外营养支持及抗感染治疗.
两组患者均与术后1 mo接受6个周期的XELOX方案化疗(第一天: 奥沙利铂, 130 mg/m2加入5%葡萄糖注射液500 mL静脉滴注(>2 h); 卡培他滨(希罗达)1000 mg/m2, 每日2次, 第1-14日, 21 d为一周期. )两组患者用药期间密切监测患者电解质、血常规、肝肾功变化, 若出现白细胞计数<3.0×109/L和(或)血小板计数<80×109/L, 则暂停用药, 并给予升白细胞、升血小板药物治疗, 待血液毒性缓解后方可再次用药, 不补充停药期间未服用药的剂量.
1.2.2 观察指标: (1)手术指标: 记录患者手术时间、术中出血量、中转开腹例数、手术切除范围(全胃切除或远端胃切除)、手术切缘(R0切除或R1/R2切除)、淋巴结清扫数目及姑息性手术例数; (2)术后恢复情况: 记录患者术后下床活动时间、胃肠道恢复时间、术后住院时间、术后并发症发生情况(切口感染、肺部感染、胸腔积液、吻合口瘘、肠梗阻); (3)分别于入院时、术后3 mo、6 mo采用KPS评分对患者生活质量进行评价(总分100分, 得分越高说明身体状况越好; 低于60分时许多抗肿瘤治疗无法实施); (4)记录患者术后化疗期间出现3级以上(红细胞、白细胞、血小板)减少、呼吸道感染、肝功能异常、周围神经炎、胃肠道反应、皮肤色素沉着等不良反应发生情况.
1.2.3 疗效判定: 采用WTO制定的实体瘤疗效评价标准分为完全缓解(CR): 所有可见病变完全消失并至少维持4 wk以上; 部分缓解(PR): 肿瘤病灶的最大径及最大垂直的乘积减少50以上, 维持4 wk以上; 无变化(NC)或病变稳定(SD): 病变两径乘积缩小不超过50%, 增大不超过25%; 进展(PD): 病变两径乘积增大超过25%或出现新的病变. 临床有效率(RR) = CR+PR, 疾病控制率(DCR) = CR+PR+NC.
1.2.4 随访: 所有患者出院后采用门诊或电话方式进行随访, 随访截止时间为2017-12, 了解患者术后生存、复发和转移情况.
统计学处理 采用SPSS19.0软件进行数据分析, 计量资料以mean±SD表示, 采用t检验; 计数资料以n(%)表示, 采用χ2检验; K-M法绘制生存曲线, 应用Log-Rank检验比较两组死亡风险, 设检验水准0.05, P<0.05时差异具有统计学意义.
56例观察组患者共完成201个周期化疗, 平均3.59个周期/例, 且每例患者新辅助化疗均≥2个周期; 所有患者均获得不同程度的临床缓解, 其中完全缓解7例, 部分缓解21例, 病情稳定22例, 疾病进展5例, 临床有效率为48.21%, 疾病控制率为92.45%.
两组患者手术时间、术中出血量、中转开腹例数、手术切除范围、姑息性手术例数及淋巴结清扫数比较差异无统计学意义(P>0.05); 观察组手术切缘R0切除率明显高于对照组, 差异具有统计学意义(P<0.05), 见表2; 两组患者术后下床活动时间、肛门排气时间、术后并发症发生率及住院时间比较差异无统计学意义(P>0.05), 见表3.
| 相关指标 | 观察组 (n = 56) | 对照组 (n = 48) | 统计值 | P值 |
| 手术时间 (min) | 241 ± 28 | 236 ± 39 | 0.758 | >0.05 |
| 术中出血量 (mL) | 138 ± 82 | 132 ± 67 | 0.404 | >0.05 |
| 中转开腹例数 (n) | 8 | 10 | 0.772 | >0.05 |
| 手术切除范围 | ||||
| 远端胃切除术 | 33 | 22 | 0.531 | >0.05 |
| 全胃切除术 | 21 | 19 | ||
| 手术切缘 | ||||
| R0切除 | 48 | 25 | 13.972 | <0.05 |
| R1或R2切除 | 8 | 23 | ||
| 姑息性手术例数 | 4 | 8 | 2.297 | >0.05 |
| 淋巴结清扫数目 (枚) | 23 ± 9 | 22 ± 10 | 0.537 | >0.05 |
| 术后指标 | 观察组 (n = 56) | 对照组 (n = 48) | 统计值 | P值 |
| 术后下床活动时间 (d) | 2.8 ± 0.7 | 2.9 ± 0.9 | 0.637 | >0.05 |
| 术后肛门排气时间 (d) | 3.7 ± 1.3 | 3.8 ± 1.4 | 0.377 | >0.05 |
| 术后住院时间 (d) | 11.8 ± 4.5 | 12.0 ± 3.9 | 0.240 | >0.05 |
| 术后并发症 | ||||
| 切口感染 | 4 | 5 | 1.035 | >0.05 |
| 肺部感染 | 1 | 1 | ||
| 胸腔积液 | 1 | 1 | ||
| 吻合口瘘 | 0 | 1 | ||
| 肠梗阻 | 1 | 2 |
两组患者入院时KPS评分比较差异无统计学意义(P>0.05); 观察组在化疗结束后3 mo、6 mo KPS评分明显高于对照组, 差异具有统计学意义(P<0.05), 见表4.
| 分组 | 入院时 | 术后3 mo | 术后6 mo |
| 观察组 (n = 56) | 65.6 ± 3.2 | 82.8 ± 6.9 | 91.6 ± 8.1 |
| 对照组 (n = 48) | 64.9 ± 4.8 | 76.2 ± 5.1 | 85.2 ± 7.3 |
| t值 | 0.886 | 5.468 | 10.769 |
| P值 | >0.05 | <0.05 | <0.05 |
治疗期间观察组出现3级以上不良反应发生率为16.07%, 对照组为16.67%, 差异无统计学意义(P>0.05), 见表5.
| 分组 | 死亡 | 复发 | 转移 |
| 观察组 (n = 56) | 4 (7.14) | 4 (7.14) | 6 (10.71) |
| 对照组 (n = 48) | 11 (22.92) | 8 (16.67) | 11 (22.92) |
| χ2 | 5.210 | 6.067 | |
| P值 | <0.05 | <0.05 |
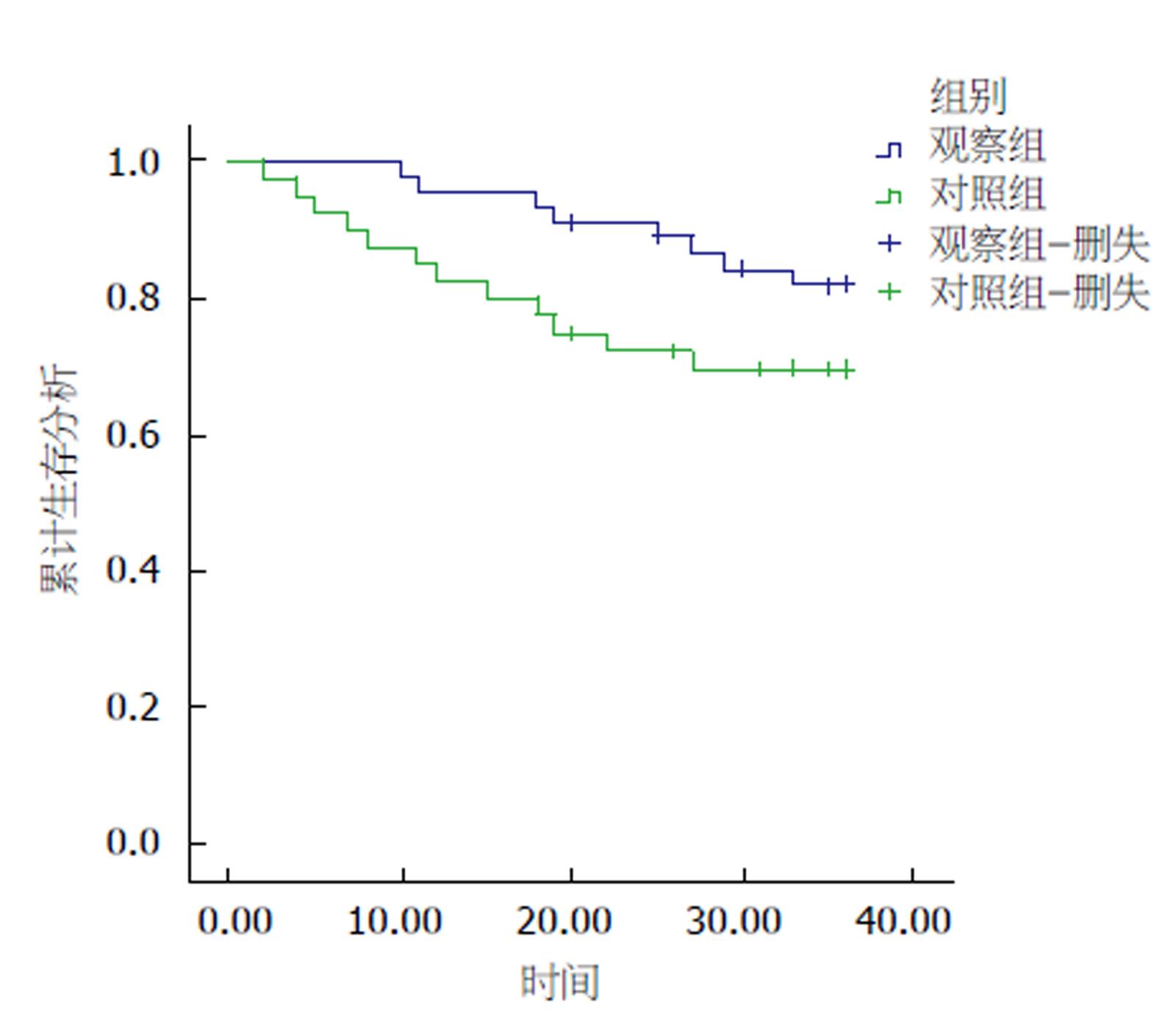
截止至2017-12, 随访9-46 mo, 中位随访时间为24 mo, 随访期间观察组共出现4例死亡, 10例复发、转移, 对照组出现11例死亡, 19例复发转移, 比较差异具有统计学意义(χ2 = 5.210, 6.067, P<0.05), 见表6; Log-rank检验分析显示, 观察组死亡风险明显低于对照组, 差异具有统计学意义(P<0.05), 见图1.
| 分组 | 死亡 | 复发 | 转移 |
| 观察组 (n = 56) | 4 (7.14) | 4 (7.14) | 6 (10.71) |
| 对照组 (n = 48) | 11 (22.92) | 8 (16.67) | 11 (22.92) |
| χ2 | 5.210 | 6.067 | |
| P值 | <0.05 | <0.05 |
胃癌是常见的消化道肿瘤, 目前手术切除是胃癌的主要治疗方式, 随着腹腔镜技术的不断发展, 腹腔镜辅助胃癌根治术在国内大部分地区得到了推广和认可, 但目前业内关于进展期胃癌采用腹腔镜辅助治疗胃癌根治术的手术效果仍存在一定争议[7-9]. 上世纪90年代以来, 进展期胃癌术前采用新辅助化疗在国内逐渐开展, 国内外大量研究显示[10-14], 进展期胃癌患者术前给予新辅助化疗能够有效杀灭微小转移病灶, 提高手术切除率, 增加远期生存效果.
目前国内外学者对于进展期胃癌术前应用新辅助化疗的意义主要体现在[15,16]: (1)减轻肿瘤组织反应性水肿与周围组织的粘连, 降低肿瘤临床分期, 提高手术切除率, 对于术前评估行根治性手术困难者通过降低临床分期达到行根治性手术的目的; (2)对于患者体内的亚临床病灶进行有效抑制, 降低瘤细胞活性, 减少术中瘤细胞播散的几率, 达到降低术后复发和转移的效果; (3)进展期胃癌的化疗方案多样, 通过术前新辅助化疗可以了解肿瘤细胞对该方案的反应性, 为术后化疗提供参考依据; (4)由于术前胃周围血管和淋巴系统相对完整, 化疗药物可以更加有效的作用于病灶, 优势更加明显.
MAGIC试验作为对新辅助化疗的经典研究证实[17], 进展期胃癌患者术前首先进行新辅助化疗再行根治性手术期疗效能够得到明显改善. NCCN指南已将进展期胃癌术前行新辅助化疗作为Ⅰ类证据应用于胃癌的治疗方案中[18]. 本研究结果显示, 观察组术前应用2-4个疗程的新辅助化疗, 其临床有效率为48.21%, 疾病控制率为92.45%; 说明术前行新辅助化疗能够有效抑制肿瘤进展, 美国一项回顾性研究也表明[19], 新辅助化疗在进展期胃癌的治疗中的应用逐年增加. 2006年MAGIC试验是证实胃癌术前新辅助化疗的里程碑, 该试验表明[20], 术前新辅助化疗可明显改善患者无进展生存(progression free survival, PFS)和总生存期(overall survival, OS), 降低肿瘤分期, 并将5年生存率提高至36%.
进展期胃癌术后复发的主要途径为淋巴转移途径, 尽管目前根治性手术对胃周围淋巴结的清扫越来越彻底, 但仍无法排除肉眼无法识别的亚临床病灶, 胡芃等[21]人的研究结果表明, 进展期胃癌术前通过新辅助化疗能够提高R0切除率, 减少复发和转移. 本研究结果显示, 观察组患者手术切缘R0切除率明显高于对照组(P<0.05), 与国内外学者报道相一致[22,23]; 笔者团队研究结果还显示, 新辅助化疗并不会延长手术时间, 通过腹腔镜放大视野和超声刀锐性分离、清扫, 不会增加手术难度和风险. 另外, 有研究表明[24,25], 新辅助化疗可能会增加胃周围组织纤维瘢痕增生, 增加手术风险和并发症. 本研究在其他手术指标方面, 观察组中转开腹例数和姑息性手术例数相比于对照组也较低. 两组患者在围手术期恢复情况比较无差异(P>0.05). 在生活质量方面, 观察组术后3 mo、6 mo KPS评分高于对照组, 分析该结果可能是由于观察组患者完全切除比例较高, 患者在生理及心理层面得到了较高的恢复所致. 在术后不良反应发生情况方面, 两者术后出现3级以上不良反应发生率比较无明显差异(P>0.05).
法国的FNCLCC研究关于可切除性胃癌和食管胃结合部腺癌术前行新辅助化疗结果显示[26], 新辅助化疗患者在OS、PFS及五年生存率方面均高于单纯手术组患者(P<0.05). 但欧洲癌症研究的EORTC研究中结果表明[27], 新辅助化疗+胃癌根治术于单纯胃癌根治术组在OS和PFS方面差异无统计学意义(P>0.05), 但其亚组结果分析表明, 新辅助化疗+胃癌根治术组5年生存率优势较大. 本研究随访结果显示, 观察组术后复发率和转移率均明显低于对照组, 且COX生存分析显示, 观察组死亡风险明显低于对照组, 与国内外学者报道相一致[28,29].
本研究虽然得出了新辅助化疗+腹腔镜辅助胃癌根治术能够提高患者疗效, 降低复发转移率, 但仍存在一定局限性, 首先本研究为回顾性分析, 非前瞻性随机对照研究; 另外由于腹腔镜胃癌根治术在我院开展时间较短, 收集病例数有限, 远期疗效尚需要进一步研究.
总之, 新辅助化疗联合腹腔镜辅助胃癌根治术治疗进展期胃癌疗效显著, 能够显著提高手术切缘R0切除率, 改善患者生活质量, 减少复发转移, 提高患者生存期.
随着腹腔镜技术的不断发展, 腹腔镜辅助胃癌根治术在国内大部分地区得到了推广和认可, 但目前业内关于进展期胃癌采用腹腔镜辅助治疗胃癌根治术的手术效果仍存在一定争议. 上世纪90年代以来, 进展期胃癌术前采用新辅助化疗在国内逐渐开展, 但关于术前新辅助化疗的效果如何国内外报道不一, 且缺乏科学证据.
指南推荐, 对患有临床分期Ⅲ期以上、淋巴结活检阳性的进展期胃癌在患者体质允许的情况下推荐术前给予2-4个疗程的新辅助化疗. 本研究旨在探讨新辅助化疗联合腹腔镜辅助胃癌根治术治疗进展期胃癌的临床疗效及对患者预后的影响, 为临床治疗提供科学参考.
本研究通过回顾性分析方式, 探讨新辅助化疗联合腹腔镜辅助胃癌根治术治疗进展期胃癌的临床疗效及对患者预后的影响, 为新辅助化疗的应用提供科学依据.
回顾性分析我院收治的进展期胃癌患者104例, 根据患者意愿决定是否术前行新辅助化疗, 分为观察组(新辅助化疗+腹腔镜手术组)56例, 对照组(直接行腹腔镜辅助胃癌根治术组)48例, 术后均给予6个疗程XELOX化疗; 观察两组患者临床疗效、手术指标、术后恢复情况、生活质量、化疗期间不良反应发生率及复发、转移率. 本研究的独特之处在于对手术的R0切除率等详细手术指标进行了分析, 且对两组患者预后进行了短期随访.
新辅助化疗术前具有较高的临床有效率及疾病控制率, 且观察组手术切缘R0切除率明显高于对照组, Log-rank检验分析显示, 观察组死亡风险明显低于对照组, 差异具有统计学意义(P<0.05).
新辅助化疗联合腹腔镜辅助胃癌根治术治疗进展期胃癌疗效显著, 能够显著提高手术切缘R0切除率, 改善患者生活质量, 减少复发转移, 提高患者生存期.
本研究虽然得出了新辅助化疗+腹腔镜辅助胃癌根治术能够提高患者疗效, 降低复发转移率, 但仍存在一定局限性, 首先本研究为回顾性分析, 非前瞻性随机对照研究; 另外由于腹腔镜胃癌根治术在我院开展时间较短, 收集病例数有限, 远期疗效尚需要进一步研究.
学科分类: 胃肠病学和肝病学
手稿来源地: 浙江省
同行评议报告分类
A级 (优秀): 0
B级 (非常好): 0
C级 (良好): C, C, C
D级 (一般): 0
E级 (差): 0
编辑:马亚娟 电编:张砚梁
| 2. | 孙 震, 李 雁. 新辅助化疗治疗进展期胃癌疗效的Meta分析. 武汉大学学报(医学版). 2015;36:393-398. [DOI] |
| 3. | Jung M, Park SH, Jeon YK, Won JK, Yang HK, Kim WH. Gastrointestinal stromal tumor of unusual phenotype after imatinib treatment: A case report and diagnostic utility of ETV1 mRNA in situ hybridization. Medicine (Baltimore. ). 2017;96:e9031. [PubMed] [DOI] |
| 4. | Treese C, Harloff H, Daum S. [FLOT becomes standard neoadjuvant chemotherapy for adenocarcinoma of the esophagogastric junction and stomach]. Z Gastroenterol. 2017;55:881-882. [PubMed] [DOI] |
| 7. | Tu RH, Lin JX, Li P, Xie JW, Wang JB, Lu J, Chen QY, Cao LL, Lin M, Zheng CH. Prognostic significance of postoperative pneumonia after curative resection for patients with gastric cancer. Cancer Med. 2017;6:2757-2765. [PubMed] [DOI] |
| 8. | Noble F, Lloyd MA, Turkington R, Griffiths E, O'Donovan M, O'Neill JR, Mercer S, Parsons SL, Fitzgerald RC, Underwood TJ; OCCAMS consortium. Multicentre cohort study to define and validate pathological assessment of response to neoadjuvant therapy in oesophagogastric adenocarcinoma. Br J Surg. 2017;104:1816-1828. [PubMed] [DOI] |
| 9. | Yamamoto M, Takahashi T, Serada S, Sugase T, Tanaka K, Miyazaki Y, Makino T, Kurokawa Y, Yamasaki M, Nakajima K. Overexpression of leucine-rich α2-glycoprotein-1 is a prognostic marker and enhances tumor migration in gastric cancer. Cancer Sci. 2017;108:2052-2060. [PubMed] [DOI] |
| 10. | 张 才华, 吕 孝鹏, 孟 良. 新辅助化疗联合腹腔镜手术治疗进展期胃癌. 中国普外基础与临床杂志. 2016;23:961-966. [DOI] |
| 12. | Xing X, Jia S, Wu J, Feng Q, Dong B, Li B, Jia Y, Shan F, Li Y, Zhang Y. Clonality analysis of synchronous gastro-oesophageal junction carcinoma and distal gastric cancer by whole-exome sequencing. J Pathol. 2017;243:165-175. [PubMed] [DOI] |
| 13. | Song Z, Wu Y, Yang J, Yang D, Fang X. Progress in the treatment of advanced gastric cancer. Tumour Biol. 2017;39:1010428317714626. [PubMed] [DOI] |
| 14. | Satake H, Kondo M, Mizumoto M, Kotake T, Okita Y, Ogata T, Hatachi Y, Yasui H, Miki A, Imai Y. Phase I Study of Neoadjuvant Chemotherapy with Capecitabine and Oxaliplatin for Locally Advanced Gastric Cancer. Anticancer Res. 2017;37:3703-3710. [PubMed] [DOI] |
| 17. | Stahl M, Walz MK, Riera-Knorrenschild J, Stuschke M, Sandermann A, Bitzer M, Wilke H, Budach W. Preoperative chemotherapy versus chemoradiotherapy in locally advanced adenocarcinomas of the oesophagogastric junction (POET): Long-term results of a controlled randomised trial. Eur J Cancer. 2017;81:183-190. [PubMed] [DOI] |
| 18. | Ronellenfitsch U, Schwarzbach M, Hofheinz R, Kienle P, Nowak K, Kieser M, Slanger TE, Burmeister B, Kelsen D, Niedzwiecki D. Predictors of overall and recurrence-free survival after neoadjuvant chemotherapy for gastroesophageal adenocarcinoma: Pooled analysis of individual patient data (IPD) from randomized controlled trials (RCTs). Eur J Surg Oncol. 2017;43:1550-1558. [PubMed] [DOI] |
| 20. | 刘 伟, 安 杰, 侯 会池. 新辅助化疗加腹腔镜手术治疗进展期胃癌的临床研究. 中国现代普通外科进展. 2015;18:733-735. [DOI] |
| 22. | Guo Q, Liu X, Lu L, Yuan H, Wang Y, Chen Z, Ji R, Zhou Y. Comprehensive evaluation of clinical efficacy and safety of celecoxib combined with chemotherapy in management of gastric cancer. Medicine (Baltimore. ). 2017;96:e8857. [PubMed] [DOI] |
| 23. | Li Z, Shan F, Wang Y, Zhang Y, Zhang L, Li S, Jia Y, Xue K, Miao R, Li Z. Correlation of pathological complete response with survival after neoadjuvant chemotherapy in gastric or gastroesophageal junction cancer treated with radical surgery: A meta-analysis. PLoS One. 2018;13:e0189294. [PubMed] [DOI] |
| 24. | Inokuchi M, Nakagawa M, Baogok N, Takagi Y, Tanioka T, Gokita K, Okuno K, Kojima K. Prognostic Significance of High EphA1-4 Expression Levels in Locally Advanced Gastric Cancer. Anticancer Res. 2018;38:1685-1693. [PubMed] [DOI] |
| 25. | Cho JH, Lim JY, Cho JY. Comparison of capecitabine and oxaliplatin with S-1 as adjuvant chemotherapy in stage III gastric cancer after D2 gastrectomy. PLoS One. 2017;12:e0186362. [PubMed] [DOI] |
| 26. | Terada M, Kinoshita T, Kaito A, Sugita S, Watanabe M, Hayashi R. Evaluation of the prognostic factors in patients with pT3N0 or pT1N2-3 gastric cancer: a single institutional retrospective cohort study. Surg Today. 2018;48:325-332. [PubMed] [DOI] |
| 27. | Pattison S, Mitchell C, Lade S, Leong T, Busuttil RA, Boussioutas A. Early relapses after adjuvant chemotherapy suggests primary chemoresistance in diffuse gastric cancer. PLoS One. 2017;12:e0183891. [PubMed] [DOI] |
| 28. | Cao Y, Liu H, Li H, Lin C, Li R, Wu S, Zhang H, He H, Zhang W, Xu J. Association of O6-Methylguanine-DNA Methyltransferase Protein Expression With Postoperative Prognosis and Adjuvant Chemotherapeutic Benefits Among Patients With Stage II or III Gastric Cancer. JAMA Surg. 2017;152:e173120. [PubMed] [DOI] |