修回日期: 2018-03-14
接受日期: 2018-03-18
在线出版日期: 2018-04-18
探讨CXCR7对人胃癌细胞株SGC-7901生长的影响, 并研究阻断CXCR7对胃癌肿瘤生长的影响.
利用RNA重组质粒技术,构建CXCR7的siRNA慢病毒表达载体,转染人胃癌细胞株SGC-7901, 评价沉默CXCR7的SGC-7901细胞在黏附、侵袭、血管内皮生长因子(vascular endothelial growth factor, VEGF)的分泌及血管新生方面的影响; 运用免疫组化和免疫荧光双染检测人胃癌组织中CXCR7在血管内皮的表达情况; 同时运用动物实验靶向抑制CXCR7检测对胃癌生长的影响, 运用CD31染色显示肿瘤新生血管, 揭示CXCR7与血管密度的关系, 同时运用PCR检测VEGF的含量.
在体外, CXCR7促进SGC-7901细胞的黏附、侵袭和VEGF的分泌; 免疫组化和免疫荧光双染显示CXCR7能够表达在人胃癌组织的血管内皮细胞上; 在鼠体内, CXCR7的阻滞剂CCX711能够抑制肿瘤的生长(体积F = 5.487, P = 0.047; 重量F = 5.364, P = 0.049)和血管新生(F = 6.438, P = 0.035)并能够减少VEGF的分泌(F = 87.211, P = 0.000).
CXCR7能够促进胃癌细胞SGC-7901的黏附、侵袭和血管新生, 靶向阻滞CXCR7可以减少血管新生, 阻止胃癌的生长, 为胃癌的治疗提供一个潜在的作用靶点.
核心提要: CXCR7能够显著促进胃癌细胞的黏附、侵袭和血管新生, 靶向阻滞CXCR7可以减少血管新生, 阻止胃癌的生长, 为胃癌的治疗提供一个潜在的作用靶点.
引文著录: 辛琪, 张娜, 温丽坤, 张勤, 张传山. 趋化因子受体CXCR7通过VEGF促进胃癌生长. 世界华人消化杂志 2018; 26(11): 639-647
Revised: March 14, 2018
Accepted: March 18, 2018
Published online: April 18, 2018
To investigate the effect of CXCR7 on the invasion of human gastric cancer cell line SGC-7901, and to explore the effect of blocking CXCR7 on gastric cancer growth and the underlying molecular mechanism.
A lentiviral vector overexpressing CXCR7 was transfected into SGC-7901 cells, and RT-PCR and Western blot were used to confirm if transfection was successful. The effect of CXCR7 overexpression on cell invasion and adhesion as well as vascular endothelial growth factor (VEGF) secretion was also assessed. Immunohistochemistry and immunofluorescence double staining were performed to assess the expression of CXCR7 in the vascular endothelium of human gastric cancer tissues. After blocking CXCR7 in nude mice carrying tumors, new blood vessels were detected by immunohistochemical staining for CD31 and microvessel density was calculated to reveal the relationship between CXCR7 and vascular density. The expression of VEGF was also detected.
In vitro, CXCR7 was found to induce cell invasion and adhesion and VEGF secretion in SGC-7901 cells. CXCR7 was expressed in blood vessels of human gastric cancer tissues. In vivo, tumor growth (volume: F = 5.487, P = 0.047; weight: F = 5.364, P = 0.049) and angiogenesis (F = 6.438, P = 0.035) were suppressed, and VEGF was down-regulated (F = 87.211, P = 0.000) by CCX711.
CXCR7 can significantly promote SGC-7901 cell invasion, adhesion, and angiogenesis. CXCR7 antagonist can inhibit tumor growth by inhibiting the secretion of VEGF and reducing angiogenesis, suggesting the value of CXCR7 as a potential target for gastric cancer therapy.
- Citation: Xin Q, Zhang N, Wen LK, Zhang Q, Zhang CS. Chemokine receptor CXCR7 promotes gastric cancer growth via VEGF. Shijie Huaren Xiaohua Zazhi 2018; 26(11): 639-647
- URL: https://www.wjgnet.com/1009-3079/full/v26/i11/639.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v26.i11.639
胃癌是最常见的恶性肿瘤, 其高死亡率的一个主要原因就是失控生长和恶性转移. 由于不能很好的明确胃癌浸润和转移的分子学机制, 使得胃癌缺乏有效的治疗, 因此明确胃癌进展的分子机制, 寻找有效的能够提示恶性潜能的分子靶点是非常重要的. 趋化因子CXCL12(stromal cell derived factor 1 α, SDF-1α)在胃癌的生长、侵袭和转移中起到重要作用[1,2]可能是影响胃癌预后的一个独立影响因子[3]. CXCR7(CXC chemokine receptor-7)是近年来发现的CXCL12的一个新受体, 在各种肿瘤中都有表达, 并且与肿瘤的生长发展密切相关[4]. 我们之前究证实, CXCR7在胃癌中表达, 并且能够促进其生长侵袭[5-9]. 但是CXCR7在胃癌中的生物学作用并不明确, 在本研究中我们通过采用重组质粒干扰CXCR7慢病毒载体稳定转染SGC-7901细胞, 考察CXCR7表达的变化对人胃癌细胞株SGC-7901细胞侵袭和黏附的影响. 并进一步分析CXCR7的胃癌细胞是否通过刺激血管内皮生长因子(vascular endothelial growth factor, VEGF)的分泌促进瘤性血管的生成介导肿瘤的生长浸润, 最后我们运用动物实验靶向阻断CXCR7观察是否能够抑制肿瘤的生长, 明确CXCR7调节肿瘤生长浸润的分子生物学机制.
人胃癌细胞SGC-7901、MGC803和BGC823购自武汉博士德公司, siRNA慢病毒载体购自Ambion公司; 胎牛血清(杭州四季青生物工程公司), 基因重组人CXCL12(购自美国dako公司), 兔抗人CXCR7多克隆抗体(购自美国dako公司), CXCR7拮抗剂CCX711, 鼠抗人CD31多克隆抗体(购自北京中杉生物公司), 总RNA提取试剂盒(Life Technologies公司), RT-PCR试剂盒(Life Technologies公司), PVDF膜(Millipore公司), 辣根酶标记二抗(北京中杉金桥), Lipofectamine 2000(Invitrogen),兔抗人β-actin抗体、羊抗兔二抗(北京中杉生物公司), BSA,ECL显色剂(北京中杉生物公司), Transwell小室、Matrigel、纤维黏连蛋白(fibronectin, FN)(购自BD Biosciences公司). 免疫荧光双染试剂盒(购自北京中杉生物公司), 裸鼠购自天津医科大学动物实验室.
1.2.1 转染及稳定表达细胞株的筛选: 在转染前24 h, 将处于对数生长期的SGC-7901细胞接种于6孔培养板中, 培养过夜, 带细胞长至密度为70%-80%后, 加入病毒上清液, 培养72 h后, 在荧光显微镜下检测转染率, 收取转染效率在80%以上的细胞作为目的细胞. 进行后续western-blot和RT-PCR实验. 本研究共分2组: 对照组(转染空白载体)、siRNACXCR7组.
1.2.2 RT-PCR检测CXCR7mRNA表达: 收获各组细胞,用超纯RNA提取试剂盒提取组织样本中总RNA. 依据HiFi-MMLVcDNA第一链合成试剂盒标准操作进行cDNA合成. RealTime PCR扩增程序为: 95℃预变性10 min, 95℃变性15 s, 60℃退火/延伸 60 s, 共40次循环. 实验依据Platinum® SYBR® Green qPCR SuperMix-UDG操作. 结果的参数主要是观察溶解曲线和扩增曲线, 用ABI7500型荧光定量PCR仪, 采用2-△△Ct法进行数据的相对定量分析. △△Ct = (Ct目的基因-Ct管家基因)实验组-(Ct目的基因- Ct管家基因)对照组.
1.2.3 Western blotting检测CXCR7蛋白水平表达: 收获各组细胞后提取总蛋白. 通过BCA法进行蛋白定量, 然后常规10%SDS-PAGE凝胶电泳、转PVDF膜和蛋白印迹反应. CXCR7抗体(1:100)和GAPDH抗体(1:1000)4℃孵育过夜, 辣根过氧化物酶标记山羊抗兔二抗室温孵育1 h后用DAB显色. 用AlphaView系统软件进行灰度定量.
1.2.4 细胞黏附实验: 96孔板用FN和Matrigel胶包被, 4℃过夜. PBS洗涤2次, 加入含2%BSA的RPMI 1640, 37℃封闭1 h. 用RPMI 1640制备细胞悬液(2×105/mL), 将200 μL细胞悬液加入各孔, 37℃, 5%CO2孵育1 h, 使细胞黏附于细胞外基质, 每种细胞设置4个复孔. 吸出培养基, PBS轻柔洗涤3次, 除去未黏附细胞, 依次加入100 μL RPMI 1640、10 μL CCK-8, 37℃, 5% CO2孵育4 h, 在波长450 nm处读数,空白对照组调零, 测各孔吸光度值. 实验重复3次.
1.2.5 细胞体外侵袭实验: 在上室和下室各加入500 μL无血清RPMI 1640培养基,置于37℃、50 mL/L CO2培养箱中水化2 h. 吸弃上下室中的无血清培养基, 常规制备无血清1%双抗RPMI 1640单细胞悬液,调整细胞密度为2×l04/mL. 每孔上室中加入500 μL无血清1%双抗RPMI细胞悬液,下室中加入750 μL含100 ng/Ml CXCL12的全营养RPMI 1640培养基, 每种细胞设3个复孔, 置于37℃、50 mL/L CO2培养箱培养24 h. 吸弃上下室中的细胞培养液, 用冰的PBS清洗2遍后, 用棉签抹去上室PET膜上表面的细胞及matrigel凝胶后, 置于4℃甲醇固定5 min. 吸弃甲醇固定液,室温下用苏木素染液染色4 min, 用足量的双蒸水洗脱染色液之后, 置于室温中过夜晾干. 将上室置于100倍倒置显微镜下观察并拍照计数, 每孔观察3个视野, 计算比较各组细胞之间侵袭细胞数差异. 各组实验重复3次.
1.2.6 免疫组化及免疫荧光双染: 所有标本均经10%中性福尔马林固定, 常规石蜡包埋, 4 μm连续切片. 采用免疫荧光双染法检测组织CXCR7表达部位, 红色代表CXCR7阳性部位, 绿色代表CD31血管内皮阳性部位, 黄色代表CXCR7与CD31共同阳性部位.
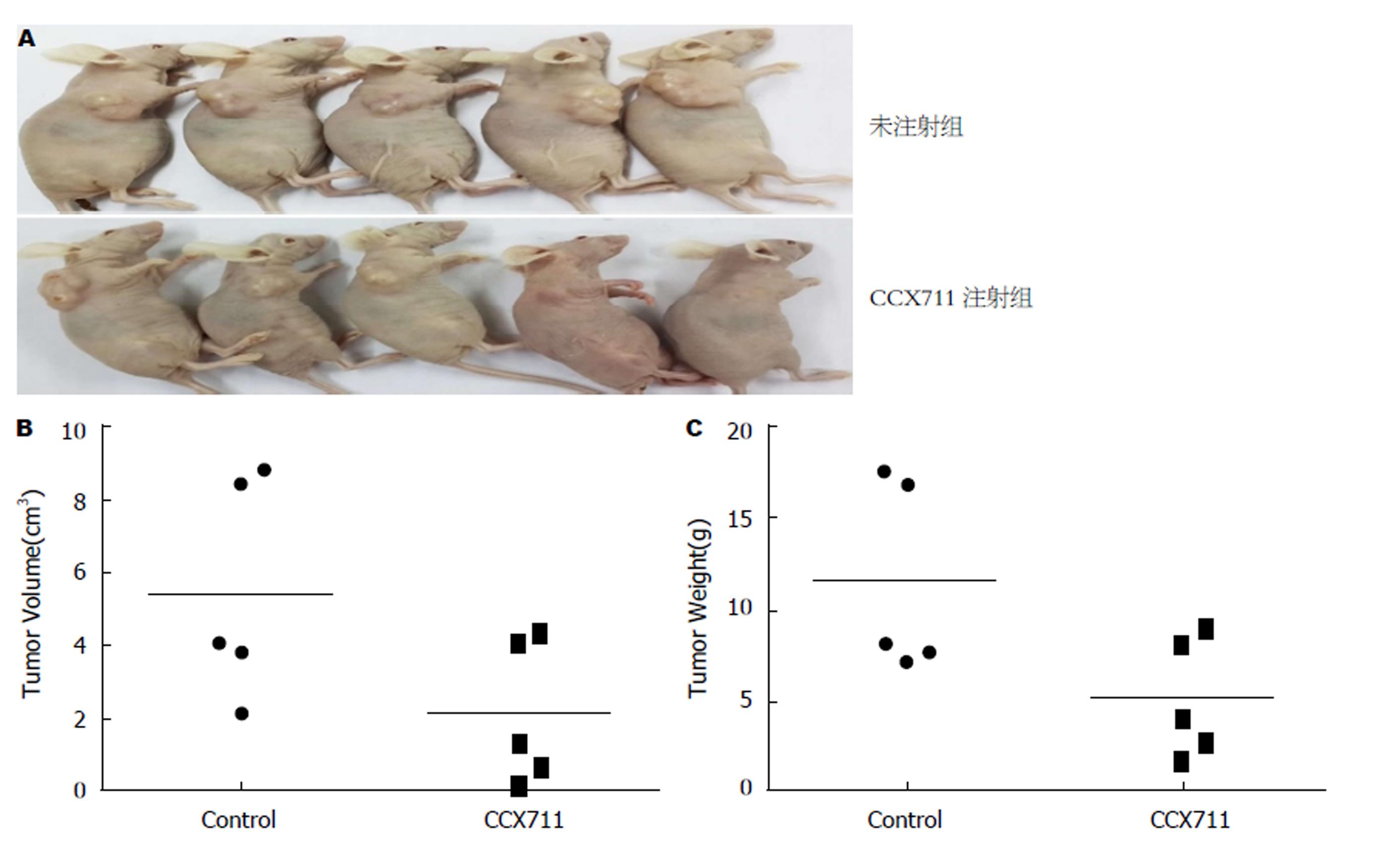
1.2.7 动物实验: 6 wk大的裸鼠10只, 给小鼠接种胃癌细胞SGC-7901, 浓度5×107个(胃癌细胞)/只, 剂量: 0.1 mL/只. 接种胃癌细胞前给小鼠称质量, 接种肿瘤细胞1 wk后, 准备在瘤体上注射给药前再次给小鼠称质量并记录. 将接种后的小鼠分为2组: 对照组: 瘤体给予PBS注射; 实验组: 给予CXCR7的阻滞剂CCX711. 接种肿瘤细胞1 wk后在瘤体上直接注射给药. 继续每周观察小鼠, 称质量、测量肿瘤瘤体大小. 药物注射20 d后, 对两组小鼠分别照相、称质量、测量肿瘤瘤体大小. 处死小鼠, 取肿瘤组织, 分别称各组肿瘤瘤体大小、重量. 肿瘤一部分用福尔马林固定后, 运用免疫组化CD31标记新生血管内皮, 用于计算微血管密度(microvessel density, MVD). 另一部分运用PCR检测VEGF含量变化.
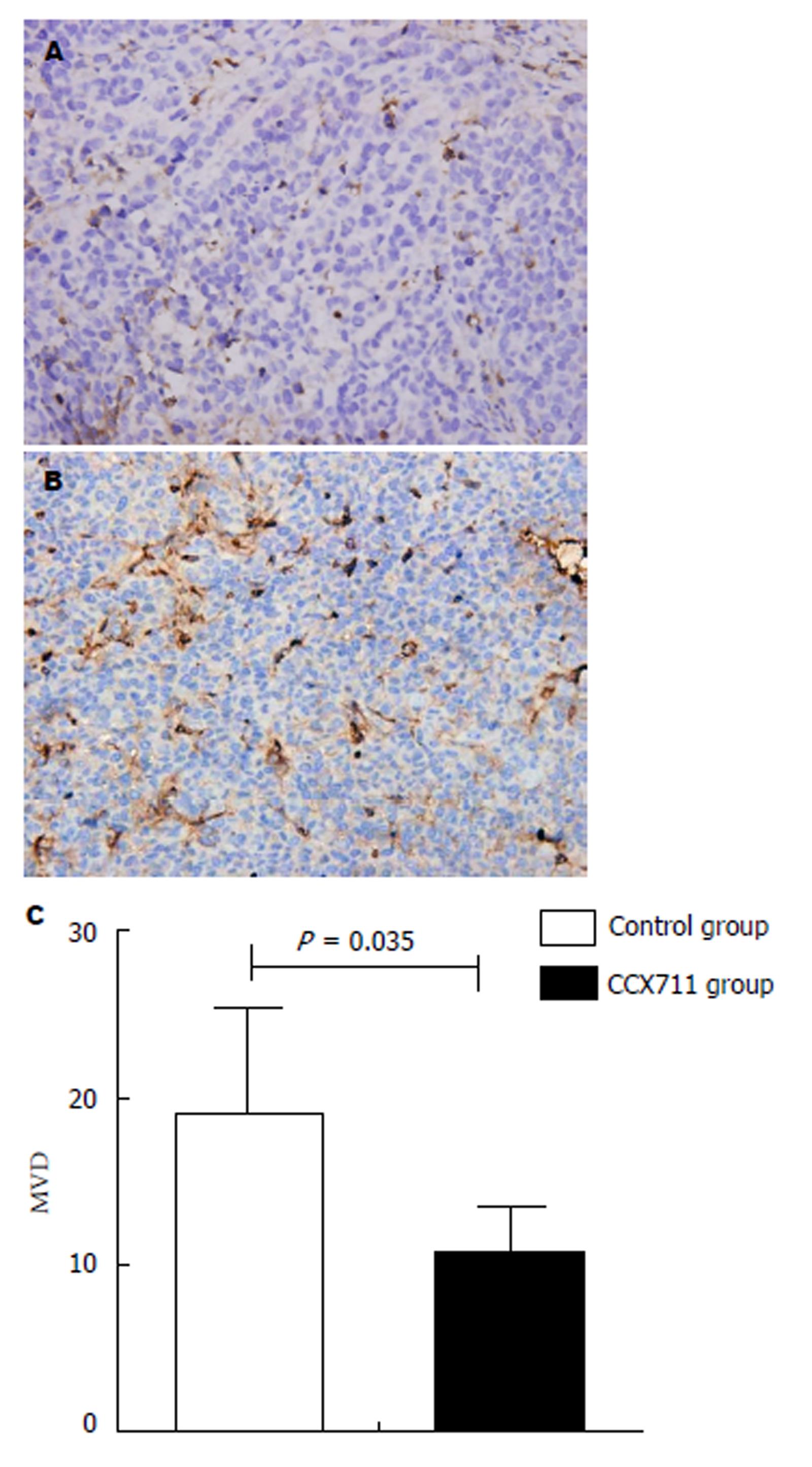
1.2.8 免疫组化和微血管密度检测 裸鼠的肿瘤模型被分离, 置于4%的福尔马林中固定, 进行石蜡包埋, 4 μm切片, 肿瘤组织中微血管密度(microvessel density, MVD)的检测通过免疫组化检测肿瘤组织中CD31的表达来完成. 用半定量分析MVD, 每张肿瘤切片随即取5个高倍视野(×400)下计数CD31阳性表达的血管数目进行计数, 计算每个高倍视野血管的平均数来计算MVD.
统计学处理 采用SPSS18.0统计软件, 呈正态分布的两组之间计量资料比较采用方差分析. P<0.05为差异有统计学意义.
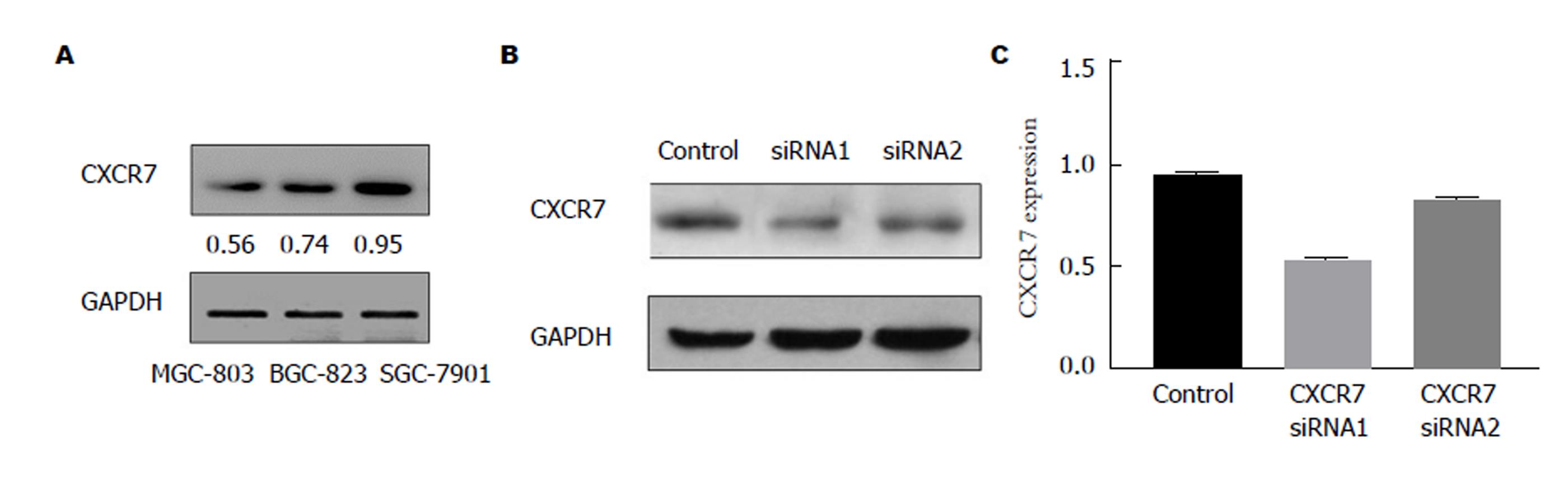
为了检测CXCR7在各组细胞中的表达情况, 我们筛选了3种不同的细胞株SGC7901、MGC803和BGC823, 通过Western blot分析显示, SGC7901细胞中CXCR7含量最高(图1A), 因此我们选取SGC7901细胞进行干扰CXCR7来观察对各方面能力的影响.
RT-PCR结果显示, 与空白对照组相比, CXCR7-siRNA二组CXCR7mRNA表达均显著下调(F = 75.663, P = 0.001), 其中干扰1组下调最为显著, 由此可见CXCR7-siRNA载体能显著下调SGC-7901细胞中CXCR7 mRNA的表达水平(图1C). 同时, 我们通过Western blot(图1B)分析发现, CXCR7-siRNA组中CXCR7的蛋白质表达水平相比较空白对照组明显下降. 其中干扰1组下调最为显著, Western blot实验结果与RT-PCR结果相一致, 挑选干扰1组用于后继实验.
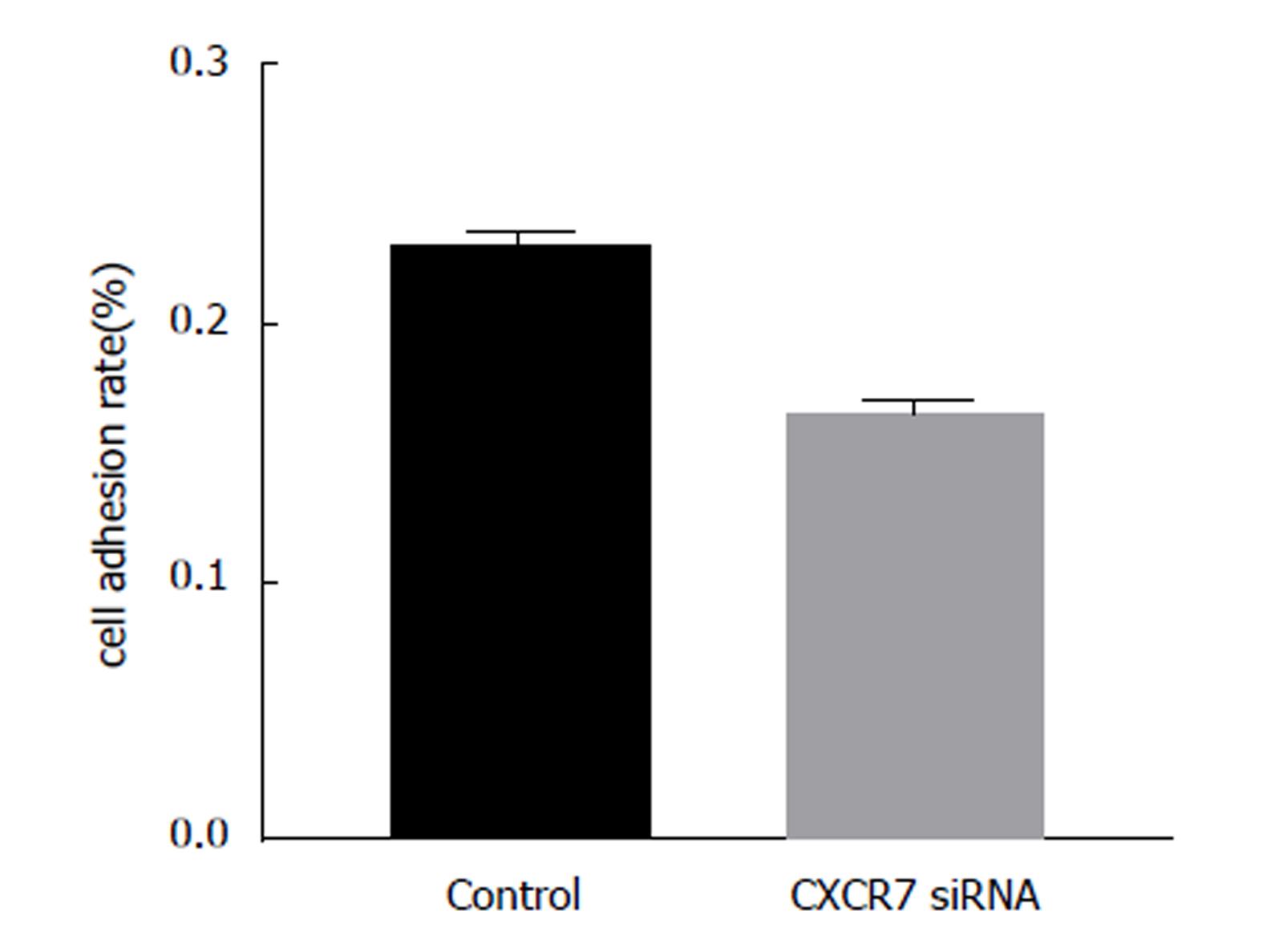
肿瘤细胞黏附到细胞外基质(extra cellular matrix, ECM)是侵袭过程中最重要的一步.通过体外检测SGC7901细胞黏附实验发现(图2), 与空白对照组相比, CXCR7siRNA显著抑制SGC7901细胞与细胞外基质的黏附(F = 10.433, P = 0.018). 结果表明, 下调CXCR7的表达能够显著抑制胃癌细胞与基质的黏附作用.
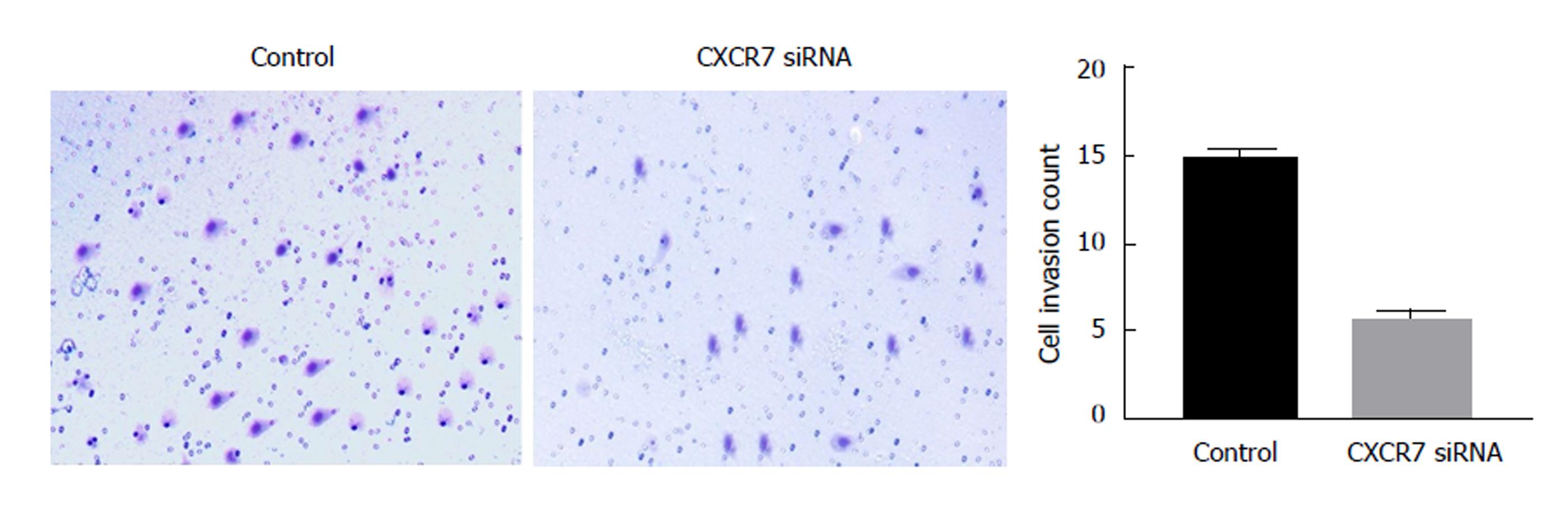
CXCR7在多种肿瘤中能够调节浸润和转移. 因此我们运用Transwell小室侵袭实验通过应用siRNA减少CXCR7的表达来检测CXCR7对胃癌细胞SGC7901的侵袭能力. 如图3所示结果显示: 干扰CXCR7组与空白对照组穿膜细胞数明显减少(F = 10.400, P = 0.032).结果提示, 抑制CXCR7的表达能够抑制SGC7901细胞的侵袭能力.
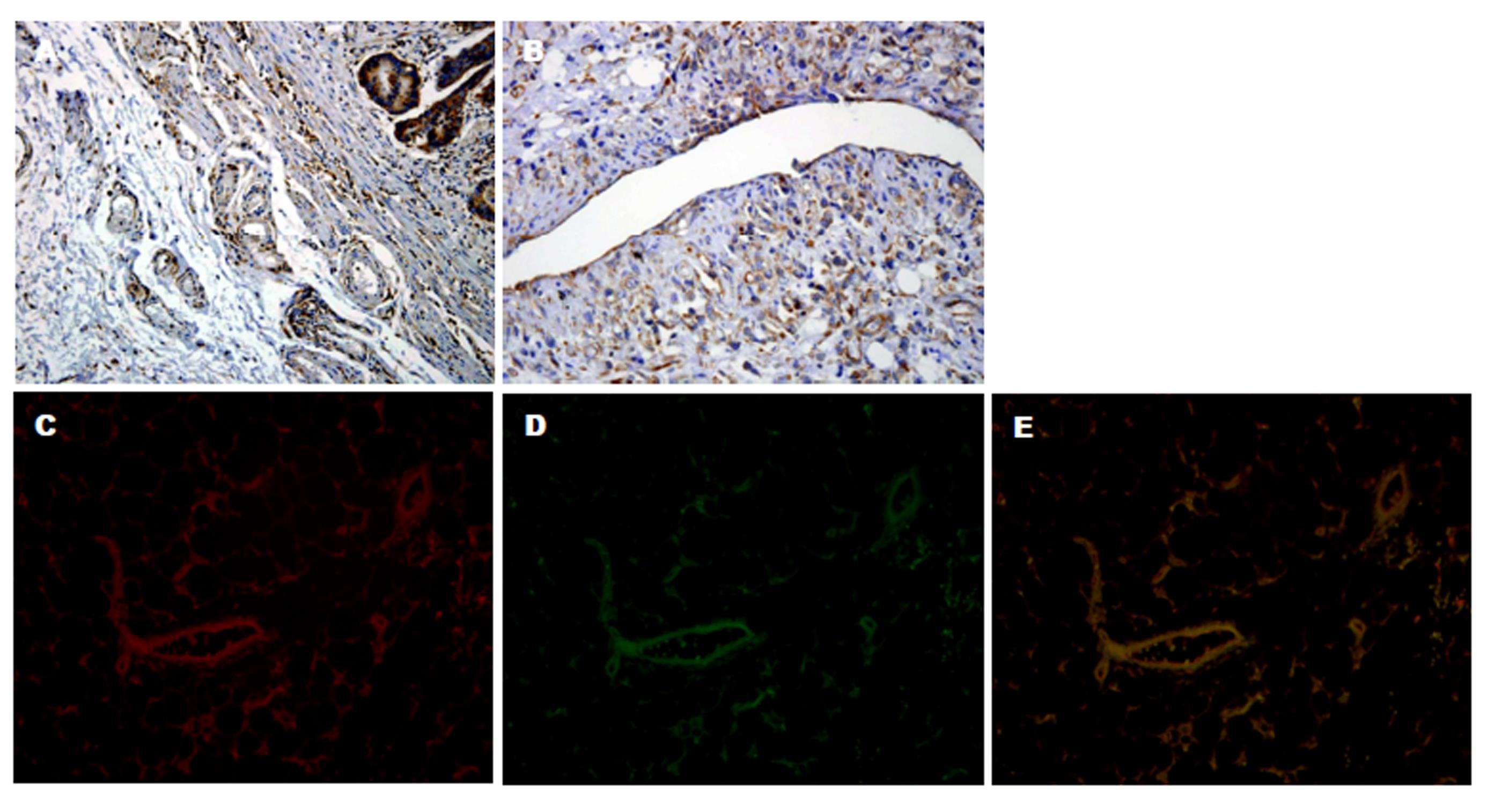
我们前期运用免疫组化检测CXCR7高表达于肿瘤细胞质[6,7]. 前期工作中我们注意到在几乎所有的胃癌组织标本中都可以观察到CXCR7表达在与肿瘤相关的血管内皮上(如图4A、B), 而在正常胃组织标本的血管中并未见到CXCR7的表达. 为进一步研究我们采用免疫荧光双染检测CXCR7在胃癌组织血管内皮的表达情况, 发现CXCR7和CD31共同表达于血管内皮(如图4C、D、E).
为了进一步证实阻断CXCR7能否抑制肿瘤的生长, 我们用SGC-7901细胞皮下注射裸鼠构建模型. 研究结果提示, 注射CXCR7阻滞剂CCX711, 注射组肿瘤的平均体积2.523 cm3±1.613 cm3, 重量5.088 g±3.286 g. 对照组; 肿瘤平均体积5.453 cm3±2.971 cm3, 重量11.488 g±5.233 g. 肿瘤生长明显被抑制(F = 5.487, P = 0.047; F = 5.364, P = 0.049)(如图5).
人体胃癌肿瘤中提示CXCR7能够促进肿瘤血管新生, 在动物实验中我们再次来验证阻断CXCR7是否能够抑制肿瘤的血管生成. MVD是用肿瘤微血管CD31+的平均数进行计算的. 结果显示肿瘤微血管在阻断CXCR7后被抑制. 注射阻滞剂CCX711组MVD(如图6A, 10.60±3.507)比对照组(如图6B, 19.00±6.519)明显减少(F = 6.438, P = 0.035). 这些结果提示我们阻断CXCR7可以抑制肿瘤的血管生成, 随后阻断肿瘤的生长.
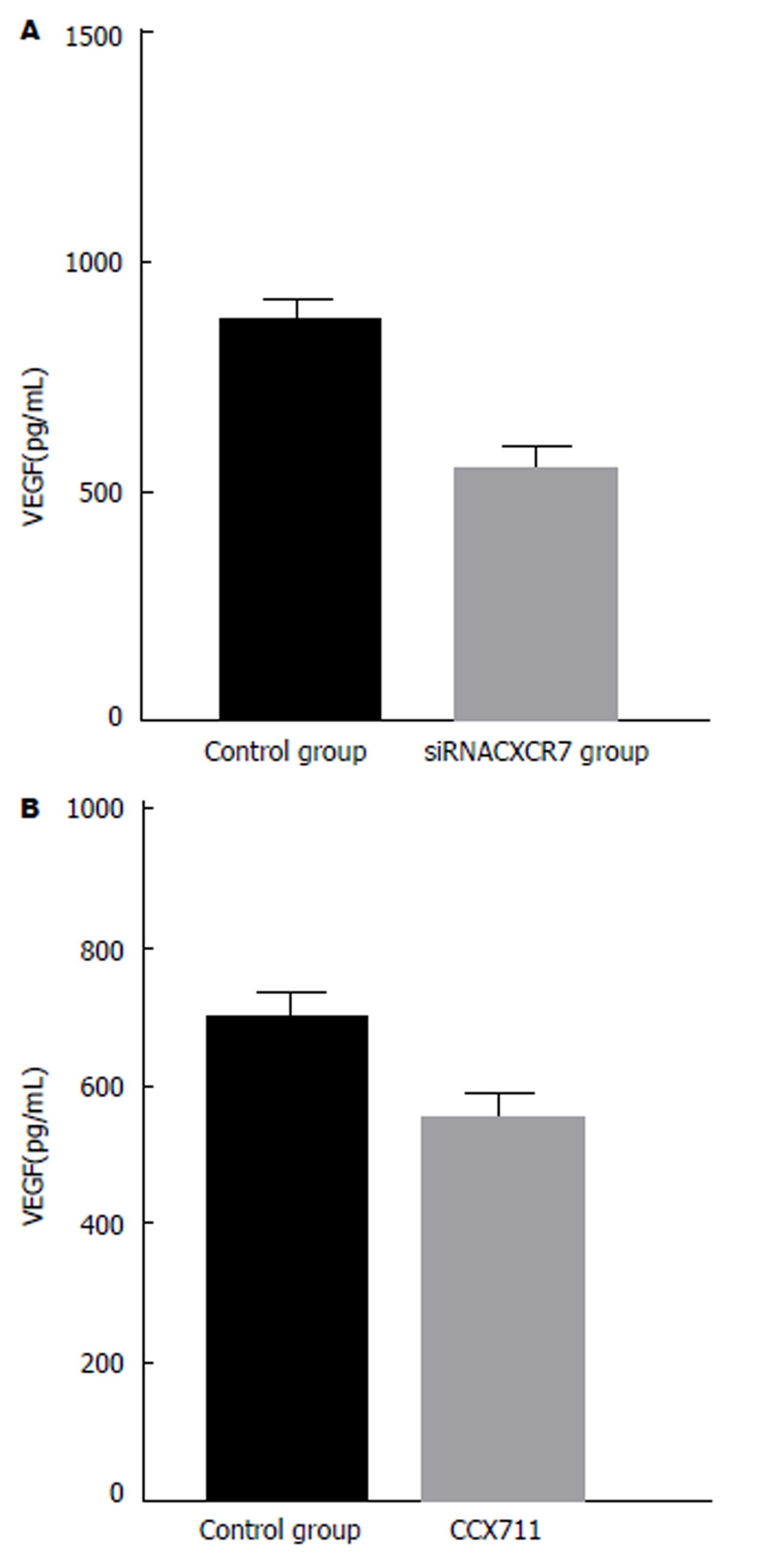
VEGF是肿瘤血管生成的重要促进因子, 以上实验证实CXCR7能够诱导胃癌血管生成, 那么接下来我们利用PCR方法检测2组细胞中VEGF的含量, 来观察是否在胃癌组织中CXCR7通过调节VEGF的变化来促进胃癌中的血管新生. 在siRNACXCR7的SGC-7901细胞中, VEGF的含量明显降低, 低于空白对照组(F = 37.231, P = 0.002)(图7A). 在裸鼠模型肿瘤上应用CXCR7阻断剂CCX711后, 运用RT-PCR实验结果显示, 阻断CXCR7后, 肿瘤中VEGF的含量降低(F = 87.211, P = 0.000)(图7B). 结果显示CXCR7能够通过调节胃癌细胞中VEGF的水平来促进肿瘤血管的生成.
趋化因子及其受体在肿瘤发生及发展中的作用已经成为研究热点[10]. 肿瘤细胞可以自分泌趋化因子, 又可以表达多种趋化因子受体, 产生反应, 如促进肿瘤细胞增殖及向远处转移、招募内皮细胞促进血管生成、下调免疫监视等, 趋化因子网络作用的阐明为肿瘤生物靶向治疗提供了研究方向[11]. 其中CXCL12和它的受体在肿瘤发展的作用备受重视[12]. CXCR7作为CXCL12新近发现的受体在多种肿瘤组织和细胞中表达[13,14], 我们前期研究及Shi AM等[15,16]的研究结果证明CXCR7可以在胃癌组织及其细胞中表达. 同时我们的前期试验也证明CXCR7在胃癌的发展侵袭方面可能发挥作用. 但是它在胃癌中的生物学作用及其分子学机制尚不明确.
在我们的研究中利用Transwell小室法发现CXCR7能够通过与CXCL12结合促进胃癌细胞株SGC-7901的侵袭. 这一研究结果与Liu Y等研究CXCR7能够通过与CXCL12结合促进胶质瘤细胞侵袭是一致的[17]. 但是也有研究认为CXCR7不能促进肿瘤的生长[18], 介导钙内流和细胞内信号转导, 如PI3K, ERK[19]. 在这篇文章中, 我们没有阐述CXCR7调节胃癌细胞侵袭的分子机制. 但在近来有研究显示CXCR7诱导C羧基和ICL-3的残余Ser/Thr发生磷酸化, 增强受体与β-arrestins的结合[20], 使的β-arrestins构象发生变化, C端暴露, 与clathrin和clathrin adaptor AP2等蛋白结合, 激活细胞内信号通路, 包括磷酸化Akt[21]和MAP-K信号通路[22], 活化JAK2/STAT3[23]. 这些信号通路进一步激活下游区的NF-kB、cAMP效应元件蛋白(CREB)、AP-1和ELK-1从而调节基质金属蛋白酶(如MMP3、MMP10、MMP11等)和HPSE的水平, 增强肿瘤细胞的浸润和转移能力[24]. 但也有研究认为CXCR7介导的信号途径主要是依赖于CXCR4来完成的[25]. 因此, CXCR7在不同类型的细胞中发挥作用的分子生物学机制可能是不同的, 我们之后将进一步研究来阐明胃癌中CXCR7与CXCL12结合引起侵袭的分子生物学机制.
肿瘤细胞与细胞外基质(extracelluar matrix, ECM)间的黏附是肿瘤生长的首要步骤[26]. 之前的研究发现CXCR7能够调节肿瘤细胞黏附到血管内皮细胞[27]. 我们的研究发现高表达CXCR7的胃癌细胞株在CXCL12的诱导下, 黏附基质的能力明显增强, 表明CXCR7能够促进胃癌细胞黏附到基质来促进胃癌的生长. 这一过程的发生可能是通过纤维连接蛋白、钙黏连蛋白11 (CDH11)、CD44等来实现的. 其他对前列腺癌的研究中发现CXCR7参与细胞基质的黏附是受到整合素β-1的调节的[28].
体外实验证明CXCR7可以促进胃癌细胞株SGC-7901的黏附和侵袭, 在生长过程中发挥了重要作用, 结合我们前期运用免疫组化检测胃癌组织标本表明CXCR7可以表达在胃癌组织中参与胃癌的生长, 证明CXCR7能够促进胃癌的生长浸润. 为了进一步证明我们的结果, 我们通过外源性注射SGC-7901细胞到裸鼠皮下构建动物模型, 应用CXCR7的阻断剂CCX711后肿瘤的生长被抑制. 综上所述, CXCR7参与胃癌生长过程, 靶向阻断CXCR7可以控制胃癌的生长. 肿瘤组织通过血管新生来维持生存和促进生长浸润. 我们运用免疫荧光双染证实CXCR7广泛表达于胃癌组织的血管内皮细胞中, 因此提示CXCR7在胃癌组织中介导肿瘤的血管新生, 结合我们的动物实验, CXCR7的拮抗剂CCX711可以减少胃癌组织中的新生血管数量, 说明在胃癌组织中CXCR7的确可以通过促进肿瘤血管的新生来促进胃癌的生长浸润.
VEGF是最重要的血管生成因子, 能够提高肿瘤微血管的通透性来维持恶性肿瘤细胞和血管内皮的联系, 促进肿瘤的浸润[29]. 乳腺癌的研究发现[30]CXCR7刺激VEGF的表达及微血管生长来刺激原始肿瘤的生长. 在本研究中我们发现干扰CXCR7能够抑制SGC-7901细胞VEGF的分泌, 进一步动物实验, 应用CCX711阻断CXCR7后, VEGF在mRNA和蛋白水平表达都下降. 因此我们总结CXCR7可以通过调节VEGF的分泌来促进胃癌肿瘤微血管的生成, 提高肿瘤细胞的生长侵袭能力.
总之, CXCR7可以在多个环节上调节胃癌细胞的生长浸润: 1、CXCR7可以促进肿瘤细胞黏附到基底膜; 2、CXCR7可以促进胃癌细胞的侵袭能力; 3、CXCR7可以通过介导VEGF来参与胃癌瘤性血管的生成. CXCR7的阻断剂CCX711可以抑制动物皮下胃癌肿瘤的生长. 通过我们的实验证明CXCR7可以参与胃癌的生长, 靶向阻断CXCR7可以有效的抑制胃癌的生长, 因此CXCR7有望成为胃癌治疗的新靶点.
趋化因子受体CXCR7是趋化因子CXCL12新近发现的另一个受体, 我们之前的研究发现CXCR7在胃癌的生长过程中具有重要作用, 本文进一步揭示了CXCR7在胃癌中的作用机制, 能够为日后胃癌的靶向治疗提供理论基础.
本篇论文研究的主题是胃癌生长的机制研究, 论证了CXCR7通过血管新生来促进肿瘤生长的机制, 能够为胃癌的靶向治疗提供理论基础.
本研究的主要目标是明确CXCR7促进胃癌生长的机制研究, 我们通过实验证实CXCR7通过调节血管内皮生长因子(vascular endothelial growth factor, VEGF)促进肿瘤血管新生来促进肿瘤生长, 揭示了CXCR7促进胃癌生长的机制, 为日后进一步研究奠定了基础.
采用了质粒转染, 细胞学实验, PCR, 免疫组化, 免疫荧光双染和动物实验的方法, 从人体组织到细胞学实验到动物实验进行了论证.
本篇论文的研究已经达到了实验目标, 解决了CXCR7能够通过调节VEGF促进胃癌肿瘤血管新生的机制, 确定了CXCR7在胃癌血管新生中的作用.
趋化因子受体CXCR7能够通过VEGF促进胃癌中的血管新生, 阻断CXCR7能够抑制胃癌的生长. 为胃癌的靶向治疗提供了新的理论基础.
本实验中我们只运用了一个细胞株, 应该选用两种不同的细胞株进行对比. 并且裸鼠皮下成瘤注射阻滞剂后对裸鼠的生存时间没有作出评价.
学科分类: 胃肠病学和肝病学
手稿来源地: 天津市
同行评议报告分类
A级 (优秀): 0
B级 (非常好): 0
C级 (良好): C, C
D级 (一般): 0
E级 (差): E
编辑: 马亚娟 电编:张砚梁
| 1. | Satomura H, Sasaki K, Nakajima M, Yamaguchi S, Onodera S, Otsuka K, Takahashi M, Muroi H, Shida Y, Ogata H. Can expression of CXCL12 and CXCR4 be used to Predict survival of gastric cancer Patients? Anticancer Res. 2014;34:4051-4057. [PubMed] |
| 2. | Liarmakopoulos E, Theodoropoulos G, Vaiopoulou A, Rizos S, Aravantinos G, Kouraklis G, Nikiteas N, Gazouli M. Effects of stromal cell-derived factor-1 and survivin gene polymorphisms on gastric cancer risk. Mol Med Rep. 2013;7:887-892. [PubMed] [DOI] |
| 3. | Ishigami S, Natsugoe S, Okumura H, Matsumoto M, Nakajo A, Uenosono Y, Arigami T, Uchikado Y, Setoyama T, Arima H. Clinical implication of CXCL12 expression in gastric cancer. Ann Surg Oncol. 2007;14:3154-3158. [PubMed] [DOI] |
| 4. | Xue TC, Jia QA, Bu Y, Chen RX, Cui JF, Tang ZY, Ye SL. CXCR7 correlates with the differentiation of hepatocellular carcinoma and suppresses HNF4α expression through the ERK pathway. Oncol Rep. 2014;32:2387-2396. [PubMed] [DOI] |
| 5. | 辛 琪, 张 勤, 张 娜, 刘 贵秋, 温 立坤, 张 传山, 战 忠利. CXCL12/CXCR7 生物学轴在肠型与弥漫型胃癌组织中的表达差异及意义. 山东医药. 2017;57:52-54. [DOI] |
| 6. | 辛 琪, 张 勤, 张 娜, 温 丽坤, 刘 贵秋, 张 传山, 战 忠利. 趋化因子配体CXCL12、趋化因子受体7在肠型胃癌中的表达与淋巴结和肝脏转移的关系. 中华消化杂志. 2016;36:740-745. [DOI] |
| 8. | Xin Q, Zhang N, Yu HB, Zhang Q, Cui YF, Zhang CS, Ma Z, Yang Y, Liu W. CXCR7/CXCL12 axis is involved in lymph node and liver metastasis of gastric carcinoma. World J Gastroenterol. 2017;23:3053-3065. [PubMed] [DOI] |
| 10. | Kallifatidis G, Munoz D, Singh RK, Salazar N, Hoy JJ, Lokeshwar BL. β-Arrestin-2 Counters CXCR7-Mediated EGFR Transactivation and Proliferation. Mol Cancer Res. 2016;14:493-503. [PubMed] [DOI] |
| 11. | Balakin KV, Ivanenkov YA, Tkachenko SE, Kiselyov AS, Ivachtchenko AV. Regulators of chemokine receptor activity as promising anticancer therapeutics. Curr Cancer Drug Targets. 2008;8:299-340. [PubMed] |
| 12. | Singh AK, Arya RK, Trivedi AK, Sanyal S, Baral R, Dormond O, Briscoe DM, Datta D. Chemokine receptor trio: CXCR3, CXCR4 and CXCR7 crosstalk via CXCL11 and CXCL12. Cytokine Growth Factor Rev. 2013;24:41-49. [PubMed] [DOI] |
| 13. | Kurban S, Tursun M, Kurban G, Hasim A. Role of CXCR7 and effects on CXCL12 in SiHa cells and upregulation in cervical squamous cell carcinomas in Uighur women. Asian Pac J Cancer Prev. 2014;15:9211-9216. [PubMed] |
| 14. | Chen Y, Teng F, Wang G, Nie Z. Overexpression of CXCR7 induces angiogenic capacity of human hepatocellular carcinoma cells via the AKT signaling pathway. Oncol Rep. 2016;36:2275-2281. [PubMed] [DOI] |
| 15. | Shi A, Dong L, Shi H, Jia M, Guo X, Jiang J, Qin B. [Expression of chemokine receptor CXCR7 in gastric cancer tissues and cell lines]. Nan Fang Yi Ke Da Xue Xue Bao. 2014;34:1780-1784. [PubMed] |
| 16. | Shi A, Shi H, Dong L, Xu S, Jia M, Guo X, Wang T. CXCR7 as a chemokine receptor for SDF-1 promotes gastric cancer progression via MAPK pathways. Scand J Gastroenterol. 2017;52:745-753. [PubMed] [DOI] |
| 17. | Liu Y, Carson-Walter E, Walter KA. Targeting chemokine receptor CXCR7 inhibits glioma cell proliferation and mobility. Anticancer Res. 2015;35:53-64. [PubMed] |
| 18. | Burns JM, Summers BC, Wang Y, Melikian A, Berahovich R, Miao Z, Penfold ME, Sunshine MJ, Littman DR, Kuo CJ. A novel chemokine receptor for SDF-1 and I-TAC involved in cell survival, cell adhesion, and tumor development. J Exp Med. 2006;203:2201-2213. [PubMed] [DOI] |
| 19. | Grymula K, Tarnowski M, Wysoczynski M, Drukala J, Barr FG, Ratajczak J, Kucia M, Ratajczak MZ. Overlapping and distinct role of CXCR7-SDF-1/ITAC and CXCR4-SDF-1 axes in regulating metastatic behavior of human rhabdomyosarcomas. Int J Cancer. 2010;127:2554-2568. [PubMed] [DOI] |
| 20. | Whalen EJ, Rajagopal S, Lefkowitz RJ. Therapeutic potential of β-arrestin- and G protein-biased agonists. Trends Mol Med. 2011;17:126-139. [PubMed] [DOI] |
| 21. | Wang J, Shiozawa Y, Wang J, Wang Y, Jung Y, Pienta KJ, Mehra R, Loberg R, Taichman RS. The role of CXCR7/RDC1 as a chemokine receptor for CXCL12/SDF-1 in prostate cancer. J Biol Chem. 2008;283:4283-4294. [PubMed] [DOI] |
| 22. | Odemis V, Boosmann K, Heinen A, Küry P, Engele J. CXCR7 is an active component of SDF-1 signalling in astrocytes and Schwann cells. J Cell Sci. 2010;123:1081-1088. [PubMed] [DOI] |
| 23. | Kumar R, Tripathi V, Ahmad M, Nath N, Mir RA, Chauhan SS, Luthra K. CXCR7 mediated Giα independent activation of ERK and Akt promotes cell survival and chemotaxis in T cells. Cell Immunol. 2012;272:230-241. [PubMed] [DOI] |
| 24. | Li XX, Zheng HT, Huang LY, Shi DB, Peng JJ, Liang L, Cai SJ. Silencing of CXCR7 gene represses growth and invasion and induces apoptosis in colorectal cancer through ERK and β-arrestin pathways. Int J Oncol. 2014;45:1649-1657. [PubMed] [DOI] |
| 25. | Kalatskaya I, Berchiche YA, Gravel S, Limberg BJ, Rosenbaum JS, Heveker N. AMD3100 is a CXCR7 ligand with allosteric agonist properties. Mol Pharmacol. 2009;75:1240-1247. [PubMed] [DOI] |
| 26. | Lin L, Han MM, Wang F, Xu LL, Yu HX, Yang PY. CXCR7 stimulates MAPK signaling to regulate hepatocellular carcinoma progression. Cell Death Dis. 2014;5:e1488. [PubMed] [DOI] |
| 27. | 戴 小珍, 熊 新, 王 兰, 潘 克俭, 何 浪, 李 红. CXCR7-shRNA慢病毒载体对人肝癌细胞生长及侵袭能力的抑制作用. 南方医科大学学报. 2013;33:994-998. [DOI] |
| 28. | Windus LC, Glover TT, Avery VM. Bone-stromal cells up-regulate tumourigenic markers in a tumour-stromal 3D model of prostate cancer. Mol Cancer. 2013;12:112. [PubMed] [DOI] |
| 29. | Ma DM, Luo DX, Zhang J. SDF-1/CXCR7 axis regulates the proliferation, invasion, adhesion, and angiogenesis of gastric cancer cells. World J Surg Oncol. 2016;14:256. [PubMed] [DOI] |
| 30. | Hernandez L, Magalhaes MA, Coniglio SJ, Condeelis JS, Segall JE. Opposing roles of CXCR4 and CXCR7 in breast cancer metastasis. Breast Cancer Res. 2011;13:R128. [PubMed] [DOI] |