修回日期: 2016-11-27
接受日期: 2016-12-05
在线出版日期: 2017-03-18
近年来丙型肝炎抗病毒药物进展迅速, 直接抗病毒药物(direct antiviral agent, DAA)是丙型肝炎治疗史上最大的标志性事件. 自2011年第一代DAA上市以来, 5年间先后又有两代DAA通过食品及药物管理局批准上市. 由于具有全基因型覆盖、高有效性、服用方便等特性, DAA自应用来迅速在全球部分地区广泛使用. 可以发现, DAA几乎已经解决了丙型肝炎抗病毒治疗领域的主要问题. 但自其应用以来, 不良事件时有报道, 甚至出现了个例严重的不良事件, 其安全性问题越来越引起大家的关注与重视. 基于此, 本文尽可能全面地叙述了自DAA临床应用以来发生的不良发应, 重点关注了DAA使用中的药物间相互作用问题, 希望能借此引起临床医生的注意.
核心提要: 自直接抗病毒药物(direct antiviral agent, DAA)问世来, 其治疗慢性丙型肝炎的高有效性及全基因覆盖性使其在临床上得到了广泛的应用. 与此同时, 不安全事件时有报道. 本文尽可能全面地叙述了自DAA临床应用以来发生的不良发应, 重点关注了其使用中的药物间相互作用问题.
引文著录: 杨颖, 党双锁. 丙型肝炎直接抗病毒药物安全性应用进展. 世界华人消化杂志 2017; 25(8): 659-669
Revised: November 27, 2016
Accepted: December 5, 2016
Published online: March 18, 2017
Antiviral drugs for treatment of hepatitis C have grown dramatically in recent years. The emergence of direct antiviral agents (DAAs) is a major advance in hepatitis C treatment. Since the first generation DAAs appeared in 2011, two more generations of DAAs have been approved by the Food and Drug Administration in only five years. With the advantages of coverage of all genotypes, high availability and easy administration, DAAs have been widely used worldwide in recent years. DAAs have nearly solved the main problems encountered in hepatitis C antiviral therapy. However, adverse events associated with DAAs use have been reported constantly, and the safety of DAAs has attracted more and more attention. According to recent reports, the adverse reactions of DAAs have been gradually reduced from the first generation to the third generation. When combined with other drugs, the drug-drug interactions (DDIs) need special attention. In addition, the usage of DAAs in special patient groups should be cautious. In this paper, we will summarize the adverse effects and DDIs of DAAs as well as their usage in the general population and special patient groups.
- Citation: Yang Y, Dang SS. Safety of direct antiviral agents for treatment of hepatitis C virus infection. Shijie Huaren Xiaohua Zazhi 2017; 25(8): 659-669
- URL: https://www.wjgnet.com/1009-3079/full/v25/i8/659.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v25.i8.659
据最新统计, 目前全球约有1亿8千万慢性丙型病毒性肝炎感染者. 2011年官方发布文章显示, 全球由丙型肝炎引发的死亡人数已超过艾滋病死亡人数, 丙型肝炎感染已成为全人类重大疾病负担之一[1]. 由于没有相应的疫苗, 丙型肝炎的临床抗病毒治疗是现今最主要的防治手段. 在过去的许多年里, 聚乙二醇干扰素(pegylated interferon, PEG-IFN) 联合利巴韦林(ribavirin, RBV), 即P/R方案是慢性丙型肝炎(chronic hepatitis C, CHC)抗病毒治疗的"标准方案", 其疗效与患者基因型密切相关. 基因1型(genotype 1, GT-1)丙型肝炎在治疗后24 wk的持续病毒学应答(sustained virological response, SVR)率约为42%-46%, GT-2/3型的应答率稍高, 约为76%-82%[2,3]. 可以看到, 标准P/R方案对于这些患者并不能起到特别好的抗病毒作用. 除此以外, P/R方案没有靶向性, 只有不到50%的患者可以获得治愈, 还存在着不良反应大、患者耐受性差、治疗周期长(48-72 wk)、失代偿期丙型肝炎患者无法使用等问题[4], 其应用受到了很大的限制. 多年来, 学者们对于研究更有针对性的抗丙型肝炎病毒(hepatitis C virus, HCV)药物的努力从未停止过. 近些年, 针对性更强、更为有效、不良反应更小的药物应运而生, 这类药物就是直接抗病毒药物(direct antiviral agent, DAA). DAA在临床应用中的有效性被广泛认可, 他的问世为丙型肝炎抗病毒治疗带来了革命性的变化. 但是随着应用病例的增加以及时间的延伸, 人们越来越多地发现、报道DAA的不良事件问题, 引起了临床使用的高度警觉和关注. 基于此, 本文试图搜集目前DAA应用以来所有的不良事件报道, 尽可能全面叙述DAA的不良反应, 重点关注DAA在使用中的药物间相互作用问题(drug-drug interaction, DDI), 希望能为DAA临床应用中相关的安全性问题提供重要的资讯.
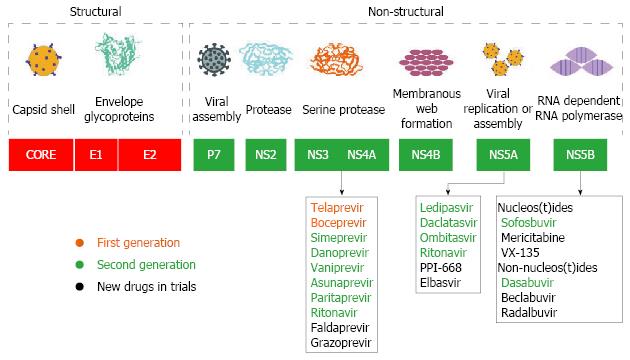
DAA是通过抑制非结构蛋白的功能从而发挥抗病毒作用的. HCV侵入肝细胞后, 丙型肝炎病毒核糖核酸(HCV ribonucleic acid, HCV RNA)在肝细胞内复制, 产生与之互补的反义链, 该反义链将作为模板合成子代HCV RNA正义链, 子代HCV RNA合成之后到达内质网和高尔基体进行组装, 完成组装后的成熟病毒体再被运输到肝细胞膜并进行释放[5]. HCV RNA编码产生多聚蛋白前体, 该蛋白前体可裂解产生10种蛋白, 其中4种为结构蛋白, 参与组装HCV病毒体; 其余6种为非结构蛋白(NS2、NS3、NS4A、NS4B、NS5A和NS5B)参与调控HCV病毒周期[6,7]. 这些非结构区是DAA治疗的靶点(图1).
上述非结构蛋白中结构被最先研究清楚的是NS3/4A蛋白, 这个区域也成为第一个DAAs治疗的靶点. 第一代NS3/4A抑制剂Telaprevir(Vertex公司)与Boceprevir(默沙东公司)于2011-05隆重上市. 这2种药物虽然也需与IFN及RBV联合使用, 但其SVR率已经有了明显的提高, 疗程明显缩短, GT-1 CHC应用12 wk SVR率提高至70%-80%[8]. 但是, 以第一代DAA为基础的混合制剂治疗CHC的治疗流程过于复杂, 价格昂贵且不良反应大, 以上种种因素制约了第一代蛋白酶抑制剂的应用.
2013-10, 强生公司的第二代丝氨酸蛋白酶抑制剂Simeprevir问世. 同年年底, 美国吉列德公司研发的NS5B核苷酸聚合酶抑制剂Sofosbuvir为代表的第二代DAA获得食品及药物管理局(Food and Drug Administration, FDA)批准紧随其后上市. NS5B是RNA依赖性的RNA聚合酶, 以NS5B为靶点的聚合酶抑制剂按结构分为核苷类和非核苷类2类, 这2类药物作用机制不同, 可以联合应用. Sofosbuvir是一种核苷类聚合酶抑制剂, 他对全基因型的HCV有效, 耐药屏障高, Sofosbuvir的出现首次使全口服免IFN治疗丙型肝炎成为现实. Lawitz等[9]发现, 对于初治的GT-1/4感染, 使用Sofosbuvir联合PEG-IFN及RBV治疗12 wk SVR可达到90%. 使用Sofosbuvir联合RBV治疗GT-2/3型丙型肝炎患者可分别获得接近100%及91%的SVR率. Lawitz[10]还发现, 即使是经治患者, 无论是否处于肝硬化状态, 使用Sofosbuvir联合PEG-IFN及RBV都能获得可喜的效果. 治疗12 wk后, GT-2型患者SVR12高达96%, GT-3型稍差, 也有83%. 从数据中可以看到, 丙型肝炎至此已经接近治愈. 虽然目前DAA发展迅速, 各种新型DAA或DAA复合制剂层出不穷, 但Sofosbuvir仍然是丙型肝炎治疗发展史上最为耀眼的明星. 由于其令人满意的有效性及易获得性, 目前Sofosbuvir联合RBV在大部分发展中地区仍是GT-2/3型患者的首选治疗方案.
2014-10-10, 吉利德公司的真正全口服药物Harvoni上市. Harvoni是Sofosbuvir和蛋白酶NS5A抑制剂Ledipasvir的混合制剂, 也是第二代DAAs. 他是第一个被FDA批准用于治疗GT-1型丙型肝炎感染且不需要联合用药的全口服抗丙型肝炎方案. 他既可以单剂使用, 也可以和其他口服制剂联合使用. Harvoni不仅使不良反应减少, 疗程也大大缩短. 临床研究[11]显示, GT-1患者接受Harvoni治疗8 wk或12 wk, 治愈率可达95%-99%, Ioannou等[12]报道, 即使是肝硬化的GT-1型患者使用Harvoni的SVR也达到了90.6%. 但关于Harvoni有效性的双盲实验暂缺.
2014-12-19, 艾伯维公司的全口服抗丙型肝炎复方制剂Viekira Pak获FDA批准上市. 该药物包括Ombitasvir、Paritaprevir、Ritonavir, 包括或不包括Dasabuvir, 即3D方案, 是继Harvoni后的第2种免IFN全口服制剂. 该混合制剂可以用于治疗GT-1型CHC患者, 也可用于治疗HIV/HCV-1混合感染患者和肝移植患者. JAMA[13]最新研究指出, 以Viekira Pak为基础治疗GT-1型初治、非肝硬化丙型肝炎12 wk, SVR12率可达90%-100%, 治疗GT-1型经治非肝硬化患者12 wk后的SVR12基本在96%以上. 可见, Viekira Pak的出现也许可以让丙型肝炎患者的治疗费用有所下降, 但疗效上的进步相较之前并不大.
2015-07, FDA批准施贵宝公司的全口服CHC药物Daclatasvir上市, 同时, Daclatasvir是欧盟批准的第一个NS5A抑制剂. Daclatasvir建议与Sofosbuvir联用, 对全基因型的CHC成年感染者均有效, 口服Daclatasvir联合Sofosbuvir在临床试验中的治愈率可达100%[14,15], 其中包括晚期肝病、GT-3型和既往使用DAA制剂治疗失败的难治性患者. 除此之外还有一些药物正在研发或临床试验中, 本文不作讨论.
DAA一直是丙型肝炎领域最大的热点. 他为丙型肝炎的治疗带来了可喜的成果. 但是随着DAA临床应用的不断扩大, 其安全性问题也随之凸显.
每个药物都有不良反应, DAA最常见的不良反应主要有皮疹、贫血、疲乏、瘙痒. 这些不良反应在药物试验中就已经显现, 在临床应用中也时有报道.
第一代DAA不良反应较大. Teleprevir最严重的不良反应为肾功能损害[16]及致命的皮肤损害. Falcão等[17]观察到一例应用Teleprevir、RBV及IFN后, 出现了严重的、全身性的红色痒疹, 伴颈淋巴结肿大、发热、嗜酸性粒细胞增多等症状, 停药并使用大剂量激素后好转. 应用Teleprevir的患者还会出现恶心、呕吐、痔疮、肛门或直肠刺激、疼痛等[18]. Teleprevir上市后, 自从人们发现他可能引起嗜酸性粒细胞增多症、Stevens-Johnson综合征、中毒性表皮坏死溶解症等皮肤问题后, 其销售额开始迅速下降. 同为第一代DAA的Boceprevir不良反应也较多, 他最严重的不良反应为贫血和中性粒细胞减少. 腹泻、抑郁、转氨酶升高、皮疹、牙龈炎、长QT间期、水肿、严重的呼吸困难、味觉障碍以及严重乏力也较常见[19,20]. Ilyas等[21]还观察到一例用Boceprevir疗程中眼压升高的案例.
第二代DAA相较于第一代不良反应有所减少. Simeprevir最常见的不良反应是高胆红素血症, 但无丙氨酸氨基转移酶(alanine aminotransferase, ALT)升高[22]. 除常见不良反应外, 服用Simeprevir的患者报道较多的不良反应有头痛、皮疹、失眠、尿失禁、肌痛及呼吸困难等[23]. Sofosbuvir常与其他药物合用. 当Sofosbuvir与RBV合用时, 常见的不良反应包括乏力和头痛; 当与PEG-IFN合用时, 常见的不良反应包括恶心、睡眠困难、严重抑郁以及红细胞计数减少[24]. 有报道[25]显示若Sofosbuvir与胺碘酮合用, 可能出现严重的缓慢型心律失常.
更新的第二代DAA不良反应相对较少. Daclatasvir在Ⅱ期临床试验中最常见的不良反应仅为腹泻、轻度头痛和疲乏. Ledipasvir主要与Sofosbuvir合用, 组成Harvoni合剂. 2015年有学者[26]报道, 一个60岁美国非裔CHC合并高血压、2型糖尿病女性使用Harvoni治疗后出现急性肾损伤, 这是第一例Harvoni(Ledipasvir+Sofosbuvir)导致急性肾损伤的案例. 另外, Baumann等[27]报道了一例应用Harvoni联合RBV治疗CHC患者治疗24 wk后诱发肺动脉高压最终导致右心衰死亡的案例. Harvoni的其他不良反应并无特异性, 如乏力、头痛、恶心、失眠等. Viekira Pak的不良反应与上述药物基本相同, 当不与RBV合用时, 不良反应将大大减少, 偶现诸如恶心、瘙痒及失眠等非特异性症状; ALT升高的患者人数较少, 但也有因为ALT升高而暂时中止治疗的案例.
某些DAA还具有肝毒性. Dyson等[28]报道了2例由于使用DAA导致的严重肝损伤的病例. 第1例病例为艾滋病及丙型肝炎(human immunodeficiency virus/hepatitis C virus, HIV/HCV)混合感染合并肝硬化失代偿期患者, 采用Sofosbuvir/Ledipasvir/RBV及抗逆转录病毒联合治疗方案, 在治疗后第15天, 血清胆红素从基线的91 μmol/L升高到273 μmol/L, 治疗后18 d胆红素升高到401 μmol/L. 停止DAA治疗后, 经肝活检证实为药物性肝损伤. 随后患者并发肺炎克雷伯菌感染, 38 d后死于多器官功能衰竭. 第2例病例为GT-3型肝硬化并高血压、甲状腺功能减退、多囊卵巢综合征和IgA肾病患者, 采用Sofosbuvir/Daclatasvir/RBV治疗方案, 治疗3 wk后, 病情明显恶化, 总胆红素一度高达313 μmol/L, 随后的肝活检显示为药物性肝损伤. 该患者停止了抗病毒治疗, 但病情继续恶化, 总胆红素最高达499 μmol/L. 37 d后该患者接受了肝移植后恢复良好. 目前也有少数其他报道证实[29]. 对于失代偿性肝病患者应用DAA如Viekira Pak和Technivie应格外慎重. 另外FDA[30]已发出警告, 对于Child-Pugh分级B级和C级的有基础肝脏疾病的患者, Paritaprevir、Ombitasvir、Dasabuvir、Ritonavir和RBV合用有可能导致急性肝损伤.
DDI指2种或2种以上的药物同时应用时所发生的药效变化, 即产生协同作用、叠加作用或拮抗作用. 当DAA与其他药物联合用药时, 一方面可能改变该联合用药的药物浓度, 一方面自身的血药浓度也会受影响. 这种双重作用可能增加副反应发生的可能性, 还可能导致其他不良事件的发生, 限制DAA的使用. 因此, DAA的DDI逐渐引起了人们的注意. 目前DAA药物间反应已见报道的有: 他汀类降脂药、地高辛等心血管药物、抑酸剂、抗逆转录病毒药物、利福平、抗癫痫药物及其他中枢神经系统药物、毒品及免疫抑制剂以及某些草药等. 目前认为, 大多数交互作用发生都与代谢(如细胞色素P450-3A4酶, CYP3A4), 或肝肠转运体如有机阴离子转运多肽(organic anion transporting polypeptide, OATP)及P-糖蛋白(P-glycoprotein , P-gp)相关. 少部分与BCRP转运体及葡萄糖醛酸转移酶(UDP glucuronosyltransferase, UGT)代谢相关. 不同DAA导致DDI的可能性不同. 一项大型队列研究显示, 复合制剂发生DDI的概率明显高于单药治疗; 单药中, Simeprevir与其他药物DDI发生概率最大; Sofosbuvir发生DDI的风险最低. 由于是P-gp和/或CYP3A4的酶底物及抑制剂, 3D方案最容易发生DDI, 其次是Daclatasvir, Simeprevir以及Ledipasvir[31].
药物可以通过肠细胞上的流出转运体如P-gp重新回到肠道内, 即P-gp可以控制药物的吸收. Sofosbuvir和Ombitasvir是P-gp的酶底物, Paritaprevir, Ritonavir, Dasabuvir, Ledipasvir, Daclatasvir及Simeprevir既是P-gp的酶底物也是其抑制剂. 当联用P-gp酶底物及P-gp抑制剂时, 会阻碍P-gp的作用, 从而导致底物的吸收增加. 当联用P-gp酶底物及P-gp诱导剂时, 底物浓度会减少[32]. 地高辛是心血管常用药物, 是P-gp底物, 因此当与Simeprevir、Daclatasvir、Ledipasvir或3D方案联用时, 地高辛的曲线下面积将分别增加39%、27%、34%及36%[33], 因此当需合并使用地高辛时, 药物应从小剂量用起, 并随时检测其血药浓度. 除此之外, 胺碘酮不应与Daclatasvir、Sofosbuvir、Sofosbuvir/Ledipasvir或3D方案合用, 其他心血管系统用药也应谨慎. 已经有很多案例[34]报道Sofosbuvir与胺碘酮合用, 出现了严重的心动过缓及传导障碍. 利福平是P-gp诱导剂, 当与Ledipasvir/Sofosbuvir等P-gp抑制剂合用时, 会导致Sofosbuvir和Ledipasvir曲线下面积下降.
OATP1B1是肝细胞上的流入转运体. 某些降脂的他汀类药物如普伐他汀、瑞舒伐他汀均通过此转运体代谢. Simeprevir、Dclatasvir、Ledipasvir、Paritaprevir及Ritonavir都是OATP1B1转运体的基质及抑制剂. 当瑞舒伐他汀与Simeprevir或Dclatasvir合用时, 瑞舒伐他汀的曲线下面积会增加至之前的1.5-3倍, 因此当与以上药物合用时, 他汀类药物应减量.
乳腺癌耐药蛋白(breast cancer resistance protein, BCRP)限制肠道吸收低渗性基质药物及调节胆汁分泌的药物和代谢产物. 柳氮磺胺吡啶即BCRP的基质药物, 拉帕替尼是BCRP的抑制剂; Sofosbuvir、Ombitasvir和Simeprevir是BCRP的基质药物, 但目前并没有柳氮磺胺吡啶、拉帕替尼与任何DAA合用的报道, 且此转运体常与其他转运体协同工作, 因此彼此之间交叉、覆盖, 资料较少.
人体中大部分生物代谢都包括细胞色素P450家族的同工酶, 尤其是CYP3A4, Budha等[35]发现, 有效血药浓度较窄的药物如免疫抑制剂比宽的药物更容易引起DDI. Tischer等[36]发现, 肝脏移植术后合并GT-1型的患者使用免疫抑制剂的同时, 使用Boceprevir和Telaprevir为基础的抗病毒方案进行治疗, 虽可使SVR明显提高, 但不良反应例如贫血(100%)、感染(30%)、肾毒性(20%)的发生概率同时提高. Coilly等[37]也发现, 蛋白酶抑制剂合并PEG-IFN/RBV治疗肝移植术后患者, 其SVR明显提高, 且重病患者的治疗效果更好. 同时, 试验还观察到, 贫血发生的概率明显提高, DDI发生的概率也较高. HIV/HCV混合感染患者需要同时使用多种药物. 核苷类逆转录酶抑制剂与DAA的DDI较少. 3D方案是强CYP3A4抑制剂, 全部的HIV蛋白酶抑制剂均不应与3D方案合用[38]. 当Atazanavir、Darunavir及Rilpivirine与3D方案合用时, 需特别关注患者各项指标. Sofosbuvir与Ledipasvir并不通过CYP3A4代谢, 因此其混合制剂与大部分HIV用药合用时并不会产生DDI, 这也为HIV/HCV混合感染患者抗HIV的同时抗HCV治疗提供了可行的方案[39]. Simeprevir是CYP3A4的底物, 同时是中度抑制剂, 当与某些镇静安眠类药物如咪达唑仑合用, 会使咪达唑仑曲线下面积增加. Patel等[40]发现, 使用Sofosbuvir治疗单纯HCV感染发生DDI概率小于使用Simeprevir治疗. 抗抑郁和抗焦虑药物主要与Simeprevir及3D方案有潜在的药物交互作用[41]. 大部分毒品都会和3D方案有潜在的相互作用, 其中大麻、可卡因、羟基丁酸、氯胺酮和苯环己哌啶都会与3D方案有潜在的交互作用.
但并不是所有的DDI都与理论上相同. 如Simeprevir与环孢霉素合用时, 将环孢霉素的曲线下面积提高了而不是降低[42]. 这可能是因为药物代谢的通路彼此重叠, 彼此干扰, 更多的解释有待探索和发掘. 因此, 在给需要合并用药的患者制定治疗方案时, 应充分评估DDI, 任何合并用药都不应被忽视, 都应密切监视其DDI的发生. 在治疗期间及治疗后都应密切监测合并用药的疗效和毒性, 注重临床用药血药浓度的检测. 如果可能的话, HCV治疗期间应停止应用已知有严重相互作用的合并用药, 或者转换为具有较少相互作用或没有相互作用的合并用药, 以减少副反应的发生、药物有效血药浓度的变动或治疗失败的发生.
特殊人群往往意味着特殊的生理、病理状态, 他们使用DAA的安全性更应该特别地关注.
目前3岁及以上儿童CHC的标准疗法为PEG-IFNα-2a/2b+RBV, 临床效果优于成人, 但GT-1/4患者的SVR同成人一样较低. 儿童HCV感染的DAA抗病毒治疗尚有争议. DAA在儿童中的应用困难更多, 例如除了不良反应及DDI外, Telaprevir和Boceprevir还必须与高脂肪食物同服, 且需服用3次/d. 种种不利因素决定了儿童患者很难使用Telaprevir和Boceprevir, 尤其是二者与PEG-IFN+RBV联用时[43], 其他DAA也是一样. 目前18岁以下儿童临床使用DAA的相关数据尚未见报道[44]. 儿童患者应用DAA治疗CHC还有很长的路要走.
与儿童患者类似, 孕妇及哺乳期妇女使用DAA的数据也尚未见报道. 虽已有动物实验证实, Boceprevir和Telaprevir均不会对胚胎造成任何影响, 但由于Boceprevir和Telaprevir需与PEG-IFN及RBV组成三联合剂, 而RBV已被证实有不孕、致畸的作用, 因此Boceprevir和Telaprevir均应避免对孕妇使用. 不仅如此, 服药期间及服药后至少半年, 育龄期妇女及其性伴侣都应做好充分的避孕措施[45]. Sofosbuvir作为应用最广的第二代DAA, 其孕期安全性受到了广泛地关注. 但在孕妇特殊的生理状态下, Sofosbuvir的血药浓度是否会变化, 是否能通过胎盘屏障等孕期用药相关问题均缺少相关数据阐明. 尽管如此, 指南指出, 单独使用Sofosbuvir时, 其FDA孕期用药安全等级为B级, 也就是说Sofosbuvir是相对安全的. 因此当Sofosbuvir不与RBV合用时, 他可以成为感染HCV孕妇的抗病毒选择之一. 与Sofosbuvir不同, Simeprevir是不适合孕期妇女及哺乳期妇女使用的. 已有动物实验证实, 当给予孕鼠4倍标准剂量的Simeprevir时, 有流产和致畸风险; 另外Simeprevir还有通过乳汁排泄、血药浓度受肝脏状况影响大、药物间作用多等缺点, Simeprevir的FDA孕期用药安全等级为C级. Daclatasvir在4-16倍常规剂量时, 在动物实验中被证实有胚胎毒性和致畸作用, 其FDA孕期用药安全等级尚未给出. Ledipasvir药代动力学参数好, 对于非孕动物, Ledipasvir有减少黄体数量及减少着床位置的作用, 但对于孕期动物仅观察到体质量改变. Ledipasvir不与RBV合用时, 其FDA孕期用药安全等级为B级. Ledipasvir和Sofosbuvir对于孕期妇女都相对安全, 因此当与Sofosbuvir合用时(即Harvoni), 是目前感染HCV孕妇更好的选择[46]. 目前尚无应用DAA阻止母婴垂直传播的统一方案[47].
60岁以上的老年人整体器官机能较差, 合并症多, 肝脏基础状态较差且耐受性差, 出现DDI的风险更高, 影响也更大[48]. 但已有数据显示, 使用DAA进行抗病毒治疗的效果与年轻人及中年人并无差异. 虽然寿命年和质量调整寿命年随着年龄的增大而增幅减低, 但即使是处于肝纤维化期的老年丙型肝炎患者, 治疗后质量调整寿命年也比未治疗的高[49].
合并肾损害患者对含RBV的治疗方案耐受性差, 即使减量, 仍无法耐受. 合并肾损害的患者首选的是无Interferon和无RBV的DAA治疗方案, 药物选择与单纯CHC患者相同. 如果患者的肾小球滤过率(glomerular filtration rate, GFR)>60 mL/min, DAA无需调整剂量; 如果患者的GFR<30 mL/min或已经处于终末期肾病状态, 一般不能应用DAA[50]. 但也有学者[51]认为, Grazoprevir联合Elbasvir可以应用于GFR<30 mL/min患者的治疗. 终末期肾脏病状态的DAA治疗尚有争议.
乙、丙型肝炎病毒(hepatitis B virus/hepatitis C virus, HBV/HCV)混合感染临床较为常见. 有研究表明, 当患者同时感染HBV及HCV时, HCV常常占主导地位, HBV的复制被抑制, 表面抗原的呈现也被抑制. 此时如仅使用DAA, 会导致乙型病毒性肝炎加重甚至肝衰竭. Takayama等[52]报道了一项案例, 一位HBV/HCV混合感染患者在使用Daclatasvir及Asunaprevir第15天, ALT升高至237 IU/mL, HBV-DNA由基线的2.5 log copies/mL升高至7 log copies/mL, HBV再激活. 第50天, Takayama用Entecavir控制住了HBV的再激活. 2016-10, FDA已经发出黑框警告: HBV/HCV共感染患者采用DAA方案进行抗病毒治疗时, 需警惕HBV的再激活. 采用DAA治疗前应进行HBV筛查, 治疗期间及治疗后的随访应密切监测HBV的爆发.
由于感染途径类似, HIV/HCV混合感染越来越常见, 因此HIV/HCV混合感染患者的治疗问题一直是目前学者关注的焦点. 标准IFN治疗方案仅能获得30%左右的HCV清除率. 目前, 有越来越多的HIV/HCV混合感染患者开始使用DAA进行抗HCV的治疗[53]. 可以看到, 使用DAA治疗与标准IFN方案相比SVR明显提高, 但HIV-HCV混合感染患者的DDI问题也应引起足够的重视.
除上述问题外, DAA仍有其他潜在问题.
个体化治疗指出, 现代医学应根据每一位患者的特点调整医学治疗措施, 即根据患者的特定疾病易感性不同、所患疾病生物学基础和预后不同, 以及对某种特定治疗的反应不同, 而将患者分为不同亚群, 从而给予不同的治疗方案. DAA上市仅有几年, 还有更多的DAA尚在研发阶段, 其个体和群体的量效曲线和毒量曲线尚未建立, 无法给予每位患者精准化、个体化的治疗.
有数据显示, 口服DAA治疗HCV感染的肝硬化患者, 虽没有升高患者发生肝细胞癌的风险, 但是这些药物会导致现有的或既往未发现的肝细胞癌恶化或更加难以治疗. Alberti等[54]展开了一项大型前瞻性研究, 研究结果显示, 整体肝癌发生率1.64%, 18 mo随访期间累计发病率稳定增加2.5%. 因此, 接受DAA治疗的晚期肝病患者应当常规检测肝癌.
另有数项个例报道指出, 肝癌治疗后进行DAA再治疗, 肝癌复发率高. Reig等[55]报道, 2014-2015年, 经过筛选, 有58例已经确诊肝癌的患者, 接受手术、射频消融治疗或肝动脉栓塞化疗后, 经影像学证实肝脏病变已经消失. 口服DAA治疗平均半年后, 其中27.6%的患者经影像学证实肝癌复发, 且HCV清除率越高, 肝癌复发率越高. 目前类似的结果已有数例报道, 但结果的真实性还需更大规模的试验证实.
DAA的价格及其获取渠道也是阻碍其临床广泛应用的重大问题. 在美国, 28片/瓶装索非布韦片的批发商采购成本费用为2.8万美元, 即每片1000美元(约6000多人民币), 大多数患者需要治疗12 wk, 一个疗程总费用就高达8.4万美元. 近期Chen等[56]一项调查模型显示, 对于经治患者, 除了中国东部地区外(64%), 其余地区支付得起Harvoni的患者不超过50%. 高昂的治疗费用对于绝大多数人来说都是难以承受的. 另外DAA的获取渠道也是阻碍DAA在肝炎患者中应用的障碍之一. 以中国为例, 患者只能自行去印度或其他渠道购买DAA, 过高的门槛让许多患者望而却步, 综合经济原因, DAA的使用受到了极大的限制.
另外, DAA与合并症合并用药问题的探讨并不系统, 除了合并症用药, 具有各国特色的合并用药例如中药是否会带来更多的不良反应及DDI? 除此之外, DAA对肝硬化、肝癌患者的治疗方法尚不清晰; 使用DAA时保肝方案有待商榷, 诸如此类种种问题都亟待解决.
DAA从上市至今仅5年多时间, 就已经为慢性丙型病毒性肝炎的治疗带来了翻天覆地的变化, 他的高有效性得到了肝病医生的确认, 使得治愈丙型肝炎成为可能, 但安全性的问题显然应该引起注意. 本文的目的就在于此. 除了DAA临床试验中已经发现不良反应外, 如急性肾损伤、高胆红素血症、严重皮肤反应、肝功能损害等不良事件也相继报道. 我们推测, 随着DAA的广泛使用及时间的推进, 未来有意想不到的不良事件发生应该是大概率事件. DAA与其他药物同时应用时的交互作用问题, 如今已经得到大家关注, 但与HCV感染的合并症并不限于这些比较常见的HBV、HIV、脂肪肝、酒精性肝炎、自身免疫性肝炎等, 也就是说, DAA可能会与更多药物产生DDI. 国内医生比较喜欢使用中药、草药用于保护肝脏的治疗, 虽目前尚无相关文献报道. 但DAA在中国上市后, 与不同中药的联合使用中的交互问题, 估计很难提前预判, 只有在临床应用中密切观察, 及时发现, 也许才是降低用药后DDI的良策.
此外, 文中有关DAA在特殊人群中应用的资料不多, 有待后续观察发现. 但应该再次强调HBV/HCV患者单纯使用DAA治疗患者不能获益, 当同时治疗时, 应格外注意监测病毒的早期再活化, 从而阻止乙型肝炎爆发及肝衰竭的发生.
除此之外, 患者停药后长期获益还有待观察: 如是否有病毒变异的出现以及治疗后获得SVR后长期有效性和安全性问题; 还有对于降低肝硬化甚至肝癌的发生率还缺乏相关数据的分析. 但不管怎样, DAA的发现和使用, 再次证明了人类可以战胜疾病的高超智慧, 人们的收获和自信良多. 只是在高兴之余, 更应注意用药的安全性, 最为合理、恰当的使用DAA才能是人们获取最大利益的上策.
既往治疗慢性丙型肝炎(chronic hepatitis C, CHC)的标准方案是干扰素联合利巴韦林方案. 自2011年第一代直接抗病毒药物(direct antiviral agent, DAA)问世来, 由于其高有效性及全基因覆盖性, 迅速在全球部分地区广泛使用. 然而近年来时有不安全事件报道, 其安全性问题逐渐引起了人们的注意.
临床医生在使用DAA治疗CHC时, 应注意密切观察DAA应用中的不良反应及药物间相互作用问题(drug-drug interaction, DDI), 应及时处置并尽力预防.
2015-03, FDA警告: 胺碘酮与丙型肝炎抗病毒药物合用增加严重心动过缓风险. 2015-10, FDA警告: Viekira和Technivie可能增加严重肝损伤风险. 2016-10, FDA黑框警告: 乙、丙型肝炎病毒共感染患者, 采用DAAs方案进行丙型肝炎抗病毒治疗时, 需警惕乙型肝炎病毒的再激活.
本文选题新颖, 临床结合紧密. 目前尚无全面叙述直接抗病毒安全性的中、英文论著.
DAA已经在全球部分地区广泛使用, 不久将在中国上市. 本文通过搜集自DAA治疗CHC患者以来所发生的不良事件, 尽可能予以全面展示, 以期为广大临床医生就DAA临床应用中相关的安全性问题提供重要的资讯, 从而更有效、更安全的使用DAA.
药物间相互作用问题(DDI): 指2种或2种以上的药物同时应用时所发生的药效变化, 即产生协同作用、叠加作用或拮抗作用.
范学工, 教授, 中南大学湘雅医院感染病科; 金博, 主任医师, 解放军第309医院(总参谋部总医院)消化内科; 汤静, 副主任药师, 上海交通大学附属第一人民医院药学部
DAA的抗HCV作用及效果令人鼓舞, 也是近年来丙型肝炎领域最重要的进展. 随着DAA应用越来越广泛, 以及将在中国上市, 其所可能带来的药物不良反应有的已在临床显现, 有的应该引起大家的高度关注, 非常重要. 本文对这一问题进行了较为详尽的介绍, 所收集、分析资料较为完善, 具有极好的临床指导意义.
手稿来源: 邀请约稿
学科分类: 胃肠病学和肝病学
手稿来源地: 陕西省
同行评议报告分类
A级 (优秀): 0
B级 (非常好): B, B
C级 (良好): C
D级 (一般): 0
E级 (差): 0
编辑: 马亚娟 电编:胡珊
| 1. | Tang L, Marcell L, Kottilil S. Systemic manifestations of hepatitis C infection. Infect Agent Cancer. 2016;11:29. [PubMed] [DOI] |
| 2. | Manns MP, McHutchison JG, Gordon SC, Rustgi VK, Shiffman M, Reindollar R, Goodman ZD, Koury K, Ling M, Albrecht JK. Peginterferon alfa-2b plus ribavirin compared with interferon alfa-2b plus ribavirin for initial treatment of chronic hepatitis C: a randomised trial. Lancet. 2001;358:958-965. [PubMed] [DOI] |
| 3. | Zopf S, Kremer AE, Neurath MF, Siebler J. Advances in hepatitis C therapy: What is the current state - what come's next? World J Hepatol. 2016;8:139-147. [PubMed] [DOI] |
| 4. | McHutchison JG, Lawitz EJ, Shiffman ML, Muir AJ, Galler GW, McCone J, Nyberg LM, Lee WM, Ghalib RH, Schiff ER. Peginterferon alfa-2b or alfa-2a with ribavirin for treatment of hepatitis C infection. N Engl J Med. 2009;361:580-593. [PubMed] [DOI] |
| 5. | Westbrook RH, Dusheiko G. Natural history of hepatitis C. J Hepatol. 2014;61:S58-S68. [PubMed] [DOI] |
| 6. | Tamori A, Enomoto M, Kawada N. Recent Advances in Antiviral Therapy for Chronic Hepatitis C. Mediators Inflamm. 2016;2016:1-11. [PubMed] [DOI] |
| 7. | Elbaz T, El-Kassas M, Esmat G. New era for management of chronic hepatitis C virus using direct antiviral agents: A review. J Adv Res. 2015;6:301-310. [PubMed] [DOI] |
| 8. | Wu S, Kanda T, Nakamoto S, Imazeki F, Yokosuka O. Hepatitis C virus protease inhibitor-resistance mutations: our experience and review. World J Gastroenterol. 2013;19:8940-8948. [PubMed] [DOI] |
| 9. | Lawitz E, Mangia A, Wyles D, Rodriguez-Torres M, Hassanein T, Gordon SC, Schultz M, Davis MN, Kayali Z, Reddy KR. Sofosbuvir for previously untreated chronic hepatitis C infection. N Engl J Med. 2013;368:1878-1887. [PubMed] [DOI] |
| 10. | Lawitz E, Poordad F, Brainard DM, Hyland RH, An D, Dvory-Sobol H, Symonds WT, McHutchison JG, Membreno FE. Sofosbuvir with peginterferon-ribavirin for 12 weeks in previously treated patients with hepatitis C genotype 2 or 3 and cirrhosis. Hepatology. 2015;61:769-775. [PubMed] [DOI] |
| 11. | Wilder JM, Jeffers LJ, Ravendhran N, Shiffman ML, Poulos J, Sulkowski MS, Gitlin N, Workowski K, Zhu Y, Yang JC. Safety and efficacy of ledipasvir-sofosbuvir in black patients with hepatitis C virus infection: A retrospective analysis of phase 3 data. Hepatology. 2016;63:437-444. [PubMed] [DOI] |
| 12. | Ioannou GN, Beste LA, Chang MF, Green PK, Lowy E, Tsui JI, Su F, Berry K. Effectiveness of Sofosbuvir, Ledipasvir/Sofosbuvir, or Paritaprevir/Ritonavir/Ombitasvir and Dasabuvir Regimens for Treatment of Patients With Hepatitis C in the Veterans Affairs National Health Care System. Gastroenterology. 2016;151:457-471.e5. [PubMed] [DOI] |
| 14. | Keating GM. Daclatasvir: A Review in Chronic Hepatitis C. Drugs. 2016;76:1381-1391. [PubMed] [DOI] |
| 15. | Nelson DR, Cooper JN, Lalezari JP, Lawitz E, Pockros PJ, Gitlin N, Freilich BF, Younes ZH, Harlan W, Ghalib R. All-oral 12-week treatment with daclatasvir plus sofosbuvir in patients with hepatitis C virus genotype 3 infection: ALLY-3 phase III study. Hepatology. 2015;61:1127-1135. [PubMed] [DOI] |
| 16. | Kohjima M, Kurokawa M, Enjoji M, Yoshimoto T, Nakamura T, Ohashi T, Fukuizumi K, Harada N, Murata Y, Matsunaga K. Analysis of renal function during telaprevir-based triple therapy for chronic hepatitis C. Exp Ther Med. 2016;11:1781-1787. [PubMed] [DOI] |
| 17. | Falcão EM, Trope BM, Godinho MM, Carneiro LH, de Araujo-Neto JM, Nogueira CA, Ramos-E-Silva M. Cutaneous Eruption due to Telaprevir. Case Rep Dermatol. 2015;7:253-262. [PubMed] [DOI] |
| 18. | Kumada H, Suzuki F, Kamiya N, Orihashi M, Nakayasu Y, Yamada I. Efficacy and safety of telaprevir with pegylated interferon α-2a and ribavirin in Japanese patients. Hepatol Res. 2016; Apr 7. [Epub ahead of print]. [PubMed] [DOI] |
| 19. | Bakulin I, Pasechnikov V, Varlamicheva A, Sannikova I. NS3 protease inhibitors for treatment of chronic hepatitis C: Efficacy and safety. World J Hepatol. 2014;6:326-339. [PubMed] [DOI] |
| 20. | Ferenci P, Caruntu FA, Lengyel G, Messinger D, Bakalos G, Flisiak R. Boceprevir Plus Peginterferon Alfa-2a/Ribavirin in Treatment-Naïve Hepatitis C Virus Genotype 1 Patients: International Phase IIIb/IV TriCo Trial. Infect Dis Ther. 2016;5:113-124. [PubMed] [DOI] |
| 21. | Ilyas F, Singh H, Anand N, Ahmed II. Intraocular pressure rise in the course of peginterferon alpha-2a, ribavirin, and boceprevir therapy for hepatitis C. Can J Ophthalmol. 2015;50:e112-e114. [PubMed] [DOI] |
| 22. | Lenz O, Verbinnen T, Fevery B, Tambuyzer L, Vijgen L, Peeters M, Buelens A, Ceulemans H, Beumont M, Picchio G. Virology analyses of HCV isolates from genotype 1-infected patients treated with simeprevir plus peginterferon/ribavirin in Phase IIb/III studies. J Hepatol. 2015;62:1008-1014. [PubMed] [DOI] |
| 23. | Asselah T, Moreno C, Sarrazin C, Gschwantler M, Foster GR, Craxí A, Buggisch P, Ryan R, Lenz O, Scott J. An Open-Label Trial of 12-Week Simeprevir plus Peginterferon/Ribavirin (PR) in Treatment-Naïve Patients with Hepatitis C Virus (HCV) Genotype 1 (GT1). PLoS One. 2016;11:e0158526. [PubMed] [DOI] |
| 24. | Abraham GM, Spooner LM. Sofosbuvir in the treatment of chronic hepatitis C: new dog, new tricks. Clin Infect Dis. 2014;59:411-415. [PubMed] [DOI] |
| 25. | Lagrutta A, Zeng H, Imredy J, Balasubramanian B, Dech S, Lis E, Wang J, Zhai J, DeGeorge J, Sannajust F. Interaction between amiodarone and hepatitis-C virus nucleotide inhibitors in human induced pluripotent stem cell-derived cardiomyocytes and HEK-293 Cav1.2 over-expressing cells. Toxicol Appl Pharmacol. 2016;308:66-76. [PubMed] [DOI] |
| 26. | Wanchoo R, Thakkar J, Schwartz D, Jhaveri KD. Harvoni (Ledipasvir With Sofosbuvir)-Induced Renal Injury. Am J Gastroenterol. 2016;111:148-149. [PubMed] [DOI] |
| 27. | Baumann L, Haen S, Berg C, Artunc F, Riessen R, Spengler W, Fend F, Haap M. An unexpected cause of pulmonary hypertension. Dtsch Med Wochenschr. 2016;141:1102. [PubMed] [DOI] |
| 28. | Dyson JK, Hutchinson J, Harrison L, Rotimi O, Tiniakos D, Foster GR, Aldersley MA, McPherson S. Liver toxicity associated with sofosbuvir, an NS5A inhibitor and ribavirin use. J Hepatol. 2016;64:234-238. [PubMed] [DOI] |
| 29. | Marchan-Lopez A, Dominguez-Dominguez L, Kessler-Saiz P, Jarrin-Estupiñan ME. Liver failure in human immunodeficiency virus - Hepatitis C virus coinfection treated with sofosbuvir, ledipasvir and antiretroviral therapy. J Hepatol. 2016;64:752-753. [PubMed] [DOI] |
| 30. | FDA Drug Safety Communication. FDA warns of serious liver injury risk with hepatitis C treatments Viekira Pak and Technivie. 2015; Available from: http://www.fda.gov/Drugs/DrugSafety/ucm468634.htm. |
| 31. | Höner Zu Siederdissen C, Maasoumy B, Marra F, Deterding K, Port K, Manns MP, Cornberg M, Back D, Wedemeyer H. Drug-Drug Interactions With Novel All Oral Interferon-Free Antiviral Agents in a Large Real-World Cohort. Clin Infect Dis. 2016;62:561-567. [PubMed] [DOI] |
| 32. | Talavera Pons S, Boyer A, Lamblin G, Chennell P, Châtenet FT, Nicolas C, Sautou V, Abergel A. Managing drug-drug interactions with new direct-acting antiviral agents in chronic hepatitis C. Br J Clin Pharmacol. 2017;83:269-293. [PubMed] [DOI] |
| 33. | Menon RM, Badri PS, Wang T, Polepally AR, Zha J, Khatri A, Wang H, Hu B, Coakley EP, Podsadecki TJ. Drug-drug interaction profile of the all-oral anti-hepatitis C virus regimen of paritaprevir/ritonavir, ombitasvir, and dasabuvir. J Hepatol. 2015;63:20-29. [PubMed] [DOI] |
| 34. | Brainard DM, McHutchison JG. Bradyarrhythmias Associated with Sofosbuvir Treatment. N Engl J Med. 2015;373:1888. [PubMed] [DOI] |
| 35. | Budha NR, Ji T, Musib L, Eppler S, Dresser M, Chen Y, Jin JY. Evaluation of Cytochrome P450 3A4-Mediated Drug-Drug Interaction Potential for Cobimetinib Using Physiologically Based Pharmacokinetic Modeling and Simulation. Clin Pharmacokinet. 2016;55:1435-1445. [PubMed] [DOI] |
| 36. | Tischer S, Fontana RJ. Drug-drug interactions with oral anti-HCV agents and idiosyncratic hepatotoxicity in the liver transplant setting. J Hepatol. 2014;60:872-884. [PubMed] [DOI] |
| 37. | Coilly A, Roche B, Dumortier J, Leroy V, Botta-Fridlund D, Radenne S, Pageaux GP, Si-Ahmed SN, Guillaud O, Antonini TM. Safety and efficacy of protease inhibitors to treat hepatitis C after liver transplantation: a multicenter experience. J Hepatol. 2014;60:78-86. [PubMed] [DOI] |
| 38. | Khatri A, Wang T, Wang H, Podsadecki TJ, Trinh R, Awni WM, Dutta S, Menon RM. Drug-Drug Interactions of the Direct Acting Antiviral Regimen of ABT-450/r, Ombitasvir and Dasabuvir with HIV Protease Inhibitors [abstract V-484] [Abstract presented at the 54th Interscience Conference on Antimicrobial Agents and Chemotherapy (ICAAC)]. Washington, DC. 2014;. |
| 39. | El-Sherif O, Khoo S, Solas C. Key drug-drug interactions with direct-acting antiviral in HIV-HCV coinfection. Curr Opin HIV AIDS. 2015;10:348-354. [PubMed] [DOI] |
| 40. | Patel N, Nasiri M, Koroglu A, Bliss S, Davis M, McNutt LA, Miller C. A Cross-Sectional Study Comparing the Frequency of Drug Interactions After Adding Simeprevir- or Sofosbuvir-Containing Therapy to Medication Profiles of Hepatitis C Monoinfected Patients. Infect Dis Ther. 2015; Jan 28. [Epub ahead of print]. [PubMed] [DOI] |
| 41. | Rowan PJ, Bhulani N. Psychosocial assessment and monitoring in the new era of non-interferon-alpha hepatitis C virus treatments. World J Hepatol. 2015;7:2209-2213. [PubMed] [DOI] |
| 42. | Ouwerkerk-Mahadevan S, Snoeys J, Peeters M, Beumont-Mauviel M, Simion A. Drug-Drug Interactions with the NS3/4A Protease Inhibitor Simeprevir. Clin Pharmacokinet. 2016;55:197-208. [PubMed] [DOI] |
| 43. | Ohmer S, Honegger J. New prospects for the treatment and prevention of hepatitis C in children. Curr Opin Pediatr. 2016;28:93-100. [PubMed] [DOI] |
| 44. | Mohan N, González-Peralta RP, Fujisawa T, Chang MH, Heller S, Jara P, Kelly D, Mieli-Vergani G, Shah U, Murray KF. Chronic hepatitis C virus infection in children. J Pediatr Gastroenterol Nutr. 2010;50:123-131. [PubMed] [DOI] |
| 45. | European Association for Study of Liver. EASL Recommendations on Treatment of Hepatitis C 2015. J Hepatol. 2015;63:199-236. [PubMed] [DOI] |
| 46. | Spera AM, Eldin TK, Tosone G, Orlando R. Antiviral therapy for hepatitis C: Has anything changed for pregnant/lactating women? World J Hepatol. 2016;8:557-565. [PubMed] [DOI] |
| 47. | Kanninen TT, Dieterich D, Asciutti S. HCV vertical transmission in pregnancy: New horizons in the era of DAAs. Hepatology. 2015;62:1656-1658. [PubMed] [DOI] |
| 48. | Vermehren J, Peiffer KH, Welsch C, Grammatikos G, Welker MW, Weiler N, Zeuzem S, Welzel TM, Sarrazin C. The efficacy and safety of direct acting antiviral treatment and clinical significance of drug-drug interactions in elderly patients with chronic hepatitis C virus infection. Aliment Pharmacol Ther. 2016;44:856-865. [PubMed] [DOI] |
| 49. | Maor Y, Malnick SD, Melzer E, Leshno M. Treatment of Chronic Hepatitis C in the Aged - Does It Impact Life Expectancy? A Decision Analysis. PLoS One. 2016;11:e0157832. [PubMed] [DOI] |
| 50. | Bhamidimarri KR, Martin P. Finally, safe and effective treatment options for hepatitis C in hemodialysis patients. J Hepatol. 2016;65:7-10. [PubMed] [DOI] |
| 51. | Smolders EJ, de Kanter CT, van Hoek B, Arends JE, Drenth JP, Burger DM. Pharmacokinetics, Efficacy, and Safety of Hepatitis C Virus Drugs in Patients with Liver and/or Renal Impairment. Drug Saf. 2016;39:589-611. [PubMed] [DOI] |
| 52. | Takayama H, Sato T, Ikeda F, Fujiki S. Reactivation of hepatitis B virus during interferon-free therapy with daclatasvir and asunaprevir in patient with hepatitis B virus/hepatitis C virus co-infection. Hepatol Res. 2016;46:489-491. [PubMed] [DOI] |
| 53. | Cotte L, Pugliese P, Valantin MA, Cuzin L, Billaud E, Duvivier C, Naqvi A, Cheret A, Rey D, Pradat P. Hepatitis C treatment initiation in HIV-HCV coinfected patients. BMC Infect Dis. 2016;16:345. [PubMed] [DOI] |
| 54. | 2016 Hepatology referees (volumes 63 and 64). Hepatology. 2016;64:2280-2285. [PubMed] [DOI] |