修回日期: 2017-01-23
接受日期: 2017-02-13
在线出版日期: 2017-03-08
分析慢性乙型肝炎(chronic hepatitis B, CHB)患者在乙型肝炎病毒(hepatitis B virus, HBV)感染免疫耐受和活动状态的临床和病理学差别.
选择102例CHB免疫耐受期患者组成免疫耐受组, 215例CHB免疫清除期或再活动期患者组成免疫活动组, 分析两组间肝组织内乙型肝炎病毒表面抗原(hepatitis B surface antigen, HBsAg)和乙型肝炎核心抗原(hepatitis B core antigen, HBcAg)的表达、性别、谷丙转氨酶、血清HBV DNA载量、肝脏炎症活动度分级(G)和纤维化分期(S)的差异.
免疫耐受组的HBsAg胞膜表达强度低于免疫活动组(P = 0.037), 而肝组织内HBcAg表达强度、HBcAg胞核表达强度显著高于免疫活动组(P = 0.00). 仅在免疫活动组, 肝组织内HBsAg表达强度与HBV DNA存在正相关性(P = 0.019), 肝组织内HBcAg表达强度、HBcAg胞浆和胞核表达强度与HBV DNA均存在正相关性(均P<0.05); 肝组织内的HBcAg表达强度和HBcAg胞核表达强度与G、S存在负相关性(均P<0.05). 仅在免疫耐受组, 肝组织内的HBsAg胞浆表达强度与G、S存在正相关性(P = 0.016和P = 0.003).
肝组织内的HBsAg胞膜表达强度与CHB免疫活动程度呈正相关. 肝细胞胞浆内表达的HBsAg有可能系免疫耐受状态机体攻击的靶抗原. 肝细胞核内表达的HBcAg即是CHB病毒复制, 又是免疫耐受状态的打破进展至免疫活动状态的关键, 也是肝组织炎症活跃和纤维化进展的关键.
核心提要: 乙型肝炎病毒感染的划分为4个期: 免疫耐受期、免疫清除期、非活动或低(非)复制期和再活动期. 本文研究慢性乙型肝炎患者免疫耐受和活动状态的临床和病理学差别, 探讨免疫耐受状态打破进展至免疫活动状态的机制.
引文著录: 吴家箴, 黄仁刚, 杨兴祥. 慢性乙型肝炎患者免疫耐受和活动状态肝组织内HBsAg和HBcAg表达差异. 世界华人消化杂志 2017; 25(7): 620-626
Revised: January 23, 2017
Accepted: February 13, 2017
Published online: March 8, 2017
To address the clinical and pathological differences between chronic hepatitis B (CHB) patients with immune tolerance vs immune activity for hepatitis B virus (HBV).
One hundred and two patients in CHB immune tolerance phase were assigned to the immune tolerance group, and 215 patients in CHB immune clearance or reactivation phase were assigned to the immune activity group. The two groups were compared for differences in hepatitis B surface antigen (HBsAg) and hepatitis B core antigen (HBcAg) expression in liver tissues, gender, alanine transaminase, serum HBV DNA load, liver inflammatory activity grade, and fibrosis stage.
Membrane HBsAg expression intensity in liver tissues was lower in the immune tolerance group than in the immune activity group (P = 0.037). HBcAg expression intensity in liver tissues and nuclear HBcAg expression intensity were significantly higher in the immune tolerance group than in the immune activity group (P = 0.00). In the immune activity group, HBsAg expression intensity in liver tissues was positively correlated with HBV DNA load (P = 0.019), and HBcAg expression intensity in liver tissues, plasma HBcAg expression intensity and nuclear HBcAg expression intensity were all positively correlated with HBV DNA load (P < 0.05 for all), while HBcAg expression intensity in liver tissues and nuclear HBcAg expression intensity were negatively correlated with liver inflammatory activity grade and fibrosis stage (P < 0.05 for both). In the immune tolerance group, cytoplasmic HBsAg expression intensity in liver tissues was positively correlated with liver inflammatory activity grade and fibrosis stage (P = 0.016 and P = 0.003, respectively).
Membrane HBsAg expression intensity in liver tissues is positively correlated with the CHB activity; cytoplasmic HBsAg expression in liver cells might provide the target antigen in the immune tolerance phase. HBcAg expression in liver cell nucleus is not only key to both CHB replication, the breaking of immune tolerance and its progression into immune activity, but also essential for inflammatory activity and fibrosis progression in liver tissues.
- Citation: Wu JZ, Huang RG, Yang XX. Differences in HBsAg and HBcAg expression in liver tissues between chronic hepatitis B patients with immunologic tolerance vs immune activity. Shijie Huaren Xiaohua Zazhi 2017; 25(7): 620-626
- URL: https://www.wjgnet.com/1009-3079/full/v25/i7/620.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v25.i7.620
乙型肝炎病毒(hepatitis B virus, HBV)感染的自然史可人为划分为4个期, 即免疫耐受期、免疫清除期、非活动或低(非)复制期和再活动期[1]. 免疫耐受期是HBV慢性感染的特殊阶段, 机体免疫系统对HBV处于耐受状态, 持续时间长者可达数十年之久[2]. 受多种因素影响, 如病毒、宿主一些外在因素以及医学干预, 免疫耐受状态打破进展至免疫活动状态. 本文着重于研究慢性乙型肝炎(chronic hepatitis B, CHB)患者免疫耐受和活动状态的临床和病理学差别, 进一步揭示由免疫耐受状态进入免疫活动状态的机制.
收集2010-01/2012-12在四川省人民医院住院的317例CHB患者的资料进行回顾性研究, 以我国2015年修订的《慢性乙型肝炎防治指南》更新版[1]描述的免疫耐受期、免疫清除期、再活动期临床特征作为纳入标准. 所有患者均无失代偿性肝病的临床表现和实验室依据, 排除合并其他病毒性肝炎、药物性肝病、遗传性肝病、血吸虫性肝病以及自身免疫性疾病、内分泌与代谢疾病、血液系统疾病, 均未接受干扰素α、核苷(酸)类、甾体激素类、甘草酸类药物治疗. 所有患者临床及生化、影像学资料均采集自肝穿刺前1 wk之内, 其中男性177例, 女性140例, 男女比例1.26:1, 年龄15-70岁, 平均年龄30岁±18岁.
1.2.1 肝组织病理: 首先彩超定位, 局麻后用美国巴德活检针MN1816获取肝组织. 标本置于10%甲醛溶液内固定, 石蜡包埋, 切片, 行HE染色、网状纤维染色; 病理学免疫组织化学采用LDP法染色检测肝组织内乙型肝炎病毒表面抗原(hepatitis B surface antigen, HBsAg)、乙型肝炎核心抗原(hepatitis B core antigen, HBcAg), 试剂购自福州迈新生物技术有限公司. 由四川省人民医院病理科医师评价标本的质量和读片. 病理学诊断参照2000年修订的《病毒性肝炎防治方案》[3]的标准, 包括炎症活动度分级(G0-G4)、纤维化分期(S0-S4). 肝组织内HBsAg、HBcAg表达强度的评价参考半定量计分法, 参照Chu提出的标准[4]: 无肝细胞着色为(-), 着色肝细胞<10%为(1+), 10%-50%为(2+), >50%为(3+).
1.2.2 实验室检测: (1)血清HBV DNA采用实时荧光定量PCR检测法(ABI7500实时PCR定量检测仪, 试剂购自中山大学达安基因股份有限公司); (2)血清谷丙转氨酶(alanine transaminase, ALT)采用日本OlympusAU2700型全自动生化分析仪检测, 其正常值上限为40 IU/L; (3)乙型肝炎标志物采用ELISA检测(HAMILTON全自动酶免分析仪2420, 试剂购自北京万泰生物药业有限公司).
统计学处理 选用SPSS19.0软件进行统计学分析. 非正态分布计量资料如年龄、ALT、HBV DNA, 采用均数±四分位数间距M±QR表示, 秩和检验比较. 计数资料采用例数表示, 率和构成比的比较采用χ2检验. 等级资料采用例数表示, 秩和检验比较, P<0.05为差异具有统计学意义.
免疫耐受组的年龄、ALT、肝脏炎症活动度分级(G)和肝脏纤维化分期(S)低于免疫活动组, 但血清HBV DNA载量显著高于免疫活动组, 均存在统计学差异(均P<0.05). 免疫耐受组的年龄低于免疫活动组(27.42岁±12.25岁 vs 35.32岁±17岁, P = 0.00); ALT低于免疫活动组(27.48 U/L±15.25 U/L vs 58.5 U/L±26 U/L, P = 0.00); G和S低于免疫活动组(P = 0.007和P = 0.001); 但血清HBV DNA载量显著高于免疫活动组(3.8×107 IU/ML±4.5×107 IU/ML vs 1.8×107 IU/ML±3.0×107 IU/ML, P = 0.00)(表1).
| 分组 | 年龄(M±QR, 岁) | 性别(男/女) | ALT(M±QR, U/L) | HBV DNA(M±QR, IU/ML) | G (n) | S (n) | ||||||||
| 0 | 1 | 2 | 3 | 4 | 0 | 1 | 2 | 3 | 4 | |||||
| 免疫耐受组(n = 102) | 27.42±12.25 | 40/62 | 27.48±15.25 | 3.8×107±4.5×107 | 0 | 41 | 61 | 0 | 0 | 15 | 85 | 1 | 1 | 0 |
| 免疫活动组(n = 215) | 35.32±17 | 137/78 | 58.5±26.0 | 1.8×107±3.0×107 | 0 | 71 | 92 | 47 | 5 | 21 | 157 | 26 | 11 | 0 |
| 统计量 | t = 11711.50 | χ2 = 16.847 | t = 7261.0 | t = 21228.0 | t = 14332.0 | t = 14268.50 | ||||||||
| P值 | 0.00 | 0.00 | 0.00 | 0.00 | 0.007 | 0.001 | ||||||||
免疫耐受组的肝组织内HBsAg表达强度、HBsAg胞浆表达强度与免疫活动组无统计学差异(P = 0.384和P = 0.317); HBsAg胞膜表达强度低于免疫活动组, 存在统计学差异(P = 0.037). 免疫耐受组肝组织内HBcAg表达强度、HBcAg胞核表达强度显著高于免疫活动组, 有统计学意义(P = 0.00); HBcAg胞浆表达强度与免疫活动组无统计学差异(P = 0.10, 表2).
| 分组 | 肝组织内HBsAg表达强度 | HBsAg胞浆表达强度 | HBsAg胞膜表达强度 | 肝组织内HBcAg表达强度 | HBcAg胞浆表达强度 | HBcAg胞核表达强度 | ||||||||||||||||||
| - | + | ++ | +++ | - | + | ++ | +++ | - | + | ++ | +++ | - | + | ++ | +++ | - | + | ++ | +++ | - | + | ++ | +++ | |
| 免疫耐受组(n = 102) | 0 | 23 | 28 | 51 | 0 | 4 | 12 | 86 | 2 | 19 | 45 | 36 | 36 | 29 | 30 | 7 | 96 | 3 | 2 | 1 | 38 | 8 | 28 | 28 |
| 免疫活动组(n = 215) | 6 | 34 | 56 | 119 | 8 | 5 | 30 | 172 | 9 | 31 | 65 | 110 | 146 | 45 | 23 | 1 | 210 | 5 | 0 | 0 | 147 | 8 | 32 | 28 |
| 统计量t值 | 15616.50 | 16682.0 | 14750.0 | 20344.0 | 16615.50 | 19670.0 | ||||||||||||||||||
| P值 | 0.384 | 0.317 | 0.037 | 0.00 | 0.10 | 0. 00 | ||||||||||||||||||
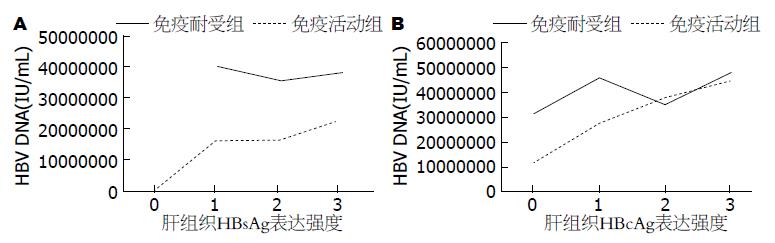
免疫活动组肝组织内HBsAg表达强度与HBV DNA存在正相关性(P = 0.019, r = 0.16). 免疫活动组肝组织内HBcAg、HBcAg胞浆和HBcAg胞核表达强度与HBV DNA均存在正相关性(P = 0.00, r = 0.455; P = 0.015, r = 0.163; P = 0.00, r =0.45)(图1, 表3).
| 分组 | 肝组织内HBsAg表达强度 | HBsAg胞浆表达强度 | HBsAg胞膜表达强度 | 肝组织内HBcAg表达强度 | HBcAg胞浆表达强度 | HBcAg胞核表达强度 | ||||||||||||||||||
| 免疫耐受组 | 免疫活动组 | 免疫耐受组 | 免疫活动组 | 免疫耐受组 | 免疫活动组 | 免疫耐受组 | 免疫活动组 | 免疫耐受组 | 免疫活动组 | 免疫耐受组 | 免疫活动组 | |||||||||||||
| P值 | r值 | P值 | r值 | P值 | r值 | P值 | r值 | P值 | r值 | P值 | r值 | P值 | r值 | P值 | r值 | P值 | r值 | P值 | r值 | P值 | r值 | P值 | r值 | |
| HBV DNA | 0.660 | 0.044 | 0.019 | 0.160 | 0.744 | -0.033 | 0.062 | 0.127 | 0.689 | -0.054 | 0.803 | -0.017 | 0.162 | 0.140 | 0.00 | 0.455 | 0.983 | 0.002 | 0.015 | 0.165 | 0.277 | 0.109 | 0.000 | 0.450 |
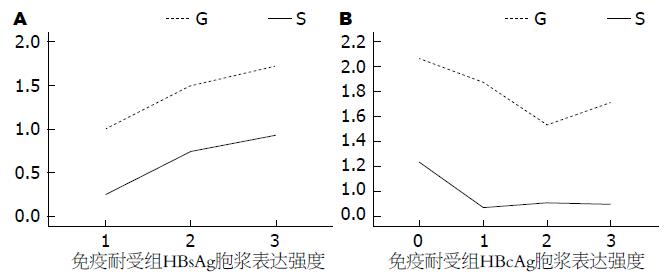
| G | 0.236 | 0.118 | 0.691 | 0.027 | 0.016 | 0.237 | 0.487 | -0.048 | 0.100 | 0.164 | 0.451 | -0.052 | 0.294 | -0.105 | 0.001 | -0.231 | 0.097 | -0.165 | 0.792 | -0.018 | 0.878 | 0.015 | 0.001 | -0.230 |
| S | 0.605 | 0.052 | 0.959 | -0.004 | 0.003 | 0.293 | 0.291 | 0.072 | 0.768 | 0.030 | 0.740 | -0.023 | 0.229 | -0.120 | 0.00 | -0.238 | 0.394 | 0.085 | 0.710 | -0.026 | 0.248 | -0.115 | 0.001 | -0.234 |
免疫耐受组HBsAg胞浆表达强度与G、S存在正相关性(P = 0.016, r = 0.237和P = 0.003, r = 0.293). 免疫活动组肝组织内HBcAg表达强度与G、S存在负相关性(P = 0.001, r = -0.231和P = 0.00, r = -0.238); HBcAg胞核表达强度与G、S存在负相关性(P = 0.001, r = -0.230和P = 0.001, r = -0.234, 图2, 表3).
本文选择102例CHB免疫耐受期患者组成免疫耐受组, 全部系血清HBsAg、HBeAg阳性和ALT正常(10-40 U/L), HBV DNA水平高(1.0×106-1.29×108 IU/ML), 肝组织学病理以轻度慢性肝炎(G0-G2期患者占100%)和轻度纤维化为主(S0-S2期患者占99.01%). 选择215例CHB免疫清除期或再活动期患者组成免疫活动组, 全部系ALT升高(41-280 U/L), 血清HBV DNA水平>2000 IU/mL(2.3×103-1.0×108 IU/ML), 其中血清HBeAg阳性(46.9%). 这是较为接近且真实反映慢性HBV感染者免疫耐受和免疫活动状态的数据. 本研究显示: 免疫耐受状态患者的年龄、ALT、肝脏炎症活动度和纤维化低于免疫活动状态患者, 但血清HBV DNA载量显著高于免疫活动状态患者. 符合免疫耐受状态的特点: HBeAg阳性、HBV DNA载量高、血清ALT及AST正常, 肝脏损伤轻微[5].
关于肝组织内HBsAg在免疫耐受和活动状态的表达差异, 国外研究[6]认为HBsAg膜型表达与血清HBV DNA定量的一致率为98.7%, 可作为活跃的HBV复制的敏感和特异标志, HBsAg的胞浆型表达或其分布与病变活动无相关性. 本研究显示: 肝组织内的HBsAg胞膜表达强度在免疫耐受状态低于免疫活动状态, 但HBsAg胞浆表达强度则并无差异. 说明免疫耐受状态肝组织内的HBsAg胞膜表达强度低, 免疫活动状态表达强度高, 但HBsAg胞浆表达强度则无变化. 提示肝组织内HBsAg胞膜表达强度与CHB免疫活动程度呈正相关, 但HBsAg胞浆表达强度则与之无相关关系.
肝组织HBsAg的表达与肝组织炎症活动度分级(G)和纤维化分期(S)的相关性, 乐晓华等[7]研究认为肝细胞内HBsAg表达强度或表达方式与炎症分级、纤维化分期和血清HBV载量均无相关性. 而本研究显示: 肝组织内的HBsAg胞浆表达强度仅在免疫耐受状态与肝组织炎G、S存在正相关性. 说明免疫耐受状态肝组织内的HBsAg胞浆表达强度高, 肝组织炎G、S程度也高. 目前大量文献表明, CHB即使处于免疫耐受期, 仍然存在不同程度的疾病进展[8]. 提示在肝细胞胞浆内表达的HBsAg与免疫耐受期疾病进展有密切关系, 有可能系免疫耐受期机体攻击的靶抗原.
关于肝组织内HBcAg在免疫耐受和活动状态的表达, 近年报道较为一致. 刘晖等[9]报道免疫耐受期以HBcAg表达以核型为主. 艾书玲等[10]报道慢性HBV感染表现出由免疫耐受期→免疫清除期→非活动或低(非)复制期→再活动期的自然过程, 在这个过程中, 肝组织HBcAg经过了以核型为主→浆型为主→阴性→浆型为主的规律性变化. 目前大部分学者认为HBcAg由细胞核向细胞浆漂移过程是肝组织炎症趋于活跃的重要标志[11], 存在于肝细胞核内的HBcAg是肝脏炎症较为静止时的表现形式, 胞浆表达HBcAg的肝细胞是细胞免疫效应攻击的靶细胞[12]. 本研究显示: 肝组织内的HBcAg表达强度和HBcAg胞核表达强度在免疫耐受状态显著高于免疫活动状态, 但HBcAg胞浆表达强度则并无差异. 提示肝细胞核内的HBcAg表达强度高, 机体处于免疫耐受状态; 肝细胞核内的HBcAg表达强度低, 机体处于免疫活动状态. 说明细胞核内的HBcAg可能并非直接引起机体对被感染肝细胞的免疫应答的靶抗原. 但有研究[13]发现免疫清除肝胞核内HBcAg转移至胞浆, 提示病毒抗原呈递的改变有可能导致了免疫耐受的丧失, 也有研究[4]表明在免疫清除期肝细胞核内的HBcAg向胞浆的转移继发于肝脏受损和肝脏再生之后. 说明CHB免疫耐受状态的打破进展至免疫活动状态的关键与细胞核内的HBcAg的表达强度的密切相关.
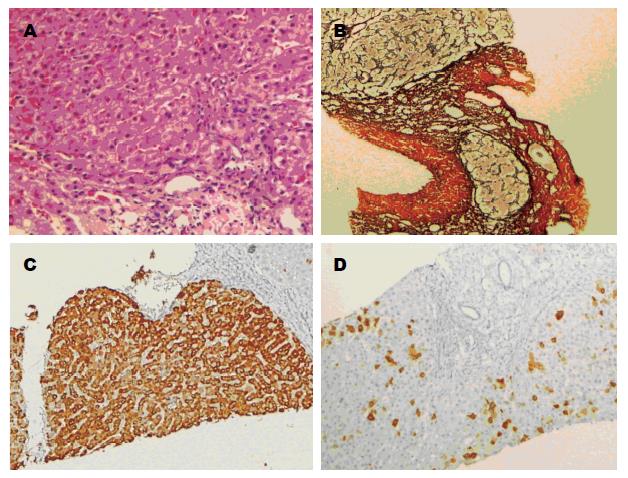
肝组织内HBcAg表达强度与G和S的相关性目前研究结果不一, 免疫耐受和活动状态下上述情况的相关报道亦少. Chu等[4]报道患者生化学及组织学炎症水平与HBcAg呈核型表达的程度呈显著负相关. 王功遂等[14]报道浆膜型HBcAg的表达强度与肝脏炎症程度间存在明显的负相关. 本研究显示: 肝组织内的HBcAg表达强度和HBcAg胞核表达强度仅在免疫活动状态与G、S存在负相关性, 但HBcAg胞浆表达强度则与之无相关性. 形成免疫活动状态患者的肝脏炎症重纤维化程度高, 而肝细胞核内HBcAg的表达减少的病理图像(图3). 而在免疫耐受状态患者中则不存在上述现象. 提示导致肝脏G和S升高的关键与肝细胞核内的HBcAg表达强度密切相关.
HBsAg和HBcAg表达强度与血清HBV DNA载量的关系目前报道较多. 邢汉前等[15]报道HBV慢性感染者肝细胞内HBsAg表达与血清HBV DNA对数值无相关性, 而肝细胞内HBcAg阳性表达与血清HBV DNA对数值呈正相关. 王功遂等[14]报道肝细胞内HBsAg表达强度与血浆HBV DNA定量只表现较弱相关性; 肝细胞内HBcAg表达强度与血浆HBV DNA定量呈明显正相关. 大多数学者认为肝细胞内HBcAg阳性表达越强, 则肝细胞内HBV DNA复制水平越高[16]. 本研究显示: 仅在免疫活动组, 肝组织内HBsAg表达强度, 肝组织内HBcAg表达强度、HBcAg胞浆表达强度和HBcAg胞核表达强度与HBV DNA均存在正相关性. 其中肝细胞核内的HBcAg表达强度与HBV DNA的相关系数高达0.45, 提示肝细胞核内的HBcAg与HBV复制的关系最为紧密.
总之, CHB的发病机制是免疫损伤而不是HBV对肝细胞的直接细胞不良反应[17], 肝细胞内HBV抗原的复制和表达激发炎症活动, 引起一系列的组织病变. CHB免疫耐受状态的打破进展至免疫活动状态、肝组织炎症活跃和纤维化进展均与肝细胞核内的HBcAg的表达强度密切相关, 此方面应继续深入研究.
肝穿刺活检取得组织标本, 采用免疫组织化学LDP法染色检测肝组织内乙型肝炎病毒表面抗原(hepatitis B surface antigen, HBsAg)、乙型肝炎核心抗原(hepatitis B core antigen, HBcAg), 再通过半定量计分法评价表达强度, 为研究肝组织内HBsAg、HBsAg在免疫耐受和活动状态的表达差异, 分析其与肝组织炎症活动度分级、纤维化分期、血清乙型肝炎病毒(hepatitis B virus, HBV) DNA载量等的关系提供了实验室基础.
免疫耐受期是HBV慢性感染的特殊阶段, 机体免疫系统对HBV处于耐受状态, 持续时间长者可达数十年之久. 受何种因素影响免疫耐受状态打破进展至免疫活动状态是目前国内外学者研究的热点难点.
目前大部分学者认为HBsAg膜型表达可作为活跃的HBV复制的敏感和特异标志; HBcAg由细胞核向细胞浆漂移过程是肝组织炎症趋于活跃的重要标志.
本文着重对比肝组织内HBsAg表达强度、HBcAg表达强度在免疫耐受及活动状态的差异, 分析与肝组织炎症活动度分级、纤维化分期、血清HBV DNA载量存在的相关关系.
本文着重研究慢性乙型肝炎患者免疫耐受和活动状态的临床和病理学差别, 进一步揭示由免疫耐受状态进入免疫活动状态的机制.
免疫组织化学染色: 是用一抗与被检测组织中目的蛋白抗原结合, 然后有标记的二抗与一抗进行结合, 最后通过显色反应, 进而确认所要检测蛋白抗原的定位、半定量等.
高月求, 教授, 主任医师, 博士生导师, 上海中医药大学附属曙光医院中医肝病; 林世德, 教授, 遵义医学院附属医院临床医学研究所, 遵义医学院传染病教研室及附属医院感染科; 王兵, 主任医师, 上海交通大学附属第六人民医院中医科
本文说理明确、层次清晰, 对治疗慢性乙型肝炎有一定的理论意义和临床应用价值.
手稿来源: 自由投稿
学科分类: 胃肠病学和肝病学
手稿来源地: 四川省
同行评议报告分类
A级 (优秀): 0
B级 (非常好): B, B
C级 (良好): C
D级 (一般): 0
E级 (差): 0
编辑: 闫晋利 电编:李瑞芳
| 2. | Liaw YF. Natural history of chronic hepatitis B virus infection and long-term outcome under treatment. Liver Int. 2009;29 Suppl 1:100-107. [PubMed] [DOI] |
| 4. | Chu CM, Yeh CT, Sheen IS, Liaw YF. Subcellular localization of hepatitis B core antigen in relation to hepatocyte regeneration in chronic hepatitis B. Gastroenterology. 1995;109:1926-1932. [PubMed] [DOI] |
| 5. | Hui CK, Leung N, Yuen ST, Zhang HY, Leung KW, Lu L, Cheung SK, Wong WM, Lau GK. Natural history and disease progression in Chinese chronic hepatitis B patients in immune-tolerant phase. Hepatology. 2007;46:395-401. [PubMed] [DOI] |
| 6. | 张 玉果, 王 泰龄. 慢性乙型肝炎肝组织内HBsAg、HBcAg的表达及临床研究进展. 胃肠病学和肝病学杂志. 2010;19:189-192. |
| 7. | 乐 晓华, 陈 心春, 林 巧, 李 美忠, 王 敏, 刘 赛云, 余 志勇, 周 伯平. 慢性乙型肝炎患者肝组织中HBV抗原表达特征及临床意义. 中华实验和临床病毒学杂志. 2007;21:41-43. |
| 8. | 黄 珊, 何 清, 唐 奇远, 唐 蔚, 敖 飞健, 李 知玉, 张 斌, 白 冰. 112例慢性HBV感染免疫耐受期患者肝组织病理学特点. 中国肝脏病杂志(电子版). 2011;3:16-20. |
| 9. | 刘 晖, 祖 可佳, 常 静, 吕 福东, 孙 琳, 孔 贺利, 张 世杰, 宋 晨朝, 戴 洁. 慢性乙型肝炎免疫耐受期患者肝穿组织的临床病理学特征. 中国医药导报. 2011;8:18-21. |
| 10. | 艾 书玲, 何 清, 唐 奇远, 吴 繁, 唐 情容, 敖 飞健, 廖 雪姣, 赵 连三. 慢性HBV感染自然史各期肝组织HBcAg演变规律的探讨. 中华实验和临床感染病杂志(电子版). 2014;8:396-399. |
| 11. | 唐 奇远, 何 清, 乐 晓华, 吕 德良, 张 香梅, 敖 飞健, 唐 怡敏, 黄 珊. 958例慢性乙型肝炎患者肝细胞内HBcAg分布规律的研究. 中西医结合肝病杂志. 2010;20:204-206. |
| 12. | Yim HJ, Lok AS. Natural history of chronic hepatitis B virus infection: what we knew in 1981 and what we know in 2005. Hepatology. 2006;43:S173-S181. [PubMed] [DOI] |
| 13. | Frelin L, Wahlström T, Tucker AE, Jones J, Hughes J, Lee BO, Billaud JN, Peters C, Whitacre D, Peterson D. A mechanism to explain the selection of the hepatitis e antigen-negative mutant during chronic hepatitis B virus infection. J Virol. 2009;83:1379-1392. [PubMed] [DOI] |
| 14. | 王 功遂, 王 曼曼, 谢 秋里, 明 朗, 姜 湘宁, 陈 乐无, 刘 梅华. HBsAg、HBcAg在慢性乙型肝炎肝细胞内的表达及临床意义. 中华肝脏病杂志. 2004;12:287-289. |
| 15. | 邢 汉前, 辛 绍杰, 赵 景民, 陈 黎明, 李 保森, 游 绍莉, 赵 军, 周 光德, 潘 登. HBV慢性感染免疫耐受期患者肝组织内NK细胞及Kupffer细胞的研究. 中国现代医学杂志. 2007;17:1330-1333. |
| 16. | Chan HL, Leung NW, Hussain M, Wong ML, Lok AS. Hepatitis B e antigen-negative chronic hepatitis B in Hong Kong. Hepatology. 2000;31:763-768. [PubMed] [DOI] |
| 17. | 李 春娜, 夏 瑾瑜, 周 耀勇, 黄 珊凤. 慢性乙型肝炎患者肝脏病理与年龄、血清ALT、HBV DNA、HBeAg关系的探讨. 中华临床医师杂志(电子版). 2013;7:1514-1515. |