胃癌是我国常见的恶性肿瘤之一, 其治疗手段主要是手术和放化疗, 然而大多数胃癌被发现时已处于晚期, 错失最佳手术期, 加上对放化疗的不敏感, 无法解决癌细胞弥漫和转移等一系列问题. 随着医学分子生物学的发展, 研究致癌的分子信号通路也越来越多, 阻断其信号通路, 从而逆转癌症的发生发展、提高胃癌细胞对放化疗的敏感性和阻滞癌细胞的转移, 成为目前研究胃癌的重点. 本文综述了近几年与胃癌密切相关的分子信号通路, 如丝裂原活化蛋白激酶通路、PI3K-Akt-mTOR通路、AMPK通路、NF-κB-COX-2通路和HNF4a-Wnt通路, 拟给实验研究和临床治疗提供新的思路.
关键词: 胃癌; MAPK; PI3K-Akt-mTOR; AMPK-mTOR; NF-κB-COX-2; HNF4a-Wnt
核心提要: 研究胃癌的信号分子, 找出与胃癌细胞生长增殖、迁移侵袭相关的生物分子以及诱导其自噬凋亡的机制, 有针对性的拮抗或激活, 不仅能辅助手术和放化疗, 解决癌细胞转移等问题, 还能作为早期胃癌特异的筛选标志, 有利于早诊断、早治疗, 提高临床治愈率和5年生存期, 给胃癌患者带来希望.
引文著录: 胡倩, 易屏. 胃癌分子信号通路及其干预的研究进展. 世界华人消化杂志 2017; 25(7): 576-583
Gastric cancer associated signaling pathways and interventions
Qian Hu, Ping Yi
Qian Hu, Tongji Hospital, Tongji Medical College, Huazhong University of Science and Technology, Wuhan 430030, Hubei Province, China
Ping Yi, Department of Integrated Traditional Chinese and Western Medicine, Tongji Hospital, Tongji Medical College, Huazhong University of Science and Technology, Wuhan 430030, Hubei Province, China
Supported by: National Natural Science Foundation of China, Nos. 30973836 and 81673757.
Correspondence to: Ping Yi, Associate Professor, Department of Integrated Traditional Chinese and Western Medicine, Tongji Hospital, Tongji Medical College, Huazhong University of Science and Technology, 1095 Jiefang Avenue,Wuhan 430030, Hubei Province, China. pyi219@163.com
Received: December 26, 2016
Revised: January 18, 2017
Accepted: January 22, 2017
Published online: March 8, 2017
0 引言
近年来, 癌症的发病率和致死率呈逐渐上升趋势, 并成为国人首要的致死原因, 严重影响了国人的身体健康. 在临床上, 由于早期胃癌症状不典型, 大多数胃癌被发现时已处于晚期, 错过最佳手术时期, 加上对放化疗的不敏感, 使胃癌的致死率居高不下, 位于癌症死亡的第2名[1,2]. 寻找有效治疗胃癌的方法成为时下研究的热点与关键点. 21世纪兴起的分子靶向治疗, 给传统癌症治疗提供了新的方向, 曲妥珠单抗[3,4]治疗HER-2高表达型胃癌细胞取得的巨大成功, 让我们有理由相信胃癌的分子靶向治疗, 会给胃癌的治疗带来新的变革. 本文总结了近几年关于胃癌的分子信号通路的最新研究, 对胃癌细胞中可能存在的信号通路以及相应通路阻断剂的治疗效果进行了综述, 以期给胃癌的靶向治疗研究提供更多思路.
1 丝裂原活化蛋白激酶信号通路
丝裂原活化蛋白激酶(mitogen-activated protein kinase, MAPK)在多细胞生物中广泛表达, 是一种能被不同的细胞外刺激, 如细胞因子、神经递质、激素、细胞应激及细胞黏附等激活的丝氨酸-苏氨酸蛋白激酶, 是将胞外信号传递到细胞内的传递者. 有研究表明MAPK参与基因表达、细胞增殖、分化、凋亡、迁移和侵袭等过程, 胞外信号调节激酶(extracellular signal-regulated kinase, ERK)、c-Jun氨基末端激酶(c-Jun N-terminal kinase, JNK)和p38 MAPK作为MAPK亚族, 分别联合MAPK建立各自的信号通路参与细胞的增殖、分化和凋亡等过程, 目前已在各类癌症中发现了以上踪迹.
Yang等[5]认为肿瘤侵袭和转移主要是借助黏着斑激酶和基质金属蛋白酶(matrix metallo-proteases, MMPs), 增加对邻近细胞或靶向细胞的黏附性从而达到肿瘤的转移, 而MAPK可以调节MMPs的活性, 从而影响胃癌细胞的迁移和侵袭能力, 因此Yang等[5]总结了在胃癌细胞中的3个MAPK信号通路: ERK、JNK、P38, 并分别列述其上游信号以及各自信号通路抑制胃癌细胞侵袭和迁移的作用机制. Li等[6]发现长链非编码RNA CASC2在胃癌细胞中表达较低, 通过CASC2转染的细胞发现上调CASC2的表达可以抑制胃癌细胞的增殖, 接着使用特异性MAPK抑制剂U0126和JNK抑制剂SP600125, 比较p-ERK1/2、ERK1/2、p-JNK和JNK等相关蛋白的表达水平的变化, 发现以上蛋白均下调, 因此推断MAPK通路包括ERK1/2和JNK均参与了CASC2介导的抑制胃癌细胞增殖的过程. CASC2的上调可以负向调节MAPK通路, 造成ERK1/2或JNK低表达, 最终达到抑制胃癌细胞增殖的目的. Liu等[7]发现胃癌细胞株相比正常胃部组织细胞, 微RNA(miR-302b)的表达较低, 推测miR-302b可能与胃癌细胞增殖有关, 通过检测G0/G1周期蛋白, 发现miR-302b表达下调能明显促进G1/S期的转化进而促进胃癌细胞的增殖. 不仅如此, Liu等[7]还通过一系列实验研究发现miR-302b的表达是通过抑制ERK的信号通路, 最终抑制胃癌细胞的增殖和G1/S的转换率, 说明ERK/MAPK在胃癌细胞中起着直接调控作用. Li等[8]同样在melatonin(褪黑激素, N-乙酰-5-甲氧基色胺)抑制胃癌细胞生存、克隆形成、转移和侵袭以及诱导凋亡的实验中, 发现分别使用P38和JNK的抑制剂SB203580、SP600125后, melatonin诱导的胃癌细胞凋亡减少, 于是进一步实验证明了melatonin的作用通路仍为MAPK信号通路(P38、JNK和ERK).
以上实验研究表明, 无论是长链非编码RNA CASC2、微RNA miR-302b还是melatonin均可干扰胃癌细胞的增殖, 其作用的共同机制为抑制MAPK信号通路, 因MAPK上游调节的信号分子为P38、JNK和ERK, 其构建各自的MAPK信号通路参与并调节胃癌细胞的增殖与转移, 抑制其信号分子活性或阻断此信号通路的药物均能够抑制胃癌细胞的增殖与转移, 有助于减少胃癌的恶化和转移程度, 延缓患者的病情发展, 延长患者生存期.
2 PI3K-Akt-mTOR信号通路
磷脂酰肌醇-3激酶(phosphoinositide 3-kinase, PI3K)是一种胞内磷脂酰肌醇激酶, PI3K通过与蛋白激酶B结合来激活Akt, 并且PI3K/Akt具有丝氨酸/苏氨酸(Ser/Thr)激酶的活性, 是雷帕霉素靶蛋白[(mammalian target of rapamycin, mTOR), 一种丝/苏氨酸蛋白激酶]的上游信号, mTOR信号是调控自噬的一条经典通路, 抑制mTOR可以增加自噬水平从而抑制癌细胞的增殖. 已有大量实验研究证明, PI3K和Akt能磷酸化并调控许多与细胞代谢、凋亡、增殖和分化有关的蛋白, 进而能抑制细胞的凋亡并促进肿瘤的生长, 并且PI3K-Akt-mTOR参与细胞的生长、存活、增殖、凋亡、血管生成、自噬等过程, 在多种癌症存在着重要的调控作用. 例如在HPV诱导的宫颈癌中, 激活PI3K-Akt-mTOR信号通路可以增加遗传的不稳定性, 阻碍细胞凋亡和干扰细胞增殖, 总之是通过多种细胞和分子事件调节肿瘤的发生发展和影响治疗疗效[9].
因此Singh等[10]推测胃癌细胞中也可能存在PI3K-Akt-mTOR信号通路. 他们先分析PI3K-Akt-mTOR在正常细胞的调控作用: 直接磷酸化或间接调控处于G1/S和G2/M期的细胞周期分子的蛋白水平, 参与细胞代谢、蛋白合成和细胞生长等过程; 其次通过分析PIK3CA、PTEN、mTOR等分子作用机制, 找出胃癌细胞中PI3K-Akt-mTOR信号通路可能致的癌作用; 最后推断出, 使用PI3K-Akt-mTOR通路抑制剂可以改善胃癌细胞恶化状态. Liu等[11]根据针对PI3K/Akt/mTOR信号通路的治疗药物可能提高胃癌治疗疗效这一理论, 发现甲氟拉(一种抗疟药, 能够下调磷酸化的PI3K、Akt、mTOR和Rs6等相关蛋白)具有潜在的抑制胃癌细胞增殖及诱导胃癌细胞凋亡的作用. Raha等[12]在做柚皮抗胃癌细胞活性实验, 发现柚皮正是通过抑制PI3K-Akt-mTOR信号通路从而达到抑制胃部肿瘤细胞的增殖. Riquelme等[13]也证明三种miRNAs(miR-101-2, miR-125b-2和miR-451)在胃癌细胞或组织中发挥抑制细胞增殖和克隆形成、增加细胞死亡、减少细胞转移和侵袭的功能是通过PI3K/Akt/mTOR信号通路. 因此可以看出抑制PI3K-Akt-mTOR信号通路的药物具有作为胃癌补充治疗剂的潜力. Zhang等[14]发现HER-2可与不同的配体包括TGF-βα, 肝素连接双调蛋白, 表皮生长因子, β细胞素等结合, 这些配体可以同源二聚体或异源二聚体的形式通过激活细胞PI3K信号进而启动相应下游通路, 这一发现将HER-2与经典的PI3K-Akt-mTOR信号通路联系在一起, 从侧面证明HER-2作用的靶基因是PI3K-Akt-mTOR信号通路. 曲妥珠单抗, 抗HER-2的单克隆抗体, 可以干扰和阻断HER-2与其他配体结合介导的PI3K-Akt-mTOR细胞信号通路和细胞周期进展, 诱导抗体依赖性细胞毒性作用, 进而抑制过度表达HER-2的胃部肿瘤细胞的增殖.
由此可知, PI3K-Akt-mTOR可调控胃癌细胞的生长和增殖, 是使胃部细胞恶化的主要通路, 抑制PI3K-Akt-mTOR信号通路, 可以抑制胃癌细胞的增殖, 诱导胃癌细胞凋亡. 阻断此信号通路或负向调节信号分子的药物均具有抗胃癌细胞增殖和诱导凋亡的作用, 是治疗胃癌的新方向.
3 AMPK信号通路
1924年被Otto Warburg发现的Warburg效应使单磷酸腺苷激活的蛋白激酶(AMP-activated protein kinase, AMPK)抗肿瘤得到极大的关注. 其效应是指健康细胞依靠线粒体氧化糖类分子释放出三磷酸腺甙(adenosine triphosphate, ATP), 而大多数肿瘤细胞则通过产能率相对较低糖酵解作用为自身供能, 即在氧气充足的条件下也会通过大量的糖酵解来获得ATP, 这种作用机制不需要氧气也不需要线粒体参与, 其结果给肿瘤细胞的快速繁殖提供了核苷酸、氨基酸、脂质等营养物质. AMPK的激活可以磷酸化一些关键的代谢酶或者激活转录因子调节基因表达, 使细胞从合成代谢状态转换为分解代谢状态, 因此AMPK可以通过抑制肿瘤细胞糖脂新生、脂肪生成和蛋白质合成从而抑制肿瘤细胞的增殖[15]. 另外有研究[16]表明激活AMPK后, 可引起结节性硬化复合物2(tuberous sclerosis complex 2, TSC2)的磷酸化, TSC1/TSC2复合体的形成能够直接抑制哺乳动物mTOR并最终抑制下游的信号因子核糖体蛋白激酶和磷酸化4E结合蛋白1抗体的活性, 而这两者直接影响到蛋白的转录与合成, 从而抑制肿瘤细胞的复制. 并且mTOR信号通路也是调控自噬的一条经典通路, 通过激活AMPK抑制mTOR, 增加自噬水平从而抑制肿瘤的增殖.
AICRA, 已被公认的AMPK激动剂, 已被广泛运用于抑制癌症的生长[17], 目前发现其可以抑制乳腺癌、胶质瘤、前列腺癌的细胞增殖[18], 促进前列腺癌、肺癌细胞的凋亡[19]. 还可以提高胃癌细胞对化疗药的化疗增敏性[20]. Lee等[21]发现科罗索酸, 一种AMPK激动剂, 通过激活AMPK通路, 从而下调mTOR, 可以抑制胃癌细胞的形成及其生长和增殖. Han等[22]在做二甲双胍诱导胃癌细胞凋亡实验中发现, 二甲双胍(AMPK激动剂)可以上调AMPK信号, 下调mTOR分子, 从而抑制蛋白质合成、细胞增殖、细胞周期进展和血管再生, 从多方面发挥诱导凋亡的作用. Yu等[23]发现琥珀酸维生素E可以诱导胃癌细胞自噬, 但当使用siRNA抑制AMPK的活性后, 琥珀酸维生素E诱导细胞自噬能力下降, 并且伴随着mTOR蛋白的下调, 因此高度怀疑AMPK-mTOR信号轴是琥珀酸维生素E诱导胃癌细胞自噬的信号通路.
故AMPK-mTOR信号通路的激活具有抑制胃癌细胞生长、诱导细胞自噬的功效, 激动此信号通路可以作为治疗胃癌的另一方法, 通过激活AMPK通路从而抑制其下游mTOR信号分子可以从多方面抑制癌细胞的生长繁殖, 最终达到治疗胃癌的目标.
4 COX-2/NF-κB信号通路
越来越多的证据表明, 各种炎症网络在肿瘤微环境中起着至关重要的作用, 约有15%的恶性肿瘤与感染有关[24], 炎症的刺激可导致肿瘤的发生和发展, 在合适的阶段治愈炎症, 阻断炎症信号网络可以在很大程度上防治肿瘤[25,26]. 而最重要的网络通路是COX-2/NF-κB. 环氧酶-2(cyclooxygenase, COX-2)是一个重要的炎性因子, 绝大部分组织细胞不表达COX-2, 而在炎症、肿瘤等病理状态呈现高表达状态, Cheng等[27]发现胃癌细胞中, COX-2高度表达, 并且通过促进细胞增殖、抑制凋亡、诱导血管形成、增强淋巴转移、增强肿瘤的侵袭性及转移活性、抑制免疫等一系列生理活动参与胃癌的发生发展. 核因子-κB(nuclear factor-κB, NF-κB)通路在人类的几种重要的感染性疾病中扮演重要角色, 如炎症性肠病、幽门螺旋菌相关的胃炎等. NF-κB的激活也在凋亡、细胞增殖、对癌症化疗药物的反应和病毒的转录和复制中具有重要作用. 有研究[28]表明COX-2与NF-κB存在两个共识位点, 所以COX-2与NF-κB结合后, 可上调其表达. 激活COX-2/NF-κB信号通路, 可以抑制细胞凋亡和促进细胞增殖, 从而促进癌症的发生; 抑制COX-2/NF-κB信号通路就能发挥抑制肿瘤细胞的增殖, 目前这条通路已被证明在多种癌症中起作用, 如肺癌、乳腺癌等. 当然也有研究者探讨这条通路在胃癌中的存在及作用方式. 上皮细胞钙黏蛋白(epithelial-cadherin, E-cadherin)是由CDH1编码的, 是一种跨膜糖蛋白, 在维持上皮细胞结构、细胞间黏附性和细胞极性上占有重要的作用, 且E-cadherin通过多种信号通路参与调节细胞增殖、存活、侵袭和迁移的信号通路, 其功能失调可导致胃上皮细胞功能紊乱进而造成胃癌的发生[29].
Chen等[30]通过比较正常胃部细胞和胃癌细胞发现, 相比正常胃部组织细胞, 胃癌细胞中的NF-κB和COX-2蛋白较为丰富, 反而E-cadherin的表达降低, 且正常胃部组织细胞几乎不表达NF-κB和COX-2. 于是认为COX-2、NF-κB信号分子在胃癌细胞中起着重要作用. Bai等[28]在探讨健脾通络解毒方对胃癌前病变患者作用的分子机制中, 发现与治疗前相比, 治疗后COX-2、NF-κB-p65和抑制凋亡蛋白Bcl-2表达下调, 促进凋亡蛋白Bax表达上调, 细胞凋亡指数上调, 由于Bcl-2启动子存在NF-κB特异性结合位点, NF-κB可通过转导途径直接上调Bcl-2表达[31]. 于是白宇宁等[28]推断健脾通络解毒方可能通过NF-KBp65/COX-2、COX-2/Bcl-2及NF-KBp65/Bcl-2等信号转导通路促进胃癌细胞凋亡. Su等[32]研究从中药丹参提取的丹参酮ⅡA对胃癌细胞AGS的分子作用机制, 发现丹参酮ⅡA具有诱导胃癌细胞凋亡、抑制胃癌细胞增殖的功效, 且在其作用过程中, NF-κB-p65蛋白、COX-2蛋白、MMP-2、-7、-9蛋白表达下降, 且MMPs介导细胞外基质的降解, 于是猜想丹参酮ⅡA可能是通过降低NF-κB、COX-2和MMP蛋白的表达起作用的. Chen等[30]用COX-2的抑制剂celecoxib作用过度表达COX-2的胃癌细胞系SGC7901, 发现COX-2和NF-κB的表达蛋白下降, E-cadherin的表达上调, 胃癌细胞侵袭能力下降. 确认COX-2正是通过NF-κB信号通路调节E-cadherin的活性, 最终导致胃癌细胞的转移和侵袭. Liu等[33]用NF-κB的干扰小RNA处理SGC7901细胞, 发现E-cadherin的表达上调, COX-2的表达无改变, 进一步说明, 在胃癌的调控机制中, COX-2是NF-κB的上游信号, COX-2/NF-κB/E-cadherin信号通路影响胃癌细胞的转移.
因此可以说明, COX-2/NF-κB通路对胃癌的发生发展有着重要的作用, 阻断此通路活性, 若是下调Bcl-2, 上调Bax, 可促进胃癌细胞的凋亡; 若是使基质金属蛋白酶的表达蛋白下降, 可以诱导胃癌细胞凋亡、抑制胃癌细胞增殖; 若是使下游信号E-cadherin的功能失调, 可影响胃癌细胞的转移与侵袭能力. 总之, COX-2/NF-κB通路可通过多方面影响胃癌细胞的发展, 尤其是炎症相关性胃癌.
5 HNF4a-WNT信号通路
肝细胞核因子4a(hepatocyte nuclear factor 4a, HNF4a)是内胚层特异的锌指转录因子, 具有高度保守性, 属于核激素受体超家族[34], 在胃肠道、肝、肾和胰腺的黏膜上皮细胞中均有所表达[35], 同时决定上皮细胞表型的重要基因, 是与肿瘤分化相关性最高的基因之一[36]. 近来研究[37]表明, HNF4a基因表达的变化与许多癌症有关, 如肝细胞癌、肾细胞癌、胃腺癌、壶腹癌和结直肠癌等. 例如HNF4a可抑制结肠癌细胞(HT29、LoVo、SW480)增殖、转移、侵袭和诱导G2/M期停滞, 最终促进细胞凋亡[38]. Massillon等[39]也证实HNF4a是物质代谢平衡相关基因调控的主要调节因子, 2014年在国际权威期刊Nature和Cell Metabolism上相继发表的文章将代谢异常亦视为肿瘤的一个重要特征[40,41], 暗示HNF4a与癌症存在某些联系. Yano等[42]用免疫组织化学和RT-PCR等实验技术检测肝样胃腺癌、非肝样胃腺癌、正常胃部组织的HNF4a, 发现在肝样胃腺癌和非肝样胃腺癌均表达丰富的HNF4a, 且两者并无差别, 但正常胃部组织不表达HNF4a, 说明HNF4a的表达可能参与胃癌的发生. Kojima等[43]将胃腺癌分为胃型、肠型和混合型, 用免疫组织化学分析黏蛋白MUC5AC、MUC2、CD10和胃型黏液, 分析HNF4a在腺癌组织中的表达与胃腺癌肠表型是否相关, 发现HNF4a与胃腺癌有关联, 且HNF-4a在大多数肿瘤细胞的细胞核中层现阳性, 与组织学类型分类没有统计学意义(P>0.05), 由此认为HNF4a与胃腺癌有关. 目前已发现Wnt/β-catenin信号通路参与多种肿瘤调控, 其中β-catenin在Wnt信号途径中起转导激活作用, 通过其对细胞分裂和生长调节基因(如c-myc和周期素D1)的不恰当的激活, 导致细胞增生失控而致癌[44-46]. 张明基等[47]通过论述Wnt信号传导通路中的组成成分及其与胃癌的关系, 发现Wnt信号传导通路与胃癌的发生、发展密切相关.
Yao等[38]发现HNF4a可以通过Wnt/β-catenin信号通路抑制上皮-间质转化(epithelial-mesenchymal transition, EMT), EMT是将具有极性的上皮细胞转换成为具有活动能力的间质细胞, 并获得侵袭和迁移能力的过程, 进而导致癌细胞的转移. 其中β-连接蛋白是关键元素, HNF4a可与β-连接蛋白竞争结合TCF4, 使β-连接蛋白不能在胞浆内结合TCF4形成复合体, 进而不能转运到细胞核内, 负向调节Wnt/β-catenin信号通路, 最终抑制EMT过程和肿瘤细胞的转移. Nam等[48]发现在胃癌细胞中, HNF4a可直接调节Wnt5a蛋白分子. Chang等[49]在六种胃癌细胞系运用siRNA介导的HNF4a基因沉默, 并使用TCF/LEF受体荧光素检测WNT信号, 发现有5种胃癌细胞系TCF/LEF受到抑制, 其中有3种细胞中Wnt5a蛋白表达下降, 说明HNF4α-Wnt5a信号通路存在于胃癌中, 并起到一定的调控作用.
6 结论
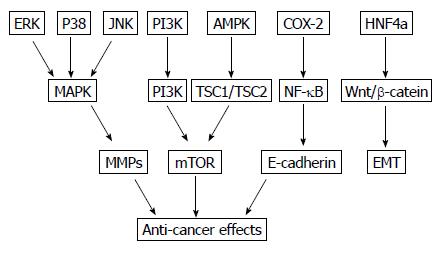
以上几种信号通路都存在于胃癌中, 阻断或激活其通路, 能够从不同方面或抑制胃癌细胞增殖、迁移, 或诱导细胞凋亡(图1). 因此找到促进胃癌发生和发展的信号通路, 并针对性阻断或抑制, 对于胃癌的治疗具有重大意义. 随着分子研究的不断深入, 寻找抗胃癌作用的关键靶向通路, 并设计出相应的靶向治疗药物, 将是下一步研究的热点. 但目前仍存在许多问题, 首先, 要确定胃癌的信号通路是否具有其他生物效应. 例如下调的HNF4a能够促进肝癌的发生, 但是却抑制胃部肿瘤细胞的增殖[49,50], 因此HNF4a在不同组织的肿瘤细胞中, 其控制机制不尽相同, 更深入地研究致癌通路的下游信号是解决这一矛盾的重点. 另外, 不排除还存在更多的致癌信号通路. 探索更多未知信号通路, 绘制全面的胃癌发生发展的信号通路图, 对于寻找有效治疗胃癌的药物, 从而达到治愈胃癌的目的, 具有重要的临床和科研意义.
图1 胃癌相关的分子信号通路的信号通路图.
MAPK: 丝裂原活化蛋白激酶, 胞内的一类丝氨酸/苏氨酸蛋白激酶; ERK: 细胞外调节蛋白激酶, MAPK的亚家族之一; P38: p38丝裂原活化蛋白激酶, MAPK的亚家族之一; JNK: c-Jun氨基末端激酶, 又称应激活化蛋白激酶, MAPK的亚家族之一; PI3K: 磷脂酰肌醇-3激酶, 一种胞内磷脂酰肌醇激酶; AMPK: 单磷酸腺苷激活的蛋白激酶; COX-2: 环氧合酶-2; HNF4a: 肝细胞核因子4a; Akt: 蛋白激酶B, 又称PKB; TSC1/TSC2: 结节性硬化复合物1/2的二聚体; NF-κB: 哺乳动物的转录因子; Wnt/β-catein: Wnt/β-连环蛋白; MMPs: 基质金属蛋白酶; mTOR: 雷帕霉素靶蛋白, 一种丝/苏氨酸蛋白激酶; E-cadherin: 上皮细胞钙黏蛋白; EMT: 上皮间质转化; Anti-cancer effects: 抗癌作用.
评论
背景资料
由于亚洲人的饮食习惯以及幽门螺旋杆菌的感染等原因, 我国胃癌的发病率较高, 然而手术和放化疗只能根除局部病灶, 对癌细胞的迁移与弥漫治疗有限, 使5年生存期较低, 此文总结近几年的胃癌分子信号的研究, 以期找到阻断胃癌发展的通路, 提高治愈率和生存质量.
研发前沿
拮抗癌细胞的生长因素, 从而阻断其生长是目前在癌症治疗中最热门的方向. 找到不同种类胃癌细胞的生长通路, 以及诱导其自噬和凋亡的机制, 使用药物针对性地治疗, 是目前亟待解决的问题.
相关报道
廖毅从细胞生物学和分子生物学的角度, 提出与胃癌的发生发展相关的细胞、转录因子和非编码RNA, 并进一步指出多个胃癌干预的潜在治疗靶点, 还认为不同类群的胃癌细胞, 其生物标志物靶向不同, 应该分门别类地研究各自信号分子, 有利于提高科研效率.
创新盘点
本文综述性讲解胃癌细胞中, 促进其生长、增殖、迁移和侵袭的信号通路, 以及利用相关药物抑制其通路后, 能够负向调节胃癌细胞的生长、增殖、迁移、侵袭, 甚至诱导其自噬和凋亡, 强调胃癌靶向治疗目前取得的成果, 并有可能作为未来癌症治疗的重要手段.
应用要点
本文可以在寻找早期胃癌标志物、靶向治疗胃癌、研究对胃癌有效药物的药理分析等方面提供新的思路, 而且靶向治疗胃癌具有针对性、高效性、无创性等优点, 曲妥珠单抗治疗HER-2高表达型胃癌在临床上取得较好的效果, 期待其他相关药物走入临床应用.
同行评议者
麻勇, 副研究员, 哈尔滨医科大学附属第一医院肝脏外科; 王阁, 教授, 中国人民解放军第三军医大学第三附属医院; 王金胜, 教授, 长治医学院病理学教研室
同行评价
本文介绍了炎症性肠病及其治疗方法与血栓栓塞性疾病的关系, 并介绍了防治现状, 具有一定新颖性和创新性. 文章设计合理, 证据应用准确, 文字表达清楚.