修回日期: 2017-01-07
接受日期: 2017-01-11
在线出版日期: 2017-02-28
探讨在干扰素α(interferon α, IFNα)与利巴韦林(ribavirin, RBV)基础上联合他汀治疗丙型肝炎的有效性.
通过计算机全面检索PubMed、Web of Science、EMBASE、Cochrane Library、CNKI、万方、中国生物医学文献、维普等数据库已发表的他汀联合IFNα与RBV治疗丙型肝炎的文献, 对文献质量进行评价, 采用RevMan5.3软件对持续病毒学应答(sustained virological response, SVR)、快速病毒学应答(rapid virological response, RVR)、早期病毒学应答(early virological response, EVR)等病毒学应答指标进行Meta分析.
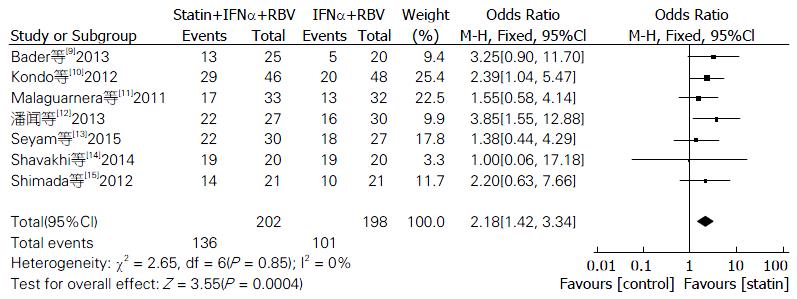
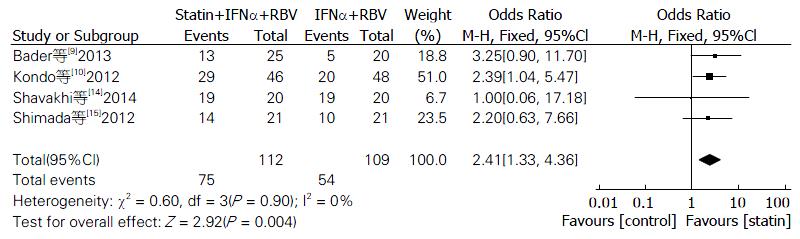
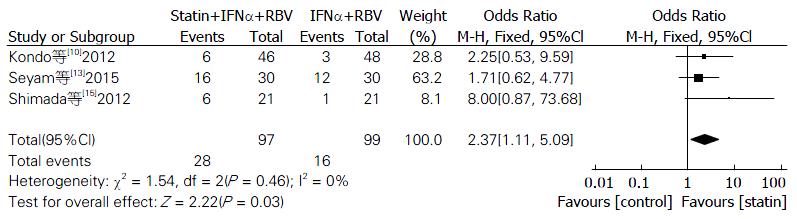
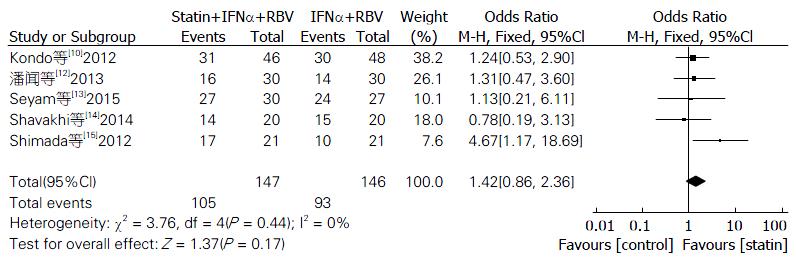
最终纳入7个随机对照试验, 试验组202例, 对照组198例. 分析显示: 他汀组的SVR率、RVR率均优于对照组(OR = 2.18, 95%CI: 1.42-3.34, P = 0.0004; OR = 2.37, 95%CI: 1.11-5.09, P = 0.03), 差异具有统计学意义; 对丙型肝炎病毒1型单独分析, 他汀组SVR率优于对照组, 差异具有统计学意义(OR = 2.41, 95%CI: 1.33-4.36, P = 0.004); 而EVR率, 2组差异无统计学意义(OR = 1.42, 95%CI: 0.86-2.36, P = 0.17).
在IFNα与RBV基础上加用他汀类药物可显著改善SVR, 提高丙型肝炎的治愈率.
核心提要: 本研究对国内外各大数据库自建库至2016-08公开发表的关于他汀辅助干扰素α(interferon α, IFNα)和利巴韦林(ribavirin, RBV)治疗丙型肝炎的随机对照研究进行Meta分析, 结果表明在IFNα与RBV基础上加用他汀类药物可显著改善持续病毒学应答, 提高丙型肝炎的治愈率.
引文著录: 赵健, 梁才全, 李伟, 姚定康. 他汀辅助干扰素α与利巴韦林治疗丙型肝炎有效性的Meta分析. 世界华人消化杂志 2017; 25(6): 484-490
Revised: January 7, 2017
Accepted: January 11, 2017
Published online: February 28, 2017
To systematically evaluate the therapeutic efficacy of statins as add-on to interferon α (IFNα) plus ribavirin (RBV) therapy for hepatitis C.
A thorough search was done in PubMed, Web of Science, EMBASE, Cochrane Library, CNKI, Wanfang Data, SinoMed and VIP to collect articles on statins as add-on to IFNα plus RBV therapy for hepatitis C. Quality of each study was assessed, and meta-analysis of sustained virological response (SVR), rapid virological response (RVR) and early virological response (EVR) was performed with RevMan5.3 software.
Seven randomized controlled trials were included with 202 patients in the add-on therapy group and 198 patients in the control group. Meta-analysis showed that triple therapy with IFNα, RBV and statin was superior to therapy with IFNα and RBV in achieving SVR and RVR (OR = 2.18, 95%CI: 1.42-3.34, P = 0.0004; OR = 2.37, 95%CI: 1.11-5.09, P = 0.03), while the difference in EVR was not significant (OR = 1.42, 95%CI: 0.86-2.36, P = 0.17). For hepatitis C virus genotype 1, the increase in the SVR rate remained significant (OR = 2.41, 95%CI: 1.33-4.36, P = 0.004).
The addition of statins to IFNα and RBV can improve sustained virological response and increase the cure rate in hepatitis C.
- Citation: Zhao J, Liang CQ, Li W, Yao DK. Efficacy of addition of statins to interferon α and ribavirin for hepatitis C: A meta-analysis. Shijie Huaren Xiaohua Zazhi 2017; 25(6): 484-490
- URL: https://www.wjgnet.com/1009-3079/full/v25/i6/484.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v25.i6.484
丙型肝炎病毒(hepatitis C virus, HCV)感染是一个全球性的公共卫生问题, 慢性HCV感染可导致肝硬化和肝癌的发生, 我国在全球范围内属HCV低流行地区, 但丙型肝炎报告病例数逐年上升且速度较快, 其在病毒性肝炎构成比也迅速增长[1]. 长期以来, 干扰素α(interferon α, IFNα)联合利巴韦林(ribavirin, RBV)是抗HCV的标准化治疗方案, 但作为"治愈"标志的持续病毒学应答(sustained virological response, SVR)率只为50%左右. 近几年虽然已经研发出多种可显著提高应答率的直接抗病毒药物(direct-acting antiviral drugs, DAAs), 但DAAs在我国上市前IFNα联合RBV仍然是我国目前丙型肝炎主要的抗病毒治疗方案也是首推方案[2]. 有研究表明宿主的脂质代谢在HCV的生存周期中扮演着关键角色[3], 而体外研究显示调血脂药物他汀可抑制HCV的复制[4]. 部分观察性研究发现他汀的应用与丙肝病毒学应答改善有关[5-7], 也已经有临床试验将他汀联合IFNα与RBV应用于治疗HCV感染者, 但疗效有一定差异. 为评价他汀类药物联合IFNα与RBV治疗丙型肝炎的有效性, 本研究运用循证医学方法, 检索相关文献进行Meta分析, 为临床治疗提供理论证据.
1.1.1 文献检索: 检索的数据库: PubMed、Web of Science、EMBASE、Cochrane Library、CNKI、万方数据库、中国生物医学文献数据库、维普期刊全文数据库. 检索的年限: 从创刊至2016-08-30. 中文以"丙肝、丙型肝炎、他汀、他汀类药物"为检索词进行检索, 英文以"hepatitis C、hepatitis C virus or HCV、3-hydroxy-3-methylglutaryl-coenzyme A reductase inhibitor、statin、randomized controlled trial"为检索词进行检索. 此外对部分文献的参考文献进行了人工检索.
1.1.2 文献纳入标准: (1)研究类型: 无论是否采用盲法的随机对照临床试验; (2)研究人群: 患者符合《丙型肝炎防治指南》中关于丙型肝炎的诊断标准; (3)干预措施: 试验组为他汀类药物联合IFNα与RBV, 对照组仅为IFNα联合RBV, 多组病例临床试验中只选择本研究所需的2组; (4)结局指标: 符合《丙型肝炎防治指南》[2]所定义的SVR、快速病毒学应答(rapid virological response, RVR)、早期病毒学应答(early virological response, EVR).
1.1.3 排除标准: (1)非随机对照临床试验研究; (2)合并乙型肝炎病毒或HIV感染者; (3)联合除他汀外其他调血脂药物的研究; (4)仅有摘要或者会议汇编资料.
1.2.1 资料提取: 提取的数据包括发表信息(作者、发表时间、研究类型); 受试对象(样本数、性别、年龄、HCV基因型); 治疗方案(2组所用药品的名称、剂量、给药方式与疗程)、结局指标(SVR、RVR、EVR)、失访及处理方式等数据.
1.2.2 文献质量评价: 由两名研究人员按预定的标准独立筛选文献并进行质量评价. 质量评分按照Jadad质量标准[8], 评分方法如下: (1)随机: 具体描述随机分配方法, 2分; 文献提及"随机", 但未明确交待分配方法, 1分; 未叙述随机分配, 0分; (2)盲法: 描述具体盲法, 2分; 文献虽提及"盲法"但未具体交待, 1分; 非盲法, 0分; (3)失访或退出情况: 具体记录失访或退出情况, 1分; 未提及失访或退出, 0分. 将0-2分定为低质量文献, 3-5分定为高质量文献. 如遇分歧, 协商解决.
统计学处理 用RevMan5.3软件对纳入指标进行Meta分析. 若纳入的研究间不存在明显异质性(P≥0.1, I2≤50%), 则采用固定效应模型; 反之, 采用随机效应模型; 最终统计指标计数资料用比值比以及95%可信区间表示并绘制SVR、RVR、EVR的森林图.
共检索出100篇文献. 排除重复发表, 阅读题目及摘要后纳入14篇, 进一步阅读全文后最终纳入7篇文献[9-15]: 6篇英文文献, 1篇中文文献. 排除的主要原因为会议摘要资料、观察性研究、患者合并HIV感染、加用他汀之外调血脂药物、无法获得全文等. 共纳入400例患者, 其中他汀辅助治疗组202例, 对照组198例. 纳入文献的基本特征如表1.
| 纳入研究 | 分组 | 样本量 | 治疗方案 | 疗程 | 结局指标 | Jadad评分(分) |
| Bader等[9]2013 | 试验组 | 25 | 氟伐他汀(20 mg/d)或辛伐他汀(10-80 mg/d)+PEG-IFNα+RBV | 48 wk | SVR | 2 |
| 对照组 | 20 | PEG-IFNα+RBV | ||||
| Kondo | 试验组 | 46 | 氟伐他汀(20 mg/d)+PEG-IFNα+RBV | 48-72 wk | SVR, RVR, EVR | 3 |
| 等[10]2012 | 对照组 | 48 | PEG-IFNα+RBV | |||
| Malaguarnera | 试验组 | 33 | 瑞舒伐他汀(5 mg/d)+普通IFNα+RBV | 12 mo | SVR | 3 |
| 等[11]2011 | 对照组 | 32 | 普通IFNα+RBV | |||
| 潘闻等[12]2013 | 试验组 | 30 | 氟伐他汀(20-40 mg/d)+PEG-IFNα+RBV | 48 wk | SVR, EVR | 1 |
| 对照组 | 30 | PEG-IFNα+RBV | ||||
| Seyam | 试验组 | 30 | 氟伐他汀(80 mg/d)+PEG-IFNα+RBV | 48 wk | SVR, RVR, EVR | 2 |
| 等[13]2015 | 对照组 | 27 | PEG-IFNα+RBV | |||
| Shavakhi | 试验组 | 20 | 阿托伐他汀(20 mg/d)PEG-IFNα+RBV | 3 mo | SVR, EVR | 2 |
| 等[14]2014 | 对照组 | 20 | PEG-IFNα+RBV | |||
| Shimada | 试验组 | 21 | 匹伐他汀(1-2 mg/d)+PEG-IFNα+RBV | 48 wk | SVR, RVR, EVR | 2 |
| 等[15]2012 | 对照组 | 21 | PEG-IFNα+RBV |
本研究纳入的7篇文献中, 2篇[10,11]描述了具体的随机方法, 1篇[12]未叙述随机分配, 其余文献均在文中提到了随机分组, 但未描述随机方法; 所有文献均未报道分配隐藏和具体的盲法; 7篇文献均报道了退出或失访情况. 文献Jadad评分如表1.
2.3.1 他汀辅助治疗组与对照组SVR率比较: 纳入的文献中7篇都报道了他汀辅助治疗组与对照组相比较的SVR的数据, 异质性检验结果显示P = 0.82, I2 = 0%; 应用固定效应模型进行合并分析. 结果显示: 他汀+IFNα+RBV组SVR率优于IFNα+RBV组, 差异有统计学意义(OR = 2.18, 95%CI: 1.42-3.34, P = 0.0004, 图1).
鉴于我国HCV基因型主要为HCV 1型, 从纳入文献中筛选出4篇患者明确为HCV 1型(包括1a和1b型)的数据进行敏感性分析, 异质性检验结果显示P = 0.90, I2 = 0%; 应用固定效应模型进行合并分析. 结果显示: 他汀+IFNα+RBV组SVR率仍优于IFNα+RBV组, 差异有统计学意义(OR = 2.41, 95%CI: 1.33-4.36, P = 0.004, 图2).
2.3.2 他汀辅助治疗组与对照组RVR率比较: 有3篇报道了他汀治疗组与对照组相比较的RVR的数据, 异质性检验结果显示, P = 0.46, I2 = 0%; 应用固定效应模型进行合并分析. 结果显示: 他汀+IFNα+RBV组RVR率优于IFNα+RBV组, 差异有统计学意义(OR = 2.37, 95%CI: 1.11-5.09, P = 0.03, 图3).
2.3.3 他汀辅助治疗组与对照组EVR率比较: 纳入的文献中有5篇报道了他汀治疗组与对照组相比较的EVR的数据, 异质性检验结果显示, P = 0.44, I2 = 0%; 应用固定效应模型进行合并分析. 结果显示, 他汀+IFNα+RBV与IFNα+RBV相比较, EVR率无明显变化, 差异无统计学意义(OR = 1.42, 95%CI: 0.86-2.36, P = 0.17, 图4).
2.3.4 不良反应: 纳入的文献中有6篇文献[9-13,15]对药物相关不良反应进行了报道, 他汀组有4例因ALT严重升高而停用他汀, 在其他诸如发热、乏力、肌肉酸痛等症状和ALT、AST、WBC、CK、Hb等指标变化方面, 2组无明显差异.
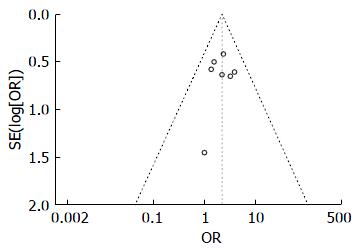
2.3.5 发表偏倚的评价: 通过绘制SVR率的漏斗图观察发表偏倚, 漏斗图较对称(图5), 应用Stata12.0软件进行Egger检验P = 0.755, 说明结果受潜在的文献发表偏倚的影响较小, Meta分析结果具有较高的可信度.
丙型肝炎抗病毒治疗的目标是清除HCV, 获得治愈, 以阻止肝损害进展为肝硬化失代偿期甚至肝细胞癌, 提高患者的长期生存率. 已有研究明确SVR与因HCV导致的肝脏相关死亡率和全因死亡率的下降相关[16,17]. 因此, 达到SVR是抗病毒治疗有效性的重要指标, 可以评判患者的预后. 虽然DAAs的出现挑战了IFNα联合RBV的"标准化治疗方案"的地位, 但结合实际, IFNα联合RBV方案仍是我国现阶段HCV现症感染者抗病毒治疗的推荐方案, 可应用于所有基因型HCV感染同时无治疗禁忌证的患者[2]. 因此在IFNα联合RBV的基础上提高病毒应答率有重要的临床意义. 他汀是常用的且被认为是安全性和耐受性较佳的降胆固醇药物, 他汀抗HCV的作用机制有很多, 主要是胆固醇参与了HCV生存周期中入胞、复制等关键步骤, 他汀降低了胆固醇水平从而减少了病毒的复制[18,19], 也有研究显示他汀与微管的相互作用减慢了病毒的组装[20]. 不仅有大量研究指出他汀可提高病毒的清除率, 还有观察性研究发现他汀的应用可降低HCV患者肝硬化[21-24]或肝细胞癌的发生风险[25,26].
本研究遵循循证医学的相关原则, 全面检索了他汀类药物联合IFNα与RBV治疗丙型肝炎的随机对照试验, 采用Meta分析对其疗效进行合并分析, 结局指标的异质性检验均发现I2 = 0%, 说明各组研究的同质性尚可. 结果表明他汀辅助治疗组的SVR、RVR都明显优于对照组, 差异有统计学意义(P<0.05). 此外相较于对照组, 试验组未见严重的不良反应的发生. 他汀辅助治疗丙型肝炎可以提高病毒的清除率且安全性良好, 他汀的安全性方面也进一步被其他相关研究所证实[27,28]. 在他汀类药物的选择上, 有研究报道在5种他汀类药物中, 对HCV抑制能力最强的是氟伐他汀[4,29], 单用氟伐他汀80 mg/d可使HCV RNA下降1.75log[30]. 另外Kondo等[10]对样本进行亚组分析发现具有以下特点人群加用他汀类药物的SVR明显优于对照组, 包括男性、ISDR高突变、低HCV RNA水平以及IL28B基因型等.
本研究存在的局限性: 纳入的7篇文献, 总样本量均较小, 部分文献未报道具体的随机方法、盲法、分配隐藏等情况导致文献质量普遍不高, 这些将使得检验效能降低. 此外由于部分纳入文献对不良反应的描述较笼统, 因此联合用药的安全性还有待进一步研究.
总之, 本研究表明与仅用IFNα和RBV的治疗方案相比, 联合他汀类药物可以改善SVR, 增加HCV的清除率, 为临床用药提供了循证医学证据.
丙型肝炎病毒(hepatitis C virus, HCV)感染是一个全球性的公共卫生问题, 我国丙型肝炎报告病例数逐年上升且速度较快. 长期以来, 干扰素α(interferon α, IFNα)联合利巴韦林(ribavirin, RBV)是抗HCV的标准化治疗方案, 但作为"治愈"标志的持续病毒学应答(sustained virological response, SVR)率只为50%左右.
近年来有研究表明调血脂药物他汀可抑制HCV的复制且已将他汀联合IFNα与RBV应用于治疗HCV感染者, 但疗效有一定差异. 为评价他汀类药物联合IFNα与RBV治疗丙型肝炎的有效性, 本研究运用循证医学方法, 检索相关文献进行Meta分析.
近两年Simon和Yang等的研究结果表明应用他汀类药物能降低HCV感染者进展为肝硬化的风险, 改善HCV患者的生活质量.
本文在全面检索及严格评价的基础上, 运用循证医学方法评价他汀辅助治疗丙型肝炎的有效性, 为临床应用提供了一定依据.
本文研究发现在IFNα与RBV基础上联合应用他汀类药物能提高丙型肝炎总应答率, 而不良反应未有明显增加, 因此他汀辅助治疗丙型肝炎具有一定的临床应用价值.
持续病毒学应答(SVR): 治疗结束后第12周和24周HCV RNA不可测, 可表示为SVR12和SVR24;
快速病毒学应答(RVR): 治疗第4周HCV RNA不可测;
早期病毒学应答(EVR): 治疗第12周HCV RNA较治疗前下降> 2log.
丁向春, 副教授, 主任医师, 宁夏医科大学总医院感染性疾病科; 吴君, 主任医师, 贵阳医学院附属医院感染科; 张福奎, 主任医师, 首都医科大学附属北京友谊医院肝病中心
作者对当前发表的关于"IFNα与RBV基础上联合他汀治疗丙型肝炎的有效性"的研究文献进行了Meta分析, 对临床工作有重要的意义. 分析方法合适, 内容具有新颖性.
手稿来源: 自由投稿
学科分类: 胃肠病学和肝病学
手稿来源地: 上海市
同行评议报告分类
A级 (优秀): 0
B级 (非常好): B
C级 (良好): C, C
D级 (一般): 0
E级 (差): 0
编辑: 马亚娟 电编:胡珊
| 2. | 陈 红松, 窦 晓光, 段 钟平, 侯 金林, 贾 继东, 李 杰, 李 兰娟, 鲁 凤民, 饶 慧瑛, 任 红. 丙型肝炎防治指南(2015年更新版). 临床肝胆病杂志. 2015;31:1961-1979. |
| 3. | Peyrou M, Clément S, Maier C, Bourgoin L, Branche E, Conzelmann S, Kaddai V, Foti M, Negro F. PTEN protein phosphatase activity regulates hepatitis C virus secretion through modulation of cholesterol metabolism. J Hepatol. 2013;59:420-426. [PubMed] [DOI] |
| 4. | Ikeda M, Abe K, Yamada M, Dansako H, Naka K, Kato N. Different anti-HCV profiles of statins and their potential for combination therapy with interferon. Hepatology. 2006;44:117-125. [PubMed] [DOI] |
| 5. | Rao GA, Pandya PK. Statin therapy improves sustained virologic response among diabetic patients with chronic hepatitis C. Gastroenterology. 2011;140:144-152. [PubMed] [DOI] |
| 6. | Pandya P, Rzouq F, Oni O. Sustained virologic response and other potential genotype-specific roles of statins among patients with hepatitis C-related chronic liver diseases. Clin Res Hepatol Gastroenterol. 2015;39:555-565. [PubMed] [DOI] |
| 7. | Butt AA, Yan P, Bonilla H, Abou-Samra AB, Shaikh OS, Simon TG, Chung RT, Rogal SS. Effect of addition of statins to antiviral therapy in hepatitis C virus-infected persons: Results from ERCHIVES. Hepatology. 2015;62:365-374. [PubMed] [DOI] |
| 8. | Jadad AR, Moore RA, Carroll D, Jenkinson C, Reynolds DJ, Gavaghan DJ, McQuay HJ. Assessing the quality of reports of randomized clinical trials: is blinding necessary? Control Clin Trials. 1996;17:1-12. [PubMed] [DOI] |
| 9. | Bader T, Hughes LD, Fazili J, Frost B, Dunnam M, Gonterman A, Madhoun M, Aston CE. A randomized controlled trial adding fluvastatin to peginterferon and ribavirin for naïve genotype 1 hepatitis C patients. J Viral Hepat. 2013;20:622-627. [PubMed] [DOI] |
| 10. | Kondo C, Atsukawa M, Tsubota A, Itokawa N, Fukuda T, Matsushita Y, Kidokoro H, Kobayashi T, Narahara Y, Nakatsuka K. An open-label randomized controlled study of pegylated interferon/ribavirin combination therapy for chronic hepatitis C with versus without fluvastatin. J Viral Hepat. 2012;19:615-622. [PubMed] [DOI] |
| 11. | Malaguarnera M, Vacante M, Russo C, Gargante MP, Giordano M, Bertino G, Neri S, Malaguarnera M, Galvano F, Li Volti G. Rosuvastatin reduces nonalcoholic fatty liver disease in patients with chronic hepatitis C treated with α-interferon and ribavirin: Rosuvastatin reduces NAFLD in HCV patients. Hepat Mon. 2011;11:92-98. [PubMed] |
| 12. | 潘 闻, 鲍 旭丽, 王 金环, 李 红霞, 渠 亚超. 氟伐他汀对合并高胆固醇血症的慢性丙型肝炎的抗病毒疗效的影响. 中华临床医师杂志(电子版). 2013;7:94-96. |
| 13. | Seyam MS, Gabr HA, Salama ZA, Mokhles MA, Marzaban RN, Soliman AF. Evaluation of fluvastatin in combination with the standard of care therapy (PEG-IFN/Ribavirin) in Egyptian patients with hepatitis C virus. Turk J Gastroenterol. 2015;26:511-516. [PubMed] [DOI] |
| 14. | Shavakhi A, Minakari M, Bighamian A, Sadeghian S, Shavakhi S, Khamisi N, Khodadustan M, Talebi M, Ataei B. Statin efficacy in the treatment of hepatitis C genotype I. J Res Med Sci. 2014;19:S1-S4. [PubMed] |
| 15. | Shimada M, Yoshida S, Masuzaki R, Schuppan D. Pitavastatin enhances antiviral efficacy of standard pegylated interferon plus ribavirin in patients with chronic hepatitis C: a prospective randomized pilot study. J Hepatol. 2012;56:299-300. [PubMed] [DOI] |
| 16. | van der Meer AJ, Veldt BJ, Feld JJ, Wedemeyer H, Dufour JF, Lammert F, Duarte-Rojo A, Heathcote EJ, Manns MP, Kuske L. Association between sustained virological response and all-cause mortality among patients with chronic hepatitis C and advanced hepatic fibrosis. JAMA. 2012;308:2584-2593. [PubMed] [DOI] |
| 17. | Bruno S, Stroffolini T, Colombo M, Bollani S, Benvegnù L, Mazzella G, Ascione A, Santantonio T, Piccinino F, Andreone P. Sustained virological response to interferon-alpha is associated with improved outcome in HCV-related cirrhosis: a retrospective study. Hepatology. 2007;45:579-587. [PubMed] [DOI] |
| 18. | Blanchet M, Le QT, Seidah NG, Labonté P. Statins can exert dual, concentration dependent effects on HCV entry in vitro. Antiviral Res. 2016;128:43-48. [PubMed] [DOI] |
| 19. | Simon TG, Butt AA. Lipid dysregulation in hepatitis C virus, and impact of statin therapy upon clinical outcomes. World J Gastroenterol. 2015;21:8293-8303. [PubMed] [DOI] |
| 20. | Ali N, Allam H, Bader T, May R, Basalingappa KM, Berry WL, Chandrakesan P, Qu D, Weygant N, Bronze MS. Fluvastatin interferes with hepatitis C virus replication via microtubule bundling and a doublecortin-like kinase-mediated mechanism. PLoS One. 2013;8:e80304. [PubMed] [DOI] |
| 21. | Simon TG, King LY, Zheng H, Chung RT. Statin use is associated with a reduced risk of fibrosis progression in chronic hepatitis C. J Hepatol. 2015;62:18-23. [PubMed] [DOI] |
| 22. | Yang YH, Chen WC, Tsan YT, Chen MJ, Shih WT, Tsai YH, Chen PC. Statin use and the risk of cirrhosis development in patients with hepatitis C virus infection. J Hepatol. 2015;63:1111-1117. [PubMed] [DOI] |
| 23. | Mohanty A, Tate JP, Garcia-Tsao G. Statins Are Associated With a Decreased Risk of Decompensation and Death in Veterans With Hepatitis C-Related Compensated Cirrhosis. Gastroenterology. 2016;150:430-440.e1. [PubMed] [DOI] |
| 24. | Oliver NT, Hartman CM, Kramer JR, Chiao EY. Statin drugs decrease progression to cirrhosis in HIV/hepatitis C virus coinfected individuals. AIDS. 2016;30:2469-2476. [PubMed] [DOI] |
| 25. | Tsan YT, Lee CH, Ho WC, Lin MH, Wang JD, Chen PC. Statins and the risk of hepatocellular carcinoma in patients with hepatitis C virus infection. J Clin Oncol. 2013;31:1514-1521. [PubMed] [DOI] |
| 26. | Khurana V, Saluja A, Caldito G, Fort C, Schiff ER. Statins are protective against hepatocellular cancer in patients with hepatitis C virus infection: Half a million US veterans' study. Gastroenterology. 2005;1282:A714. |
| 27. | Khorashadi S, Hasson NK, Cheung RC. Incidence of statin hepatotoxicity in patients with hepatitis C. Clin Gastroenterol Hepatol. 2006;4:902-907; quiz 806. [PubMed] [DOI] |
| 28. | Segarra-Newnham M, Parra D, Martin-Cooper EM. Effectiveness and hepatotoxicity of statins in men seropositive for hepatitis C virus. Pharmacotherapy. 2007;27:845-851. [PubMed] [DOI] |
| 29. | O'Leary JG, Chan JL, McMahon CM, Chung RT. Atorvastatin does not exhibit antiviral activity against HCV at conventional doses: a pilot clinical trial. Hepatology. 2007;45:895-898. [PubMed] [DOI] |
| 30. | Bader T, Fazili J, Madhoun M, Aston C, Hughes D, Rizvi S, Seres K, Hasan M. Fluvastatin inhibits hepatitis C replication in humans. Am J Gastroenterol. 2008;103:1383-1389. [PubMed] [DOI] |