修回日期: 2016-12-06
接受日期: 2016-12-19
在线出版日期: 2017-02-18
探讨脂多糖(lipopolysaccharide, LPS)对高糖环境下肝脏枯否细胞(Kupffer cells, KCs)增殖和分泌功能及超微结构的影响.
将小鼠原代KCs培养扩增后随机分为4组: 高糖组[(high glucose, HG), 25.0 mmol/L D-葡萄糖], 正常对照组[(normal control, CON), 11.1 mmol/L D-葡萄糖], LPS+高糖组[(LPS+high glucose, LPS-HG), 25.0 mmol/L D-葡萄糖], LPS+正常对照组[(LPS normal+control, LPS-CON), 11.1 mmol/L D-葡萄糖]. 培养24 h后, LPS-HG和LPS-CON组分别加入等量LPS, 继续培养6 h后, 四甲基偶氮唑盐比色法测定细胞增殖, 流式细胞仪检测细胞周期, Luminex xMAP技术检测细胞上清液中肿瘤坏死因子-α(tumor necrosis factor alpha, TNF-α)、白介素(interleukin, IL)-1β、IL-6水平, 透射电镜观察KCs细胞超微结构.
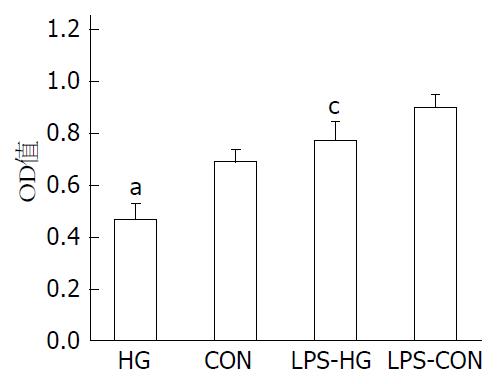
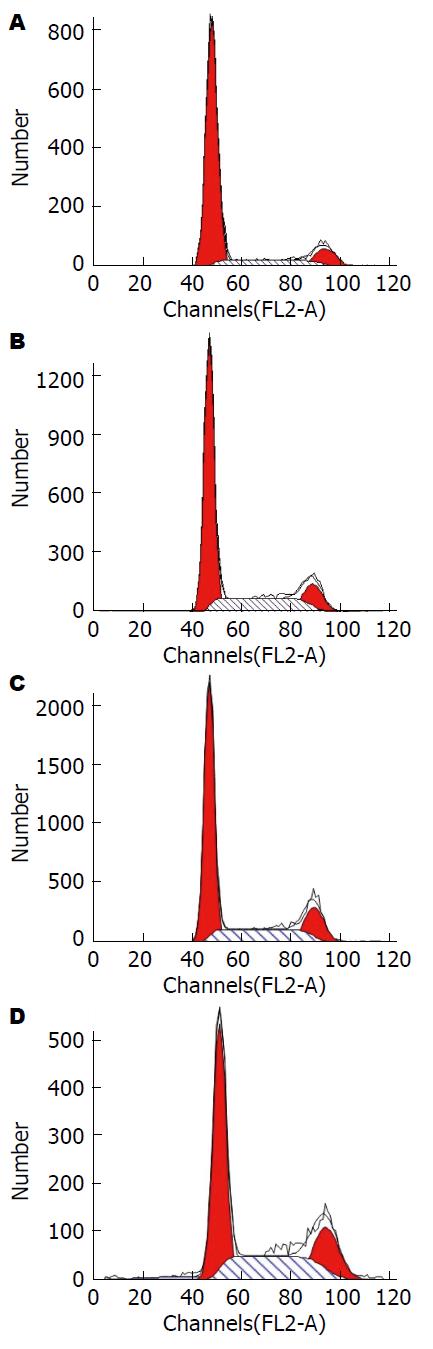
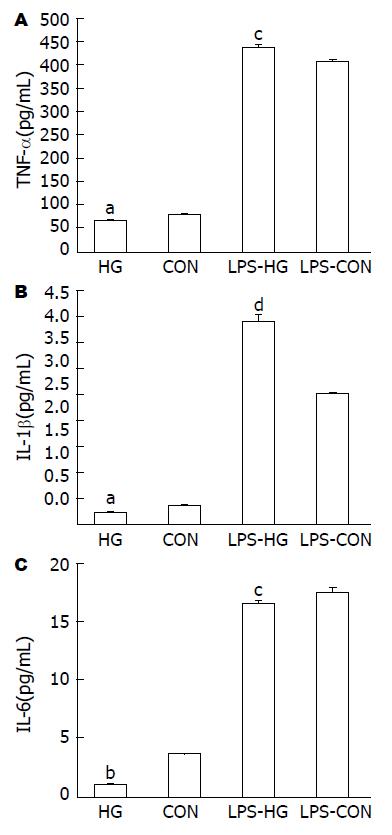
MTT比色法测定结果显示, KCs经LPS干预6 h后吸光度(absorbance, OD)测值显著升高, HG和LPS-HG组的OD测值明显低于相对照的CON组和LPS-CON组(P<0.05). 流式细胞仪技术检测结果显示, KCs经LPS干预6 h后G0/G1期细胞分布明显下降, S期+G2/M期细胞分布明显升高(P<0.01). HG和LPS-HG组的G0/G1期细胞分布显著高于相对照的CON和LPS-CON组, HG和LPS-HG组的S期+G2/M期细胞分布显著低于相对照的CON和LPS-CON组(P<0.01); Luminex xMAP技术结果显示, KCs经LPS干预6 h后TNF-α、IL-1β、IL-6水明显升高, TNF-α和IL-1β的变化更为显著. 电镜观察KCs结果显示, HG组可见自噬体形成, CON组个别细胞胞质内仅见少量空泡; LPS-HG组可见大量空泡及自噬体形成, LPS-CON组可见空泡形成而未见自噬体.
LPS能激活并强化高糖环境中肝脏KCs的增殖和分泌功能, 高糖环境和LPS均可引发肝脏KCs自噬等超微结构改变.
核心提要: 本研究发现, 脂多糖(lipopolysaccharide, LPS)能激活并强化高糖环境中肝脏枯否细胞(Kupffer cells, KCs)的增殖和分泌功能, 高糖环境和LPS均可引发肝脏KCs自噬等超微结构改变.
引文著录: 闫洪锋, 孙宏伟, 王平, 张诗琳, 杨建武, 徐冰心, 周金莲, 李成林, 崔彦. 脂多糖对高糖环境下肝脏Kupffer细胞增殖和分泌及超微结构的影响. 世界华人消化杂志 2017; 25(5): 412-419
Revised: December 6, 2016
Accepted: December 19, 2016
Published online: February 18, 2017
To investigate the effect of lipopolysaccharide (LPS) on the proliferation, secretion and ultrastructure of liver Kupffer cells (KCs) under high glucose conditions.
Murine liver KCs were cultured, amplified, and then randomly divided into a high glucose group [(HG), 25.0 mmol/L D-glucose], a normal glucose group [(CON), 11.1 mmol/L D-glucose], a LPS + high glucose group [(LPS-HG), 25.0 mmol/L D-glucose], and a LPS + normal glucose group [(LPS-CON), 11.1 mmol/L D-glucose)]. The KCs in each group were cultured for 24 h, and then LPS was added for the LPS-HG and LPS-CON groups. After 6 h of continuous cultivation, cell proliferation and cell cycle were detected by MTT colorimetric assay and flow cytometry, respectively. Cell supernatants were collected to determine the levels of tumor necrosis factor alpha (TNF-α), interleukin (IL)-1β and IL-6 by Luminex xMAP technique. The ultrastructure of KCs was observed by transmission electron microscopy (TEM).
MTT colorimetric assay showed that the optical density (OD) of murine liver KCs treated with LPS for 6 h under high glucose conditions increased significantly, but the OD values decreased significantly in the HG and LPS-HG groups compared with those of the CON and LPS-CON groups (P < 0.05). Flow cytometry revealed that high glucose arrested the cell cycle in G0/G1 phase; the percentage of G0/G1 phase cells decreased and that of S + G2/M phase cells increased significantly (P < 0.01) after KCs were treated with LPS for 6. The Luminex xMAP assay showed that the levels of TNF-α, IL-1β and IL-6 increased significantly after murine liver KCs were treated with LPS for 6 h under high glucose conditions, and the changes in TNF-α and IL-1β were more obvious. TEM revealed obvious ultrastructural alterations of KCs treated with LPS for 6 h under high glucose conditions. A large number of autophagosomes were observed in the LPS-HG group, and only few were noted in the HG group. Only vacuolar degenerations were visible in the CON and LPS-CON groups.
LPS can activate and enhance the proliferation and secretion of murine liver Kupffer cells under high glucose conditions. Both LPS and hyperglycemia can induce ultrastructural alterations of KCs including autophagy.
- Citation: Yan HF, Sun HW, Wang P, Zhang SL, Yang JW, Xu BX, Zhou JL, Li CL, Cui Y. Effect of lipopolysaccharide on proliferation, secretion and ultrastructure of murine liver Kupffer cells under high glucose conditions. Shijie Huaren Xiaohua Zazhi 2017; 25(5): 412-419
- URL: https://www.wjgnet.com/1009-3079/full/v25/i5/412.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v25.i5.412
肝脏枯否细胞(Kupffer cells, KCs)为定居于肝内的巨噬细胞, 他是体内最大的固有巨噬细胞群, 具有吞噬、分泌、免疫调节与监视等作用, 是肝脏炎症反应各条信号通路上的重要交汇点, 在肝脏及机体其他部位感染机制中发挥重要作用[1-3]. 由于糖尿病(Diabetes mellitus, DM)患者免疫功能低下、高糖环境利于细菌生长等因素, DM患者容易合并各种感染性疾病[4,5]. 近年来研究[6-8]发现, DM患者罹患肝脏感染的比例亦明显高于非DM人群, DM已成为引发肝脓肿(pyogenic liver abscess, PLA)的重要危险因素之一. 然而, 上述病理演变过程中KCs功能状态和DM患者罹患PLA的机制尚不明确. 本研究进行KCs体外培养, 研究脂多糖(lipopolysaccharide, LPS)对高糖环境下KCs增殖和分泌及超微结构的影响, 进一步探讨DM患者易患PLA及其他感染性疾病的内在机制.
BALB/C鼠源肝KCs(吉尼欧生物科技有限公司), RPMI 1640培养基(Gibco BRL Co.Ltd., United States), RPMI 1640无糖培养基(Gibco BRL Co.Ltd., United States), Mouse TNF-alpha Simplex试剂盒(eBioscience co. Ltd., United States), Mouse白介素(interleukin, IL)-1β Simplex试剂盒(eBioscience co. Ltd., United States), Mouse IL-6 Simplex(eBioscience co. Ltd., United States), FACS Calibur型流式细胞仪(BD, United States), 全自动酶标仪(Bio-Rad Laboratories Ltd., United States), LPS(Sigma Industrial Co. Ltd., United States).
1.2.1 实验分组: 参照文献报道[9-11], 将KCs随机分为4组, 分别为高糖组[(high glucose, HG), 25.0 mmol/L D-葡萄糖], 正常对照组[(normal control, CON), 11.1 mmol/L D-葡萄糖], LPS+高糖组[(LPS+high glucose, LPS-HG), 25.0 mmol/L D-葡萄糖], LPS+正常对照组[(LPS normal+control, LPS-CON), 11.1 mmol/L D-葡萄糖].
1.2.2 MTT比色法测定KCs细胞增殖: 将分组细胞接种于96孔板, 每孔接种2000个细胞, 加入含不同浓度葡萄糖的RPMI 1640培养基分别培养24 h. LPS-CON和CON组葡萄糖浓度为普通RPMI 1640培养基的葡萄糖浓度. HG和CON组使用原培养基换液; LPS-HG和LPS-CON组使用LPS含量为1 μg/mL培养基换液. 按分组加入LPS及对照液后继续培养6 h. 每孔加入20 μL MTT溶液(5 mg/mL, 即0.5%MTT), 37 ℃避光孵育4 h后小心吸去孔内培养液. 每孔加入150 μL二甲基亚砜, 置摇床上低速振荡10 min, 使结晶物充分溶解. 在全自动酶标仪吸光度(absorbance, OD)490 nm处测量各孔的吸光值, 同时设置调零孔、对照孔.
1.2.3 流式细胞仪技术检测KCs周期: 将分组细胞接种于6孔板, 每孔接种5×104个细胞, 加入含不同浓度葡萄糖的RPMI 1640培养基培养24 h后, HG和CON组使用原培养基换液; LPS-HG和LPS-CON组使用LPS含量为1 μg/mL的培养基换液. 按分组加入LPS及对照液后继续培养6 h. 采用胰蛋白酶消化法使贴壁细胞脱落, 收集细胞. 将收集好的细胞每个标本取1×106个, 加300 μL不含血清的培养基重悬, 然后缓慢加入700 μL预冷无水乙醇, 置于-20 ℃冰箱内固定48 h以上, 1200 r/min离心5 min, 弃去上清液; 加入2 mL预冷的磷酸盐缓冲溶液, 洗涤细胞1次, 再次离心沉淀细胞, 小心吸除上清液, 重复此操作1次. 加RNA酶溶液(100 μg/mL, stock solution)100 μL, 37 ℃培养箱内孵育30 min, 然后冰浴终止酶作用, 加PI(50 μg/mL, stock solution)300 μL, 4 ℃避光染色30 min, FACS Calibur流式细胞仪检测细胞周期, ModFit软件分析细胞周期的分布.
1.2.4 Luminex xMAP技术检测KCs细胞因子TNF-α、IL-1β、IL-6水平: 将分组细胞接种于96孔板, 每孔接种2000个细胞, 加入含不同浓度葡萄糖1640培养基培养24 h. LPS-CON组、LPS-HG组使用LPS含量为1 μg/mL的培养基换液. 按分组加入LPS及对照液后继续培养6 h, 收集细胞上清. 将收集好的细胞上清液10000 r/min高速冷冻离心20 min, 弃去沉淀. 在96孔超滤板上标记标准浓度和待测样本, 每孔加200 μL缓冲液, 振荡15 min. 对照标准孔每孔加25 μL标准蛋白, 待测孔内每孔加25 μL上清液和25 μL球形基质, 室温震荡孵育60 min, 洗涤. 每孔加25 μL标记好的3种细胞因子的探针分子, 室温震荡孵育30 min, 每孔加25 μL链霉亲和素-藻红蛋白, 孵育30 min, 洗涤, 每孔加150 μL鞘液, 震荡5 min, 运行Luminex操作系统.
1.2.5 电子显微镜观察KCs细胞超微结构: 将分组细胞接种于6孔板, 加入含不同浓度葡萄糖1640培养基培养24 h后, LPS-CON组、LPS-HG组使用LPS含量为1 μg/mL的培养基换液. 按分组加入LPS及对照液后继续培养6 h, 收集细胞加入4%戊二醛固定液固定48 h送检.
统计学处理 采用CHISS(2010)统计软件进行数据分析, 数据用mean±SD表示, 多个样本的比较采用方差分析, 组间两两比较采用SNK法, 以α = 0.05为检验水准.
实验各组KCs细胞培养24 h, 并经LPS干预及对照培养6 h后, HG组OD测值明显低于CON组(P<0.05); LPS-HG组OD测值明显低于LPS-CON组(P<0.05); 实验结果同时显示, LPS-HG组和LPS-CON组的OD测值分别明显高于HG组和CON组(图1).
结果显示, 实验各组KCs细胞培养24 h, 并经LPS干预及对照培养6 h后, HG组的G0/G1期细胞分布明显高于CON组, HG组的S期+G2/M期细胞分布明显低于CON组; LPS-HG组的G0/G1期细胞分布明显高于LPS-CON组, LPS-HG组的S期+G2/M期细胞分布明显低于LPS-CON组; LPS-HG组的G0/G1期细胞分布明显低于HG组, LPS-HG组的S期+G2/M期细胞分布明显高于HG组, 各组间差异显著(P<0.01, 图2, 表1).
实验各组KCs细胞培养24 h, 并经LPS干预及对照培养6 h后, HG组的肿瘤坏死因子-α(tumor necrosis factor alpha, TNF-α)水平明显低于CON组(P<0.05), LPS-HG组的TNF-α水平明显高于LPS-CON组(P<0.05); HG组的IL-1β水平明显低于CON组(P<0.05), LPS-HG组的IL-1β水平显著高于LPS-CON组(P<0.01); HG组的IL-6水平显著低于CON组(P<0.01), LPS-HG组的IL-1β水平亦明显低于LPS-CON组(P<0.05). 添加LPS两组的TNF-α、IL-1β、IL-6水平均较未添加LPS两组的TNF-α、IL-1β、IL-6水平显著增高(图3).
HG组可见自噬体形成, 个别细胞胞质内见少量空泡; CON组个别细胞胞质内见少量空泡, 未见明显自噬体; LPS-HG组可见大量空泡及自噬体形成, LPS-CON组可见大量空泡形成, 未见明显自噬体(图4).
正常生理条件下, 肝脏KCs的吞噬、分泌以及其他各种功能是一种有益的防御反应[12-15], 然而在各种病理环境中, 大量有毒物质经胆管或门静脉等途径入肝, 最先激活肝窦周围的KCs, 进而产生大量的氧自由基和各种细胞因子, 这种异常的炎性反应不仅不能改善病情, 还反过来加重了肝脏的病理变化[1-3,16]. Hewett等[17]早在1993年研究证实, 病理状态下细菌细胞壁裂解产生的LPS可激活KCs, 使其分泌功能亢进, 从而释放或产生大量氧自由基、TNF-α等一系列炎性介质, 引起肝脏病理性损伤. Xu等[18]进一步研究证实, LPS经过TLR4信号途径激活KCs, 激活后的KCs分泌肿瘤坏死因子、白介素等炎症因子的能力增强.
LPS由革兰氏阴性菌死亡后菌体细胞壁裂解所释放. LPS位于细菌细胞壁的最外一层、覆盖在细胞壁的黏肽上. 各种细菌的LPS的生物活性基本相同, 耐热稳定, 抗原性弱, 不良反应作用不一, 可引起人体发热、微循环障碍、休克等. 循环中的LPS可广泛激活TLR4, 进入细胞核内与DNA结合, 启动干扰素、炎症因子如TNF-α、IL-1β、IL-6等的表达, 引起机体非特异性炎症反应[19,20].
随着DM的广泛流行和DM患者PLA发病率的上升, 高糖环境对肝脏KCs造成的影响以及这种影响对DM的进程乃至PLA的形成机制亟待阐明. 本课题组前期研究发现, 高糖环境下KCs活性受到明显抑制, 增殖及分泌功能明显下降[21]. 分析认为, 高糖环境中KCs细胞活性下降可能是DM患者免疫力低下和易患PLA的重要因素之一.
在前期研究的基础上, 本实验应用LPS对高糖环境中的鼠肝KCs进行干预. 研究发现, LPS能激活并强化高糖环境中肝脏KCs的增殖和分泌功能. 结果显示, 鼠肝KCs在高糖环境中细胞活性受抑制的情况下, LPS作用6 h即明显提升KCs的OD值, 并使G0/G1期细胞比例下降, S期+G2/M期细胞比例上升; 同时, TNF-α、IL-1β和IL-6水平明显升高. 上述研究结果与文献报道[22-24]相类似. Yee等[22]和Wei等[23]研究认为KCs的活化是引起肝损害的关键, 其在PLA发病转归过程中清除病原体的同时引发炎症级联反应, 超出肝组织承受能力的炎症反应即导致组织器官损伤. Yang等[24]研究发现, LPS/D-氨基半乳糖诱导的急性肝损伤小鼠KCs跨膜型肿瘤坏死因子-α(transmembrane form tumor necrosis factor alpha, tmTNF-α)水平显著升高, 与血清转氨酶活性呈正相关, tmTNF-α在促/抗炎因子失衡、加剧细胞凋亡、炎症应激和损伤以及细胞外基质生成等病理过程中发挥重要作用. 结合文献分析认为, 肝脏一旦遭受到组织损伤或感染等情况时, KCs首先被激活, IL-1β和IL-6与TNF-α等共同被刺激释放进而协同作用发挥效应. KCs在高糖环境中受到内环境异常的不利影响基础上, 一旦进一步受到LPS的作用, TNF-α、IL-1β和IL-6等细胞因子的双刃剑样作用将更为明显和更具危害性. 从这个角度分析, DM患者容易继发难治性PLA有其一定的病理生理基础.
本研究还发现, LPS对高糖环境中的鼠肝KCs进行干预, 6 h作用即明显加重KCs细胞超微结构改变, 出现大量空泡及自噬体形成. 现已明确, 自噬是细胞对于环境变化和维持自身稳定的快速有效反应, 是细胞从产生到死亡整个生理或病理过程中的重要调控机制, 是维持细胞自身代谢平衡及环境稳定的重要代谢途径[25]. Rautou等[26]的研究结果显示, 急性肝损伤时自噬在某种程度上发挥保护作用, 但异常自噬会导致细胞死亡. Chien等[27]研究发现, 在实验大鼠脓毒血症早期, 肝脏KCs及肝细胞即发生明显的自噬现象, 自噬能力可随病情进展而下降, 预示肝脏功能衰退. 显然, 高糖环境和LPS均为可引发肝脏KCs自噬的不良因素.
尽管高糖环境和LPS对KCs的影响作用迥然有别, 然而综合作用必然导致KCs功能紊乱和超微结构改变. 分析认为, 在DM患者肠道菌群失调的基础上, 肠源性LPS持续通过门静脉入肝作用并活化KCs, 导致促/抗炎因子失衡, 引发细胞自噬, 直接和间接引起病理性肝损害, 这可能是DM患者罹患PLA的重要病理基础之一. 对LPS与KCs之间的复杂关系以及如何调控KCs的功能状态, 国内外学者从不同角度入手展开了相关研究[28-30], 尚需进一步探讨.
近年来研究发现, 糖尿病(diabetes mellitus, DM)患者罹患肝脏感染的比例亦明显高于非DM人群, DM已成为引发肝脓肿(pyogenic liver abscess, PLA)的重要危险因素之一. 然而, 上述病理演变过程中枯否细胞(Kupffer cells, KCs)功能状态和DM患者罹患PLA的机制尚不明确, 亟待深入研究.
KCs为定居于肝内的巨噬细胞, 具有吞噬、分泌、免疫调节与监视等作用, 是肝脏炎症反应各信号通路上的重要交汇点, 在肝脏及机体其他部位感染过程中发挥重要作用. 脂多糖(lipopolysa-ccharide, LPS)由革兰氏阴性菌死亡后菌体细胞壁裂解所释放, 循环中的LPS可广泛激活TLR4等通路而引发机体非特异性炎症反应. 研究LPS对高糖环境下KCs增殖和分泌及超微结构的影响, 对进一步探讨DM患者易患PLA及其他感染性疾病的内在机制有重要意义.
病理状态下细菌细胞壁裂解产生的LPS可进入肝脏激活KCs, 从而释放或产生大量氧自由基和炎症因子, 引起肝脏病理性损伤. 高糖环境下KCs活性受到抑制, 增殖及分泌功能下降. LPS对高糖环境中KCs的吞噬和分泌功能及超微结构影响尚未见研究报道.
肝脏一旦遭受到组织损伤或感染等情况时, KCs首先被激活, 白介素(interleukin, IL)-1β和IL-6与肿瘤坏死因子-α等共同被刺激释放进而协同作用发挥效应. KCs在高糖环境中受到内环境异常的不利影响基础上, 一旦进一步受到LPS的作用, 多种细胞因子的双刃剑样作用表现更为明显和更具危害性. 据此分析, DM患者容易继发难治性PLA有其一定的病理生理基础.
本文探讨LPS对高糖环境下肝脏KCs细胞增殖和分泌及超微结构的影响, 为进一步认识DM合并PLA的病理过程和机制及临床防治提供理论依据.
方哲平, 主任医师, 浙江省台州医院肝胆外科; 李靖, 教授, 主任医师, 第三军医大学第二附属医院肝胆外科; 李胜, 研究员, 山东省肿瘤防治研究院肝胆外科; 许钟, 副主任医师, 贵州省人民医院消化内科
本文选题密切结合临床, 学术思想先进, 实验设计合理, 方法得当, 结论可信; 对认识DM患者易发生PLA的机制有重要临床价值.
手稿来源: 自由投稿
学科分类: 胃肠病学和肝病学
手稿来源地: 北京市
同行评议报告分类
A级 (优秀): 0
B级 (非常好): B, B
C级 (良好): C, C
D级 (一般): 0
E级 (差): 0
编辑: 马亚娟 电编:李瑞芳
| 1. | Sato K, Hall C, Glaser S, Francis H, Meng F, Alpini G. Pathogenesis of Kupffer Cells in Cholestatic Liver Injury. Am J Pathol. 2016;186:2238-2247. [PubMed] [DOI] |
| 2. | Wu HW, Yun KM, Han DW, Xu RL, Zhao YC. Effects of glycine on phagocytosis and secretion by Kupffer cells in vitro. World J Gastroenterol. 2012;18:2576-2581. [PubMed] [DOI] |
| 4. | Mohamed J, Nazratun Nafizah AH, Zariyantey AH, Budin SB. Mechanisms of Diabetes-Induced Liver Damage: The role of oxidative stress and inflammation. Sultan Qaboos Univ Med J. 2016;16:e132-e141. [PubMed] [DOI] |
| 6. | Jha AK, Das A, Chowdhury F, Biswas MR, Prasad SK, Chattopadhyay S. Clinicopathological study and management of liver abscess in a tertiary care center. J Nat Sci Biol Med. 2015;6:71-75. [PubMed] [DOI] |
| 7. | Liu L, Chen W, Lu X, Zhang K, Zhu C. Pyogenic Liver Abscess: A Retrospective Study of 105 Cases in an Emergency Department from East China. J Emerg Med. 2016; Oct 17. [Epub ahead of print]. [PubMed] [DOI] |
| 8. | 纪 安来, 孙 宏伟, 李 成林, 王 平, 周 立艳, 段 育忠, 吉 敏, 周 金莲, 崔 彦. 糖尿病合并细菌性肝脓肿的临床及病理学特点. 解放军医学杂志. 2012;37:884-888. |
| 9. | Yang RH, Lin J, Hou XH, Cao R, Yu F, Liu HQ, Ji AL, Xu XN, Zhang L, Wang F. Effect of docosahexaenoic acid on hippocampal neurons in high-glucose condition: involvement of PI3K/AKT/nuclear factor-κB-mediated inflammatory pathways. Neuroscience. 2014;274:218-228. [PubMed] [DOI] |
| 10. | Madhyastha R, Madhyastha H, Pengjam Y, Nakajima Y, Omura S, Maruyama M. NFkappaB activation is essential for miR-21 induction by TGFβ1 in high glucose conditions. Biochem Biophys Res Commun. 2014;451:615-621. [PubMed] [DOI] |
| 11. | 叶 长根, 梁 冬雨, 赵 亮, 于 芳苹, 孙 水林, 张 吉翔, 刘 亮明. 大鼠枯否细胞的分离、鉴定以及LPS刺激诱导TNF-α的表达. 世界华人消化杂志. 2013;21:307-312. [DOI] |
| 12. | Guerville M, Boudry G. Gastrointestinal and hepatic mechanisms limiting entry and dissemination of lipopolysaccharide into the systemic circulation. Am J Physiol Gastrointest Liver Physiol. 2016;311:G1-G15. [PubMed] [DOI] |
| 13. | Hutchins NA, Chung CS, Borgerding JN, Ayala CA, Ayala A. Kupffer cells protect liver sinusoidal endothelial cells from Fas-dependent apoptosis in sepsis by down-regulating gp130. Am J Pathol. 2013;182:742-754. [PubMed] [DOI] |
| 14. | Stauffer JK, Scarzello AJ, Jiang Q, Wiltrout RH. Chronic inflammation, immune escape, and oncogenesis in the liver: a unique neighborhood for novel intersections. Hepatology. 2012;56:1567-1574. [PubMed] [DOI] |
| 15. | Gordon S, Martinez FO. Alternative activation of macrophages: mechanism and functions. Immunity. 2010;32:593-604. [PubMed] [DOI] |
| 16. | Tsutsui H, Nishiguchi S. Importance of Kupffer cells in the development of acute liver injuries in mice. Int J Mol Sci. 2014;15:7711-7730. [PubMed] [DOI] |
| 17. | Hewett JA, Roth RA. Hepatic and extrahepatic pathobiology of bacterial lipopolysaccharides. Pharmacol Rev. 1993;45:382-411. [PubMed] |
| 18. | Xu FL, You HB, Li XH, Chen XF, Liu ZJ, Gong JP. Glycine attenuates endotoxin-induced liver injury by downregulating TLR4 signaling in Kupffer cells. Am J Surg. 2008;196:139-148. [PubMed] [DOI] |
| 19. | Peri F, Piazza M, Calabrese V, Damore G, Cighetti R. Exploring the LPS/TLR4 signal pathway with small molecules. Biochem Soc Trans. 2010;38:1390-1395. [PubMed] [DOI] |
| 20. | Ramana KV, Willis MS, White MD, Horton JW, DiMaio JM, Srivastava D, Bhatnagar A, Srivastava SK. Endotoxin-induced cardiomyopathy and systemic inflammation in mice is prevented by aldose reductase inhibition. Circulation. 2006;114:1838-1846. [PubMed] [DOI] |
| 21. | 闫 洪锋, 周 金莲, 王 平, 徐 冰心, 田 西朋, 李 晓鸥, 孙 宏伟, 司 少艳, 崔 彦. 高糖环境影响小鼠肝脏Kupffer细胞增殖及分泌功能. 解放军医药杂志. 2016;28:1-4. |
| 22. | Yee SB, Ganey PE, Roth RA. The role of Kupffer cells and TNF-alpha in monocrotaline and bacterial lipopolysaccharide-induced liver injury. Toxicol Sci. 2003;71:124-132. [PubMed] [DOI] |
| 23. | Wei SD, Li JZ, Liu ZJ, Chen Q, Chen Y, Chen M, Gong JP. Dexamethasone attenuates lipopolysaccharide-induced liver injury by downregulating glucocorticoid-induced tumor necrosis factor receptor ligand in Kupffer cells. Hepatol Res. 2011;41:989-999. [PubMed] [DOI] |
| 24. | Yang P, Zhou W, Li C, Zhang M, Jiang Y, Jiang R, Ba H, Li C, Wang J, Yin B. Kupffer-cell-expressed transmembrane TNF-α is a major contributor to lipopolysaccharide and D-galactosamine-induced liver injury. Cell Tissue Res. 2016;363:371-383. [PubMed] [DOI] |
| 26. | Rautou PE, Mansouri A, Lebrec D, Durand F, Valla D, Moreau R. Autophagy in liver diseases. J Hepatol. 2010;53:1123-1134. [PubMed] [DOI] |
| 27. | Chien WS, Chen YH, Chiang PC, Hsiao HW, Chuang SM, Lue SI, Hsu C. Suppression of autophagy in rat liver at late stage of polymicrobial sepsis. Shock. 2011;35:506-511. [PubMed] [DOI] |
| 29. | 陈 先锋, 李 旭宏, 游 海波, 刘 海忠, 刘 作金, 龚 建平. SOCS-1在内毒素血症及耐受小鼠肝组织中的表达变化及意义. 世界华人消化杂志. 2010;18:1747-1755. [DOI] |
| 30. | Wang Z, Lv H, Song S, Shen X, Yang L, Yu W. Emulsified isoflurane preconditioning protects isolated rat Kupffer cells against hypoxia/reoxygenation-induced injury. Int J Med Sci. 2013;10:286-291. [PubMed] [DOI] |